KARAKTERISASI ADSORBEN KOMPOSIT ALUMINIUM OKSIDA PADA LEMPUNG TERAKTIVASI ASAM
on
ISSN 1907-9850
KARAKTERISASI ADSORBEN KOMPOSIT ALUMINIUM OKSIDA PADA LEMPUNG TERAKTIVASI ASAM
P. Suarya
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
ABSTRAK
Telah dilakukan preparasi komposit aluminium oksida pada lempung. Preparasi dilakukan yaitu: pertama aktivasi dengan asam sulfat 1,2 M yang kemudian dilanjutkan dengan penyisipan polioksikation aluminium yang kemudian dikalsinasi untuk membentuk komposit aluminium oksida (Al2O3). Karakterisasi dilakukan dengan metode difraksi sinar-X untuk menentukan basal spacing (d001), metode titrasi asam basa untuk menentukan keasaman permukaan, serta spektrofotometer UV-Vis untuk mengukur luas permukaan spesifik.
Hasil penelitian melalui aktivasi dengan asam sulfat dan penyisipan komposit aluminium oksida menyebabkan terjadinya peningkatan keasaman permukaan berturut turut untuk adsorben CC0-0, CCa-0, CCa-1, CCa-2, dan CCa-3 yaitu 0,4665; 0,9743; 1,2957; 1,1609; dan 1,1193 mmol/g adsorben. Luas permukaan spesifik yang dihasilkan berturut-turut 27,0307 m2/g; 28,2351 m2/g; 29,0040 m2/g; 29,2074 m2/g; dan 29,1513 m2/g adsorben untuk CC0-0, CCa-0, CCa-1, CCa-2, dan CCa-3. Hasil difraksi sinar-X menunjukkan adsorben mengandung campuran mineral berupa montmorillonit, kaolinit, klorit, feldspar, dan kalsit.
Kata kunci : lempung, adsorben, adsorpsi, komposit aluminium oksida
ABSTRACT
Composite of alluminium oxide in clay has been prepared. The materials were prepared as follow: first, clay was activated with 1.2 M sulphuric acid, then intercalated using polyoxycation of alluminium, and finally calcinated to form composite of alluminium oxide (Al2O3). X-ray diffraction (XRD) was employed to characterize basal spacing (d001). Acid-base titration was used for determining the surface acidity, and spectrophotometer UV-Vis for determining the specific surface area.
The results show that activation of clay with sulphuric acid and interchalation with polyoxycation of alluminium increase the surface acidity of aluminium oxide composite in clay the namely. The specific surface area of CC0-0, CCa-0, CCa-1, CCa-2 and Cca-3 were 27.0307 m2/g; 28.2351 m2/g; 29.0040 m2/g; 29.2074 m2/g; and 29.1513 m2/g respectively. The X-ray results indicated that adsorbent was composed by montmorillonite, kaolinite, chlorite, feldspar, and calsite.
Keywords : clay, adsorbent, adsorption, composite of alluminium oxide
PENDAHULUAN
Lempung banyak dimanfaatkan sebagai salah satu alternatif bahan penyerap (adsorben) karena memiliki luas permukaan yang besar, porositas yang tinggi, kelimpahannya tinggi,
serta harga yang relatif lebih murah dibandingkan dengan adsorben yang lain. Berdasarkan kandungan mineralnya, tanah lempung dibedakan menjadi montmorillonit, kaolinit, haloisit, klorit, dan illit. Montmorillonit termasuk mineral lempung yang memiliki sifat
mudah mengembang, memiliki kation-kation yang dapat dipertukarkan dan luas permukaan yang cukup besar. Sifat-sifatnya tersebut menjadikan montmorillonit cocok dimanfaatkan sebagai adsorben. Namun tanpa dimodifikasi terlebih dahulu, bila diaplikasikan sebagai adsorben, montmorillonit memberikan hasil yang kurang maksimal. Hal ini disebabkan oleh sifatnya yang mudah menyerap air dan pori-pori yang dimilikinya sering tidak seragam. Oleh karena itu, usaha pengembangan potensi lempung ini perlu terus ditingkatkan agar daya gunanya lebih bervariasi dan menguntungkan (Wijaya, 2003). Berbagai penelitian yang telah dilakukan terhadap tanah lempung mendapatkan bahwa aktivitas lempung tidak termodifikasi umumnya tidak begitu tinggi, sehingga untuk meningkatkan aktivitasnya, baik secara fisik maupun kimia perlu adanya modifikasi terhadap tanah lempung (Negara, 2005).
Penelitian Suarya (2005), melaporkan bahwa interkalasi garam amonium kuarterner dan asam palmitat ke dalam antarlapis lempung bentonit menyebabkan peningkatan basal spacing, keasaman permukaan dan kapasitas adsorpsinya terhadap Pb2+. Simpen (2001) melaporkan lempung montmorillonit teraktivasi asam sulfat 1,5 M terpilar TiO2 memiliki luas permukaan dan keasaman permukaan yang relatif tinggi yaitu 275,5984 m2/g dan 1,5341 mmol/g, sedangkan lempung tanpa dimodifikasi hanya memiliki luas permukaan 88,1316 m2/g dan keasamaan permukaan sebesar 0,6844 mmol/g.
Salah satu metode untuk meningkatkan sifat-sifat fisik dan kimia lempung adalah proses aktivasi dengan asam yang diikuti dengan penyisipan polioksikation aluminium ke dalam struktur lempung yang selanjutnya dikalsinasi untuk membentuk komposit aluminium oksida. Pemanfaatan oksida logam aluminium ini sebagai agen pembentuk komposit disebabkan hidrolisisnya paling mudah dikontrol dan dimensi oksida yang terbentuk tidak sensitif terhadap kondisi hidrolisis. Pembentukan komposit aluminium oksida melalui mekanisme pertukaran kation. Kation-kation yang mudah dipertukarkan terlebih dahulu dipertukarkan dengan H- dari asam, selanjutnya kation-kation yang belum tergantikan akan digantikan oleh
kation aluminium dari agen pembentuk komposit.
Pada penelitian ini akan dilakukan modifikasi lempung melalui pembentukan komposit aluminium oksida pada lempung yang terlebih dahulu diaktivasi dengan asam sulfat. Pemilihan asam sulfat sebagai asam pengaktif disebabkan asam sulfat merupakan asam mineral kuat dengan jumlah ekivalen asam (H+) lebih banyak dari asam mineral lain yang umum digunakan seperti asam nitrat dan asam klorida. Aktivasi lempung dengan asam mineral dapat melarutkan pengotor-pengotor atau senyawa-senyawa yang dapat menurunkan kapasitas adsorpsi sehingga kemampuan adsorpsinya meningkat (Simpen, 2002). Modifikasi lempung melalui pembentukan komposit aluminium oksida pada lempung ini ditentukan sifat-sifat fisik dan kimianya seperti basal spacing (d001), luas permukaan spesifik dan keasaman permukaan.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah : lempung dari PT. BRATACO Yogyakarta, H2SO4 pekat (p.a, 96%v/v; Bj=1,84 kg/L), HCl pekat (p.a, 37%v/v; Bj=1,19kg/L), AlCl3.6H2O (p.a), NaOH (p.a), BaCl2.2H2O (p.a), H2C2O4.2H2O (p.a), AgNO3 (p.a), metilen biru, indikator pp, dan akuades.
Peralatan
Peralatan yang digunakan dalam penelitian antara lain timbangan analitik, ayakan 106 dan 250 µm, oven, desikator, penggerus porselin, kaca arloji, hotplate dan magnetic stirer, pH meter, termometer, furnace, gelas ukur, gelas beker, erlenmeyer, labu ukur, pipet ukur, pipet volume, pipet mikro ukuran 1001000 μL, buret, corong gelas, pipet tetes, bola hisap, statif dan klem, spatula, pencatat waktu, kertas saring halus, kertas saring Whatman 42, Difraktometer Sinar-X dan Spektrofotometer UV-Vis.
Cara Kerja
Aktivasi lempung dengan asam sulfat
Sebanyak 300 g lempung dengan ukuran 250-106 µm ditimbang dengan teliti, yang mana 250 g lempung didispersikan kedalam 1,25 L larutan H2SO4 1,2 M dalam gelas beker berukuran 2 L (diberi kode Ca) dan 50 g lempung yang tersisa digunakan sebagai kontrol yang didispersikan dalam 250 mL akuades dalam gelas beker berukuran 1 L (diberi kode C0) sambil diaduk dengan pengaduk magnet dengan kecepatan konstan. Aktivasi dilakukan selama 24 jam, kemudian disaring dan dicuci dengan air panas (60-700C) sampai terbebas dari ion sulfat yang ditandai dengan tidak terbentuknya endapan putih BaSO4 saat filtrat diuji dengan BaCl2. Lempung kemudian dioven pada suhu 100-1100C sampai kering (selama ± 3 jam). Lempung digerus sampai halus, dan diayak menggunakan ayakan 250 dan 106 µm (lolos 250 µm dan tertahan 106 µm), selanjutnya disimpan dalam desikator.
Pembuatan larutan polioksikation aluminium
Larutan polioksikation aluminium dibuat dengan cara menghidrolisis larutan AlCl3.6H2O 0,2 M dengan larutan NaOH 0,2 M secara perlahan-lahan sampai rasio OH/Al = 2. Larutan ini diaduk sampai homogen selama 24 jam, selanjutnya dilakukan proses aging selama 5 hari pada temperatur kamar. Dibuat 3 larutan polioksikation aluminium dengan variasi rasio mmol Al/lempung 1, 2, dan 3.
Pembuatan suspensi lempung
Sebanyak 25 g lempung Ca dan C0 ditimbang dengan teliti dan dilarutkan dalam 500 mL akuades atau dengan perbandingan 5% (b/v). Larutan ini diaduk dengan pengaduk magnet dengan kecepatan konstan selama 5 jam pada suhu kamar. Dibuat tiga suspensi sesuai dengan kajian variasi mmol Al/lempung, satu suspensi untuk lempung kontrol dan satu suspensi untuk lempung teraktivasi asam.
Proses pembentukan komposit aluminium oksida pada lempung
Suspensi untuk kajian variasi mmol Al/lempung yang telah disiapkan ditambahkan
sedikit demi sedikit larutan polioksikation aluminium dengan perbandingan mmol Al/lempung 1; 2; dan 3 sambil diaduk dengan kuat dengan pengaduk magnet dengan kecepatan konstan selama 24 jam (sampel berturut-turut diberi kode Ca-1, Ca-2, dan Ca-3). Sedangkan suspensi untuk lempung tanpa perlakuan/kontrol (kode C0-0) dan lempung teraktivasi asam (kode Ca-0) tanpa ditambahkan larutan polioksikation aluminium. Seluruh campuran dibiarkan selama 24 jam, kemudian disaring dan dicuci dengan akuades hingga bebas ion Cl- (uji negatif terhadap AgNO3 yaitu jika filtrat diuji dengan AgNO3 tidak membentuk endapan putih AgCl), kemudian dioven pada suhu 100-1100C sampai kering (selama ± 5 jam), selanjutnya digerus sampai halus, diayak menggunakan ayakan 250 dan 106 µm (lolos 250 µm dan tertahan 106 µm), dan dikalsinasi pada suhu 4000C selama 3 jam (sampel berturut-turut diberi kode CC0-0, CCa-0, CCa-1, CCa-2, dan CCa-3). Adsorben yang telah terbentuk ditentukan luas permukaan spesifiknya dengan spektrofotometer UV-Vis dengan metode metilen biru, keasaman permukaan dengan titrasi asam basa, dan jenis mineral dan perubahan basal spacing (d001) dengan difraktometer sinar-X.
HASIL DAN PEMBAHASAN
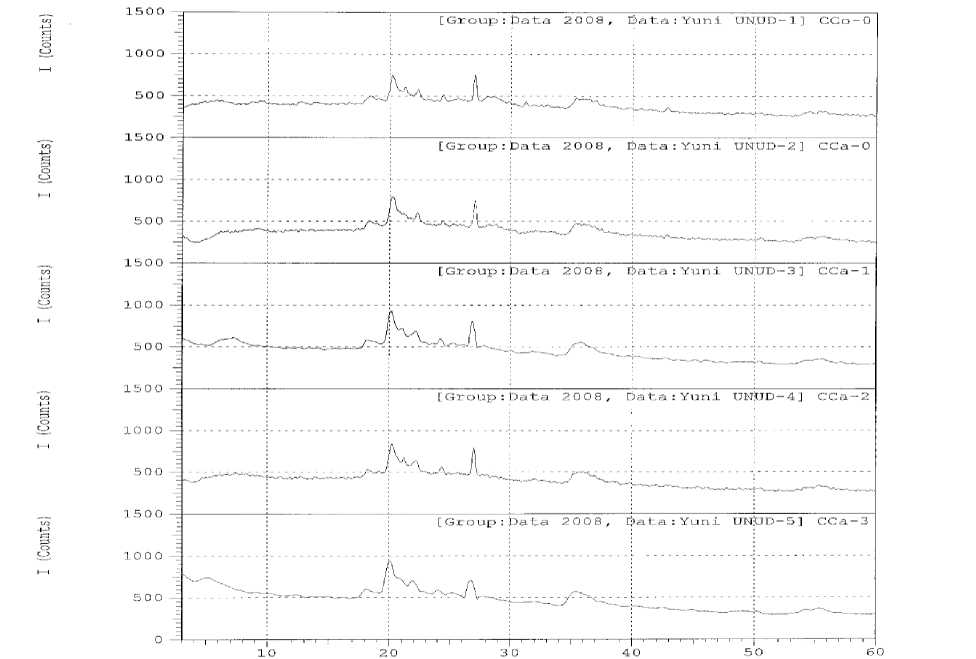
Fenomena terjadinya komposit aluminium oksida dapat diketahui dengan melihat data difraktogram sinar-X pada Gambar 1.
Hasil karakterisasi adsorben CC0-0 dengan metode difraksi sinar-X menunjukkan bahwa adsorben tersebut mengandung beberapa mineral yang dibuktikan dengan munculnya puncak-puncak difraksi pada nilai 2θ yang karakteristik. Puncak difraksi pada daerah 2θ = 5,72000 dengan jarak dasar/basal spacing (d001) = 15,43821 Å diperkirakan merupakan basal spacing untuk mineral montmorillonit. Hal ini didukung oleh hasil penelitian Simpen (2001) yang menemukan lempung Na-montmorillonit terhidrat mempunyai jarak dasar/basal spacing (d001) sebesar 15,53 Å pada daerah 2θ = 5,690. Sedangkan Widihati (2005) menyebutkan karakterisasi Na-montmorillonit dengan metode difraksi sinar-X menunjukkan adanya refleksi
spesifik pada daerah 2θ = 5,970 yang merupakan ciri khas bidang 001 mineral montmorillonit. Refleksi puncak yang khas untuk montmorillonit adalah ramping. Namun dari hasil difraksi sinar-X diperoleh puncak montmorillonit melebar dan intensitasnya lemah. Hal ini mengindikasikan kandungan montmorillonit yang sangat rendah dalam lempung disamping juga akibat kerusakan struktur montmorillonit akibat proses kalsinasi. Montmorillonit yang tanpa dimodifikasi memiliki stabilitas termal yang rendah, sehingga apabila mengalami pemanasan akan terjadi kerusakan struktur.
Puncak yang kuat juga ditunjukkan oleh data difraktogram pada daerah 2θ = 20,25710 dengan jarak dasar d001 = 4,38026 Å. Puncak ini
diperkirakan berupa mineral kaolinit. Tan (1982) menyebutkan mineral kaolinit selain memiliki jarak dasar d001 yang khas pada 7,10-7,20 Å, juga memiliki jarak dasar antara 4,35-4,36 Å. Diperkirakan pada daerah 2θ = 20,25710 dengan jarak dasar d001 = 4,38026 Å adalah berupa mineral kaolinit yang mana jarak dasarnya dekat dengan rentang jarak dasar kaolinit menurut Tan (1982). Tan (1982) juga menyebutkan jarak dasar d001 mineral klorit berkisar antara 13,0-14,0 Å sehingga puncak pada daerah 2θ = 6,66000 dengan jarak dasar d001 = 13,26120 Å diperkirakan berupa mineral klorit. Puncak difraksi yang tidak tajam pada 2θ = 6,66000 yang menunjukkan adanya mineral klorit.
Multi P I at
Thetci-2 Theta (deg)
Gambar 1. Difraktogram difraksi sinar-X
Refleksi puncak dengan jarak dasar d001 3,30 Å merupakan karakteristik dua mineral, yaitu kalsit dan gibsit. Perbedaan kedua mineral tersebut terdapat pada intensitas puncaknya. Kalsit memiliki karakteristik puncak yang tajam dengan intensitas yang kuat, sedangkan gibsit memiliki karakteristik puncak yang rendah dengan intensitas yang lemah (Tan, 1982). Dari Gambar 1 terlihat bahwa pada pada 2θ = 26,97830 dengan jarak dasar d001 = 3,30231 Å dan intensitas yang kuat diperkirakan bahwa puncak tersebut adalah kalsit. Intensitas puncak tertinggi ini menunjukkan dalam adsorben CC0-0 (lempung kontrol) tersebut mengandung komponen utama berupa kalsit.
Pada daerah 2θ = 21,22000 dengan jarak dasar d001 4,18362 Å diperkirakan berupa mineral feldspar. Hal ini diperkuat oleh data dari Tan (1982) yang memberikan informasi bahwa pada jarak dasar antara 4,00-4,20 Å dengan intensitas yang cukup tinggi yang didukung oleh adanya puncak pada jarak dasar d = 3,73-3,75 Å dengan intensitas rendah sampai cukup tinggi adalah karakteristik untuk mineral feldspar. Data pendukung pada jarak dasar d001 = 4,18362 Å adalah berupa mineral feldspar adalah puncak pada daerah 2θ = 24,34800 dengan jarak dasar d001 = 3,65277 Å. Nilai jarak dasar ini berada pada rentang nilai jarak dasar untuk mineral feldspar. Susianah (2005) menemukan feldspar berada pada daerah 2θ = 22,200.
Pengaruh aktivasi menyebabkan perubahan puncak refleksi dari hasil analisis difraksi sinar-X. Perubahan akibat proses aktivasi dengan asam dapat dilihat dari adanya pergeseran 2θ untuk mineral montmorillonit ke arah kiri yaitu dari 2θ = 5,72000 dengan jarak dasar d001 sebesar 15,43821 Å menjadi 14,33643 Å dan 2θ = 6,16000 untuk lempung teraktivasi asam. Hal ini diduga disebabkan oleh terlarutnya kation-kation yang mudah ditukarkan seperti Na+, K+, dan Ca2+ dan/ atau Al, Mg, dan Fe (pada lembar oktahedral) sehingga perubahan struktur dari oktahedral menjadi tetrahedral telah terjadi yang menyebabkan penurunan kristalinitasnya. Penurunan kristalinitas ini bisa dilihat dari refleksi puncak yang semakin melebar. Namun intensitas puncaknya mengalami peningkatan setelah aktivasi dengan asam yang diduga
disebabkan terlarutnya pengotor-pengotor yang menutupi pori-pori montmorillonit.
Puncak refleksi untuk mineral kaolinit mengalami pergeseran 2θ ke arah kanan yaitu menjadi 20,22000 dengan jarak dasar d001 meningkat menjadi 4,38821Å. Hal ini diduga disebabkan oleh kation-kation yang mudah ditukarkan seperti Na+, K+, dan Ca2+ telah terlarutkan oleh adanya asam (tergantikan oleh kation H+). Intensitas puncak refleksinya juga mengalami peningkatan seperti halnya dengan mineral montmorillonit yang juga disebabkan terlarutnya lebih banyak pengotor yang menutupi pori-pori kaolinit.
Adanya aktivasi juga menyebabkan penurunan intensitas dari mineral klorit. Selain itu nilai 2θ bergeser ke kanan, akibatnya jarak dasar d001 mengalami penurunan menjadi 12,00144 Å. Hal ini mengindikasikan telah terjadinya perubahan struktur klorit akibat adanya aktivasi dengan asam. Hal yang sama juga terjadi pada feldspar dan kalsit yang juga mengalami pergeseran 2θ ke arah kanan dan penurunan jarak dasar d001 menjadi 3,65099 Å untuk feldspar dan 3,29860 Å untuk kalsit.
Pembentukan komposit aluminium oksida pada lempung mengakibatkan terjadinya perubahan hasil analisis difraksi sinar-X. Indikasi keberhasilan proses pembentukan komposit aluminium oksida pada lempung pada adsorben CCa-1 ditandai dengan munculnya puncak pada daerah 2θ = 7,20000 yang lebih terlihat jelas dibandingkan dengan puncak CC0-0 dan CCa-0 yang terjadi pada mineral montmorillonit. Hal ini mengindikasikan telah terbentuk komposit konvensional dimana komposit yang terbentuk menempel pada permukaan lempung. Komposit yang terbentuk diduga lebih dominan menempel pada mineral kaolinit, kalsit, serta feldspar yang ditandai dengan peningkatan jarak dasar d001 masing-masing mineral yaitu berturut-turut 4,39494 Å untuk kaolinit, 3,32044 Å untuk kalsit, dan 4,23892 Å untuk feldspar. Terbentuknya komposit aluminium oksida pada lempung yang menempel pada permukaan lempung menyebabkan semakin menurunnya kristalinitas mineral-mineral kaolinit, kalsit serta felsdpar yang ditandai dengan puncak refleksi yang semakin melebar dari mineral-mineral tersebut.
Semakin tinggi rasio Al/lempung, semakin besar oligomer Al13 yang terbentuk. Pada rasio Al/lempung = 2, diduga terjadi penyebaran komposit yang tidak merata yang ditandai dengan melebarnya puncak-puncak difraksi masing-masing mineral. Komposit yang terbentuk menempel pada mineral-mineral lain selain mineral kaolinit, kalsit, feldspar, klorit serta montmorillonit yang lebih dominan, yang ditandai dengan semakin banyaknya puncak refleksi yang terbentuk dibandingkan dengan adsorben rasio 1 (CCa-1).
Berbeda halnya dengan puncak refleksi adsorben CCa-3 dimana muncul puncak pada daerah 2θ = 5,30000 yang mengindikasikan munculnya mineral montmorillonit yang terkomposit aluminium oksida. Pergeseran 2θ ke arah kiri menandakan keberhasilan pembentukan komposit, dan diduga dengan peningkatan jarak dasar d001 menjadi 16,66063 Å telah terbentuk nano komposit yang mana komposit yang terbentuk sudah mulai masuk ke dalam antarlapis mineral montmorillonit. Dengan semakin melebarnya puncak refleksi dan penurunan intensitas refleksi diduga semakin banyaknya komposit yang terbentuk yang menempel pada permukaan mineral lempung. Rendahnya intensitas puncak yang terbentuk disebabkan kemungkinan terbentuknya struktur rumah kartu.
Tabel 1. Data keasaman permukaan dan luas permukaan spesifik masing-masing adsorben
|
Jenis |
Luas |
Kal |
|
Adsorben |
Permukaan | |
|
Spesifik | ||
|
(m2/g) |
(mmol/g) | |
|
CC0-0 |
27,0307 |
0,4665 ± 0,0312 |
|
CCa-0 |
28,2351 |
0,9743 ± 0,0179 |
|
CCa-1 |
29,0040 |
1,2957 ± 0,0182 |
|
CCa-2 |
29,2074 |
1,1609 ± 0,0181 |
|
CCa-3 |
29,1513 |
1,1193 ± 0,0313 |
Bila dilihat dari keasaman permukaan dan luas permukaan spesifik adsorben pada Tabel 1, adanya aktivasi dan pembentukan komposit aluminium oksida pada lempung mengakibatkan peningkatan keasaman permukaan dan luas permukan yang aktif. Hal ini disebabkan adanya aktivasi akan menambah situs asam dalam lempung yang berupa situs asam Bronsted dan situs asm Lewis. Sedangkan pembentukan komposit aluminium oksida akan memberikan sumbangan keasaman permukaan karena terbentuk situs asam Bronsted, situs asam Lewis, serta gabungan situs asam Bronsted dan situs asam Lewis.
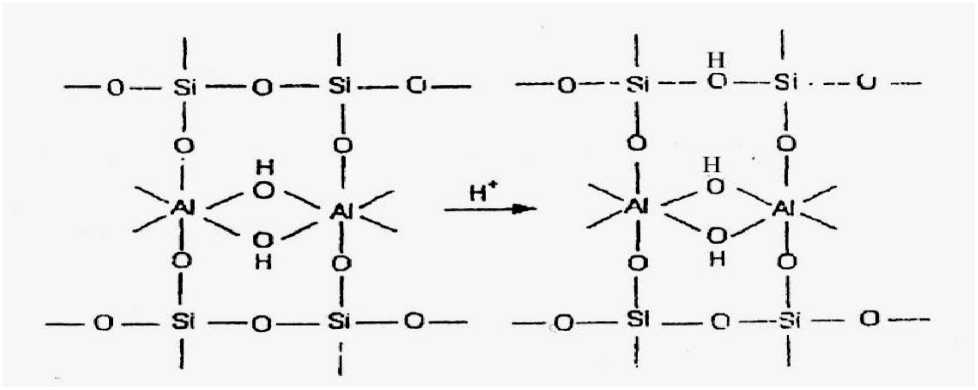
Gambar 2. Substitusi Tetrahedral (Leonard dalam Simpen, 2001)
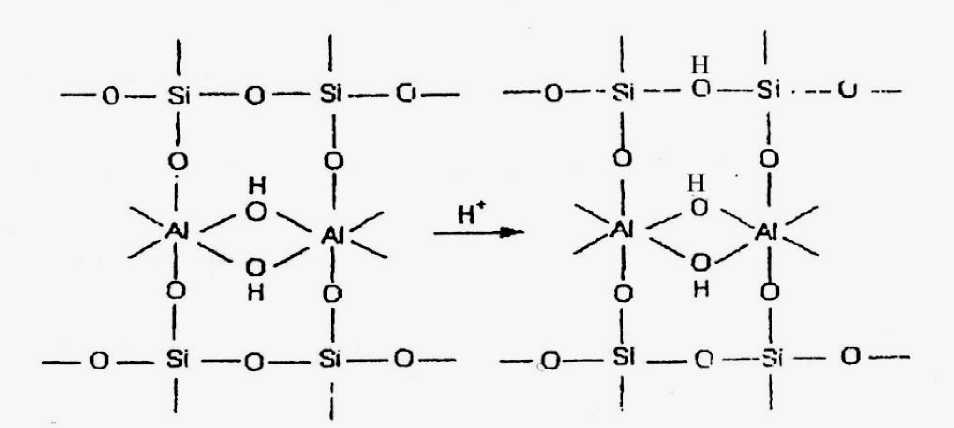
Gambar 3. Substitusi Oktahedral (Leonard dalam Simpen, 2001)
Anderson dan Boudart dalam Simpen (2001), menyatakan lempung montmorillonit dapat menunjukkan karakter keasaman baik asam Bronsted maupun asam Lewis. Situs asam Bronsted terbentuk karena adanya kation H+ (dari aktivasi dengan asam sulfat) yang berfungsi menyeimbangkan muatan negatif pada lempung montmorillonit. Selain itu karena telah terjadi substitusi tetrahedral dan oktahedral akibat protonasi pada ikatan Si-O-Si dan Al-O-Al (Gambar 2 dan Gambar 3).
SIMPULAN DAN SARAN
Simpulan
Adanya aktivasi asam dan pembentukan komposit aluminium oksida pada lempung mengakibatkan terjadinya peningkatan keasaman permukaan dan luas permukaan spesifik adsorben.
Saran
Perlu dilakukan penelitian pembentukan komposit dengan logam yang lainnya untuk mendapatkan lempung termodifikasi dengan karakterik yang baik sebagai adsorben.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Bapak I Wayan Sudiarta, S.Si., M.Si. dan Ni Luh Yuni Astari, S.Si. atas saran dan masukannya.
DAFTAR PUSTAKA
Negara, I. M. S., 2005, Preparasi Komposit Krom Oksida-Montmorillonit dan Aplikasinya untuk Sorpsi Benzena, Tesis, Program Pasca Sarjana Univesitas Gadjah Mada, Yogyakarta
Simpen, I. N., 2001, Preparasi dan Karakterisasi Lempung Montmorrilonit Teraktivasi Asam Terpilar TiO2, Tesis, Program Pasca Sarjana Universitas Gadjah Mada, Yogyakarta
Simpen, I., N. dan Wijaya, K., 2002,
Pemanfaatan Lempung Bentonit Terpilar Oksida Anorganik sebagai Katalis dan Adsorben, Chem. Rev., 5 (2) : 91-92
Suarya, P., 2005, Preparasi Lempung Terpilar Besi Oksida dan Pemanfaatannya Sebagai Adsorben Pengotor Minyak Daun Cengkeh, Tesis, Universitas Gadjah Mada, Yogyakarta
Suarya, P., 2008, Adsorpsi Pengotor Minyak Daun Cengkeh oleh Lempung Teraktivasi Asam, Jurnal Kimia, 2 (1) : 19-24
Susianah, T., 2005, Interkalasi Surfaktan
Kationik ke dalam Struktur Antarlapis Lempung Bentonit dan Pemanfaatannya sebagai Adsorben Pengotor Minyak Daun Cengkeh, Tesis, Program Pasca Sarjana Universitas Gadjah Mada, Yogyakarta
Tan, K. H., 1982, Dasar-dasar Kimia Tanah, a.b. Goenadi, D. H., Penyunting
Radjagukguk, B., Cet.5, Gadjah Mada University Press, Yogyakarta
Widihati, I. A. G., 2002, Sintesis Lempung Montmorillonit Terpilar Fe2O3 dan Kajian Sifat-sifat Kimia Fisiknya, Tesis, Program Pasca Sarjana Universitas Gadjah Mada, Yogyakarta
Wijaya, K., Mudasir, Tahir, I., dan Asean, F., 2003, Inklusi Senyawa p-Nitroanilin ke dalam Pori-pori Montmorillonit Terpilar TiO2, Review Kimia, 6 (2) : 84-94
100
Discussion and feedback