ISOLASI GELATIN DARI KULIT KAKI AYAM BROILER DAN KARAKTERISASI GUGUS FUNGSINYA DENGAN SPEKTROFOTOMETRI FTIR
on
ISSN 1907-9850
ISOLASI GELATIN DARI KULIT KAKI AYAM BROILER DAN KARAKTERISASI GUGUS FUNGSINYA DENGAN SPEKTROFOTOMETRI FTIR
N. M. Puspawati1), I N. Simpen1) dan I N. Sumerta Miwada2)
1)Jurusan Kimia, Fakultas MIPA, Universitas Udayana, Bukit Jimbaran 2)Fakultas Peternakan, Universitas Udayana, Denpasar
ABSTRAK
Gelatin merupakan biopolimer yang biasanya diperoleh dari hidrolisis parsial kolagen jaringan kulit, tulang, dan jaringan ikat hewan. Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi gelatin hasil ekstraksi kulit kaki ayam Broiler melalui proses curing asam dan basa. Isolasi gelatin dari kulit kaki ayam broiler dilakukan dengan ekstraksi waterbath menggunakan proses asam (tipe A) dan basa (tipe B). Larutan CH3COOH 1,5% (GA) digunakan dalam proses curing asam, sedangkan larutan NaOH 2,0% (GB) untuk proses curing basa dengan lama perendaman 2 hari. Gelatin dengan curing asam (GA) memberikan rendemen 8,74%, kadar protein 82,59%, dan kadar lemak 23,50%. Sedangkan, dengan curing basa (GB) diperoleh gelatin dengan rendemen 7,37%, kadar protein 79,75%, dan kadar lemak 15,76%. Hasil karakterisasi dengan FTIR menunjukkan GA dan GB memberikan spektra yang hampir sama, yaitu memiliki serapan pada daerah bilangan gelombang amida A, amida I, II, dan III yang merupakan serapan gugus khas gelatin. Pada daerah amida III, GB memberikan serapan pada 1242 cm-1 dengan intensitas yang sangat rendah, namun GA tidak memperlihatkan serapan pada bilangan gelombang tersebut, yang berkaitan dengan berubahnya keadaan struktur triple helix kolagen menjadi random coil atau denaturasi kolagen menjadi gelatin. Berdasarkan hasil analisis FTIR, dapat disimpulkan GA dan GB yang diperoleh adalah benar gelatin dengan GA memberikan hasil yang lebih baik.
Kata kunci : isolasi, gelatin, analisis FTIR, kolagen, kulit kaki ayam Broiler
ABSTRACT
Gelatin is a biopolymer that can be obtained from partially hydrolysis of collagen present in skin, bone, and connective tissues of animals. The aim of the present work is to isolate and characterize gelatin obtained from chicken feet Broiler’s skin after curing with acid and base. Isolation of gelatin from skin of chicken feet Broiler was performed by water-bath extraction through type A (acid) and type B (base) processes. CH3COOH 1.5% (GA) was used for acid-curing, and NaOH 2.0% (GB) for base-curing processes with 2 days soaking time. Gelatin prepared from acid-curing (GA) gave yield 8.47%, protein content 82.59%, and 23.50%. While gelatin from alkali process (GB) gave yield 7.37%, protein content 79.75% %, and fat content 15.76%. FTIR spectra of GA and GB were very similar. Both GA and GB exhibited peaks at wavelength number for region of amide A, amide I, II, and III which a characteristic for gelatin functional groups. GB exhibited peaks at 1242 cm-1 with low intensity in the amide III region while GA did not. This result is associated with the loss of triple helix or denaturation of collagen to gelatin. Based on FTIR results it can be concluded that GA and GB obtained were true gelatins, although GA gave a better result.
Keywords : isolation, gelatin, FTIR analysis, collagen, skin of chicken feet Broiler
PENDAHULUAN
Gelatin adalah suatu protein yang diperoleh dari hidrolisis parsial protein serabut
kolagen yang banyak terdapat pada kulit, tulang dan jaringan ikat hewan. Gelatin merupakan produk multiguna dan banyak dimanfaatkan dalam industri makanan, farmasi, obat-obatan,
dan lain-lain. Di Indonesia selama ini, kebutuhan akan gelatin dominan dipenuhi dengan cara impor dari negara-negara penghasil gelatin sehingga setelah tiba di Indonesia biayanya menjadi mahal. Masalah yang lebih krusial lagi adalah masalah kehalalnya bagi umat muslim, mengingat bahan baku gelatin impor diduga berasal dari kulit atau tulang babi (Apriyantono, 2003), tentunya masalah ini sangat menggangu konsumen dalam negeri. Oleh karena itu, pentingnya diproduksi gelatin dari bahan-bahan yang menjawab keraguan tersebut.
Pemanfaatan kulit kaki atau ceker ayam (shank) sebagai bahan baku gelatin perlu dikaji potensinya, mengingat komponen tersebut keberadaannya sangat melimpah yang selama ini pemanfaatannya belum optimal, tetapi memiliki komposisi kimia yang mendukung yakni kadar protein total lebih dari 80% (Purnomo, 1992). Sebagai contoh, dari data statistik pertanian tahun 2003, jumlah potongan kaki ayam yang dihasilkan 1.297.333.333 potong yang siap dimanfaatkan untuk memproduksi gelatin (Suryana, 2004). Kemudian, jumlah pemotongan ayam broiler di Indonesia pada tahun 2006 sebanyak 8,61 juta ton dan pada tahun 2007 meningkat menjadi 9,18 juta ton (Wahyu dan Gabriel, 2007). Ini berarti, jumlah potongan kaki ayam juga semakin meningkat. Sementara, saat ini ceker ayam baru hanya dimanfaatkan sebagai campuran sup dan krupuk ceker. Nilai tambah dari kedua produk tersebut masih rendah. Tingginya kandungan protein pada kulit kaki ayam membuka peluang untuk dapat mengisolasi gelatin secara ekstraksi sehingga menambah nilai ekonomi dari ceker tersebut. Namun disisi lain, belum diperoleh metode yang efektif dan efisien untuk mengekstraksi protein kolagen pada kulit kaki ayam broiler agar dihasilkan gelatin yang sesuai dengan SNI dan bebas lemak.
Gelatin dibedakan berdasarkan proses curing yang dilakukan sebelum ekstraksi yaitu gelatin tipe A (asam) dan tipe B (basa). Tujuan jangka panjang dari penelitian yang dilakukan adalah menemukan metode yang tepat untuk mengisoalsi gelatin dari kulit kaki ayam Broiler agar dihasilkan gelatin dengan kulaitas yang setara atau lebih tinggi dari gelatin yang diisolai dari kulit dan tulang babi dan sapi, sehingga bisa menggantikan sumber gelatin yang selama ini
digunakan. Ada beberapa metode yang telah dikembangkan, seperti Radiman (1976) menyebutkan bahwa metode ekstraksi yang bisa digunakan dalam ekstraksi protein kolagen kulit sapi adalah dengan cara ekstraksi bertingkat yang menekankan pada variasi suhu ekstraksi. Hasil dari metode ini dipastikan akan diperoleh gelatin dengan kandungan lemak/minyak yang tinggi serta viskositas atau kekentalannya rendah, sehingga kualitas gelatin menjadi rendah karena mudah tengik (Anonim, 2005). Bailey (1992) telah melakukan penelitian untuk mengetahui pengaruh metode curing menggunakan garam terhadap kelarutan protein kulit sapi. Hasilnya, terjadi pelepasan (terekstrak) protein kulit selama curing menggunakan garam 0,6% dari berat kulit segar, namun kandungan lemaknya relatif masih tinggi sehingga dipastikan gelatin yang dihasilkan juga cepat tengik. Selain itu, Miller et al., (1983) telah berhasil mengekstrak protein kolagen dari kulit yaitu dengan melakukan pemisahan menggunakan campuran kloroform dan metanol dengan perbandingan 50:50. Kelebihan metode Miller ini, yakni telah ada upaya untuk meminimalkan kandungan lemak dalam gelatin. Akan tetapi kelemahan metode ini adalah proses ekstraksi akan berjalan lambat, karena campuran larutan pengekstrak kloroform dan metanol yang digunakan merupakan larutan pengekstrak semipolar kuat, sehingga menyebabkan kolagen menjadi kering atau kolagen menjadi sulit pecah. Tentunya, waktu proses ekstraksi menjadi sangat lambat. Tujuan jangka pendek dari penelitian adalah mempelajari metode ekstraksi untuk mengisolasi gelatin dari kulit kaki ayam broiler dan kajian sifat fisiko-kimia. Untuk mengetahui gelatin yang dihasilkan adalah benar, maka perlu dilakukan karakterisasi gugus fungsi gelatin dengan spektroskopi fourier transform infrared (FTIR). Sejauh ini belum ada laporan tentang karakterisasi gelatin yang diperoleh dari kulit kaki ayam broiler dengan spektroskopi FTIR. Sebagai tahap awal dari penelitian yang dikerjakan, maka artikel ini melaporkan tentang bagaimana cara menganalisis kurva spektra FTIR gugus khas gelatin hasil ekstraksi kulit kaki ayam Broiler setelah melaui proses curing asam dan basa.
BAHAN DAN METODE
Preparasi Kulit Kaki Ayam Broiler
Bahan dasar penelitian ini adalah kaki ayam broiler hasil limbah RPA di sekitar Kodya Denpasar. Kaki ayam broiler dikuliti dengan teknik pengulitan menurut metode Purnomo (1992). Kulit yang diperoleh terlebih dahulu dipotong hingga berukuran kecil-kecil, dicuci dengan aquades sampai bersih, ditiriskan dan diangin-anginkan hingga tidak ada lagi air yang menetes, lalu ditimbang beratnya.
Isolasi dan Karakterisasi Gelatin
Isolasi gelatin dilakukan melalui dua tahap yaitu tahap hidrolisis kolagen dengan proses curing (perendaman) asam atau basa dan dilanjutkan dengan proses ekstraksi.
Tahap Hidrolisis
Pada tahap ini dilakukan proses curing asam dengan larutan asam asetat (CH3COOH) dan curing basa dengan larutan. Untuk mendapatkan konsentrasi optimum dalam proses curing asam dan basa, maka dilakukan proses curing dengan variasi konsentrasi larutan CH3COOH dan NaOH dengan waktu curing selama 3 hari. Masing-masing sebanyak ± 50 gr kulit kaki ayam broiler dimasukan dalam 4 botol sampel 1L yang berbeda, kemudian ditambahkan larutan CH3COOH 0,5; 1,0; 1,5; dan 2,0% (v/v) dengan rasio berat kulit terhadap larutan yang digunakan (1:8) dengan pengadukan dan ditutup. Proses curing dilakukan selama 3 hari. Hasil curing kemudian dicuci dengan akuades sampai filtrat hasil pencucian menunjukkan pH netral dan ditiriskan.
Tahap Ekstraksi, Pengentalan dan Pengeringan Gelatin.
Kulit ayam hasil curing asam maupun basa kemudian diekstraksi dengan waterbath pada suhu 70oC selama 20 menit. Ekstrak yang diperoleh kemudian disaring, diukur volumenya, ditempatkan dalam wadah sampel dan didinginkan dalam lemari pendingin sampai mengental dan berbentuk gel. Setelah
mengental, gel yang diperoleh dikeringkan dalam oven pada suhu 70oC selama 24 jam, didinginkan dalam desikator dan beratnya
ditimbang. Prosedur yang sama dilakukan untuk proses curing basa dengan konsentrasi larutan NaOH yang digunakan 0,5; 1,0; 1,5; dan 2,0% (b/v). Untuk menentukan waktu curing, maka dilakukan variasi waktu curing yaitu 1; 2; dan 4 hari. Konsentrasi larutan asam dan basa yang memberikan berat gelatin terbanyak dipilih untuk digunakan dalam menentukan lama waktu perendaman. Produk gelatin yang diperoleh dengan menggunakan kondisi optimum tersebut (konsentrasi asam/basa dan lama waktu proses curing) selanjutnya dikarakterisasi dengan FTIR, dihitung rendemennya dan dianalisis kadar proteinnya.
Karakterisasi Gugus Fungsi Gelatin
Gugus fungsi gelatin dikarakterisasi dengan spektroskopi Fourier Transform Infra Red, FTIR dengan metode pelet KBR. Sampel bubuk gelatin sebanyak 2 mg dicampur dengan 100 mg serbuk kering KBr dan ditumbuk hingga halus. Campuran tersebut kemudian dimampatkan dalam sebuah cetakan menggunakan pompa hidrolik sehingga membentuk kepingan tipis (pelet). Karakterisasi terhadap kepingan sampel dilakuan dengan spektrometer FTIR Shimadzu pada panjang gelombang 4000-500 cm-1, yang dilakukan di Jurusan Kimia, FMIPA UGM, Yogyakarta
HASIL DAN PEMBAHASAN
Dari ± 5 kg kaki ayam broiler setelah dibersihkan dari kotoran yang melekat, dikuliti, dipotong kecil-kecil, dicuci beberapa kali dengan air kran, dibilas dengan akuades kemudian ditiriskan dan diangin-anginkan hingga kering (tidak ada lagi tetesan air) diperoleh ± 600 gram sampel kulit kaki ayam.
Secara konvensional metode isolasi gelatin terdiri dari dua tahap proses yaitu proses hidrolisis dengan asam atau basa atau juga sering disebut dengan istilah curing asam/basa, perendaman atau maserasi dan proses ekstraksi gelatin. Tujuan dari curing asam atau basa adalah untuk melemahkan struktur kolagen, demineralisasi, melarutkan protein non-kolagen, menghidrolisis sebagian dari ikatan peptida
dengan masih mempertahankan konsistensi serat kolagen, dan membunuh bakteri.
Dari hasil yang diamati, secara umum protokol curing menggunakan asam asetat menunjukkan proses swelling struktur tropokolagen kulit kaki ayam lebih cepat dibandingkan dengan curing basa NaOH. Curing dengan asam asetat menyebabkan tropokolagen pada kulit kaki ayam mengembang maksimal dan hampir memenuhi botol sampel sehingga tidak terlihat ada pelarut asam asetat yang tersisa sedangkan dengan NaOH protein tropokolagen hanya sedikit mengembang sehingga pelarutnya masih banyak tersisa. Dalam proses ekstraksi gelatin, curing asam asetat menghasilkan ekstrak
gelatin berwarna jernih dan encer dengan volume yang relatif lebih banyak sedangkan ekstrak gelatin hasil curing basa NaOH berwarna kekuningan, lebih kental dan volumenya lebih sedikit. Hasil penentuan konsentrasi optimum asam asetat dan basa NaOH pada proses curing ditabulasikan pada Tabel 1 dan Tabel 2. Seperti tersaji pada Tabel 1 dan 2, curing asam asetat dengan konsentrasi 1,5% menghasilan gelatin dengan volume dan berat kering tertinggi yaitu 150 mL dan 4,05g. Sedangkan, curing basa NaOH dengan konsentrasi 2,0% memberikan volume dan berat kering gelatin maksimal yaitu secara berurutan 90 mL dan 4,36g.
Tabel 1. Rataan volume dan berat kering gelatin dari kulit kaki ayam dengan curing asam asetat variasi konsentrasi selama 3 hari
|
Berat Sampel (g) |
Konsentrasi (%) |
Waktu (hari) |
Volume Gelatin (mL) |
Berat Kering (g) |
|
50,38 |
0,5 |
3 |
120 |
2,36 |
|
50,40 |
1,0 |
3 |
128 |
3,51 |
|
50,23 |
1,5 |
3 |
150 |
4,05 |
|
50,15 |
2,0 |
3 |
135 |
2,25 |
Tabel 2. Rataan volume dan berat kering gelatin dari kulit ceker dengan curing basa variasi konsentrasi selama 3 hari
|
Berat Sampel (g) |
Konsentrasi (%) |
Waktu (hari) |
Volume Gelatin (mL) |
Berat Kering (g) |
|
50,78 |
0,5 |
3 |
39 |
3,01 |
|
50,00 |
1,0 |
3 |
33 |
2,07 |
|
50,02 |
1,5 |
3 |
65 |
3,18 |
|
50,37 |
2,0 |
3 |
90 |
4,36 |
Tabel 3. Rataan berat kering gelatin (g) dari variasi waktu curing asam dan basa
|
Jenis curing |
Berat kering gelatin (g) dalam waktu curing: 1 hari 2 hari 4 hari |
|
Asam konsentrasi 1,5% Basa konsentrasi 2,0% |
2,20 4,38 2,17 3,28 3,69 2,78 |
Tabel 4. Rendemen dan kadar protein gelatin hasil isolasi kulit kaki ayam dengan waktu curing 2 hari
Jenis curing Rendemen (%) Kadar Protein (%) Kadar Lemak (%)
Asam konsentrasi 1,5% (GA) 8,74 81,59 23,50
Basa konsentrasi 2,0% (GB) 7,37 79,75 15,76
Untuk penentuan waktu optimum, maka konsentrasi asam asetat 1,5% dan basa NaOH 2,0% dipilih dalam proses curing dengan memvariasikan waktu curing yaitu 1; 2; dan 4 hari dan hasilnya disajikan pada Tabel 3. Seperti tertera pada Tabel 3, waktu curing 2 hari memberikan berat gelatin tertinggi yaitu 4,38g dengan asam asetat 1,5% dan 3,69g dengan basa NaOH 2,0%. Rendemen gelatin dari ekstraksi kulit kaki ayam Broiler setelah proses curing dengan asam asetat 1,5% adalah 8,74% sedangkan dengan basa NaOH 2,0% sebesar 7,37% (Tabel 4). Hasil ini hampir sama dengan rendemen gelatin yang diperoleh dari ekstraksi kulit ikan Leatherjacket hasil curing asam asetat yaitu 5-9%.
Semakin lama proses perendaman, maka berat gelatin yang diperoleh juga menurun. Hasil ini menjelaskan bahwa bila perendaman dilakukan terlalu lama, maka tropokolagen tidak hanya mengalami swelling tetapi rantai tropokolagen telah terurai menjadi gelatin yang larut dalam larutan peng-curing sehingga menurunkan rendemen ekstrak gelatin (Tabel 3).
Seperti tersaji pada Tabel 3, kadar lemak dari gelatin hasil ekstraksi kaki kulit ayam
Broiler melalui proses curing asam asetat 1,5 % maupun basa NaOH 2,0% masih sangat tinggi. Sehingga diperlukan metode untuk menurunkan kadar lemaknya. Hal ini sangat penting karena menurut SNI gelatin yang baik mengandung lemak kurang dari 5% (Anonim, 1995).
Karakterisasi Gugus Fungsi Gelatin
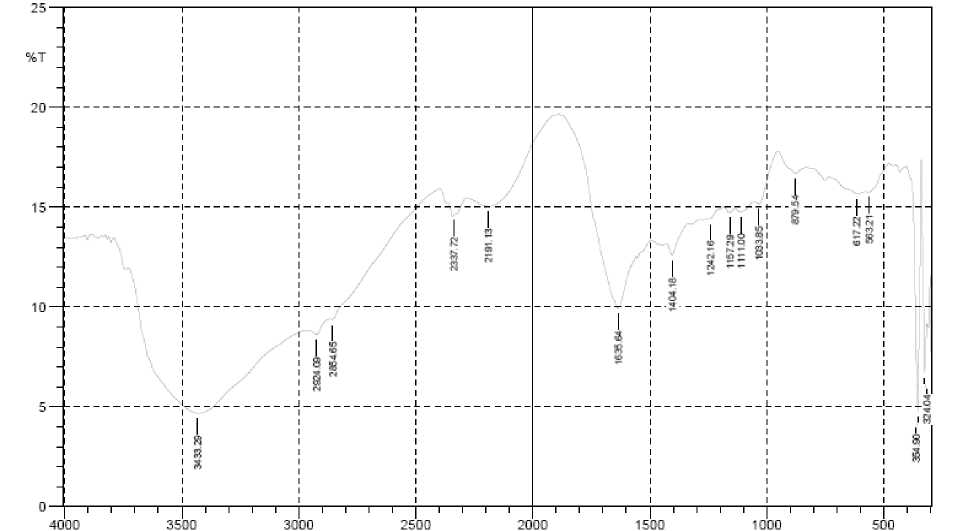
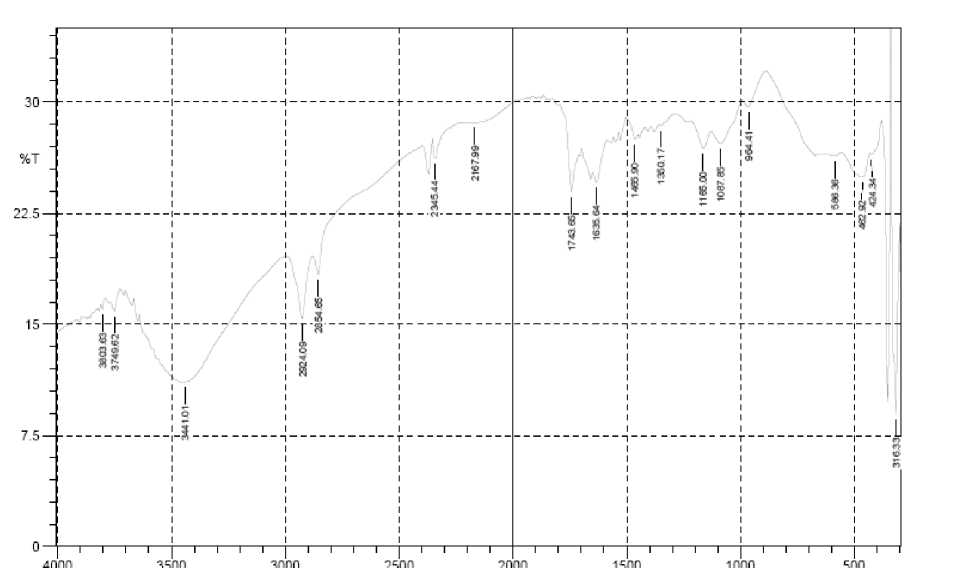
Untuk membuktikan bahwa hasil ekstraksi kulit kaki ayam broiler yang sebelumnya telah direndam dalam larutan asam asetat 1,5% (GA) dan NaOH 2,0% (GB) selama 2 hari adalah memang benar gelatin, maka dilakukan karakterisasi serapan gugus fungsi khas gelatin dengan spektroskopi FTIR. Kurva puncak serapan khas gelatin dibagi menjadi 4 bagian, yaitu daerah serapan amida A pada ν 3600-2300 cm-1, amida I pada ν 1636-1661 cm-1, amida II pada ν 1560-1335 cm-1, dan amida III pada ν 1300-1200 cm-1 (Muyongga, 2004). Rangkuman puncak serapan GA dan GB dan gugus fungsinya disajikan pada Tabel 5, sedangkan spektra FTIR GA dan GB dapat dilihat pada Gambar 1 dan Gambar 2.
Tabel 5. Rangkuman puncak serapan gelatin asam (GA) dan basa (GB)
|
Daerah Serapan |
Bilangan gelombang pada puncak serapan (cm-1) |
Dugaan | |
|
GA |
GB |
gugus fungsi | |
|
Amida A |
3749 3441 2924 2854 2345 |
3433 2924 2854 2337 |
NH bebas NH streching dari gugus amida yang berasosiasi dengan ikatan hidrogen dan OH dari hidroksi prolin CH2 asimetri streching CH2 simetri streching |
|
Amida I |
1743 1635 |
1635 |
C=O streching/ikatan hidrogen yang bergandengan dengan COO- C=O streching dengan kontribusi dari NH bending, dan CN streching |
|
Amida II |
1485 1350 |
1404 |
Deformasi NH, CH2 bending CH2 wagging dari proline CH2 wagging dari prolin |
|
Amida III |
1165 1087 985 |
1242 1157 1111 1033 |
NH bending C=O streching –CH2 |
Gambar 1. Spektra FTIR untuk Gelatin B, Curing Basa (NaOH 2%) selama 2 Hari
Gambar 2. Spektra FTIR untuk Gelatin A, Curing Asam Asetat 1,5% selama 2 Hari
GA dan GB memberikan spektra FTIR yang hampir sama. Pada kurva serapan amida A, GA menunjukkan serapan melebar pada ν 3441 cm-1 dan gelatin B pada ν 3433 cm-1 dengan serapan yang lebih lebar. Puncak serapan ini disebabkan oleh adanya ikatan regangan N-H dari gugus amida yang berasosiasi dengan ikatan hidrogen, dan adanya gugus OH. Bentuk puncak yang melebar merupakan bukti adanya gugus OH dari hidroksiprolin. Kebanyakan puncak N-H bebas yang diserap mempunyai bentuk sempit dan tajam pada ν 3650-3580 cm-1. Apabila gugus NH dari suatu peptida terlibat dalam ikatan hidrogen, maka posisinya akan bergeser ke bilangan gelombang atau frekuensi yang lebih rendah dan terdapatnya kemungkinan pertindihan ikatan NH dengan gugus OH pada daerah tersebut, yang menyebabkan terjadinya serapan dengan puncak yang melebar. Bagian amida A yang kedua adalah serapan pada ν 2930-2300cm-1. GA menunjukkan serapan pada ν 2924, 3854, dan 2345 cm-1, dan GB menunjukkan serapan pada ν 2924, 3854, dan 2337 cm-1. Menurut Kemp (1987), puncak ini menunjukkan bahwa gugus NH dalam amida akan cenderung berikatan dengan dengan regangan CH2 apabila gugus karboksilat dalam keadaan stabil. Dengan demikian GA dan GB yang diuji telah terbukti memiliki gugus OH, regangan NH, dan regangan CH2. Perbedaan yang terlihat antara GA dan GB pada kurva amida A yaitu GA menunjukkan serapan yang sempit dan tajam dengan intensitas rendah pada ν 3749cm-1 yang disebabkan oleh adanya gugus NH bebas, sedangkan GB tidak menunjukkan serapan pada daerah tersebut. Hal ini diduga disebabkan pada proses perendaman dengan asam, ada komponen protein lain atau fragmen protein non-kolagen yang ikut terkestrak dan lolos dalam proses penyaringan gelatin, yang juga didukung oleh adanya serapan regangan C=O karbonil dari asam kaboksilat pada ν 1743cm-1.
Gugus khas gelatin berikutnya adalah amida I. Puncak serapan pada frekuensi 16361661 cm-1 yang disebut sebagai kurva serapan amida I (Muyonga, dkk., 2004) Serapan ini disebabkan oleh adanya regangan ikatan ganda gugus karbonil C=O, bending ikatan NH, dan regangan CN. Daerah serapan amida I ini
menunjukkan adanya regangan C=O dan gugus OH yang berpasangan dengan gugus karboksil. Daerah serapan 1660-1650 cm-1 dikenal sebagai daerah serapan residu imida (struktur random coil) dan pada 1635-1645 cm-1 merupakan residu imida dari struktur ß-sheet (Prystupa dan Donald, 1996). Pada kurva amida I, baik GA maupun GB menunjukkan serapan pada ν 1635 cm-1 sehingga memiliki struktur random coil dengan ß-sheet yang merupakan gugus khas gelatin.
Puncak serapan khas gelatin pada kurva amida II yaitu pada ν 1560-1335 cm-1 (Muyonga, dkk., 2004). Vibrasi amida II disebabkan oleh deformasi ikatan N-H dalam protein. Daerah serapan ini berkaitan dengan deformasi tropokolagen menjadi rantai α-helix. GA dan GB tidak menunjukkan serapan pada ν 15501540 cm-1 (deformasi NH). Hasil ini hampir sama dengan kurva amida II dari gelatin hasil ekstraksi kulit muda ikan Nila pada suhu 500C yang juga tidak menunjukkan serapan pada daerah ν 1550-1540 cm-1, namun dilaporkan memiliki kekuatan gel yang tinggi yaitu 217g (Muyonga, dkk., 2004). Hal ini dapat dijelaskan terdapat kemungkinan bergabungnya atau tumpang tindihnya puncak serapan pita amida I dan pita mida II, dimana adanya serapan melebar pada ν 1635 cm-1 (merupakan sruktur random coil dari gelatin) puncak serapannya melebar dan mempunyai serapan bahu dengan intensitas rendah pada daerah pita amida II ν 1550-1540 cm-1 yang menandakan adanya struktur α-helix. Pada kurva serapan amida II berikutnya, GA menunjukkan puncak serapan pada ν 1485 cm-1 yang disebabkan oleh adanya vibrasi bending CH2 dari gugus proline dan pada 1350 cm-1 yang disebabkan oleh vibrasi wagging CH2 dari gugus proline. Sedangkan GB menunjukkan serapan pada ν 1404 cm-1 yang disebabkan oleh vibrasi bending CH2 dari gugus prolin. Dalam hal ini dapat dikatakan bahwa GA dan GB telah menghasilkan rantai α-helix dan memiliki gugus khas gelatin prolin.
Daerah serapan spesifik terakhir dari gelatin adalah amida III. Puncak serapannya adalah pada 1200-1300 cm-1 (Fries and Lee, 1996) yang berhubungan dengan struktur triplehelix (kolagen). GB menunjukkan puncak serapan dengan intensitas rendah pada 1242 cm-1
sedangkan GA tidak memperlihatkan serapan pada daerah tersebut. Hal ini berarti pada GB masih ada sebagian kecil struktur kolagen yang belum terdenaturasi menjadi gelatin dan lolos dalam proses penyaringan ekstrak gelatin. Sedangkan pada GA sudah tidak ada lagi struktur kolagen atau sudah semuanya terdenaturasi menjadi gelatin, atau dapat dikatakan bahwa struktur GB lebih banyak mengandung ikatan hidrogen intermolekuler dibandingan dengan GA.
Selain itu, spektra GA dan GB memiliki puncak serapan pada bilangan gelombang sekitar 1000-1100 cm-1 yang disebabkan oleh vibrasi C-O karbohidrat (Jackson, 1995). Karbohidrat dalam kolagen, ada karena adanya proses glisasi kolagen. Glisasi kolagen atau yang disebut dengan non-enzimatik glikosilasi molekul gula, sebagai contoh glukosa yang berikatan dengan asam amino kolagen arginin dan lisin tanpa adanya peran enzim. Puncak serapan pada ν 1087 cm-1 yang diperlihatkan oleh GA dan 1111 cm-1 pada GB menunjukkan GA dan GB mengandung karbohidrat pada struktur kolagennya. Pada spektra GA terlihat juga puncak serapan pada ν 1165 cm-1 dan GB pada ν 1157 cm-1 yang disebabkan oleh vibrasi regangan C-O dari rantai pendek peptida yang terjadi secara koinsidentil karena degradasi rantai peptida. GA dan GB juga memberikan serapan pada ν 985 dan 1033 cm-1 berurutan yang merupakan puncak serapan regangan asimetri gugus fosfat dari fosforlisasi protein yang bergandengan dengan –CH2 dari residu asam amino (Jackson, 1995).
Secara keseluruhan, kurva spektra gelatin hasil ekstraksi kulit kaki ayam broiler hasil curing asam asetat dan basa NaOH memiliki intensitas yang semakin besar dari amida A sampai amida II dan puncak-puncak pada amida II hampir tak terlihat. Hal ini sudah sesuai dengan teori bahwa kolagen telah berhasil dinaturasi menjadi gelatin. Berdasarkan analisis FTIR, GA menunjukkan serapan gugus fungsi khas gelatin yang lebih menonjol.
SIMPULAN DAN SARAN
Simpulan
Gelatin berhasil diekstraksi dari kulit kaki ayam Broiler dengan curing asam asetat 1,5 %(GA) maupun basa NaOH 2,0% (GB).
Ekstraksi gelatin hasil proses curing asam asetat memberikan yield 8,74% dengan kadar protein 81,59%, dan kadar lemak 23,50% sedangkan ekstraksi hasil curing basa NaOH memberikan yield 7,37% dengan kadar protein 79,75%, dan kadar lemak 15,76%. Analisis FTIR menunjukkan adanya serapan khas gugus fungsi gelatin pada daerah gugus amida A, amida I, II, dan amida III pada GA maupun GB. Dititikberatkan pada analisis FTIR, GA menunjukkan kualitas gelatin yang lebih baik.
Saran
Metode ekstraksi terkombinasi untuk mendapatkan gelatin dari kaki kulit ayam broiler dengan kadar lemak rendah perlu dikaji dan dikembangkan lebih lanjut.
UCAPAN TERIMA KASIH
Pada kesempatan ini diucapkan terima kasih kepada DP2M Ditjen Dikti atas persetujuan pemberian dana Penelitian Fundamental tahun anggaran 2011, sehingga kegiatan penelitian dapat berjalan dengan baik.
DAFTAR PUSTAKA
Anonim, 2005, Gelatin,
Http://www.Isbu.ac.uk/water/hygel.html Apriyantono, H. A., 2003, Makalah Halal:
Kaitan Antara Syar’i, Teknologi, dan Sertifikasi, www.indohalal.com/doc-
Bailey, D. G., 1992, Protein Removal from
Cattlehides during Brine Curing I. Identification of Bovine Serum Albumin as The major Salt Soluble Protein Component, Jalca, 87 : 26-35
Friess, W., and Lee, G., 1996, Basic
thermoanalytical studies of insoluble collagen matrices, Biomaterials, 17 (23) : 2289–2294
Jamilah and Harvinder, K. G., 2002, Properties of gelatins from skins of fish–Black tilapia (Oreochromis mossambicus) and red tilapia (Oreochromis nilotica), Food Chemistry, 77 (1) : 81–84
Jackson, M., Choo, L. P., Watson, Halliday, W. C., and Mantsch, H. H., 1995, Beware of connective tissue proteins: assignment and implications of collagen absorption in infrared spectra of human tissues, Biochimica et Biophysica Acta– Molecular Basic of Disease, 1270 : 1–6
Kemp, W., 1987, Organic Spectroscopy. Second ed., Macmillan Education Ltd., Hampshire
Miller, A. J., Karmas, and Lui, M. F., 1983, Age Related Changes in Collagen of Bovine Corium: Studies on Extractability
Solubility and Molecular Size Distribution, J. Food Sci., 48 : 681-707
Muyonga, J. H., Cole, C. G. B., and Duodu K. G., 2004, Extraction and physico
chemical characterisation of Nile perch
(Lates niloticus) skin and bone gelatin, Food Hydrocolloids, 18 (4) : 581–592
Muyonga, J. H , Cole, C. G. B., and Duodu, K. G., 2004, Fourier transform infrared
(FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus), Food Chemistry, 86 (3) : 325-332
Prystupa, D. A. and Donald, A. M., 1996,
Infrared study of gelatin conformations in gel and sol states, Polymer Gels and Networks, 4 : 87–110
Purnomo, E., 1992, Penyamakan Kulit Kaki
Ayam, Kanisius, Yogyakarta
Radiman, 1979, Penuntun Pembuatan Gelatin, Lem dan Kerupuk dari Kulit Hewan Secara Industri Rumah/Kerajinan, Balai Penelitian Kulit, Jogyakarta
Suryana, A., 2004, Ketahanan Pangan Cukup Baik Meski Belum Sempurna, Sinar Tani, Edisi 31 Desember 2003–6 Januari 2004, No. 3028, Th XXXIV
Wahyu, T. dan Gabriel, 2007, Produksi Ayam 2007 Naik 5,2 Persen.
Tempointeraktif.com, Diakses Tanggal 12 Desember 2007
87
Discussion and feedback