FRAKSINASI AMONIUM SULFAT PADA ENZIM ?-L-ARABINOFURANOSIDASE TERMOSTABIL
on
ISSN 1907-9850
FRAKSINASI AMONIUM SULFAT PADA ENZIM α-L-ARABINOFURANOSIDASE TERMOSTABIL
I Nengah Wirajana1 dan Ni Nyoman Tri Puspaningsih2
1Jurusan Kimia FMIPA Universitas Udayana, Bukit bJimbaran 2Jurusan Kimia Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya
ABSTRAK
Enzim-enzim α-L-arabinofuranosidase (EC 3.2.1.55) mengkatalisis hidrolisis ikatan α-L-arabinofuranosidik dan berperan secara sinergis dengan enzim hemiselulase lainnya untuk hidrolisis sempurna hemiselulosa. Ragi Saccharomyces cerevisiae yang telah dikenal sebagai mikroba Generally Recognized As Safe (GRAS) dipilih untuk mensekresikan α-L-arabinofuranosidase (AbfA) termostabil yang berasal dari Geobacillus thermoleovorans IT-08 dengan teknologi DNA rekombinan. Énzim ekstraseluler hasil sekresi dari ragi rekombinan ini dipresipitasi dengan fraksinasi amonium sulfat. Berdasarkan hasil pengukuran aktivitas enzim dan konsentrasi protein total menunjukkan bahwa aktivitas spesifik enzim AbfA terendah pada 40% kejenuhan ammonium sulfat, dan tertinggi pada 80% kejenuhan amonium sulfat.
Kata Kunci : α-L-arabinofuranosidase, Saccharomyces cerevisiae, Geobacillus thermoleovorans IT-08
ABSTRACT
α-L-Arabinofuranosidases (EC 3.2.1.55) catalyze the hydrolysis α-L-arabinofuranosidic bonds and act synergistically with other hemicellulases enzymes for the complete hydrolysis of hemicelluloses. Yeast Saccharomyces cerevisiae that considered as Generally Recognized As Safe (GRAS) was chosen for expression and secretion of thermostable α-L-arabinofuranosidase (AbfA) from Geobacillus thermoleovorans IT-08 termofilik dengan teknologi DNA rekombinan. The extracellular enzyme from the secretion result in this recombinant yeast was precipitated with ammonium sulphate fractionation. Base on the result of measurement of the enzyme activity and the concentration of total protein showed that the specific activity of AbfA enzyme was the lowest at 40% saturation of ammonium sulfat, and the highest at 80% saturation of ammonium sulfat. .
Keywords : α-L-arabinofuranosidase, Saccharomyces cerevisiae, Geobacillus thermoleovorans IT-08.
PENDAHULUAN
Komponen utama hemiselulosa umumnya adalah xilan, manan, arabinan, dan arabinogalaktan. Pemecahan sempurna pada polimer hemiselulosa tersebut, khususnya xilan, arabinan, dan arabinogalaktan memerlukan aktivitas sinergis dari beberapa enzim hemiselulase, salah satunya adalah α-L-arabinofuranosidase (EC 3.2.1.55). Enzim ini mengkatalisis hidrolisis ikatan α-L-
arabinofuranosidik dan berperan secara sinergis dengan enzim hemiselulase lainnya untuk hidrolisis sempurna hemiselulosa (Kaji, 1984; Saha, 2000). Prospek enzim ini cukup menjanjikan dalam aplikasinya pada berbagai proses agro-industri, seperti peningkatan kualitas pulp, roti, aroma anggur (wine), penjernihan jus, dan pakan ternak; serta produksi bioetanol dan sintesis oligosakarida (Numan & Bhosle, 2006; Saha, 2003).
Aplikasi utama penggunaan α-L-arabinofuranosidase dengan hemiselulase lainnya adalah dalam biokonversi material lignoselulosa untuk fermentasi dan peningkatan kemampuan dicernakannya bahan pakan ternak. Enzim ini juga telah dimanfaatkan dalam proses biobleaching dari pulp dan kertas untuk mengurangi atau mengeliminasi kebutuhan senyawa-senyawa kimia klorin. Enzim yang bersifat termostabil lebih sesuai untuk proses industri, karena tingginya temperatur yang diperlukan, dan kelarutan dari substrat yang mudah dicapai pada suhu tinggi (Debeche et al., 2000; Birgisson et al., 2004).
Protein-protein heterolog yang diekspresi dalam ragi sering ditargetkan untuk jalur sekresi ke dalam media kultur yang menyederhanakan proses pemurnian. Meskipun hal ini menguntungkan, level atau tingkat sekresi protein menggunakan ragi sering rendah dan berubah-ubah. Banyak upaya telah dibuat untuk menaikkan level sekresi. Walaupun kebanyakan penelitian berhasil dalam menghasilkan level yang lebih tinggi, namun hasil-hasilnya cenderung untuk protein tertentu saja, yang belum tentu sesuai untuk protein lain (Huang et al., 2008). Ekspresi enzim termofilik di sel inang mesofilik, seperti Saccharomyces cerevisiae, yang sesuai untuk sekresi efektif protein heterolog ke media pertumbuhan, dapat mengurangi biaya produksi dan menyederhanakan proses hilir (down-stream proscessing) (López-López et al., 2010).
Ragi S. cerevisiae yang telah dikenal sebagai mikroba Generally Recognized As Safe (GRAS) dipilih untuk mensekresikan α-L-arabinofuranosidase (AbfA) termostabil yang berasal dari Geobacillus thermoleovorans IT-08 dengan teknologi DNA rekombinan (Wirajana, 2010; Wirajana et al., 2010). Sebelumnya enzim ini juga telah diklon dan diekspresi di sel inang Echerichia coli (Puspaningsih et al., 2004; Puspaningsih et al., 2005).
Untuk mempelajari karaktersitik enzim AbfA ekstraseluler hasil sekresi di S. cerevisiae, pemurnian protein ini perlu dilakukan. Pemurnian protein pada umumnya diawali dengan fraksinasi, salah satunya dilakukan presipitasi dengan garam ammonium sulfat. Enzim AbfA bersifat termostabil. Sifat ini
menguntungkan dalam preparasi pemurnian enzim karena lebih mudah dipisahkan dengan campuran protein pengotor dengan cara pemanasan. Dalam penelitian ini telah dilakukan fraksinasi enzim AbfA termostabil yang disekresikan dari recombinant ragi S. cerevisiae. Sebelum fraksinasi, pemanasan dilakukan agar protein pengotor lain yang berasal dari sel inang ragi, yang tidak bersifat termostabil terdenaturasi dan terpisah dari enzim rekombinan AbfA.
MATERI DAN METODE
Bahan
Semua bahan kimia yang digunakan mempunyai kualitas pro-analisis (p.a) dan biologi molekuler, kecuali apabila disebutkan lain. Transforman ragi S. cerevisiae BJ1824 yang membawa plasmid pYES2 dan pYHM1-Af ditumbuhkan pada media selektif YNBD2 padat dengan komposisi yeast nitrogen base without amino acids (YNB) 0,67% (b/v), dekstrosa 2% (b/v), bacto-agar 2% (b/v) dan suplemen tertentu (histidin, leusin, dan triptofan). Analisis ekspresi dan sekresi enzim AbfA pada transforman S. cerevisiae BJ1824 yang membawa plasmid rekombinan turunan pYES2 dan pYHM1-Af dilakukan dengan kultivasi dalam media YNBG yang memiliki komposisi sama dengan YNBD2 namun glukosa 2% (b/v) diganti dengan galaktosa 2% (b/v). Coomasive Brilliant Blue G-250 digunakan dalam penentuan kadar protein. Para - nitrofenil-α-L-arabinofuranosida (pNP-A) (Sigma, USA) digunakan sebagai substrat spesifik untuk mengukur aktivitas enzim AbfA. Pada pengukuran dengan spektrofotometer uv-vis digunakan p-nitrofenol (pNP) sebagai larutan standar.
Peralatan
Peralatan gelas dan non-gelas serta instrumen dalam penelitian ini adalah yang umum digunakan di laboratorium biokimia dan biologi molekuler. Instrumen penelitian terdiri dari peralatan yang umum digunakan di laboratorium biokimia dan biologi molekuler, seperti : Spektrofotometer uv-vis, pH-meter, timbangan analitik, inkubator, penangas air,
sentrifuga, microsentrifuga, laminar air flow cabinet, shaker, vorteks, autoclave.
Cara Kerja
Peremajaan ragi dan bakteri
Koloni tunggal ragi S. cerevisiae diambil dengan ose steril dan ditumbuhkan pada media padat YNBD2. Selanjutnya diinkubasi pada suhu 30°C selama 3-4 hari.
Isolasi enzim ekstraseluler dari ragi
Metode yang digunakan diperoleh dari Jazwinski (1990) dan Becker et al. (1996) yang telah dimodifikasi. Koloni tunggal ragi ditumbuhkan dalam 5 ml media selektif YNBD2 pada suhu 30oC dengan penggoyangan 150 rpm selama 1 hari. Sebanyak 1 ml kultur sel yang telah tumbuh di atas diinokulasi ke dalam 100 ml media yang produksi dalam labu Erlenmeyer 500 ml, dan diinkubasi pada suhu 30oC dengan penggoyangan 150 rpm sampai 6 hari. Rekombinan ragi yang membawa plasmid pYES2 atau turunannya (pYHM1-Af), menggunakan media produksi yang selektif YNBG. Pada jam ke 64 panen sel dilakukan dengan sentifugasi 6000 rpm pada suhu 4oC selama 10-20 menit, dan supernatan (media kultur) yang diperoleh merupakan sumber enzim AbfA ekstraseluler yang digunakan untuk pemekatan dengan amonium sulfat.
Presipitasi dengan amonium sulfat
Sebelum dilakukan presipitasi, ekstrak kasar enzim ekstraseluler (media kultur) dipanaskan (heat treatment) pada suhu 70oC selama 1 jam, sehingga enzim AbfA yg termostabil akan tetap ada, sedangkan protein pengotor dari sel inang ragi diharapkan mengendap atau menggumpal. Selanjutnya sampel disentrifugasi, dan supernatan dipresipitasi dengan amonium sulfat. Untuk mengetahui persentase kejenuhan amonium sulfat terbaik yang digunakan untuk pengendapan enzim AbfA (menggunakan Tabel dalam Scope, 1993), terlebih dahulu dilakukan optimasi. Optimasi dilakukan pada persentase kejenuhan amonium sulfat 20%, 30%, 40%,
50%, 60%, 70%, dan 80% dalam masing-masing sampel dengan volume tertentu. Persentase
kejenuhan amonium sulfat terendah dan tertinggi yang dapat mengendapkan enzim AbfA dipilih untuk pengendapan skala besar. Penambahan garam amonium sulfat dilakukan secara perlahan sampai persentase kejenuhan tertentu dengan cara pengadukan menggunakan magnetic stirrer. Presipitat diperoleh dengan sentrifugasi 8.000 rpm pada suhu 4oC selama 20 menit dan selanjutnya dilarutkan dalam 50 mM bufer fosfat pH 6. Larutan didialisis selama 48 jam dan endapannya dihilangkan dengan sentrifugasi (Scope, 1993).
Penentuan kadar protein
Kadar protein diukur dengan metode Braford (dalam Bollag et al., 1996). Sebanyak 100 μl enzim direaksikan dengan 5 ml pereaksi Coomasive Brilliant Blue G-250, dikocok kuat dan dibiarkan selama 20 menit. Absorbans dibaca pada panjang gelombang 595 nm. Blanko menggunakan 100 μl akuades yang direaksikan dengan 1 ml pereaksi Coomasive Brilliant Blue G-250. Standar protein menggunakan bovine serum albumin (BSA) pada kisaran 0,05-0,25 mg protein/ml dari stok BSA 2 mg/ml.
Penentuan aktivitas enzim AbfA
Larutan enzim sebanyak 100 μl dicampur dengan 900 μ1 larutan substrat p-nitrofenil-α-L-arabinofuranosida (pNP-A) (Sigma, USA) dengan konsentrasi akhir 1 mM dalam bufer fosfat 50 mM pH 6. Campuran ini diinkubasi pada suhu 70oC selama 30 menit. Reaksi dihentikan dengan penambahan 100 μl Na2CO3 0,4 M. Aktivitas enzim ditentukan dengan mengukur jumlah p-nitrofenol (pNP) yang dilepaskan. Pengamatan jumlah p-nitrofenol yang dilepaskan diamati secara spektrofotometri pada panjang gelombang 405 nm. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang menghasilkan 1 μmol p-nitrofenol dalam waktu 1 menit pada kondisi percobaan (Puspaningsih, 2004).
HASIL DAN PEMBAHASAN
Enzim α-L-arabinofuranosidase atau AbfA yang berasal dari bakteri termofilik, Geobacillus thermoleovorans IT-08, sebelumnya
telah berhasil disubklon dan diekspresi serta disekresi dalam sistem sel inang eukariot, ragi S. cerevisiae (Wirajana, 2010). Walaupun diekspresi heterolog di sistem sel inang berbeda, pada umunya enzim akan memiliki sifat yang hampir mirip dengan aslinya, seperti sifat termostabilitasnya. Sifat ini menguntungkan dalam preparasi pemurnian enzim karena lebih mudah dipisahkan dengan campuran protein pengotor dengan cara pemanasan. Dalam penelitian ini telah dilakukan fraksinasi enzim AbfA termostabil yang disekresikan dari recombinant ragi S. cerevisiae.
Sebelum fraksinasi dengan ammonium sulfat dilakukan, pada penelitian ini telah dicoba memberikan perlakuan pemanasan terhadap
ekstrak kasar media kultur ragi rekombinan pada suhu 70 oC selama satu jam (data tida dimuat dalam artikel ini). Tujuan pemanasan awal dilakukan adalah agar protein pengotor lain yang berasal dari sel inang S. cerevisiae dapat terdenaturasi dan terpisah dari enzim rekombinan AbfA. Semua protein yang secara alami (original) berasal dari sel inang ragi ini tidak bersifat termostabil. Kondisi ini menguntungkan dalam persiapan awal sebelum pemurnian protein lebih lanjut dilakukan, sehingga tahapan berikutnya akan lebih mudah dan lebih sederhana.
Hasil optimasi persentase kejenuhan amonium sulfat dapat ditunjukkan pada Tabel 1.
Tabel 1. Optimasi persentase kejenuhan amonium sulfat untuk presipitasi protein dalam media kultur dari rekombinan S. cerevisiae.
|
Sampel dan % amonium sulfat |
Aktivitas AbfA (U/mL) |
Kadar protein (mg/mL) |
Aktivitas spesifik AbfA (U/mg) |
|
*Ekstrak kasar 1 |
0,189 |
0,137 |
1,380 |
|
**Ekstrak kasar 2 |
0,217 |
0,105 |
2,067 |
|
Endapan 20% |
0,085 |
0,072 |
1,181 |
|
Endapan 30% |
0,193 |
0,097 |
1,990 |
|
Endapan 40% |
0,319 |
0,114 |
2,798 |
|
Endapan 50% |
1,192 |
0,217 |
5,493 |
|
Endapan 60% |
1,849 |
0,264 |
7,004 |
|
Endapan 70% |
2,148 |
0,292 |
7,356 |
|
Endapan 80% |
2,115 |
0,359 |
5,891 |
|
Supernatan 80% |
Tt |
0,037 |
Tt |
Keterangan:
* Ekstrak kasar 1 = supernatan kultur sel ragi sebelum dipanaskan
** Ekstrak kasar 2 = supernatan kultur sel ragi setelah pemanasan tt = tidak terdeteksi
Diagram batang hasil pengendapan ekstrak kasar enzim AbfA dengan amonium sulfat dapat dilihat pada Gambar 1 dan Gambar 2. Diagram pada Gambar 1 menunjukkan hubungan antara persen kejenuhan amonium
sulfat terhadap aktivitas enzim AbfA dalam U/mg. Sedangkan diagram pada Gambar 2. menunjukkan hubungan antara persen kejenuhan amonium sulfat terhadap aktivitas spesifik enzim AbfA dalam U/mg.
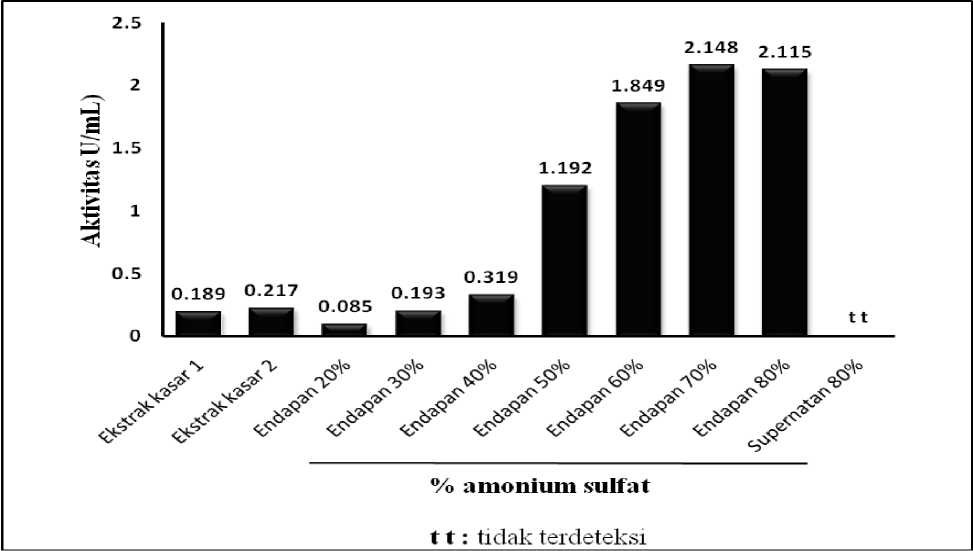
Gambar 1. Diagram batang hasil pengendapan ekstrak kasar enzim AbfA dengan amonium sulfat, yang menunjukkan hubungan antara persen kejenuhan amonium sulfat terhadap aktivitas enzim AbfA dalam U/mL.
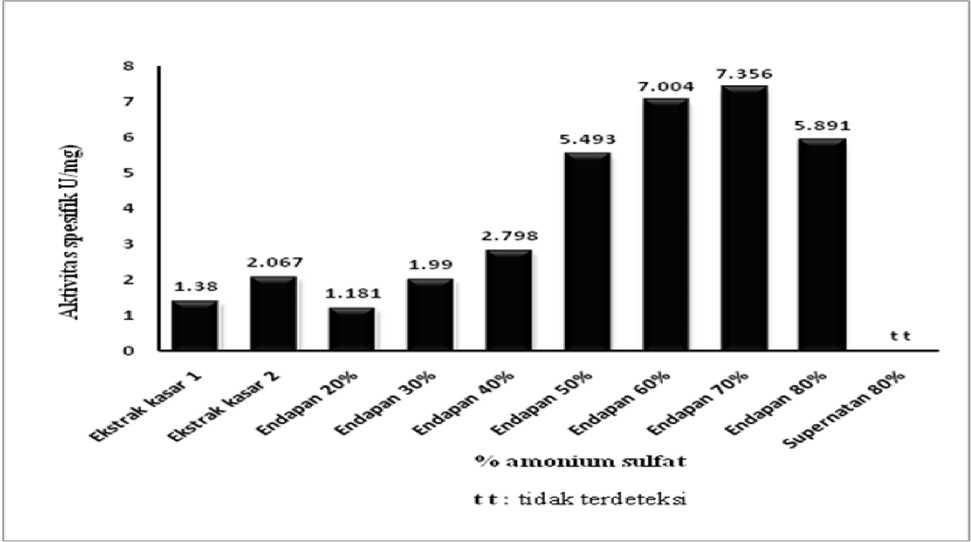
Gambar 2. Diagram batang hasil pengendapan ekstrak kasar enzim AbfA dengan amonium sulfat, yang menunjukkan hubungan antara persen kejenuhan amonium sulfat terhadap aktivitas spesifik enzim AbfA dalam U/mg
Data yang ditunjukan pada Tabel 1, Gambar 1 dan Gambar 2 memberikan gambaran bagaimna presipitasi amonium sulfat dapat memfraksinasi protein-protein yang terdapat dalam media kultur rekombinan ragi. Persen kejenuhan amonium sulfat di bawah 40% tidak menunjukkan pengendapan enzim AbfA yang cukup signifikan. Presipitasi enzim AbfA yang cukup signifikan terjadi pada persen kejenuhan amonium sulfat antara 40% dan 80%. Pada persen kejenuhan amonium sulfat 70% terjadi pengendapan enzim ini yang terbesar. Namun untuk pemisahan secara kasar enzim ini dari protein lainnya lebih baik digunakan persen kejenuhan mulai 40% sampai 80%. Jadi bukan yang tertinggi dipilih karena pada persen kejenuhan amonium sulfat 70% belum semua enzim AbfA dapat terpresipitasi.
Berdasarkan hasil optimasi persen kejenuhan amonium sulfat terhadap presipitasi enzim AbfA, maka persen kejenuhan amonium sulfat terendah adalah 40%, dan persen kejenuhan amonium sulfat tertinggi yang dipilih adalah 80%. Rentang terendah dan tertinggi dari persen kejenuhan amonium sulfat ini dipilih untuk mengendapkan enzim AbfA dalam skala besar nantinya. Umumnya yang akan dilakukan adalah: pertama, ditambahkan amonium sulfat pada ekstrak kasar enzim untuk memberikan kejenuhan 40%, kemudian disentrifugasi. Supernatan dari hasil sentrifugasi ini ditambahkan amonium sulfat selanjutnya agar memberikan kejenuhan 80%. Selanjutnya hasil presipitasi dengan amonium sulfat (40%-80%) ini didialisis dengan menggunakan larutan 50 mM bufer fosfat pH 6,0. Hasil dialisis larutan enzim Abfa ini digunakan untuk karakterisasi enzim AbfA ekstraseluler (yang hanya berasal dari media kultur).
SIMPULAN DAN SARAN
Simpulan
Persen kejenuhan amonium sulfat terendah 40% dan tertinggi 80% dipilih untuk preparasi pemurnian lebih lanjut dan karakterisasi awal enzim AbfA hasil sekresi dari rekombinan ragi.
Saran
Penelitian fraksinasi enzim AbfA hasil sekresi dari rekombinan ragi dengan menggunakan pelarut organik perlu dilakukan untuk alternatif lain dalam preparasi pemurnian enzim ini.
UCAPAN TERIMA KASIH
Melalui kesempatan ini, penulis menyampaikan terima kasih kepada semua pihak yang mendukung sehingga penelitian ini dapat berjalan sebagaimana mestinya, khususnya kepada Prof. Kazuo Sakka dan Asct. Prof. Tetsuya Kimura dari Mie University, Jepang, dan saudari Dwi Purwadi dan One Asmarani dari ITD Universitas Airlangga atas bantuan dan kerjasamanya.
DAFTAR PUSTAKA
Birgisson, H., Fridjonsson, O., Bahrani-Mougeot, F. K., Hreggvidsson, G. O., Kristjansson, J. K., and Mattiasson, B., 2004, A New Thermostable α-L-arabinofuranosidase From a Novel Thermophilic Bacterium, Biotechnology Letters, 26 : 1347-1351
Bollag, D. M., Rozycki, M. D., and Edelstein, S.
J., 1996, Protein Methods, 2nd Ed.,
Wiley-Liss, New York
Huang, D., Gore, P. R., and Shusta, E. V., 2008, Increasing Yeast Secretion of Heterologous Proteins by Regulating Expression Rates and Post-Secretory Loss, Biotechnology and
Bioengineering, 101 (6) : 1264-1275
Kaji, A., 1984, L-Arabinosidases, Advances in Carbohydrate Chemistry and
Biochemistry, 42 : 398-407, Academic Press, Inc.
Numan, M. T. and Bhosle, N. B., 2006, α-L-Arabinofuranosidase: The Potential
Applications in Biotechnology, J. Ind. Microbiol Biotechnol, 33 : 247-260.
Puspaningsih, N. N. T., 2004, Pencirian Enzim Xilanolitik dan Kloning Gen Penyandi Xilosidase dari Bacillus
thermoleovorans IT-08, Disertasi,
Institut Pertanian Bogor
Puspaningsih, N. N. T., Suwanto, A., Suhartono, M. T., Achmadi, S. S., Kimura, T., and Ohmiya, K., 2005, Cloning of Clustered Gene for Thermostable Xylan-Degrading Enzymes, β-Xylosidase and α-L-arabinofuranosidase of Bacillus thermoleovorans IT-08, Int. Workshop on Biorefinery and Bioenergy, Kyoto 910 February 2005
Saha, B. C., 2000, α-L-Arabinofuranosidase:
Biochemistry, Molecular Biology and Application in Biotechnology,
Biotechnology Advances, 18 : 403-423
Saha, B. C., 2003, Hemicellulose bioconversion, J Ind Microbiol Biotechnol, 30 : 279291
Scope, R. K., 1993, Protein Purification:
Principles and Practice, 3nd Ed.,
Springer, p: 71-101, 346-350
Wirajana, I N., 2010, Ekspresi dan Sekresi α-L-Arabinofuranosidase dari Escherichia coli DH5α/pTP510 di Saccharomyces cerevisiae, Disertasi, P. S. MIPA, PPs Universitas Airlangga, Surabaya
Wirajana, I N., Wasito, E. B., Kusuma, S. M., dan Puspaningsih., N. N. T., 2010,
Subkloning Gen α-L-
Arabinofuranosidase (abfA) dalam Vektor Ekspresi pYES2, J. Kimia, 4 (2) : 149-157
181
Discussion and feedback