BIOSORPSI Cr(III) PADA BIOSORBEN SERAT SABUT KELAPA TERAKTIVASI SODIUM HIDROKSIDA (NaOH)
on
ISSN 1907-9850
BIOSORPSI Cr(III) PADA BIOSORBEN SERAT SABUT KELAPA TERAKTIVASI SODIUM HIDROKSIDA (NaOH)
I Wayan Sudiarta1)* dan Emmy Sahara1)
1)Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*) Korespondensi e-mail : dikim_unud@yahoo.co.id
ABSTRAK
Telah dilakukan penelitian biosorpsi Cr(III) pada biosorben serat sabut kelapa teraktivasi NaOH dan NH4OH. Penelitian ini meliputi penentuan konsentrasi optimum basa untuk aktivasi biosorben, penentuan keasaman permukaan biosorben, luas permukaan spesifik, pH optimum, penentuan waktu optimum, dan isotherm adsorpsi.
Hasil penelitian menunjukkan bahwa konsentrasi optimum NaOH untuk aktivasi biosorben adalah 1,2 M. Keasaman permukaan biosorben teraktivasi NaOH (BBN) dan kontrol (B00) berturut – turut adalah 9,99 ± 0,17 dan 3,17 ± 0,21 mmol/g. Luas permukaan spesifik BBN dan B00 secara berturut – turut adalah 20,21 dan 19,14 m2/g. pH optimum yang digunakan untuk BBN dan B00 adalah pH 3, sedangkan untuk waktu optimum yang diperlukan secara berturut – turut adalah 30 dan 120 menit. Biosorpsi Cr(III) pada kedua biosorben mendekati pola isotherm tipe S.
Kata Kunci : Biosorpsi, Kromium(III), Biosorben teraktivasi NaOH
ABSTRACT
Studies on biosorption of chromium (III) on NaOH-activated biosorbent of coconut coir fibre have been carried out. These studies included the determination of optimum concentration of NaOH for activating the biosorbent, the determination of biosorbent acidity, the optimum pH, the contact time of biosorption, and the adsorption isotherm type.
The result showed that the NaOH optimum concentration for activation of coconut fiber was 1,2 M. The surface acidity of BBN and B00 were of 9,99 ± 0,17 and 3,17 ± 0,21 mmol/g respectively. The surface specific of BBN and B00 were of 20,21 and 19,14 m2/g respectively. The optimum pH of biosorption Cr(III) on BBN and B00 biosorbent was 3 and the contact time were 30, and 120 minutes. The type of isotherm adsorption for the biosorption of Cr(III) on BBN and B00 biosorbent was isotherm S.
Keywords : Biosorption, Chromium(III), NaOH-biosorbent activated
PENDAHULUAN
Sabut kelapa adalah salah satu biomassa yang mudah didapatkan dan merupakan hasil samping pertanian. Komposisi sabut dalam buah kelapa sekitar 35% dari berat keseluruhan buah kelapa. Sabut kelapa terdiri dari serat (fiber) dan gabus (pitch) yang menghubungkan satu serat dengan serat yang lainnya. Sabut kelapa terdiri dari 75% serat dan 25% gabus. Potensi penggunaan serat sabut kelapa sebagai biosorben untuk menghilangkan logam berat dari perairan
cukup tinggi karena serat sabut kelapa mengandung lignin (35%-45%) dan selulosa (23%-43%) (Carrijo, et al, 2002). Serat sabut kelapa sangat berpotensi sebagai biosorben karena mengandung selulosa yang di dalam struktur molekulnya mengandung gugus karboksil serta lignin yang mengandung asam phenolat yang ikut ambil bagian dalam pengikatan logam. Selulosa dan lignin adalah biopolimer yang berhubungan dengan proses pemisahan logam-logam berat (Pino, et al, 2005).
Salah satu logam berat yang banyak terdapat di lingkungan dan dapat menyebabkan gangguan kesehatan adalah logam kromium (Cr) (Anderson, 1997). Logam kromium (Cr) dalam tubuh manusia biasanya berada dalam keadaan sebagai ion Cr3+. Kromium dapat menyebabkan kanker paru-paru, kerusakan hati (liver), dan ginjal (Kaim and Schwederski, 1994). Jika kontak dengan kulit, logam ini dapat menyebabkan iritasi dan jika tertelan dapat menyebabkan sakit perut dan muntah (Khasani, 2001). Menurut standar Departemen Kesehatan RI, No.416/ Menkes/ Per/ IX/1990 kadar maksimal Cr yang diperbolehkan untuk air minum adalah 0,005 mg/L, sedangkan menurut surat keputusan Menteri Negara Kependudukan dan Lingkungan Hidup No. KEP-02/MENKLH/I/1998 kadar maksimum Cr yang diperbolehkan dalam air limbah adalah 2 mg/L.
Mengingat dampak negatif dari logam Cr(III) terhadap makhluk hidup dan lingkungan, maka keberadaan limbah tersebut perlu mendapatkan perhatian yang serius. Salah satu cara untuk mengurangi kadar logam adalah melalui proses adsorpsi oleh biomassa atau material alami (Shukla, et.al, 2002).
Untuk memperoleh biosorben dengan kemampuan biosorpsi yang lebih tinggi perlu dilakukan pengaktifan dengan menggunakan basa (Massel,1996). Basa yang digunakan dalam penelitian ini adalah NaOH. Aktivasi ini bertujuan untuk meningkatkan luas permukaan spesifiknya dan situs aktifnya. Perlakuan aktivasi dengan menggunakan NaOH menyebabkan pengotor yang terdapat dalam serat sabut kelapa hijau akan larut sehingga pori menjadi lebih terbuka yang memungkinkan peningkatan luas permukaan spesifiknya. Aktivasi juga dapat memunculkan situs basa baru sebagai reaksi terjadinya pelarutan. Dengan demikian diharapkan daya adsorpsi serat sabut kelapa hijau yang teraktivasi NaOH dapat lebih meningkat.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah sabut kelapa hijau kering yang diperoleh dari Kabupaten Karangasem Bali,
HCl 37%, HNO3 1%, NaOH, PP, CrCl3.6H2O, H2C2O4, metilen biru, aquadest, dan aquademineralisasi.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah seperangkat alat gelas, pipet volume, bola hisap, corong dan kertas saring Whatman 42, pH meter, oven, neraca analitik, shaker, magnetik stirer, Spektrofotometer UV-Vis, dan Spektrofotometer Serapan Atom (SSA).
Cara Kerja
Penyiapan biosorben teraktivasi NaOH
Serat sabut kelapa dicuci dengan bersih dan dibilas dengan aquades, kemudian dikeringkan di bawah sinar matahari. Setelah kering, sampel dipotong kecil-kecil dengan ukuran 1-2 mm. Kemudian dicuci dengan aquadest sampai bersih. Sampel kemudian dikeringkan dalam oven pada suhu 700C sampai diperoleh berat konstan dan disimpan dalam desikator. Selanjutnya sampel ini disebut dengan B00.
Aktivasi biosorben
Dua gram biosorben B00 dimasukkan ke dalam 25 mL larutan NaOH 0,2 M. Campuran tersebut diaduk selama 2 jam, kemudian disaring dan residunya dicuci dengan aquades sampai pH netral (pH 7). Biosorben dikeringkan dalam oven pada suhu 700C, kemudian disimpan dalam desikator. Hal yang sama juga dilakukan untuk aktivasi menggunakan larutan natrium hidroksida dengan konsentrasi 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6; 1,8; dan 2,0 M. Biosorben teraktivasi NaOH yang diperoleh masing-masing diberi label BBN0,2; BBN0,4; BBN0,6; BBN0,8; BBN1,0; BBN1,2; BBN1,4; BBN1,6; BBN1,8; dan BBN2,0.
Untuk mendapatkan biosorben teraktivasi NaOH optimum, masing-masing sebanyak 0,5 gram biosorben teraktivasi NaOH dimasukkan ke dalam 25 mL larutan Cr(III) 200 ppm, kemudian diaduk selama 2 jam. Selanjutnya larutan tersebut disaring dan Cr(III) dalam filtrat dianalisis dengan AAS dengan metode kurva kalibrasi. Biosorben yang mengadsorpsi ion logam paling banyak
merupakan biosorben yang teraktivasi paling baik. Biosorben teraktivasi NaOH terbaik disebut BBN. Aktivasi optimum dapat diketahui dengan membuat grafik antara jumlah Cr(III) yang terserap oleh masing-masing biosorben teraktivasi NaOH versus konsentrasi larutan pengaktivasi.
Penentuan keasaman permukaan biosorben
Sebanyak 0,5 gram biosorben B00 dan BBN masing-masing dimasukkan ke dalam 2 erlenmeyer 50 mL kemudian ditambahkan masing-masing 25,0 mL NaOH 1 M, selanjutnya erlenmeyer ditutup rapat dan diaduk selama 2 jam pada temperatur kamar. Perlakuan yang sama juga dilakukan pada larutan blanko yang hanya mengandung 25,0 mL larutan NaOH 1 M. Setelah 2 jam larutan disaring dibilas dengan aquades. Filtrat dan bilasan ditambah 2 tetes indikator pp lalu dititrasi dengan larutan standar HCl 1 M yang sudah dibakukan.
Karakterisasi luas permukaan biosorben
Masing-masing 0,5 g B00 dan BBN ditambahkan ke dalam 20,0 mL larutan metilen biru 50 ppm, kemudian diaduk dengan pengaduk magnet dengan waktu kontak yang bervariasi, yaitu 5, 10, 15, 20, 30, 40, 50, dan 60 menit. Larutan hasil pengocokan disaring dan diukur absorbansnya pada panjang gelombang 664,5 nm untuk mendapatkan berat teradsorpsi maksimum (mg/g).
Penentuan pH optimum biosorpsi ion Cr(III)
Ke dalam 5 buah erlenmeyer 50 mL, dimasukkan masing-masing 0,5 g biosorben BBN lalu ditambahkan 25,0 mL larutan Cr(III) 200 ppm dengan pH larutan masing-masing 1, 2, 3, 4, dan 5. Campuran kemudian diaduk dengan pengaduk magnet selama 2 jam. Selanjutnya, campuran disaring dan filtratnya diambil untuk dianalisis Cr(III) yang tersisa dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 357,9 nm. Hal yang sama juga dikerjakan menggunakan biosorben B00.
Nilai absorbans yang diperoleh dimasukkan dalam persamaan regresi linier. Dengan demikian diperoleh konsentrasi Cr III) pada masing-masing filtrat. Konsentrasi Cr(III)
yang terserap ditentukan dengan metode kurva kalibrasi. pH optimum diperoleh dengan membuat kurva antara pH dan jumlah Cr (III) yang terserap oleh 1 gram sampel (mg/g).
Penentuan waktu optimum biosorpsi ion Cr(III)
Ke dalam 7 buah erlenmeyer 50 mL dimasukkan masing-masing 0,5 g BBN dan ditambahkan masing-masing 25,0 mL larutan Cr(III) dengan konsentrasi 200 ppm dan pH optimum yang diperoleh. Campuran diaduk dengan pengaduk magnet selama masing-masing 5, 10, 30, 60, 120, 150, dan 180 menit. Selanjutnya, campuran disaring dan filtratnya diambil untuk dianalisis. Konsentrasi akhir Cr(III) dalam larutan ditentukan dengan mengukur absorbans filtrat dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 357,9 nm. Hal yang sama juga dikerjakan dengan menggunakan biosorben B00.
Nilai absorbans yang diperoleh, dimasukkan ke dalam persamaan regresi linier Cr(III) untuk mendapatkan konsentrasi Cr(III) pada masing-masing filtrat. Konsentrasi Cr(III) yang terserap ditentukan dengan metode kurva kalibrasi. Waktu kontak optimum dapat diketahui dengan membuat grafik antara banyaknya Cr(III) yang diserap (mg/g) terhadap waktu interaksi (jam), yaitu waktu biosorpsi minimum serat sabut kelapa hijau menyerap Cr(III) secara maksimum.
Penentuan isoterm dan kapasitas biosorpsi ion Cr(III)
Ke dalam 13 buah erlenmeyer 50 mL dimasukkan masing-masing 0,5 g BBN dan ditambahkan 25,0 mL larutan Cr(III) dengan konsentrasi berturut-turut 50, 75, 100, 200, 300, 400, 500, 750, 1000, 1200, 1400, 1500, dan 1700 ppm. Kemudian, campuran diinteraksikan selama waktu kontak dan pH optimumnya pada temperatur kamar dan tekanan atmosfer. Selanjutnya, campuran disaring dan filtratnya diukur dengan spektrofotometer serapan atom pada panjang gelombang 357,9 nm. Hal yang sama dilakukan dengan menggunakan biosorben B00.
Nilai absorbans yang diperoleh dimasukkan ke dalam persamaan regresi linier
Cr(III) sehingga konsentrasi Cr(III) yang tersisa dalam filtrat dapat diketahui. Konsentrasi Cr(III) yang terserap ditentukan dengan metode kurva kalibrasi. Pola isoterm biosorpsi diperoleh dengan membuat grafik hubungan antara konsentrasi logam Cr(III) dalam larutan pada keseimbangan terhadap berat Cr(III) yang terserap per gram sampel. Data pola isoterm biosorpsi diterapkan ke persamaan linier isoterm biosorpsi langmuir dan dengan memplot C terhadap C/m.
HASIL DAN PEMBAHASAN
Penentuan Konsentrasi NaOH Optimum untuk Aktivasi Biosorben
Variasi konsentrasi NaOH pada aktivasi biosorben dilakukan untuk mendapatkan konsentrasi NaOH yang optimum yaitu biosorben yang menyerap Cr(III) secara maksimum. Konsentrasi basa optimum untuk aktivasi biosorben dengan NaOH dapat diketahui dengan membuat grafik antara konsentrasi NaOH dengan jumlah Cr(III) yang terserap, seperti ditunjukkan pada Gambar 1.
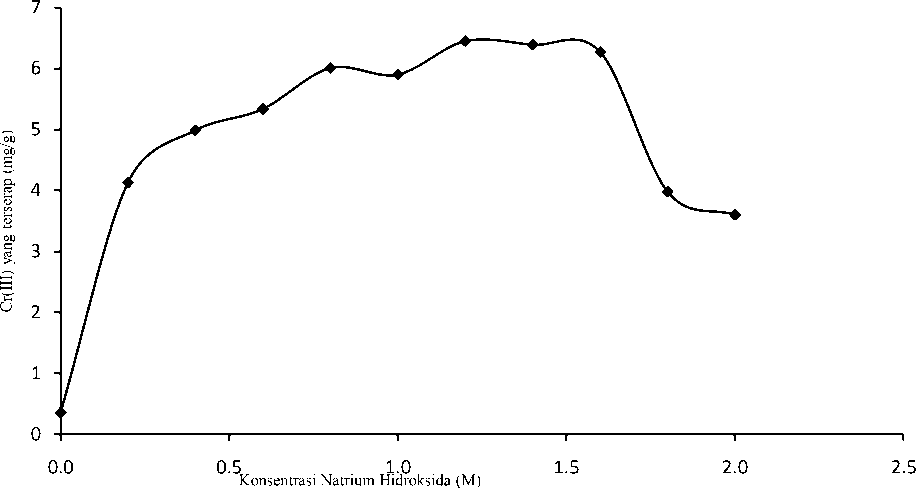
Gambar 1. Kurva hubungan antara konsentrasi NaOH dengan jumlah Cr(III) yang terserap pada biosorben teraktivasi natrium hidroksida
Gambar 1 memperlihatkan bahwa jumlah Cr(III) yang terserap naik seiring dengan kenaikan konsentrasi NaOH yang ditambahkan hingga konsentrasi optimum yaitu 1,2 M. Hal ini menunjukkan bahwa semakin bertambah konsentrasi NaOH, proses pembentukan situs aktif semakin baik. Pada penambahan konsentrasi NaOH yang lebih besar mulai terjadi
penurunan jumlah Cr(III) yang terserap. Hal ini mengindikasikan bahwa konsentrasi NaOH mulai tidak efektif membentuk situs aktif. Jumlah Cr(III) yang terserap pada biosorben teraktivasi NaOH 1,2 M adalah 6,446 mg/g, sedangkan jumlah Cr(III) yang terserap pada biosorben tanpa aktivasi (B00) adalah 0,355 mg/g. Aktivasi dengan NaOH dapat menyerap
Cr(III) lebih banyak daripada tanpa aktivasi. NaOH mampu melarutkan komponen pengotor pada serat sabut, hal ini diperkuat oleh nilai keasaman dan luas permukaan biosorben BBN lebih besar dibandingkan biosorben B00.
Penentuan Keasaman Biosorben
Penentuan keasaman biosorben ini bertujuan untuk mengetahui jumlah situs asam yang terikat pada biosorben tiap gramnya. Penentuan keasaman biosorben BBN dan B00 dilakukan dengan metode titrasi asam basa. Situs-situs asam dari biosorben direaksikan dengan NaOH berlebih dan sisa OH- yang tidak bereaksi dengan situs-situs asam dari biosorben ditentukan dengan titrasi menggunakan HCl 1M. Keasaman biosorben serat sabut kelapa hijau dihitung dari selisih antara jumlah HCl untuk titrasi blanko dengan jumlah HCl untuk titrasi biosorben.
Nilai keasaman permukaan biosorben BBN dan B00 berturut-turut adalah 9,99 ± 0,17 dan 3,17 ± 0,21 mmol/g. Nilai keasaman permukaan yang diperoleh pada biosorben teraktivasi NaOH(BNN) lebih besar dibandingkan dengan biosorben tanpa aktivasi (B00). Keasaman permukaan biosorben meningkat dengan adanya aktivasi dengan NaOH. Peningkatan keasaman yang terjadi pada biosorben tersebut disebabkan oleh pembentukan situs – situs aktif. Aktivasi biosorben dengan NaOH juga dapat mengurangi pengotor-pengotor yang terdapat pada biosorben sehingga dapat membuka pori.
Karakterisasi Luas Permukaan biosorben
Luas permukaan biosorben merupakan salah satu karakter fisik yang memiliki peranan penting dari proses adsorpsi, karena banyaknya zat yang dapat teradsorpsi selain tergantung pada situs aktif, juga ditentukan oleh luas permukaannya. Analisis luas permukaan spesifik dilakukan dengan menggunakan metode metilen biru, dimana banyaknya metilen biru yang dapat
diadsorpsi sebanding dengan luas permukaan adsorben. Nilai luas permukaan spesifik biosorben BBN dan B00 adalah 20,21 dan 19,14 m2/g.
Biosorben BBN memiliki luas permukaan yang lebih besar dibandingkan dengan serat B00. Hal ini diduga diakibatkan oleh bentuk pori serat sabut kelapa hijau teraktivasi NaOH relatif homogen dengan ukuran makropori daripada biosorben tanpa aktivasi sehingga banyak metilen biru yang teradsorpsi.
Penentuan pH Optimum Biosorben
Pengikatan kation logam oleh situs-situs aktif biosorben sangat dipengaruhi oleh pH. Parameter pH merupakan parameter yang paling penting dalam proses biosorpsi yang mempengaruhi spesies logam dalam larutan, aktivitas gugus fungsi dalam biomassa dan kompetisi dari ion – ion logam.
Penentuan pH optimum dilakukan untuk mengetahui pH interaksi dimana biosorben menyerap Cr(III) secara maksimum. Pengaruh pH terhadap kemampuan biosorpsi Cr(III) pada biosorben BBN dan B00 dilakukan dengan menginterasikan biosorben dengan larutan Cr(III) pH 1-5. Hasil penelitian menunjukkan bahwa jumlah Cr(III) yang terserap pada biosorben sangat dipengaruhi oleh pH, seperti yang ditunjukan oleh Gambar 2.
Gambar 2 menunjukkan bahwa pada pH dibawah 3 jumlah Cr(III) yang terserap lebih sedikit, hal ini disebabkan adanya jumlah H+ yang besar sehingga kation logam berkompetisi dengan H+ untuk berikatan dengan situs-situs aktif biosorben. Dalam hal ini pH 3 dipilih sebagai pH optimum karena pada pH 3 menurut Yun Y.S. ( 2001), Cr(III) dominan dalam bentuk Cr3+ sedangkan pada pH 4-5 jumlah Cr3+ yang terserap menurun, karena pada pH tersebut Cr3+ sebagian besar berubah menjadi Cr(OH)2+. Dengan demikian maka pH biosorpsi Cr(III) optimum terjadi pada pH 3.
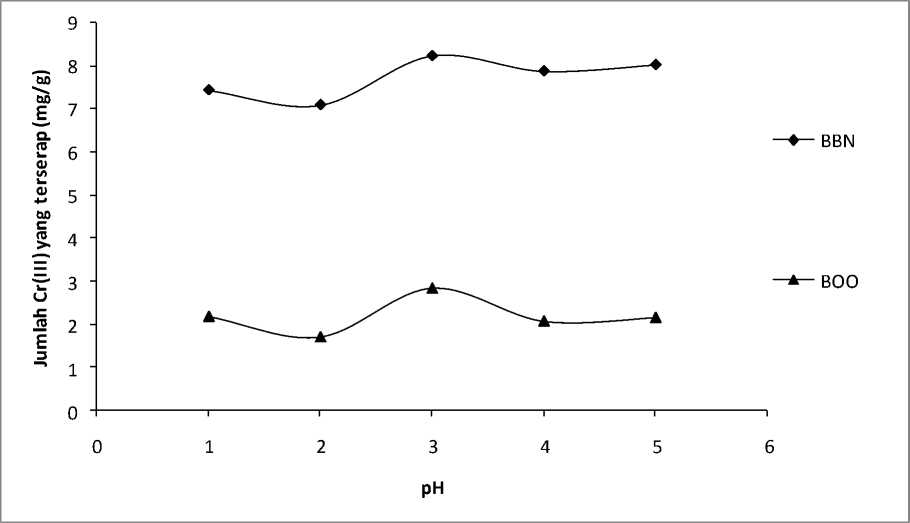
Gambar 2. Kurva pengaruh pH terhadap biosorpsi Cr(III) pada biosorben
Penentuan Waktu Kontak Biosorpsi
Penentuan waktu kontak biosorpsi dilakukan untuk mengetahui waktu minimum yang dibutuhkan biosorben dalam menyerap Cr(III) secara maksimum sampai tercapai keadaan setimbang. Waktu kontak biosorpsi biosorben dapat diketahui dengan membuat grafik antara banyaknya Cr(III) yang terserap (mg/g) terhadap waktu kontak biosorpsi. Variasi waktu yang digunakan pada studi pengaruh waktu kontak adalah 5, 10, 30, 60, 120, 150, dan 180 menit. Pengaruh waktu terhadap jumlah Cr(III) yang terserap oleh biosorben ditunjukkan pada Gambar 3.
Berdasarkan Gambar 3 dapat dilihat bahwa biosorben memiliki waktu kontak optimum yang berbeda untuk tiap biosorben. Waktu kontak optimum untuk BBN dan B00 secara berurutan adalah 30 dan 120 menit. Hal ini menunjukkan bahwa biosorben yang teraktivasi dengan NaOH memiliki waktu kontak optimum yang lebih cepat dibandingkan dengan waktu kontak optimum yang dimiliki oleh biosorben tanpa aktivasi. Dengan pengaktivasian, pengotor – pengotor yang ada dalam biosorben hilang atau berkurang sehingga dapat mempercepat teradsorpsinya Cr(III), akibatnya waktu kontak maksimum pun tercapai lebih cepat.
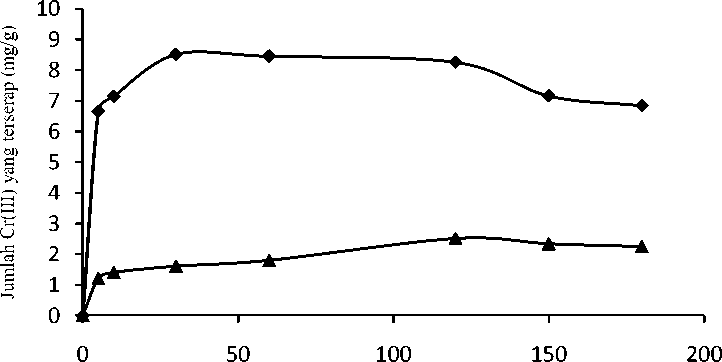
Waktu (menit)
Gambar 3. Kurva pengaruh waktu kontak biosorpsi terhadap jumlah Cr(III) yang terserap pada biosorben dengan larutan Cr(III) 200 ppm dan pH 5
Penentuan Isoterm dan Kapasitas Biosorpsi
Pengaruh konsentrasi Cr(III) yang diinteraksikan terhadap jumlah Cr(III) yang terserap oleh biosorben BBN, BBA, dan B00 dilakukan untuk mengetahui pola isoterm dan kapasitas biosorpsi. Variasi konsentrasi yang digunakan pada studi pengaruh konsentrasi adalah 50, 75, 100, 200, 300, 400, 500, 750, 1000, 1200, 1400, dan 1500 ppm. Pengaruh konsentrasi terhadap jumlah Cr(III) yang terserap oleh biosorben ditunjukkan pada Gambar 4.
Berdasarkan Gambar 4 dapat dilihat bahwa dengan bertambahnya konsentrasi biosorbat yang diinteraksikan, maka jumlah logam Cr(III) yang terserap tiap gram biosorben semakin bertambah sampai titik optimum. Pada konsentrasi Cr(III) 1500 ppm cenderung konstan sampai konsentrasi 1700 ppm.
Pola isoterm biosorpsi Cr(III) dapat diketahui dengan jalan membuat grafik antara konsentrasi Cr(III) dalam keseimbangan dengan banyaknya Cr(III) yang terserap. Pola isoterm biosorpsi biosorben BBN dan B00 dapat dilihat pada Gambar 5 dan Gambar 6.
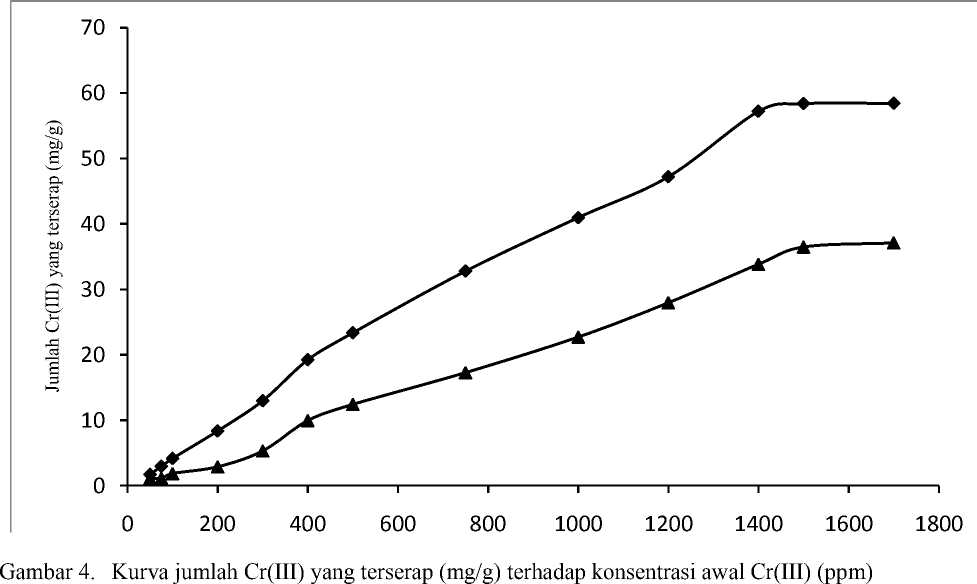
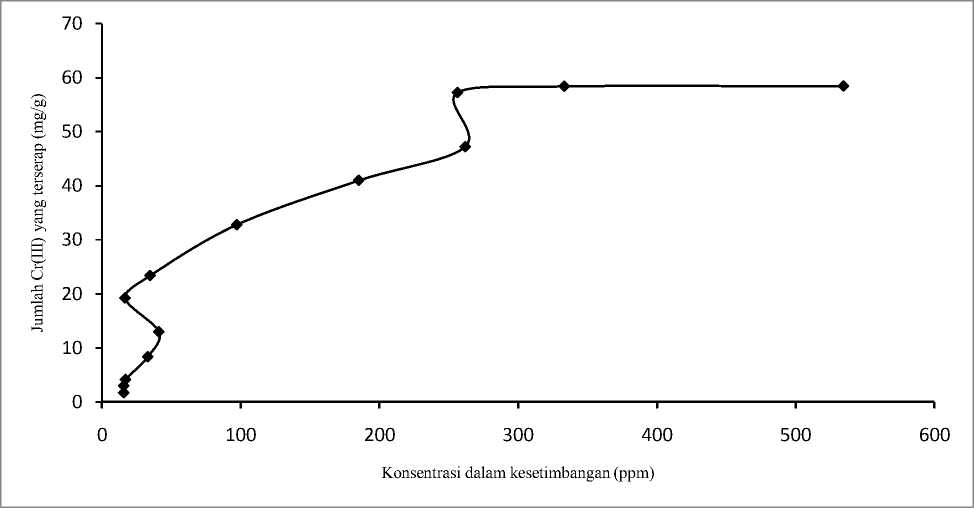
Gambar 5. Pola isoterm biosorpsi biosorben teraktivasi NaOH (BBN) dengan waktu interaksi 30 menit
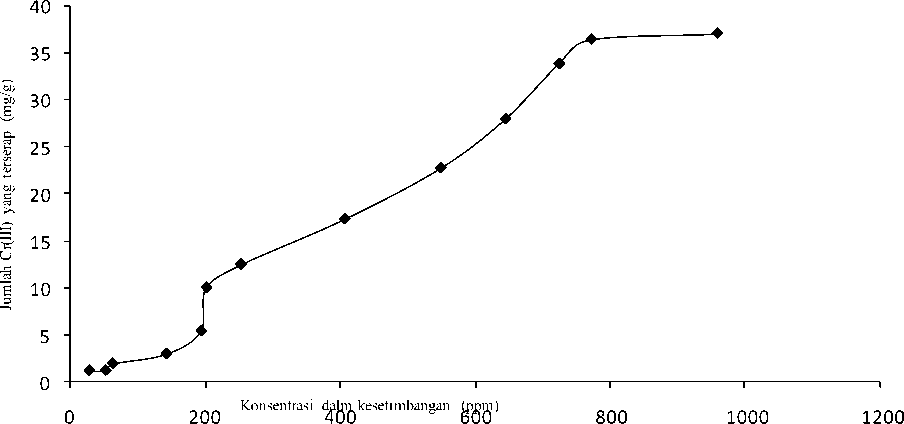
Gambar 6. Pola isoterm biosorpsi biosorben tanpa aktivasi (B00) dengan waktu interaksi 120 menit
Gambar 5 dan Gambar 6 menunjukkan bahwa pola isoterm biosorpsi yang diperoleh mendekati isoterm biosorpsi tipe S. Isoterm biosorpsi tipe S memperlihatkan bahwa padatan memiliki afinitas yang tinggi terhadap pelarut. Hal ini berarti adsorpsi lebih mudah terjadi dengan kenaikan konsentrasi (Van-Olphen, 1977)
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dan pembahasan maka dapat disimpulkan bahwa konsentrasi optimum natrium hidroksida untuk aktivasi biosorben adalah 1,2 M, dengan rasio mmol basa : gram biosorben adalah 3 : 2. Nilai keasaman untuk permukaan biosorben BBN dan B00 masing – masing secara berurutan adalah 9,99 ± 0,17 dan 3,17 ± 0,21 mmol/g. Luas permukaan spesifik BBN dan B00 secara berturut – turut adalah 20,21 dan 19,14 m2/g. pH
optimum biosorpsi Cr(III) pada BBN dan B00 adalah sama yaitu pada pH 3. Waktu kontak optimum biosorpsi Cr(III) pada masing-masing biosorben berbeda-beda yaitu 30 dan 120 menit berturut-turut untuk BBN dan B00. Pola isoterm biosorpsi Cr(III) pada masing-masing biosorben mendekati pola isoterm tipe S.
Saran
Berdasarkan hasil penelitian yang diperoleh maka perlu dilakukan penelitian lebih lanjut mengenai aktivasi bisorben menggunakan jenis basa yang lain seperti NH4OH dan Ca(OH)2.
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terimakasih kepada Universitas Udayna dan DP2M DIKTI atas dukungan finansial melalui penelitian Hibah bersaing tahun II tahun 2010.
DAFTAR PUSTAKA
Anderson, R. A., 1997, Chromium as an
Essential Nutrient for Human, Reg. Toxico. Pharmacol., 26 : 534-541
Aravindan, R., Madhan, B., Bao, J. R., and Ramasami T., An 2004,
Bioaccumulation of Chromium from Tannery Wastewater : Approach for Chrome Recovery and Reuse, Environ. Sci. Technol., 38 : 300-306
Carrijo, O. A., Liz, R. S., Makishima, N., 2002, Fiber of Green Coconut shell as Agriculture substratum, Brazilian Horticulture, 20 : 533-535
Khasani SI, 2001, Lembar Data Keselamatan Bahan, Vol. IV, Bandung: Pusat
Penelitian Kimia,. Lembaga Ilmu Pengetahuan Indonesia
Massel, R. I., 1996, Principles of Adsorption and Reaction on Solid Surfaces, First Edition, John Willey and Sone., Illionis.
Pino, G. H., Mesquita, L. M. S., Torem, M. L., and Pinto, G. A. S., 2005, Biosorption of Cadmium by Green Coconut Shell Powder, Metallurgy and Material, 225-Gavea, 22453-900 Rio de Janeiro-RJ, Brazil
Shukla, A., Zhang, Y. H., Dubey, P., Margravw, J. L., and Shukla, S., 2002, The Role of Swadust in the removal of unwanted materials from water, J. of Hazardous Materials, 95 : 137-157
Van-Olphen, H, 1977, An Entroduction to Clay Colloid Chemistry for Clay Technologist, Geologist and Soil Scientist, 2nd ed, Awiley – Interscience – Rahway, N.J., USA
Yun, Y-S., Park, D., and Volesky, B., 2001, Biosorption of Trivalent Chromium on The Brown Seaweed Biomass, Environ. Sci. Teknol., 35 : 4353-4358
142
Discussion and feedback