KOMPOSISI ASAM AMINO DAN POLA PITA PROTEIN GELATIN HALAL DARI KULIT AYAM BROILER
on
ISSN 1907-9850
KOMPOSISI ASAM AMINO DAN POLA PITA PROTEIN GELATIN HALAL DARI KULIT AYAM BROILER
Ni Made Puspawati1, Ida Ayu Gede Widihati2, dan I Nyoman Widana3
1,2Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali 3Jurusan Matematika, Fakultas MIPA, Universitas Udayana
*E-mail: made_puspawati@unud.ac.id
ABSTRAK
Penelitian ini bertujuan untuk mempelajari pengaruh perbedaan jenis asam yang digunakan pada proses perendaman terhadap komposisi asam amino, pola pita protein dan kekuatan gel produk gelatin yang diekstrak dari kulit ayam Broiler. Pada penelitian ini asam yang digunakan pada proses perendaman yaitu asam asetat (AA), sitrat (AS), dan laktat (AL). Komposisi asam amino produk gelatin dianalisis dengan HPLC, pola pita protein dianalisis menggunakan metode elektroforesis, dan kekuatan gel diukur dengan CT3 Texture Analyzer. Hasil analisis menunjukkan, ketiga produk gelatin yaitu GAA, GAL,dan GAS mempunyai komposisi asam amino yang tidak jauh berbeda dengan persentase tertinggi glisin, diikuti prolin, glutamat, arginin, dan alanin sedangkan terendah metionin, sistin dan tirosin, serta tidak terdeteksi adanya histidin. Persentase glisin (18,31%) dan prolin (9,18%) untuk GAA tidak berbeda secara signifikan dengan GAS (17,88% dan 8,85%) dan GAL (17,77% dan 7,46%). Elektroforegram SDS-PAGE untuk GAA dan GAS hampir sama yaitu memberikan pita protein dengan berat molekul tinggi pada 85kDA yang diikuti dengan pita protein dengan berat molekul lebih rendah pada 66, 45, 31, dan 25kDA namun pita protein pada GAA lebih tebal dari GAS. GAL tidak menunjukkan pita protein dengan berat molekul yang tinggi, hanya agregates protein dengan berat molekul rendah pada 21 kDA. Hasil pengukuran kekuatan gel untuk GAA 216,63 g bloom, GAS 109,01g bloom, dan GAL 32,73 g bloom. Dari penelitian ini, dapat disimpulkan bahwa jenis asam yang digunakan pada proses perendaman tidak berpengaruh terhadap persentase kandungan asam amino tetapi berpengaruh terhadap pola pita proteinnya (berat molekul) dan kekuatan gel dari produk gelatin yang dihasilkan.
Kata kunci : gelatin halal, kulit ayam broiler, SDS_PAGE elektroforesis, komposisi asam amino
ABSTRACT
This research aimed to study the effect of different types of acids used in pretreatment process to amino acid composition, protein profile and gel strength of gelatin product extracted from Broiler chicken skin. The acids used in pretreatment process were acetic (AA), lactic (AL), and citric (GAS). Amino acids composition was analysed using HPLC while protein profile analysed by SDS-PAGE electrophoresis, and gel strength was determined using CT3 Texture Analyzer. Amino acid analysis results showed that all of the gelatin products GAA, GAS, and GAL had high content of glycine followed by prolyne, glutamic, arginine, and alanine with low content of methionine, cystine and thyrosine and did not detect the presence of histidine. The percentages of glycine (18.31%) and proline (9.18%) found in GAA were pretty similar to glycine and proline in GAS (17.88% and 8.85%) and GAL (17.77 and 7.46%)respectively. SDS-Page electroforegram of GAA and GAS revealed similar protein band profile in which GAA gave thicker protein band at high molecular weight of 85kDA and both gave some aggregates protein with lower molecular weight at 66, 45, 31, and 25kDA. On the other hands, GAL only showed aggregates protein with lower molecular weight at 21 kDA. The highest gel strength 216.63 g bloom was exhibited by GAA followed by GAS 109.01 g bloom, and the lowest 32.73 g bloom shown by GAL. It can be concluded that types of acids used in pretreatment did not influence the percentage of amino acid composition but did influence the molecular weight (protein band profile) and the gel strength of gelatin products.
Keywords : halal gelatin, chicken skin broiler, SDS_PAGE electrophoresis, amino acid composition
PENDAHULUAN
Gelatin merupakan biodegradabel, edibel, dan biokompatibel polipeptida yang dihasilkan dari proses denaturasi kolagen yang terdapat terutama kulit, tulang, cartilage, dan jaringan ikat hewan (Bailey and Paul, 19988, Karim and Bhat, 2009). Saat ini, pemanfaatan gelatin sangat luas, baik dalam industri pangan maupun non-pangan antara lain sebagai bahan baku makanan (susu dan produknya, es krim, permen karet, pengental, dan mayonnaise), sebagai bahan kosmetik dan produk farmasi, sebagai bahan pembuat film, material medis (hard capsule), bahan baku kultur jaringan, sebagai pelapis kertas, tinta, inkjet, korek api, gabus, pelapis kayu untuk interior, karet plastik, dan lain-lain, karena sifatnya yang mampu sebagai pembentuk biodegradabel gel, emulsifier, adehsive, stabilizer, dan foaming agent (Zhou, Mulvaney&Regenstin, 2006). Gelatin merupakan suatu protein yang larut dalam air dan disusun oleh hampir semua asam amino essensial kecuali triptofan dengan kandungan asam amino metionin,tirosin dan sistin yang sangat rendah karena terjadinya degradasi selama proses hidrólisis (Jamilah dan Harvinder 2002, Chapman & Hall 1997). Asam-asam amino penyusun gelatin saling terikat melalui ikatan péptida membentuk gelatin dengan susunan unit ulang Gly-X-Y, dimana X prolin dan Y hidroksiprolin atau yang lainnya. Komposisi dan urutan asam amino gelatin berbeda satu dengan yang lainnya bergantung kepada spesies dan jenis jaringannya tetapi selalu mengandung glisin, prolin, hidroksiprolin dengan persentase yang tinggi (Gilsenan dan Ross-Murphy 2000).
Secara komersial, sumber utama gelatin yang beredar di dunia sampai pada tahun 2007 yaitu 46 % berasal dari kulit babi, 29,4 % dari kulit sapi, 23,1 % dari tulang sapi, dan hanya 1,5 % dari sumber lainnya, namun produksi gelatin dari sumber non-mamalia ini dua kali lipat lebih tinggi dari pada produksinya di tahun 2002 (Gimenez Monterio, 2009). Peningkatan produksi dan ketertarikan peneliti untuk mengeksplorasi dan mengembangkan gelatin yang bersumber dari non mamalia seperti ikan dan unggas (ayam, itik, burung) tidak hanya disebabkan karena faktor
sosial-budaya dan agama (halal) tetapi karena meningkatnya industri yang memanfaatkan hasil samping suatu produksi seperti industri perikanan dan poultry untuk diolah menjadi produk yang bernilai ekonomis tinggi seperti gelatin (Gimenez-Monterio 2009, Karim, Bath 2009, Mariod, 2013).
Salah satu kekurangan gelatin yang berasal dari non mamalia adalah sifat mekaniknya yang kurang bagus (kekuatan gel, titik leleh) sehingga pemanfaatannya di bidang kedokteran menjadi terbatas (Johnston-Bank, 1990). (Hafidz et al, 2011 melaporkan perbedaan komposisi asam amino pada gelatin sapi dan babi berpengaruh terhadap berat molekul dan kekuatan gelnya. Hardikawati et al, 2016 melaporkan bahwa perbedaan konsentrasi asam sitrat yang digunakan pada proses perendaman berpengaruh nyata terhadap pola pita protein (berat molekul) dan kekuatan gelnya.
Penelitian ini bertujuan untuk mengetahui pengaruh perbedaan jenis asam yang digunakan (asam asetat, laktat, dan sitrat) pada proses perendaman terhadap komposisi asam amino dan pola protein produk gelatin dan pengaruhnya terhadap sifat mekanik produk gelatin yang dihasilkan khususnya kekuatan gel.
merupakan salah satu makanan penunjang ASI untuk mendukung pertumbuhan dan perkembangan anak karena pada usia 6 bulan ke atas, ASI saja tidak cukup untuk memenuhi kebutuhan pertumbuahan dan perkembangan anak (Pudjiadi, 2005).
MATERI DAN METODE
Bahan
Bahan dasar penelitian ini adalah kulit ayam Broiler yang dibeli dari RPA UD Eka Prasetya, Nusa Dua, Bali. Bahan kimia yang digunakan meliputi: natrium hidroksida (NaOH), asam sulfat (H2SO4), asam sitrat ((C3H5O(COOH)3) (P.A), asam asetat, asam laktat, akuades, akuademineral, dan n-heksana.
Peralatan
Alat yang digunakan meliputi timbangan analitik, freeze drier, blender, beker gelas, erlenmeyer, pipet volume, labu ukur, pengaduk, pipet tetes, hot plate dan stirrer bar, corong,
termometer, penyaring, gelas ukur, waterbath, oven, loyang teflon, pH meter, soxhlet extractor, TA-XT CT3 Texture Analyzer, HPLC, dan SDS_PAGE electrophoresis
Cara Kerja
Ekstraksi Gelatin
Sebelum proses pretreatment dilakukan, kulit ayam yang sudah bersih dipotong kecil-kecil kemudian dikering bekukan (freez drier) dan diblender sehingga diperoleh serbuk kulit ayam. Serbuk kulit ayam ini kemudian diekstrak lemaknya dengan sokhlet extractor menggunakan pelarut n-heksana. Serbuk kulit ayam bebas lemak (45g) dimasukkan kedalam beker gelas 1000mL kemudian ditambahkan 600mL NaOH (0.15%) dan diaduk dengan magnetic stirrer selama 3x40 menit dengan tujuan untuk deproteinasi (melarutkan protein non kolagen, dan menghilangkan warna) dimana tiap 40 menit larutan diganti dengan yang baru (3x perendaman), kemudian disaring dan residunya dicuci dengan air . Residu yang diperoleh kemudian didemineralisasi dengan perendaman menggunakan 600mL asam sulfat (0,15% v/v) selama 3x40 menit dimana tiap 40 menit larutan diganti dengan yang baru (3x perendaman), kemudian disaring dan residunya dicuci dengan air.
Residu hasil proses demineralisasi selanjutnya dibagi menjadi tiga dan masing-masing direndam dengan 200mL asam asetat (1% b/v), asam laktat 1%, dan asam sitrat 1% untuk proses hidrolisis selama 3x40 menit dimana tiap 40 menit larutan diganti dengan yang baru (3x perendaman) kemudian disaring. Residu yang diperoleh pada tahap ini selanjutnya dicuci dengan akuades sampai pH hasil cucian menunjukkan pH 4-5, kemudian ditambahkan akuademineral (1:1) dan dipanaskan menggunakan waterbath pada suhu 45oC selama 24 jam. Ekstrak gelatin yang diperoleh dari masing-masing perlakuan kemudian disaring menggunakan kertas saring Whatman No.4, diukur volumenya, dimasukkan dalam toples kaca kedap udara dan diletakkan dalam lemari pendingin bersuhu 4-10oC selama 24 jam. Gel yang telah terbentuk selanjutnya dipindahkan ke dalam loyang teflon untuk dikeringkan pada oven dengan suhu 60oC selama 48 jam, kemudian didinginkan dalam desikator. Lapisan gelatin yang terbentuk dikerok dan ditimbang beratnya
kemudian disimpan dalam botol sampel bertutup dan digunakan untuk proses karakterisasi.
Pengukuran Kekuatan Gel
Larutan gelatin dengan konsentrasi 6,67% (b/b) disiapkan dengan melarutkan 2,5 g gelatin dalam 35 mL aquades. Larutan diaduk dengan menggunakan magnetic stirrer sampai homogen kemudian dipanaskan pada suhu 60oC selama 15 menit. Larutan kemudian dituang ke dalam beker gelas 50 mL ditutup dengan aluminium foil dan diinkubasi selama 16-18 jam pada suhu 10oC. Selanjutnya diukur menggunakan alat TA-XT plus texture analyser pada kecepatan probe 0,5 mm/detik dengan kedalaman 4 mm. Kekuatan gel dinyatakan dalam satuan gram bloom.
Analisis Asam Amino (Muchtadi, 1992)
Sebanyak 0,2 g sampel disiapkan dalam tabung reaksi tertutup dan ditambahkan sebanyak 5 mL HCl 6 N. Sampel dimasukkan dalam oven dengan suhu 100oC selama 18-24 jam. Selanjutnya sampel disaring dengan kertas saring Whatman 40. Hasil hidrolisis dipipet sebanyak 10µl dan dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 30 µl larutan pengering, lalu dikeringkan dengan pompa vacuum. Sampel yang telah dikeringkan ditambahkan larutan derivate sebanyak 30 µl dan dibiarkan kering selama 20 menit. Sampel kemudian diencerkan dengan 200 µl larutan pengencer natrium asetat 1M. Sampel siap dianalisis dengan HPLC.
Analisis Berat Molekul Gelatin Dengan Metode Elektroforesis SDS-PAGE
Sebanyak 50 miligram sampel dilarutkan dalam 1,0 mLlarutan buffer (250mM Tris-Cl pH 7,5; 5 mM EDTA; 2% SDS), kemudian
dipanaskan pada suhu 85oC selama 1 jam. Setelah itu larutandicampur dengan buffersampel0,5 M tris-HCl, pH 6,8( yang mengandung 4% (b/v) SDS, 20% (v/v) gliserol, dan 10% (v/v) βME) dengan perbandingan 1: 1 (v/v). Kemudian campuran
dipanaskan dengan suhu 100oC selama 3 menit. Sampel dimasukkan ke dalam gel poliakrilamida yang dibuat dengan 7,5% (v/v) running gel dan 4% (v/v) stacking gel sebanyak : GALH 9,5µL, GAAH 10 µL, dan GASH 5,45 µL. Elektroforesis dilakukan pada arus konstan 15 mA, kemudian gel diwarnai dengan buffer staining0,1% (b/v)
Coomassie biru R-250 dalam 15% (v/v) metanol dan 5% (v/v) asam asetat dan destaining dengan 30% (v/v) metanol dan 10% (v/v) asam asetat.
Analisis Data
Penelitian ini menggunakan Rancangan Percobaan Acak Lengkap Dengan 1 Faktor. Faktor dalam penelitian ini adalah jenis asam. Percobaan dilakukan dengan 3 kali pengulangan kecuali untuk analisis asam amino hanya dilakukan satu kali pengukuran dan SDS-PAGE dua kali pengulangan. Semua data yang diperoleh dianalisis dengan ANOVA. Jika terdapat pengaruh yang signifikan maka dilanjutkan dengan uji beda Duncan pada tingkat kepercayaan 95%.
HASIL DAN PEMBAHASAN
Rendemen dan Kekuatan Gel
Produk gelatin yang diperoleh dengan menggunakan asam asetat (GAA), laktat (GAL) dan sitrat (GAS) pada proses perendaman memberikan rendemen berturut-turut 10,70%, 19,27, dan 21,11% seperti tertera pada Tabel 1. Hasil uji Duncan menunjukkan penggunaan variasi pelarut asam, yaitu asam asetat, asam laktat, dan asam sitrat berpengaruh nyata (P<0,05) terhadap rendemen gelatin. Untuk rendemen gelatin hasil perendaman asam asetat berbeda nyata dengan rendemen hasil perendaman dengan asam laktat dan sitrat, tetapi rendemen gelatin hasil perendaman dengan asam laktat tidak berbeda nyata dengan rendemen gelatin hasil perendaman asam sitrat.
Tabel 1. Rendemen dan Kekuatan Gel Produk Gelatin Hasil Perlakuan
|
Sampel |
Rendemen (%) |
Kekuatan Gel (g bloom) |
|
GAA |
10,70 ± 0,95 a |
216,63 ± 0,11 a |
|
GAL |
19,27 ± 1,79 b |
32,73 ± 0,14 b |
|
GAS |
21,11 ± 0,38 b |
109,01 ± 1,18 c |
Keterangan: Data yang diikuti huruf berbeda pada kolom menunjukkan perbedaan nyata menurut uji Duncan
pada taraf ketelitian 5% GAA :gelatin hasil perendaman dengan asam asetat
GAL :gelatin hasil perendaman dengan asam laktat GAS :gelatin hasil perendaman dengan asam sitrat
Hasil penelitian ini menunjukkan bahwa rendemen gelatin dapat dipengaruhi oleh kemampuan interaksi ion H+ dari masing-masing larutan asam yang digunakan dengan kolagen. Semakin banyak ion H+ maka hidrolisis semakin efektif sehingga rendemen yang dihasilkan juga semakin tinggi. Proses perendaman dengan asam sitrat menghasilkan gelatin dengan rendemen yang tinggi karena asam sitrat merupakan asam poliprotik dengan tiga atom hidrogen yang dapat terionisasi dan melepaskan tiga buah proton (H+) di dalam larutannya sehingga menyebabkan semakin banyaknya ikatan hidrogen yang putus yang memudahkan konversi kolagen menjadi gelatin. Sedangkan asam asetat merupakan asam monoprotik, dimana hanya dapat melepaskan sebuah proton (H+) di dalam larutannya sehingga rendemennyapun rendah.
Kekuatan gel produk gelatin menentukan kualitas dan applikasinya. Hasil pengukuran kekuatan gel produk gelatin dengan variasi asam pada proses perendamannya disajikan pada Tabel 1. Gelatin dengan kekuatan gel tertinggi yaitu 216,63 g bloom diperoleh dari perendaman asam asetat diikuti gelatin hasil perendaman asam sitrat 109,01 g bloom, dan kekuatan gel terendah 32,73 g bloom ditunjukkan oleh gelatin hasil perendaman asam laktat. Hasil analisis statistic dengan uji lanjut Duncan menunjukkan bahwa perbedaan perlakuan berpengaruh nyata (P<0,05) terhadap nilai kekuatan gel. Kekutan gel gelatin tergantung dari panjang rantai asam aminonya. Jika proses hidrolisis kolagen berada pada fase yang tepat, yakni pada rantai polipeptida dimana terjadi pemutusan ikatan hidrogen, ikatan kovalen silang serta sebagian ikatan peptida, maka dihasilkan struktur gelatin dengan rantai peptida yang panjang sehingga kekuatan gel yang dihasilkan juga tinggi (Ward dan Courts, 1977).
Komposisi Asam Amino
Senyawa gelatin merupakan suatu polimer linier asam-asam amino. Pada umumnya rantai polimer tersebut merupakan perulangan dari asam amino glisin-prolin-prolin atau glisin-prolin-
hidroksiprolin . Analisis asam amino ini bertujuan untuk mengetahui jenis dan komposisi asam amino
produk gelatin dari kulit ayam dengan perendaman menggunakan jenis asam berbeda. Seperti disajikan pada Tabel 2, produk gelatin GAA, GAS, dan
proses yang ketiga GAL
menunjukkan jenis asam amino yang sama dengan kandungan tertinggi glisin diikuti prolin, glutamat, arginin, dan alanin dan memiliki kandungan metionin, sistin dan tirosin yang rendah, serta tidak terdeteksi adanya asam amino histidin. Secara umum komposisi asam amino ketiga produk gelatin kulit ayam pada penelitian ini jauh lebih rendah dari komposisi asam amino kulit ayam yang dilaporkan Norizah (Norizah, 2013) namun tidak jauh berbeda dari komposisi asam amino gelatin dari tulang ayam (Junianto, 2006). Hal ini mungkin disebabkan karena spesies, umur, jenis, dan lingkungan hidup ayam yang digunakan pada penelitian ini berbeda dengan ayam yang digunakan oleh Norizah.
Tabel 2. Komposisi Asam Amino Produk Gelatin Kulit Ayam Hasil perlakuan
Asam Amino (g/100g)
GAA
GAL
|
ASP |
3,83 |
3,94 |
3,40 |
|
SER |
2,08 |
2,08 |
1,77 |
|
GLU |
7,41 |
7,44 |
7,01 |
|
GLY |
18,31 |
17,88 |
17,77 |
|
HIS |
* |
* |
* |
|
ARG |
7,13 |
6,90 |
6,86 |
|
THR |
1,65 |
1,66 |
1,37 |
|
ALA |
7,07 |
6,82 |
5,84 |
|
PROLIN |
9,18 |
8,85 |
7,46 |
|
CYS |
0,02 |
0,02 |
0,02 |
|
TYR |
0,51 |
0,54 |
0,48 |
|
VAL |
1,67 |
1,63 |
1,39 |
|
MET |
0,77 |
0,80 |
0,64 |
|
LYS |
2,44 |
2,42 |
2,07 |
|
ILE |
1,12 |
1,11 |
0,95 |
|
LEU |
2,36 |
2,32 |
1,98 |
|
PHE |
1,97 |
1,94 |
1,67 |
|
*: |
tidak terdeteksi |
Dari data pada Tabel 2, gelatin
hasil
perendaman dengan asam asetat (GAA) menunjukkan persentase glisin (18,31%), prolin (9,18%), glutamate (7,41%), arginin (7,13%), dan alanin (7,07%) yang tidak jauh berbeda dengan GAS dengan persentase glisin (17,88%), prolin
(8,85%), glutamate (7,44%), arginin (6,90%), dan alanin (6,82%) dan GAL dengan persentase glisin (17,77%), prolin (7,46%), glutamate (6,33%), arginin (5,70%), dan alanin (5,84%). Kandungan glisin dari ketiga produk gelatin yang diperoleh hampir sama dengan kandungan glisin untuk gelatin tulang ayam seperti yang dilaporkan Junianto, 2016 yaitu sebesar 15,02% tetapi lebih rendah dari gelatin kulit ayam dan sapi yang dilaporkan Norizah, 2013 sebesar 33,70% (glisin), 13,42% (prolin) untuk gelatin kulit ayam, dan 37,05% (glisin), 12,66% (prolin) untuk gelatin sapi. Pada ketiga produk gelatin tidak terdeteksi adanya histidin. Hafidz et al, 2011 juga melaporkan tidak terdeteksinya histidin pada gelatin sapi dan babi. Sebaliknya pada gelatin tulang ayam dilaporkan mengandung 0,25% histidin (Junianto, 2006).
Analisis Pola Pita Protein (berat molekul) dengan Eletroforesis Menggunakan SDS_PAGE
Pada penelitian ini, pola pita protein produk gelatin kulit ayam dianalisis menggunakan teknik elektroforesis SDS gel poliakrilamida (SDS
GAS PAGE). Hasil yang didapatkan dari elektroforesis yaitu berupa pita – pita protein yang terpisahkan berdasarkan perbedaan berat molekulnya yang setara dengan panjang rantai protein. Migrasi pita protein dalam SDS PAGE berbanding terbalik dengan berat molekulnya (panjang pita), maka semakin besar berat molekul produk gelatin semakin lambat migrasinya sehingga posisinya
pada elektroforegram semakin di atas. Elektrogram pita protein produk gelatin kulit hasil perlakuan ditunjukkan pada Gambar 1.
Berdasarkan elektroforegram hasil SDS PAGE, gelatin hasil perendaman dengan asam asetat menunjukkan adanya 5 pita protein yang terpisah dengan berat molekul yang tinggi pada 85 kDA yang merupakan rantai α-protein dan beberapa pita protein dengan berat molekul yang lebih rendah pada 66 kDa, 45 kDa, 31 kDa, dan 25 kDA. Pola protein yang hampir sama ditunjukkan oleh gelatin dengan proses perendaman menggunakan asam sitrat tetapi pita protein yang terbentuk lebih tipis yaitu pada 85 kDA, 66, 45, 31, dan 25 kDA. Untukl Gelatin hasil perendaman dengan asam laktat tidak menunjukkan pemisahan pita protein dengan jelas pada berat molekul yang tinggi dan hanya tampak agregates protein dengan berat molekul yang rendah dibawah 21kDa.
kDA
M
GAL GAA GAS
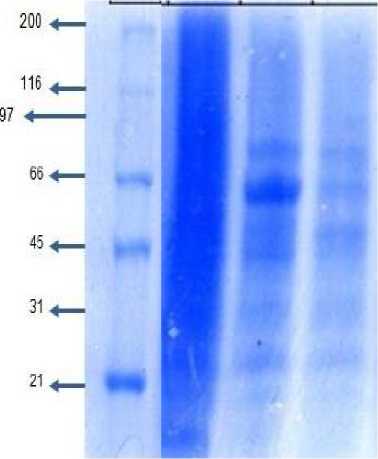
Gambar 1. Elektroforegram produk gelatin hasil perlakuan
Keterangan:
M: Marker Protein (SDS-PAGE molecular Weight Standars Broad Range (BIORAD)
Pita protein dengan berat molekul yang tinggi (200-300Kda) yang merupakan komponen protein β-sheet dan γ-sheet tidak ditemukan pada produk gelatin yang dihasilkan, hanya pita protein dengan berat
molekul 85kDa yang menunjukkan keberadaan rantai α protein dan beberapa agregates protein dengan berat molekul yang lebih rendah pada 66, 45, 31, dan 25 kDA. Hal ini berarti kondisi ekstraksi yang digunakan belum optimal sehingga protein gelatin yang terbentuk tidak utuh atau telah terdegradasi menjadi fragmen -fragmen yang kecil dengan berat molekul yang rendah.
Menurut Johnston-Banks (1990) kandungan asam imino prolin dan hidroksi prolin memegang peran penting terhadap sifat fisik dan mekanik gelatin. Namun sifat fisik dan mekanik gelatin tidak hanya bergantung pada komposisi asam aminonya tetapi juga ditentukan oleh kandungan relatif dari komponen rantai protein β- atau γ – dan aggregates dengan berat molekul yang tinggi serta adanya kandungan fragmen protein dengan berat molekul yang rendah. Faktor lain yang juga berpengaruh terhadap sifat fisik dan mekanik gelatin adalah sumber atau asal dari bahan awal yang digunakan dan proses pengawetan dari bahan mentah yang digunakan atau kesegaran dari bahan mentah yang digunakan. Sehingga pada penelitian ini dapat disimpulkan bahwa perbedaan variasi jenis asam yang digunakan tidak berpengaruh terhadap komposisi asam amino tetapi berpengaruh terhadap pola pita protein (berat molekul ) dan kekuatan gel produk gelatin. Perendaman dengan asam asetat menghasilkan gelatin dengan kekuatan gel tertinggi (216,63 g bloom) dengan sifat fisikokimia yang memenuhi standar SNI yaitu kadar air 11,53%, kadar abu 1,02% , kadar protein 80,59%, dan kadar lemak 1,85%.
SIMPULAN DAN SARAN
Simpulan
Dari penelitian yang telah dilakukan dapat disimpulkan:
Perbedaan jenis asam yang digunakan pada proses perendaman tidak berpengaruh terhadap komposisi asam amino tetapi berpengaruh terhadap pola pita protein atau berat molekul dan kekuatan gel dari produk gelatin.
Saran
-
1. Perlu dilakukan penelitian untuk
mengkaji potensi gelatin kulit ayam
sebagai penyalut sediaan padat.
-
2. Perlu dilakukan penelitian untuk
mengetahui potensi hidrolisat gelatin sebagai bioaktif peptida
-
3. Perlu dilakukan penelitan untuk membuat biomaterial berbasis gelatin yang dikopolimerisasi dengan polimer lainnya untuk pemanfaatannya di bidang kedokteran.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada Fakultas MIPA Universitas Udayana yang telah mendanai penelitian ini melalui scheme Hibah Unggulan Program Studi tahun anggaran 2015.
DAFTAR PUSTAKA
Bailey, A.J., Paul, R.G., 1998, Collagen-A Not So
Simle Protein, J.Soc. Leather.Techn.Chem, 82(3), 104-110.
Chapman and Hall. 1997. Thickening and Gelling agents for Food, 2nd edition, Blackie Academic, Professional, London, 150-153.
Zhou, P. and Regenstein, J.M., 2006, Determination of Protein Content in Gelatin Solutions with the Lowry or Biuret Assay, Journal of Food Sciences, 71(8), 474-477.
Gilsenan, P.M. and Ross-Murphy, S.B.
2000,Rheological Characterization of Gelatins from Mammalia and Marine Sources, Food Hydrocolloids, 14, 191-195.
Gomez-Guillen, M.C., Perez-Mateos,M., Gomes-Estaca, J., Lopex-Caballero, E., Gimenez, B, Montero, P., 2009, Fish Gelatin: a Renewable Materials for The Development of Active Biodegradable Films, Trends in Food Sciences and Technology, 20, 3-16.
Hardikawati, T., Puspawati, N.M., Ratnayani, Ni Ketut, 2016, Kajian Pengaruh Variasi asam Sitrat Terhadap Kekuatan Gel Gelatin Kulit Ayam Dikaitkan Dengan Pola Pita Proteinnya, Jurnal Kimia, 10(1), 115
124.
Jamilah, B. and Harvinder, 2002, Properties of Gelatin from Skin of fish-black tilapia (oreochromis mossambicus), and red tilapia (oreochromis nilotica), Food Chemistry, 77, 81-84.
Junianto., Kiki, H., dan Ine, M.,2006, Produksi Gelatin Dari Tulang Ikan Dan Pemanfaatannya Sebagai Bahan Dasar Pembuatan Cangkang Kapsul, Laporan Penelitian Hibah Bersaing, Bandung.
Karim, A.A and Bhat, R., 2009, Fish Gelatin: Properties and Challenges, and Prospecte as an Alternative to Mammalian Gelatins, Food Hydrocolloids, 23(3), 563-576
Mariod, A.A., and Adam, H.F., 2013, Review: Gelatin, Source, Extraction and Industrial Application, Acta. Sci. Pol. Technol.Aliment, 12(2), 135-137.
Muchtadi, D.1993. Teknik Evaluasi Nilai Gizi Protein. Program Studi Ilmu Pangan.IPB, Bogor.
Norizah, M. S., Farah, B., dan Nazlin, K. H. 2012.Preparation and Characterisation of
Chicken Skin Gelatin as an Alternative to Mammalian Gelatin.Faculty of Health and Medical Sciences, University of Surrey,
Guildford, Surrey.
Raja Mohd-Hafidz, Yakoob, C.M., Amin, I., and Norfaizan, A., 2011, Chemical and Functional Properties of Bovine and Porcine Skin Gelatins, International Food Research Jurnal, 18, 803
807.
Standar Nasional Indonesia (SNI) 06.3735.Mutu dan Cara Uji Gelatin.Dewan Standarisasi
Nasional.Jakarta, 1995.
Ward, A.G., Courts, A., 1977,The Science and
Technology of Gelatin, Academic Press,New York
42
Discussion and feedback