IDENTIFIKASI SENYAWA ANTIBAKTERI PADA DAUN KECAPI (Sandoricum koetjape (Burm.f.)
on
ISSN 1907-9850
IDENTIFIKASI SENYAWA ANTIBAKTERI PADA DAUN KECAPI (Sandoricum koetjape (Burm.f.))
I M. Dira Swantara1) dan Yenni Ciawi2)
1)Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran 2)Jurusan Teknik Sipil, Fakultas Teknik Uniersitas Udayana, Bukit Jimbaran
ABSTRAK
Identifikasi senyawa antibakteri terhadap Micrococcus luteus dan Eschericia coli telah dilakukan pada ekstrak daun kecapi (Sandoricum koetjape (Burm.f.)). Ekstraksi komponenya menggunakan cara maserasi dengan etanol 70%. Pemisahan fraksinya menggunakan partisi cair-cair (n-heksana, etil asetat, dan kloroform) dan dua tahap kromatografi kolom menggunakan fase diam silika gel dan eluen pertama campuran etil asetat-kloroform (3:7;2,5:7,5; dan 2:8), dan eluen kedua campuran etil asetat-kloroform (2:8; 1,5:8,5; dan 1:9). Fraksi yang paling aktif (fraksi 2.1 dan 2.3) diidentifikasi menggunakan kromatografi gas-spektroskopi massa. Fraksi 2.1 disimpulkan gabungan 3 senyawa, yaitu heksil n-valerat(C11H22O2); 2,3-dihidro benzofuran (C8H8O), dan 2,6-dimetoksi fenol (C8H10O3). Fraksi 2.3 disimpulkan gabungan 2 senyawa, yaitu ester dioktil heksadioat(C22H42O4) dan 3,5-di-tert-butil-4-hidroksi-toluena(C15H24O).
Kata kunci : identifikasi, Sandoricum koetjape (Burm.f.), antibakteri
ABSTRACT
Identification of antibacterial compound for Micrococcus luteus dan Eschericia coli bacteri have been conducted to kecapi leaf extract (Sandoricum koetjape (Burm.f.)). Extraction of that compounds was carried out by maseration methods using 70% etanol. Separation of the fraction by liquid-liquid partition (n-hexane, ethyl acetate and chloroform) and two step column chromatographic method using silicagel as stationary phase and ethyl acetate – chloroform (3:7;2,5:7,5; dan 2:8) as first eluent and ethyl acetate – chloroform (2:8; 1,5:8,5; dan 1:9) as second eluent. The active fraction (2.1 and 2.3 fraction) were identified by gas chromatography-mass spectroscopy (GC-MS). The 2.1 fraction contain 3 compound which are heksil n-valerate (C11H22O2); 2,3-dihidrobenzofurane (C8H8O); and 2,6-dimetoxy fenol (C8H10O3). The 2.3 fraction contain 2 compound which are ester dioctilehexadioat (C22H42O4) with M+ = 370 and basic peak equal to 129 and 3,5-di-tert-buthyl-4-hydroxy-toluene (C15H24O).
Keywords : isolation, identification, Sandoricum koetjape (Burm.f.), antibacterial
PENDAHULUAN
Keanekaragaman hayati seperti flora dan fauna yang tersebar luas mulai dari spesies tingkat tinggi sampai spesies tingkat rendah memiliki senyawa-senyawa bioaktif. Sebaran senyawa bioaktif yang terdapat pada tumbuhan dapat dicari dengan dua pendekatan, yaitu pendekatan fitofarmakologi (phytopharmaco-logic approaches) dan pendekatan skrining fitokimia (phytochemical screening approaches).
Pendekatan fitofarmakologi biasanya bersumber dari etnobotani yaitu informasi yang terdapat di masyarakat baik tertulis maupun tidak tertulis mengenai penggunaan tumbuhan sebagai bahan obat tradisional yang telah digunakan secara turun-temurun di masyarakat. Pendekatan fitofarmakologi tersebut berisi penelusuran senyawa-senyawa yang terkandung di dalam suatu tumbuhan berdasar aktivitas fisiologis yang ditunjukkan oleh senyawa-senyawa tersebut.
Tumbuh-tumbuhan yang dapat digunakan sebagai obat di Bali ditulis dalam bentuk lontar yang disebut usada. Masyarakat Bali masih mempercayai pengobatan dengan usada bermanfaat dan mampu untuk menyembuhkan penyakit (Tengah, 2005). Naskah dalam bentuk lontar-lontar usada ini diperkirakan tersebar di sejumlah daerah di Bali. Beberapa macam naskah usada tersebut diantaranya adalah Usada Buduh, Usada Dalem, Usada Edan, Usada Mala, Usada Rare, Usada Bebai, Usada Tiwang, Usada Tiwas Punggung, Usada Tetenger, Punggung, Usada Tetenger, Usada Timbal, Usada Usap, dan Usada Taru Premana (Sukarwa, 1983).
Tumbuhan sebagai obat tradisional, biasanya digunakan secara tunggal (satu jenis tumbuhan) atau majemuk (campuran dari beberapa jenis tumbuhan). Bagian tumbuhan yang umum digunakan sebagai obat tradisional adalah daun, bunga, buah, kulit batang, atau akarnya. Penggunaannya ada yang secara langsung dalam keadaan yang masih segar, ada pula yang diseduh ataupun direbus (Tengah, 2005).
Salah satu tumbuhan obat yang tertulis dalam Usada Taru Premana adalah tumbuhan kecapi (Sandoricum koetjape (Burm.f.) Merr). Pohon kecapi banyak dimanfaatkan dalam pengobatan tradisional sebagai obat mencret, obat mulas, sakit mata, obat panas, keputihan, dan obat batuk (Tinggen, 2000). Penyakit-penyakit yang dapat disembuhkan oleh tumbuhan kecapi pada umumnya disebabkan infeksi oleh bakteri, sehingga diperkirakan di dalam tumbuhan kecapi terkandung suatu senyawa yang mempunyai bioaktivitas antibakteri. Berdasarkan penelitian yang pernah dilakukan sebelumnya sudah diketahui bahwa ekstrak etanol daun kecapi mempunyai bioaktivitas antibakteri yang dapat menghambat pertumbuhan bakteri Micrococcus luteus dan Eschericia coli (Suartini, 2006). Tumbuhan kecapi mengandung beberapa senyawa kimia, seperti flavanoid, saponin, dan polifenol, tetapi belum diketahui senyawa kimia mana yang menyebabkan tumbuhan kecapi memiliki bioaktivitas antibakteri (Djumidi, 1997).
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan terdiri atas daun kecapi, bakteri Micrococcus luteus dan Eschericia coli, nutrient agar, nutriet broth, etanol (teknis), kloroform (teknis), etil asetat (teknis), n-heksana (teknis), akuades, natrium hidroksida, asam klorida (p.a), silikagel, pelat KLT silikagel GF254, magnesium, dan FeCl3.
Peralatan
Peralatan yang digunakan terdiri atas gelas beker, gelas ukur, pipet volume, pipet ukur, corong pisah, pipet tetes, penguap putar vakum, kertas saring, blender, batang pengaduk, pipet tetes, pipet mikro, pipet volume, botol sampel, gelas arloji, seperangkat alat KLT, seperangkat alat kromatografi kolom, lampu UV, dan kromatografi gas-spektroskopi massa.
Cara Kerja
Bahan tumbuhan yang digunakan dalam penelitian ini diambil di Banjar Pengembungan, Desa Prerenan, Kecamatan Mengwi, Kabupaten Badung. Selanjutnya kira-kira 700 gram daun kecapi dicuci, dipotong-potong, kemudian dikeringkan. Bahan yang telah kering diblender dan diayak dengan ukuran 100 mesh.
Sebanyak 300 gram serbuk kering daun kecapi diekstraksi dengan cara maserasi selama 24 jam menggunakan pelarut etanol 70% dengan cara berulang-ulang sampai diperkirakan semua metabolit habis terekstraksi. Ekstrak yang diperoleh kemudian diupkan menggunakan evaporator.
Ekstrak kasar (Crude extract) etanol kemudian dilarutkan dalam air dan dipartisi berturut-turut dengan n-heksana, etil asetat, dan kloroform. Ketiga ekstrak yang diperoleh selanjutnya diuapkan dan diuji bioaktivitas antibakterinya. Ekstrak yang paling aktif kemudian dipisahkan menggunakan kromatografi kolom (silika gel) dengan eluen yang pertama menggunakan tiga macam campuran etil asetat-kloroform (3:7;2,5:7,5; dan 2:8) dan yang kedua menggunakan tiga macam campuran etil asetat-kloroform (2:8; 1,5:8,5; dan 1:9). Fraksi yang paling aktif dan murni kemudian diidentifikasi dengan uji reaksi
fitokimia dan dengan kromatografi gas-spektroskopi massa.
HASIL DAN PEMBAHASAN
Ekstraksi
Sebanyak 300 gram serbuk kering daun kecapi dimaserasi berkali-kali dengan etanol 70 %. Proses ini dilakukan untuk menarik senyawa-senyawa dari nonpolar sampai polar ke dalam pelarut. Ekstrak kasar etanol yang diperoleh sebanyak 22,85 gram.
Semua Ekstrak kasar yang diperoleh dilarutkan ke dalam 200 mL air, kemudian dipartisi berturut-turut dengan 150 mL n-heksana, etil asetat, dan kloroform. Ketiga ekstrak yang diperoleh selanjutnya diuapkan sehingga diperoleh ekstrak n-heksana (0,92 g) berwarna hijau muda, ekstrak etil asetat (1,75 g) berwarna kuning kecoklatan, dan ekstrak kloroform (0,57 g) berwarana hijau muda. Masing ekstrak diuji bioaktivitas antibakterinya. Ekstrak yang paling aktif adalah ekstrak etil asetat memberikan luas daerah hambatan paling besar yaitu pada Micrococcus luteus 52,60 mm2 dan pada Eschericia coli 40,37 mm2.
Pemisahan dan Pemurnian.
Ekstrak etil asetat kemudian dipisahkan dan dimurnikan. Sebanyak 1,41 gram ekstrak etil asetat dipisahkan dengan kromatografi kolom (silikagel) menggunakan campuran eluen etil asetat-kloroform (3:7, 2.5:7.5, dan 2:8).
Kecepatan alir eluen diatur 3 mL/5 menit. Eluat ditampung setiap 3 mL sampai menghasilkan 212 botol eluat. Keduaratus dua belas botol eluat tersebut diuji kesamaan senyawanya menggunakan kromatografi lapis tipis, sehingga dihasilkan 4 fraksi. Masing-masing fraksi kemudian diuji bioaktivitas antibakterinya. Fraksi yang paling aktif ditunjukkan oleh fraksi 2. Dengan uji kemurnian menunjukkan bahwa fraksi 2 belum murni. Fraksi 2 ini kemudian dipisahkan lagi dengan menggunakan kromatografi kolom (silikagel) dengan eluen etil asetat-kloroform (2:8, 1.5:8.5, dan 1:9). Eluat ditampung setiap 3 mL sampai menghasilkan 107 botol eluat. Keseratus tujuh botol eluat tersebut diuji kesamaan senyawanya
menggunakan kromatografi lapis tipis, sehingga dihasilkan 3 fraksi. Masing-masing fraksi kemudian diuji bioaktivitas antibakterinya. Fraksi yang paling aktif menghambat tertumbuhan bakteri uji adalah fraksi 2.1. dan fraksi 2.3. Selanjutnya kedua fraksi ini diidentifikasi senyawanya menggunakan kromatografi gas-spektroskopi massa.
Identifikasi Senyawa Aktif Antibakteri
A. Fraksi 2.1
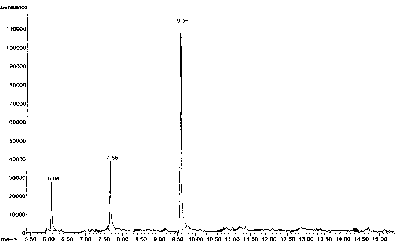
Gambar 1. Kromatogram fraksi 2.1
Kromatogram gas fraksi 2.1 (Gambar 1) menunjukkan adanya 3 puncak dengan waktu retensi (tR) dan luas puncak (%) berturut-turut: puncak 1, tR 6.08 menit (17,46%); puncak 2, tR 7.66 menit (25,17%); dan puncak 3, tR 9.56 menit (57,37%). Berdasarkan kromatogram gas tersebut diduga fraksi 2.1 mengandung 3 senyawa.
Senyawa pada puncak 1
Spektrum massa pada senyawa puncak 1 identik dengan spektrum massa senyawa heksil n-valerat yang terdapat pada database (NISTO2.L) (Gambar 2). Berat molekul senyawa tersebut (C11H22O2) adalah 186. Pada spektrum massa senyawa tersebut di database ion molekulnya tidak tampak, hal ini mungkin disebabkan karena ion molekul tersebut tidak stabil (C11H22O2+).
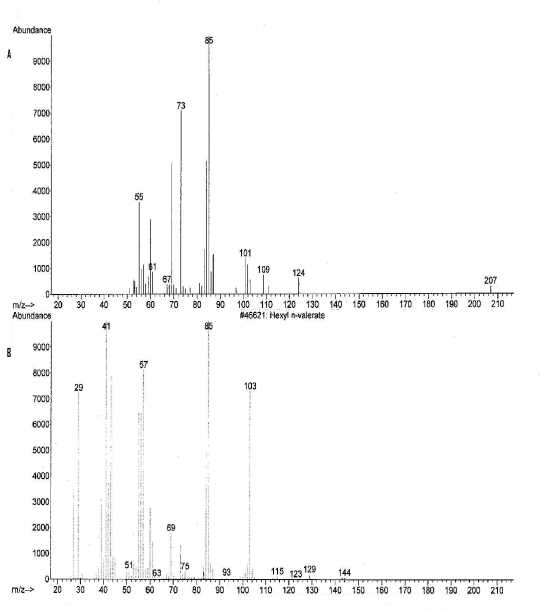
Gambar 2.
(A) Spektrum massa senyawa pada puncak 1 dan (B) Spektrum massa heksil n-valerat
Pola pemenggalan spektrum massa senyawa pada puncak 1 menunjukkan adanya pemenggalan pada m/z 101, m/z 85, dan pada m/z 57. Pada pemenggalan m/z 101 terjadi pelepasan C6H13 dan menghasilkan penggalan C5H9O2+. Pada pemenggalan m/z 85 terjadi pelepasan ester, yaitu (M+-C6H13O) dan menghasilkan penggalan C5H9O+. Pada pemenggalan m/z 57 terjadi pelepasan C7H13O2 dan menghasilkan C4H9+. Dari penggalan di atas dapat diindikasikan bahwa senyawa pada puncak 1 dengan dengan berat molekul 186 identik dengan heksil n-valerat (C11H22O2), yang struktur molekulnya dapat dilihat pada Gambar 3.
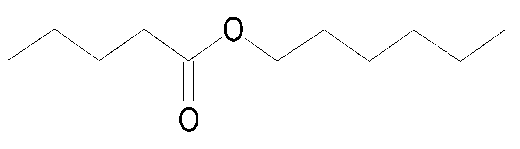
Gambar 3. Struktur molekul heksil n-valerat
Senyawa puncak 2
Spektrum massa senyawa pada puncak 2 dengan tR 7.66 menit identik dengan spektrum massa yang terdapat pada database (NISTO2.L), yaitu senyawa 2,3-dihidro benzofuran (C8H8O), ditampilkan pada Gambar 4. Pada spektrum massa ini memperlihatkan adanya ion pada m/z 120 (M+, puncak dasar). Ion molekul (M+) pada m/z 120 mengindikasikan berat molekul 120.
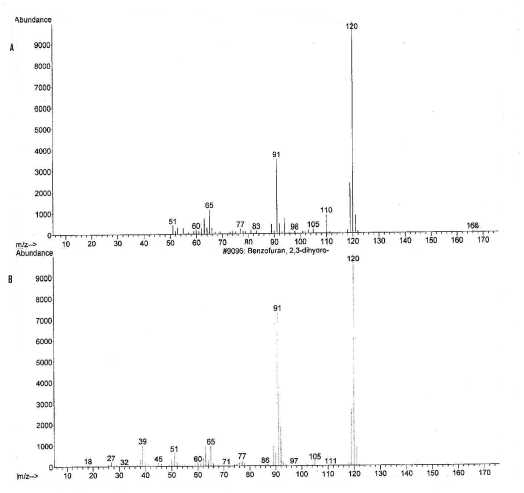
Gambar 4. (A) Spektrum massa senyawa pada puncak 2 dan (B) spektrum massa 2,3-dihidro benzofuran
Pola pemenggalan spektrum massa senyawa pada puncak 2 menunjukkan adanya pemenggalan pada m/z 91 dan pada m/z 65. Pada pemenggalan m/z 91 terjadi pelepasan gugus aldehida (M+-CHO) menghasilkan C7H7+. Adanya pemenggalan pada m/z 91 merupakan ciri khas penggalan tripolium (C7H7). Penggalan tripolium ini merupakan hasil pemecahan dan penataan ulang dari benzena. Jadi penggalan tripolium merupakan ciri khas adanya benzena (Silvertstein, Bassler, Morrill, 1991). Pada m/z 65 terjadi pelepasan gugus aldehida dan etilena (M+-CHO-C2H2) menghasilkan C5H5+. Dari penggalan di atas dapat diindikasikan bahwa senyawa pada puncak 2 dengan berat molekul 120 identik dengan 2,3-dihidrobenzofuran (C8H8O), yang struktur molekulnya dapat dilihat pada Gambar 5.
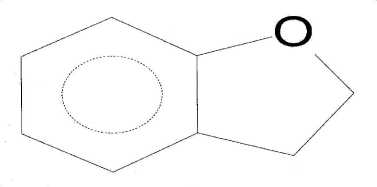
Gambar 5. Struktur molekul 2,3-dihidro benzofuran
Senyawa puncak 3
Spektrum massa senyawa pada puncak 3 dengan tR 9.56 menit identik dengan spektrum massa yang terdapat pada database (NISTO2.L), yaitu senyawa 2,6-dimetoksi fenol (C8H10O3), yang ditampilkan pada Gambar 6. Pada spektrum massa ini memperlihatkan adanya ion pada m/z 154 (M+, puncak dasar). Ion molekul (M+) pada m/z 154 mengindikasikan berat molekul 154. Pola pemenggalan spektrum massa senyawa pada puncak 3 menunjukkan bahwa adanya pemenggalan pada m/z 139 dan pada m/z 125. Pada pemenggalan m/z 139 terjadi pelepasan gugus metil (M+-CH3) dan menghasilkan penggalan C7H7O3+. Pada pemenggalan m/z 125 terjadi pelepasan metil dan etilen (M+-CH3-CH2) dan menghasilkan penggalan C6H5O3+.
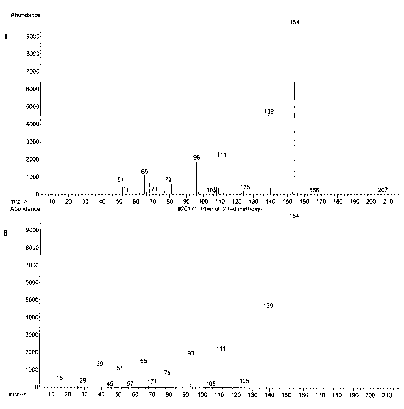
Gambar 6. (A) Spektrum massa senyawa pada puncak 3 dan (B) spektrum massa 2,6-dimetoksi fenol
Penggalan di atas dapat diindikasikan bahwa senyawa pada puncak 3 dengan berat molekul 154 identik dengan 2,6-dimetoksi fenol (C8H10O3), yang struktur molekulnya dapat dilihat pada Gambar 7.
Gambar 7. Struktur molekul 2,6-dimetoksi fenol
B. Fraksi 2.3
1SOQOO
14000-0 2039
60000
40000
20000
Time-> 5.00 6.00 7.00 8.00 9.00 10.00 11.00 12.00 13.00 14.00 15.00 16.00 17.00 18.00 19.00 20 00 21.00 22.00 23.00 24.00 25.00
Gambar 8. Kromatogram gas fraksi 2.3
Kromatogram gas fraksi 2.3 pada Gambar 8 menunjukkan adanya 2 puncak dengan waktu retensi (tR) dan luas puncak (%) secara berturut-turut: 11.66 menit (4,21%) dan 20.39 menit (95,79%). Dari puncak-puncak tersebut dapat diduga bahwa fraksi 2.3 mengandung 2 senyawa.
Senyawa pada puncak 1
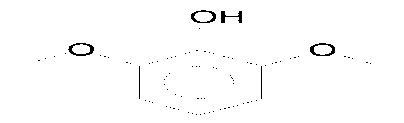
Spektrum massa senyawa pada puncak 1 dengan tR 11.66 menit identik dengan spektrum massa yang terdapat pada database (NISTO2.L), yaitu senyawa 3,5-di-tert-butil-4-hidroksi-toluena (C15H24O), ditampilkan pada Gambar 9. Pada spektrum massa ini memperlihatkan adanya ion pada m/z 220 (M+, puncak dasar). Ion molekul (M+) pada m/z 220 mengindikasikan berat molekul 220.
pelarut, pipet tetes yang digunakan, dan plastik yang digunakan pada saat penelitian dilakukan (Budavari, O’Neil, Smith, Heckelman, 1989,).
Senyawa pada puncak 2
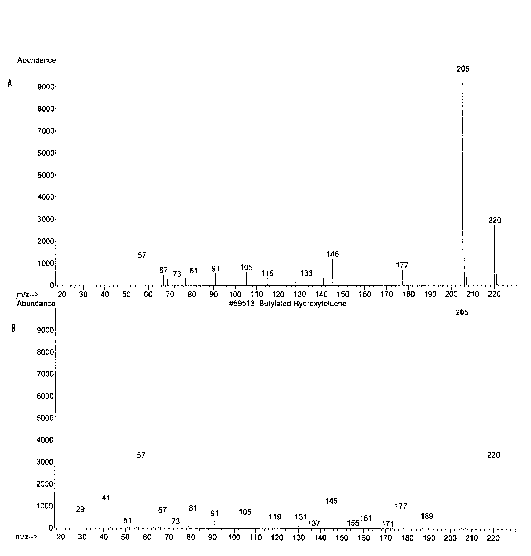
Spektrum massa pada puncak 2 dengan waktu retensi 20.39 menit identik dengan spektrum massa yang terdapat pada database (NISTO2.L), yaitu senyawa ester dioktil heksadioat, ditampilkan pada Gambar 11. Berat molekul dari ester dioktil heksadioat(C22H42O4) adalah 370. Pada spektrum massa senyawa tersebut di database ion molekulnya tidak tampak, hal ini dapat disebabkan karena ion molekul tersebut tidak stabil (C22H42O4+). Puncak dasar senyawa ini adalah 129.
Gambar 9. (A) Spektrum massa senyawa pada puncak 1 dan (B) spektrum massa 3,5-di-tert-butil-4-hidroksi-toluena
Pola pemenggalan spektrum massa senyawa pada puncak 1 menunjukkan adanya pemenggalan pada m/z 205 dan m/z 57. Pada pemenggalan m/z 205 terjadi pelepasan gugus metil (M+-CH3) dan menghasilkan penggalan C14H21O+. Pada pemenggalan m/z 57 terjadi pelepasan C11H15O dan menghasilkan (CH3)3+.
Dari penggalan di atas dapat diindikasikan bahwa senyawa pada puncak 1 dengan berat molekul 220 identik dengan 3,5-di-tert-butil-4-hidroksi-toluena (C15H24O) yang struktur molekulnya dapat dilihat pada Gambar 10.
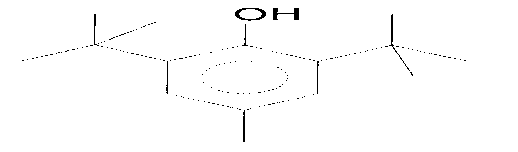
Gambar 10. Struktur molekul 3,5-di-tert-butil-
4-hidroksi-toluena
Berdasarkan beberapa laporan dijelaskan bahwa senyawa 3,5-di-tert-butil-4-hidroksi-toluena bukan merupakan komponen yang berasal dari tumbuhan, tetapi merupakan komponen sintetik antioksidan di dalam pembuatan plastik. Senyawa ini bisa terdapat di dalam sampel mungkin disebabkan dari kemasan
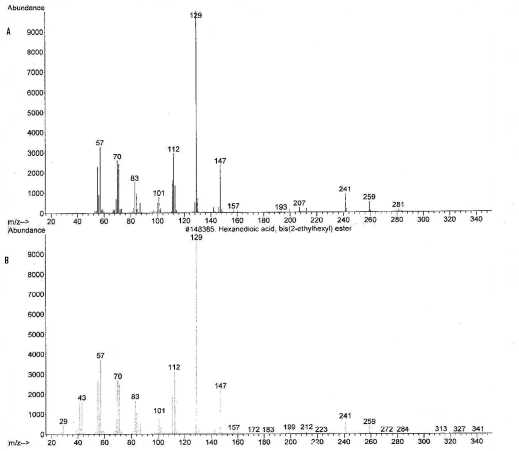
Gambar 11. (A) Spektrum massa senyawa pada puncak 1 dan (B) spektrum massa ester dioktil heksadioat
Pola pemenggalan pada senyawa pada puncak 2 menunjukkan adanya pemenggalan pada m/z 370, m/z 241, m/z 129, dan m/z 112, terjadi 2 kali pemenggalan ester, yaitu pada m/z 241 menit (M+-C8H17O) dan m/z 112 menit (M+-C16H34O2). Pada m/z 129 merupakan penggalan molekul yang melepas gugus ester oktil (M+-C14H2O3) dan menghasilkan C8H17O+. Penggalan pada m/z 112 merupakan penggalan ion molekul yang melepaskan 2 gugus ester dioktil (M+-C16H34O2) dan menghasilkan C6H8O2+.
Penggalan di atas dapat diindikasikan bahwa senyawa pada puncak 2 dengan dengan berat molekul 370 identik dengan ester dioktil
heksadioat(C22H42O4), yang struktur molekulnya dapat dilihat pada Gambar 12.
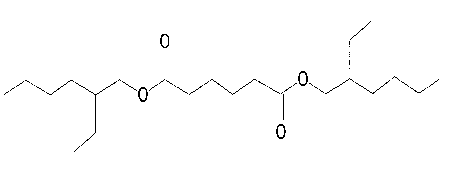
Gambar 12. Struktur molekul dioktil heksadioat
Berdasarkan penelitian-penelitian identifikasi senyawa antibakteri yang telah dilakukan, fraksi paling aktif antibakteri yang diperoleh juga mengandung senyawa dioktil heksadioat sama seperti senyawa yang terkandung di dalam fraksi 2.3. Dari hasil tersebut dapat disimpulkan bahwa senyawa dioktil heksadioat yang merupakan senyawa antibakteri (Tungga, 2006; Agung, 2006; Sukmarianti, 2007; Martiningsih, 2007).
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian yang diperoleh dapat diambil simpulan sebagai berikut :
-
1. Isolat aktif antibakteri dan relatif murni yang berasal dari fraksi 2.1 diduga gabungan dari 3 senyawa, yaitu heksil n-valerat, 2,3-dihidro benzofuran, dan 2,6-dimetoksi fenol.
-
2. Isolat aktif antibakteri dan relatif murni yang berasal dari fraksi 2.3 diduga gabungan dari 2 senyawa, yaitu 3,5-di-tert-butil-4-hidroksi-toluena dan ester dioktil heksadioat.
-
3. Senyawa antibakteri yang terdapat di dalam ekstrak daun kecapi kemungkinan senyawa dioktil heksadioat.
-
4. Senyawa 3,5-di-tert-butil-4-hidroksi-toluena merupakan komponen sintetik antioksidan yang merupakan pengotor yang terdapat di dalam sampel yang berasal dari plasitik dan kemasan pelarutnya.
Saran
-
1. Sehubungan sudah diketahuinya gabungan senyawa yang aktif menghambat
pertumbuhan bakteri uji pada fraksi 2.1 dan fraksi 2.3, perlu dilakukan pemisahan terhadap gabungan senyawa tersebut sehingga diketahui senyawa tunggal yang aktif menghambat pertumbuhan bakteri uji.
-
2. Fraksi 1 dan 2.2 yang juga aktif menghambat bakteri uji perlu diteliti lebih lanjut sehingga diketahui secara keseluruhan senyawa yang terkandung dalam daun kecapi yang aktif menghambat pertumbuhan bakteri uji.
-
3. Ekstrak kloroform yang sudah terbukti aktif menghambat pertumbuhan bakteri uji perlu diteliti lebih lanjut.
-
4. Tumbuhan lain yang tercatat di dalam Usada Taru Premana yang ekstrak etanolnya sudah terbukti aktif menghambat pertumbuhan bakteri uji perlu diteliti lebih lanjut.
UCAPAN TERIMA KASIH
Melalui kesempatan ini, penulis menyampaikan terima kasih kepada saudara Luh Putu Sawitri Nandari atas bantuannya mengerjakan penelitian ini. Demikian juga kepada semua pihak yang tidak bisa disebutkan satu per satu, diucapkan terima kasih.
DAFTAR PUSTAKA .
Agung, I B. P. G., 2006, Skrining, Isolasi, dan
Identifikasi Senyawa Kimia yang Bersifat Antibakteri dalam Tanaman Obat pada Usada Taru Premana, Skripsi, Universitas Udayana, Bukit Jimbaran Budavari, S., O’Neil, M. J., Smith, A., and
Heckelman, P. E., 1989, The Merk Index an Encyclopedia of Chemical, Drugs, and Biologicals, Eleventh Edition, Merck and CO, USA
Djumidi, H. (Ed), 1997, Inventaris Tanaman Obat Indonesia, Jilid IV Badan
Penelitian dan Pengembangan Kesehatan, Departemen Kesehatan dan Kesejahteraan Sosial RI, Jakarta
Martiningsih, N. W., 2007, Identifikasi Senyawa Antibakteri pada Rimpang Lempuyang (Zingiber Gramenium Blume), Skripsi, Universitas Udayana, Bukit Jimbaran
Silvertstein, R. M., Bassler, G. C., and Morrill, T. C., 1991, Spectrometric Identification of Organic Compounds, Fifth Edition, John Wiley and Sons, Singapore
Suartini, N. M., 2006, Skrining, Isolasi, dan Identifikasi Senyawa Antibakteri dalam Tumbuhan Berkhasiat Sebagai Obat Sakit Perut yang Tercatat dalam Usada Taru Premana, Skripsi, Universitas Udayana, Bukit Jimbaran.
Sukarwa, I M., 1983a-k, Usada Bali, Proyek Pengadaan Pembinaan, dan Pengawasan Obat dan Makanan, Departemen Kesehatan, Propinsi Bali.
Sukmarianti, N. W. S., 2007, Identifikasi Senyawa Antibakteri pada Daun Paspasan (Coccinia Grandis Voigt), Skripsi, Universitas Udayana, Bukit Jimbaran.
Tengah, I. G. P., 1995, Studi tentang: Inventaris, Determinasi, dan Cara Penggunaan Tanaman Obat pada “Lontar Usada” di Bali, Departemen Kesehatan RI, Jakarta.
Tinggen, I N., 2000, Taru Premana (Pustaka Leluhur), Eka Cipta, Singaraja.
Tungga, D., 2006, Isolasi dan Identifikasi Senyawa yang Bersifat Antibakteri dan Toksik dalam Tumbuhan Iler, Skripsi, Universitas Udayana, Bukit Jimbaran.
68
Discussion and feedback