DEGRADASI FOTOKATALITIK FENOL MENGGUNAKAN FOTOKATALIS ZnO DAN SINAR UV
on
ISSN 1907-9850
DEGRADASI FOTOKATALITIK FENOL MENGGUNAKAN FOTOKATALIS ZnO DAN SINAR UV
Dessy Gilang Permata, Ni Putu Diantariani*, Ida Ayu Gede Widihati
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran
*E-mail : putu_diantariani@unud.ac.id
ABSTRAK
Telah dilakukan penelitian mengenai degradasi fotokatalitik fenol menggunakan fotokatalis ZnO dan sinar UV. ZnO disintesis menggunakan metode pengendapan dan dikarakterisasi menggunakan Difraksi Sinar-x (XRD) dan Scanning Electron Microscope (SEM). Degradasi fotokatalitik fenol meliputi penentuan pH optimum, jumlah fotokatalis optimum, waktu reaksi optimum, dan efektivitas degradasi fotokatalitik. Hasil karakterisasi XRD menunjukkan ZnO memiliki struktur kristal heksagonal wurtzite dengan ukuran kristal 28,05 nm. Dari hasil karakterisasi SEM menunjukkan ZnO yang dihasilkan berbentuk bulat. Kondisi optimum degradasi fotokatalitik fenol dengan fotokatalis ZnO yaitu pH optimum 8, jumlah fotokatalis ZnO optimum 40 mg, dan waktu optimum radiasi 8 jam. Efektivitas degradasi fotokatalitik fenol pada kondisi optimum sebesar (63,52±3,48)%.
Kata kunci: Degradasi Fotokatalitik, Fenol, Fotokatalis ZnO.
ABSTRACT
Research on photocatalytic degradation of phenol using ZnO as photocatalyst and UV ray as radiation sources has been carried out. ZnO was synthesized using precipitation method and characterized using X-ray Diffraction (XRD) and Scanning Electron Microscope (SEM). The study of photocatalytic degradation of phenol included the determination of the optimum conditions (pH, amount of photocatalyst and irradiation time) and the effectivity of photocatalytic degradation. The characterization of the synthesized ZnO using x-ray diffraction showed that ZnO has hexagonal wurtzite structure and particle size of 28.05 nm, whereas characterization using SEM suggested that the particles were spherical. Optimum conditions of photocatalytic degradation of phenol were pH 8, photocatalyst amount of 40 mg and irradiation time of 8 hours. The effectivity of photocatalytic degradation of phenol at optimum conditions was (63.52±3.48) %.
Keywords : Photocatalytic Degradation, Phenol, Photocatalyst
PENDAHULUAN
Perkembangan industri yang semakin pesat tetapi tidak diimbangi dengan teknologi pengolahan limbah yang tepat dapat memberikan dampak negatif bagi lingkungan seperti pencemaran limbah industri. Fenol merupakan salah satu limbah cair yang mempunyai toksisitas tinggi dan bersifat karsinogenik. Pencemaran fenol dapat berasal dari limbah cair rumah sakit
misalnya pada laboratorium kimia klinik, laboratorium hematologi, laboratorium mikrobiologi, ruang operasi dan instalasi lainnya (Mukaromah dan Irawan, 2008).
Fenol yang ada di perairan dapat terakumulasi pada organisme yang hidup di perairan, yang apabila senyawa ini dimakan oleh manusia akan terakumulasi pada tubuh dalam konsentrasi tertentu dapat memberikan dampak negatif bagi kesehatan manusia seperti penurunan
tekanan darah, pelemahan detak jantung, kerusakan ginjal dan hati hingga kematian.
Degradasi fotokatalitik merupakan metode yang dapat dikembangkan untuk mendegradasi limbah fenol dengan bantuan cahaya sinar matahari. Sinar matahari yang sampai ke permukaan bumi intensitasnya lemah sehingga proses degradasi fenol berlangsung lambat. Fotodegradasi fenol dapat ditingkatkan dengan menggunakan bahan fotokatalis dan sinar ultraviolet (UV). Bahan fotokatalis yang biasanya digunakan merupakan oksida logam yang bersifat semikonduktor, antara lain TiO2, ZnO, CuO, CdO, Fe2O3 dan sebagainya (Arief, 2011).
Fotokatalis semikonduktor apabila diberi foton sebesar hv, maka energi foton akan diabsorpsi oleh elektron pada pita valensi sehingga elektron tersebut akan pindah ke tingkat energi yang lebih tinggi yaitu pita konduksi (Kurniatun dkk., 2012). Hal ini mengakibatkan terbentuknya pasangan electrone-hole pada permukaan katalis semikonduktor ketika diinduksi oleh energi foton yang sesuai (Arief, 2011). Fotokatalis yang akan digunakan dalam penelitian ini adalah ZnO. Fotokatalis ZnO memiliki aktivitas fotokatalitik yang tinggi (Sakthivel et al., 2003), murah dan memiliki energi celah pita (band gap energy) yang lebar yaitu 3,2 eV (Ali and Siew, 2006, Attia et al., 2008).
Keefektifan dari fotokatalis dalam mendegradasi ditentukan oleh ukuran partikel dari fotokatalis. Semakin kecil ukuran partikel dari fotokatalis semakin efektif dalam mendegradasi senyawa organik. Fotokatalis dapat disintesis dengan beberapa metode, salah satunya dengan menggunakan prekursor seng asetat sebagai sumber Zn. Metode ini memiliki keunggulan yaitu menghasilkan partikel ZnO yang berbentuk bulat (sperical) dengan ukuran partikel yang relatif kecil, yaitu 332,3 nm sampai 1.105 nm (Diantariani dkk, 2013).
Berdasarkan latar belakang di atas maka dilakukan penelitian mengenai degradasi fotokatalitik fenol menggunakan fotokatalis ZnO yang disintesis dengan metode pengendapan menggunakan prekursor seng asetat. Dalam penelitian ini akan dipelajari bagaimana pengaruh pH, waktu, jumlah katalis dan efektivitas fotokatalis ZnO dalam mendegradasi fenol.
MATERI DAN METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain: fenol (C6H6OH), aquades, seng asetat dihidrat
((CH3COO)2Zn.2H2O), etanol (C2H6O), TEA (trietanolamin), n-propylamin, HCl, NaOH, ammonium hidroksida (NH4OH), kalium
dihidrogen fosfat (KH2PO4), kalium hidrogen fosfat (K2HPO4), 4-aminoantipirin, kalium ferisianida (K4Fe(CN)6).
Peralatan
Alat-alat yang digunakan dalam penelitian ini antara lain: alat refluks, pengaduk mekanik, sinar UV, batang pengaduk, erlenmeyer, gelas beker, spektrofotometer UV-Vis (Shimadzu UV Spectrofotometer UV-1800), Difraktometer sinar-X, Scanning electron microscope (SEM), pH meter, kotak radiasi yang dilengkapi dengan lampu UV philips TUV 15W/G15T8.
Cara Kerja
Sintesis Fotokatalis ZnO
Sebanyak 0,15 mol seng asetat dihidrat dilarutkan dengan 150 mL akuades. Dibuat juga larutan 0,30 mol TEA (trietanolamin) dan 0,30 mol n-propilamin dalam 150 mL etanol absolut (99,5%). Larutan seng asetat ditambahkan secara perlahan-lahan sambil diaduk ke dalam larutan TEA (trietanolamin) dan n-propilamin. Pencampuran larutan dilakukan pada labu alas bulat yang dilengkapi kondensor untuk mengontrol larutan pada tekanan uap jenuh. Larutan direfluk dan dipanaskan pada suhu 65-77oC selama 8 jam. Endapan putih yang diperoleh kemudian disaring dengan kertas saring mikropori, kemudian endapan dicuci tiga kali dengan etanol untuk menghilangkan reagen organik dan OH- yang tersisa. Endapan yang diperoleh dikeringkan dengan oven pada suhu 60oC. Setelah mendapatkan berat konstan, endapan ZnO yang terbentuk disimpan di dalam desikator (Diantariani dkk., 2013).
Karakterisasi Fotokatalis
ZnO hasil sintesis dikarakterisasi dengan difraksi sinar-X untuk mengidentifikasi struktur
kristal dan ukuran kristal dan scanning elektron microscope (SEM) untuk mengetahui morfologi kristal ZnO.
Analisis Fenol
Sebanyak 50 mL larutan sampel fenol dimasukkan ke dalam erlenmeyer 100 mL, ditambah 2,5 mL larutan NH4OH 0,5 N dan pH-nya diatur menjadi 7,9±0,1 dengan penambahan larutan penyangga fosfat. Larutan ditambah 1 mL larutan aminoantipirin 8 %, 1 mL kalium ferisianida sambil diaduk. Larutan didiamkan selama 15 menit kemudian diukur dengan spektrofotometer UV-Vis pada panjang gelombang maksimum (SNI, 2004).
Optimasi pH Larutan
Sebuah gelas beker 250 mL diisi dengan 100 mL fenol 50 ppm, 50 mg ZnO dan diatur pHnya pada pH 4. Campuran diradiasi dengan lampu sinar UV selama 5 jam sambil diaduk dengan pengaduk magnetik. Selesai radiasi, campuran disentrifugasi untuk memisahkan filtrat dari endapannya. Filtratnya diukur absorbansinya pada panjang gelombang maksimum dari fenol dengan spektrofotometer UV-Vis. Selanjutnya masing-masing perlakuan dihitung untuk ditentukan nilai persentase degradasinya. Prosedur kerja yang sama dilakukan untuk pH larutan 5, 6, 7, 8, 9, dan 10 (Benhebal et al., 2013).
Optimasi Jumlah Katalis ZnO
Sebuah gelas beker 250 mL diisi dengan 100 mLfenol 50 ppm, 30 mg ZnO dan diatur pHnya pada pH optimum. Campuran diradiasi dengan lampu sinar UV selama 5 jam sambil diaduk dengan pengaduk magnetik. Selesai radiasi, campuran disentrifugasi untuk memisahkan filtrat dari endapannya. Filtratnya diukur absorbansinya pada panjang gelombang maksimum dari fenol dengan spektrofotometer UV-Vis. Selanjutnya masing-masing perlakuan dihitung untuk ditentukan nilai persentase degradasinya. Prosedur kerja yang sama dilakukan untuk variasi jumlah katalis ZnO 40, 50, 60, dan 70 mg (Benhebal et al., 2013).
Optimasi Waktu Reaksi
Sebuah gelas beker 250 mL diisi dengan 100 mL fenol 50 ppm, ZnO optimum dan diatur pHnya pada pH optimum. Campuran diradiasi dengan lampu sinar UV selama 5 jam sambil
diaduk dengan pengaduk magnetik. Selesai radiasi, campuran disentrifugasi untuk memisahkan filtrat dari endapannya. Filtratnya diukur absorbansinya pada panjang gelombang maksimum dari fenol dengan spektrofotometer UV-Vis. Selanjutnya masing-masing perlakuan dihitung untuk ditentukan nilai persentase degradasinya. Prosedur kerja yang sama dilakukan untuk variasi waktu 1, 2, 3, 4, 5, dan 6 jam (Benhebal et al., 2013).
Efektifitas Fotodegradasi
Tiga buah gelas beker 250 mL masing-masing diisi dengan 100 mL larutan fenol 50 ppm. Ke dalam masing-masing gelas dimasukkan 40 mg ZnO dan pHnya diatur pada pH 8. Campuran larutan selanjutnya diradiasi dengan sinar UV selama 8 jam sambil diaduk dengan pengaduk magnetik. Selesai radiasi, campuran disentrifugasi untuk memisahkan filtrat dari endapannya. Filtrat yang diperoleh dari masing-masing gelas beker kemudian diukur absorbansinya pada panjang gelombang maksimum dari fenol dengan spektrofotometer UV-Vis. Selanjutnya masing-masing perlakuan dihitung untuk ditentukan nilai persentase degradasinya.
HASIL DAN PEMBAHASAN
Karakterisasi Fotokatalis
Difraksi Sinar-X (XRD)
Sintesis ZnO pada penelitian ini menggunakan metode pengendapan kimia basah menggunakan seng asetat dihidrat sebagai prekursor. Reaksi kimia yang terjadi pada sintesis ZnO (Hsieh, 2007) yaitu:
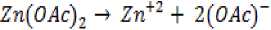
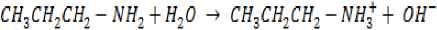
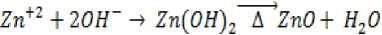
Hasil karakterisasi XRD pada Gambar 1 terlihat adanya puncak-puncak yang muncul pada 2Ɵ 31,78; 34,44; 36,27; 47,55; 56,60; 62,87 dan 67,96 menyatakan ZnO yang dihasilkan memiliki struktur wurtzite heksagonal. Puncak-puncak lain yang muncul adalah pengotor yang berasal dari reagen yang tersisa.
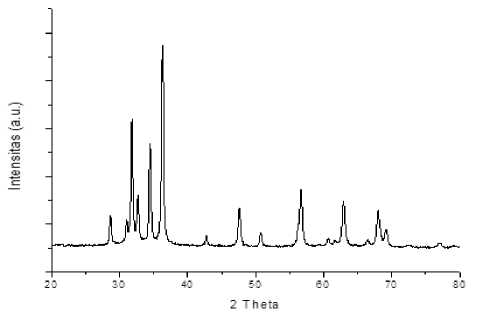
Gambar 1. Difraktogram XRD ZnO hasil sintesis.
Ukuran kristal dapat dihitung dari pola XRD dengan menggunakan rumus Scherrer dari puncak tertinggi dari 2Ɵ yaitu 36,27o. Berdasarkan perhitungan tersebut dapat diperoleh ukuran partikel ZnO sintesis sebesar 28,05 nm.
Scanning Elektron Microscopy
Analisis Scanning Elektron Microscopy (SEM) dilakukan untuk mengetahui struktur morfologi (Muchi, 2012). Dari hasil SEM fotokatalis ZnO hasil sintesis diperoleh hasil sintesis dengan perbesaran 20.000 kali dan 5.000 kali seperti Gambar 2.

Gambar 2. Hasil foto permukaan ZnO hasil sintesis menggunakan Scanning
Electron Microscopy perbesaran 5.000 kali dan 20.000 kali.
Hasil SEM fotokatalis ZnO hasil sintesis memperlihatkan bentuk kristal yang cukup homogen dan teramati dengan bentuk membulat. Ukuran kristal ZnO hasil sintesis yang didapatkan tidak seragam, tetapi bervariasi.
pH Larutan Optimum
Pengaruh pH larutan fenol terhadap persentase degradasi ditunjukkan pada Gambar 3. Hasil penelitian menunjukkan fenol lebih terdegradasi dalam suasana basa. Persentase degradasi (%D) tertinggi berada pada pH 8 adalah sebesar 40,65% menyebabkan fenol semakin cepat terdegradasi.
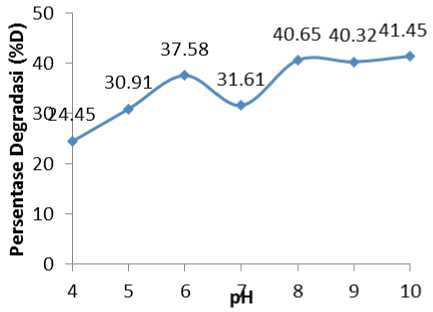
Gambar 3. Pengaruh pH terhadap persentase degradasi (%D) dari larutan fenol 50 ppm.
Permukaan fotokatalis ZnO akan bermuatan negatif pada pH basa dan bermuatan positif pada pH asam (Ali dan Siew, 2006). Oleh karena itu, persentase degradasi terbesar diperoleh pada pH basa, karena fenol yang bermuatan positif akan lebih mudah teradsorpsi pada permukaan ZnO yang bermuatan negatif.
Jumlah fotokatalis ZnO optimum
Jumlah fotokatalis ZnO optimum dalam proses degradasi fotokatalitik fenol ditunjukkan dalam Gambar 4.
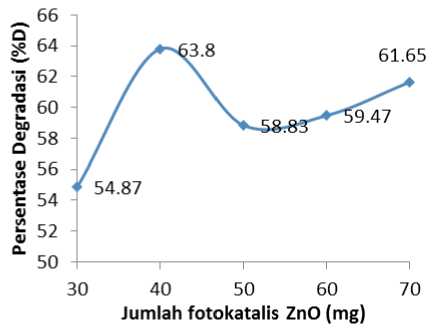
Gambar 4. Pengaruh jumlah fotokatalis ZnO
terhadap persentase degradasi (%D) dari larutan fenol 50 ppm.
Kurva di atas memperlihatkan bahwa persentase degradasi (%D) tertinggi ditunjukkan pada jumlah fotokatalis ZnO 40 mg dengan %D 63,80%. Pada penambahan fotokatalis ZnO lebih dari 40 mg, larutan mengalami titik jenuh dengan persentase degradasi tidak lagi bertambah dan sebaliknya mengalami penurunan ketika fotokatalis yang ditambahkan terlalu banyak sehingga terjadi kekeruhan pada larutan. Kekeruhan pada larutan dapat menghalangi sinar UV yang masuk yang mengakibatkan pembentukan elektron yang dihasilkan dari fotokatalis tidak maksimal, sehingga efektifitas degradasi menurun. Hal ini memperlihatkan bahwa massa ZnO 40 mg dapat meningkatkan jumlah permukaan fotokatalis yang menyediakan radikal hidroksi (•OH).reaksi fotodegradasi fenol akan efektif dan persentase degradasi (%D) fenol yang terdegradasi akan meningkatkan seiring dengan semakin meningkatnya jumlah permukaan fotokatalis yang menyediakan radikal hidroksida (•OH).
Waktu Reaksi Optimum
Waktu reaksi optimum degradasi fotokatalitik fenol dibuat kurva dengan menghubungkan waktu reaksi larutan fenol dengan persentase degradasi (%D). Kurva tersebut ditunjukkan pada Gambar 5.
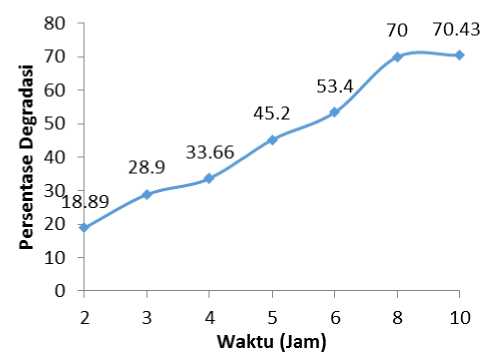
Gambar 5. Pengaruh waktu terhadap persentase degradasi (%D) dari larutan fenol 50 ppm.
Kurva di atas menunjukkan bahwa persentase degradasi fenol akan semakin meningkat seiring dengan semakin lamanya waktu degradasi. Semakin meningkatnya jumlah permukaan fotokatalis yang menyediakan •OH maka reaksi fotodegradasi fenol akan semakin efektif dan persentase degradasi (%D) fenol akan semakin meningkat.
Kurva menunjukkan bahwa semakin lama penyinaran, persentase degradasi (%D) semakin meningkat. Untuk penyinaran yang lebih tinggi dari 8 jam, persentase degradasi (%D) relatif tetap. Hal ini menunjukkan bahwa pada penyinaran 2-8 jam, interaksi antara cahaya, fenol dan ZnO semakin besar dan •OH yang terbentuk semakin banyak. Akan tetapi pada waktu reaksi yang semakin lama, produk hasil fotodegradasi yang telah terbentuk semakin banyak. Hal ini dapat menghalangi interaksi antara cahaya dengan reaktan dan fotokatalis, maupun fotokatalis dengan reaktan, sehingga degradasi fotokatalitik fenol lebih lambat atau kurang efektif (Mukaromah, 2005).
Efektifitas Fotodegradasi
Efektifitas fotodegradasi dari ZnO terhadap fenol 50 ppm memberikan persentase degradasi sebesar (63,53±3,49)%. Sementara penelitian yang dilakukan oleh Slamet dkk (2007) yang menggunakan fotokatalis TiO2 untuk mendegradasi fenol 40 ppm memberikan persentase degradasi sebesar 81,94%. Jika dibandingkan dengan penelitian Slamet dkk.
(2007) ini, ZnO hasil sintesis yang dihasilkan dalam penelitian ini cukup efektif dalam mendegradasi fenol dengan konsentrasi yang lebih tinggi yaitu 50 ppm.
Konsentrasi Laju Fotodegradasi Fenol
Pada penentuan konstanta laju fotodegradasi fenol dilakukan dengan perlakuan fotodegradasi fenol dengan konsentrasi 50 ppm pada waktu (t). Kurva tersebut ditunjukkan pada Gambar 6.
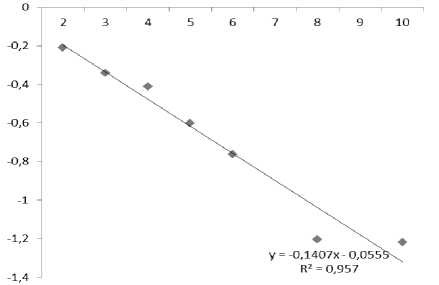
Gambar 6. Pengaruh ln Ct/Co terhadap waktu
Dari plot antara ln Ct/Co terhadap waktu (t) didapatkan nilai kemiringan sebesar 0,14 menit -1 yang merupakan besarnya nilai konstanta laju fotodegradasi fenol. Waktu paruh reaksi fotodegradasi dari fenol pada penelitian ini didapatkan sebesar 4,93 menit.
SIMPULAN DAN SARAN
Simpulan
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa ZnO hasil sintesis yang dikarakterisasi dengan XRD memiliki struktur heksagonal wurtzite dengan ukuran kristal 28,05 nm. Sementara hasil karakterisasi SEM, ZnO hasil sintesis mempunyai bentuk bulat. Kondisi optimum degradasi fotokatalitik fenol dengan fotokatalis ZnO yaitu pH optimum 8, jumlah fotokatalis ZnO optimum 40 mg dan waktu radiasi optimum 8 jam. Degradasi fotokatalitik fenol menggunakan fotokatalis ZnO dan sinar UV pada kondisi optimum, efektif dalam menurunkan kadar
limbah fenol dengan persentase degradasi sebesar (63,52 ± 3,48)%.
Saran
Dari hasil yang telah diperoleh perlu dilakukan analisis lebih lanjut untuk mengetahui produk akhir dari degradasi fotokatalitik fenol. Perlu dilakukan penelitian degradasi fotokatalitik dengan mengaplikasikan langsung pada limbah fenol dari industri.
UCAPAN TERIMA KASIH
Melalui jurnal ini penulis menyampaikan ucapan terima kasih kepada semua pihak yang telah membantu dalam penyelesaian penelitian ini.
DAFTAR PUSTAKA
Ali, R. and Siew, 2006, Photodegradation of New Methylen Blue N in Aqueous Solution Using Zinc Oxide and Titanium Dioxide as Catalyst, Jurnal Teknologi, 45 : 31–42
Arief, M., 2011, Sintesis dan Karakterisasi
Nanopartikel Seng Oksida (ZnO) dengan Metode Proses Pengendapan Kimia Basah dan Hidrotermal untuk Aplikasi Fotokatalisis, Skripsi, Universitas
Indonesia, Depok
Attia, A. J., Kadhim, S. H., and Hussein, F. H., 2008, Photocatalytic Degradation of Textile Dyeing Wastewater Using Titanium Dioxide and Zinc Oxide, E-J. Chem., 5 (2) : 219–223
Benhebal, H., Chaid, M., Salmon, T., Geens, J., Leonard, A., Lambert, S.D., Crine, M., dan Heinrichs, B., 2013, Photocatalytic
Degradation of Phenol and Benzoic Acid Using Zinc Oxide Powders Prepared by the Sol–Gel Process, Alexandria Engineering., 52: 517-523
Diantariani, N.P., Iryanti, E.S., Widihati, I.A.G., 2013, Minimalisasi Limbah Tekstil Metylene Blue dan Congo Red melalui Fotodegradasi Menggunakan Komposit ZnO-Arang Aktif, Laporan Hibah Bersaing, Universitas Udayana, Denpasar
Hsieh, C. 2007. Sperical Zinc Oxide Nano Particle from Zinc Acetate in Precipitation Method, Journal of the Chinese Chemical Society, 54, 31-34.
Kurniatun, P. A. P., Kadarwati, S., dan Priatmoko, S., 2012, Sintesis Nano ZnO yang
Diembankan pada Abu Vulkanik untuk Katalis Fotodegradasi Dikloro Difenil Trikloroetana, Indo.J.Chem., 1(1): 55-60.
Mukaromah, A. H., 2005, Efektifitas
Fotodegradasi p-Klorofenol dengan Katalis TiO2. Journal Litbang Universitas Muhammadiyah Semarang, ISSN 1829880x Vol. 2 (2)
Mukaromah, A. H., dan Irawan, R. B., 2008, Pemanfaatan Reaktor Membran
Fotokatalitik dalam Mendegradasi Fenol dengan Katalisis TiO2 dengan Adanya Ion Logam Fe (III) dan Cu (II), Journal Litbang Universitas Muhammadiyah Semarang,
Sakthivel, S., Neppolian, B., Shankar, M.V., Arabindoo, B., Palanichamy, M., Murugesan, V. 2003. Solar Photocatalityc Degradation of Dye: Comparison of Photocatalityc Efficiency of ZnO and TiO2. Solar energy materials and solar cells, 77(1), 65-82.
Slamet., Kustiningsih, I., Jayanudin., Usmanizar, D., Yuliati, E., 2007., Degradasi Senyawa Fenol Dengan Metode Fotokatalisis Menggunakan Reaktor Annular UV-C, Universitas Indonesia.
Standar Nasional Indonesia., 2004., Air dan Air Limbah – Bagian 21: Cara Uji Kadar Fenol secara Spektrofotometri, Badan Standarisasi Nasional, SNI 06-6989.212004
269
Discussion and feedback