ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF ANTIJAMUR DARI DAUN MIMBA (Azadiractha indica A. Juss.) SEBAGAI PENGENDALI JAMUR Fusarium sp. PADA TANAMAN BUAH NAGA (Hylocereus sp.)
on
ISSN 1907-9850
ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF ANTIJAMUR DARI
DAUN MIMBA (Azadiractha indica A. Juss.) SEBAGAI PENGENDALI JAMUR Fusarium sp.
PADA TANAMAN BUAH NAGA (Hylocereus sp.)
Sri Wahjuni, Ni Made Puspawati, dan Ni Putu Rusma Eva Arista*
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : rusmaeva@yahoo.co.id
ABSTRAK
Pada penelitian ini dilakukan isolasi, identifikasi dan uji aktivitas antijamur dari ekstrak daun mimba (AzadirachtaIndica) terhadap jamur Fusarium sp. Tujuan penelitian ini adalah untuk mengetahui konsentrasi minimum ekstrak mimba yang dapat menghambat pertumbuhan jamur Fusarium sp. dan mengidentifikasi golongan senyawa aktifnya. Serbuk daun mimba sebanyak 1000 gram diekstraksi menggunakan etanol 70%. Kemudian ekstrak pekat etanol dipartisi dengan menggunakan n-heksana, kloroform dan etil asetat. Hasil skrining awal uji aktivitas antijamur yang dilakukan pengamatan selama tiga hari menunjukkan ekstrak kloroform memiliki aktivitas antijamur dengan daya hambat sebesar 1 mm. Ekstrak kloroform selanjutnya diuji aktivitas antijamur dengan varian konsentrasi. Pada konsentrasi 10 ppm dan 30 ppm tidak menunjukkan adanya daya hambat, sedangkan pada konsentrasi 50; 70; dan 100 ppm menunjukkan daya hambat berturut-turut yaitu 9,5; 9,75; dan 18,3 mm yang termasuk kategori sedang sampai kuat. Ekstrak kloroform selanjutnya dipisahkan dengan kromatografi kolom menggunakan silika gel sebagai fase diam dan n-heksana : etil asetat : kloroform (1:1:1) sebagai fase gerak dan diperoleh 3 fraksi. Hasil uji kemurnian menunjukkan fraksi 3 dikatakan relatif murni secara KLT. Selanjutnya fraksi 3 diuji fitokimia dan diidentifikasi menggunakan spektrofotometer UV-Vis dan Inframerah. Hasil uji fitokimia menunjukkan fraksi 3 merupakan senyawa terpenoid. Hasil analisis UV-Vis fraksi 3 memberikan serapan maksimum pada panjang gelombang 410,80 nm, 325,60 nm, dan 269,40 nm yang diduga adanya transisi elektron dari n-π* , n-σ*, dan π-π*. Berdasarkan hasil spektra inframerah dan fitokimia fraksi 3 menunjukkan puncak yang sesuai dengan gugus fungsi karakteristik terpenoid yaitu O-H, C-H alifatik, C=O karbonil, dan C=C alifatik.
Kata kunci : AzadirachtaIndica, Fusarium sp., terpenoid
ABSTRACT
In this experiment extract of the mimba leaves has been isolated, identified, and analysed for its antifungal activity against Fusarium sp. The purpose of this reserch was to determine minimum concentration of mimba leaves extact to inhibit Fusarium sp. and to identify its active compounds. The leaves powder (1000g) has been extracted by ethanol 70%. The crude ethanol extract was fractionated into n-hexane, chloroform, and ethyl acetate fraction respectively. The preliminary result showed chloroform extract exhibited antifungal activity with diameter inhibition zone of 1 mm. The extract of chloroform was further tested for its antifungal activity at several concentration. The chloroform extract at 10 ppm and 30 ppm did not show antifungal activity toward Fusarium sp., while the concetrations of 50 ppm, 70 ppm, and 100 ppm showed inhibition zone with low activity, 9.5 mm, 9.75 mm, and 18.3 mm respetively. The extract of chloroform was separated by chromatography column using silica gel column chromatography was n-hexane : chloroform : ethyl acetate (1:1:1) as mobile phase and three fractions were obtained (F3). The third fraction indicated to be relatively pure on TLC. The identification of the third fraction showed absorption at 410,80 nm, 325,60 nm, and 269,40 nm. These might represent the transitions of n-π* , n-σ*, and π-π*. The infrared spectra revealed peaks that correspond to characteristic fuctional groups of terpenoid including O-H, CH aliphatic, C=O charbonyl, dan C=C aliphatic.
Keywords : AzadirachtaIndica, Fusarium sp., terpenoid
PENDAHULUAN
Jamur Fusarium sp. merupakan salah satu hama penyakit yang dapat menyebabkan penyakit
layu batang. Salah satu tanaman yang sering terserang jamur Fusarium sp. adalah tanaman buah naga, (Deptan, 2007). Tanaman buah naga yang terserang penyakit jamur Fusarium sp. akan
memucat tulang daunnya sampai berubah menjadi kecoklatan. Serangan jamur ini akan menyebakan penyakit busuk pangkal pada tanaman buah naga (Semangun, 1996).
Upaya pengendalian terhadap hama penyakit pada tumbuhan buah naga sampai saat ini masih menggunakan fungisida kimia sintetik (Kardinan, 2002). Penggunaan fungisida sintetik digunakan dalam pengendalian hama dan penyakit pada tanaman karena zatnya lebih cepat bereaksi dan memiliki daya racun yang tinggi terhadap hama pengganggu. Namun, penggunaaan fungisida sintetik yang berlebihan dapat menimbulkan dampak negatif yang dapat membahayakan kesehatan manusia, matinya beberapa mikroorganisme yang dapat membantu dalam penyuburan tanah, dan rusaknya lingkungan karena efek residu yang ditimbulkan. Fungisida yang digunakan pada hama target akan menimbulkan efek residu dan terurai di udara, air permukaan dan tanah (Kardinan, 2002 ).Untuk mengurangi efek penggunaan fungisida sintentik perlu di upayakan alternatif sebagai pengendalian jamur Fusarium sp. dengan menggunakan fungisida nabati. Fungisida nabati merupakan fungisida yang bahan aktifnya berasal dari tumbuhan seperti daun, batang, akar, dan buah (Oka, 1994).
Salah satu tanaman yang diketahui dapat digunakan sebagai pengendalian jamur Fusarium sp. yaitu tanaman mimba (Azadirachta indica A. Juss.). Daun mimba mengandung senyawa flavonoid dan tannin yang dapat digunakan sebagai antijamur (Kardinan dan Ruhayat, 2003). Senyawa antijamur banyak ditemukan pada berbagai jenis tumbuhan seperti dari famili Meliaceae, Solanaceae, Piperaceae, Legumineceae, Burseraceae, Astaceae, dan Annonaceae. Tumbuhan mimba merupakan jenis pohon yang tergolong dalam subfamily Meliaceae yang paling banyak diteliti karena bahan aktif yang terkandung didalamnya yang berpotensi sebagai pestisida alami (Rukmana et al., 2002). Berdasarkan penelitian yang dilakukan Sintowati, et al., (2009) minyak atsiri biji mimba mampu menghambat pertumbuhan jamur C. Albicans. Hasil penelitiannya menunjukkan bahwa pada konsentrasi minyak atsiri biji mimba 0% (kontrol) tidak ada hambatan terhadap pertumbuhan C. Albicans, pada konsentrasi 50%, mampu menghambat pertumbuhan C. Albicans dengan diameter hambat sebesar 10,33
mm (kuat), konsentrasi 60% sebesar 11,67 mm (kuat), konsentrasi 70% dan 80% sebesar 12,33 mm, konsentrasi 90% sebesar 13,33 mm (kuat) dan konsentrasi 100% sebesar 25 mm (sangat kuat).
Penelitian mengenai tanaman mimba sebagai antijamur telah banyak dilakukan, namun sejauh ini belum ada yang melakukan penelitian mengenai uji aktivitas antijamur terhadap jamur Fusarium pada tanaman buah naga. Dengan hasil uji pendahuluan fitokimia yang telah dilakukan menunjukkan daun mimba mengandung senyawa metabolit sekunder golongan flavonoid, tannin, saponin, terpenoid, dan alkaloid (Biu et al., 2009), maka perlu dilakukan penelitian mengenai potensi mimba sebagai antijamur dengan varian konsentrasi untuk mengetahui pada konsentrasi berapakah ekstrak mimba dapat menghambat aktivitas jamur Fusarium sp. dan mengetahui golongan senyawa aktif mimba yang dapat menghambat aktivitas jamur Fusarium sp.
MATERI DAN METODE
Bahan
Bahan kimia yang digunakan dalam penelitian ini adalah daun mimba, jamur Fusarium sp. yang terlebih dahulu sudah diisolasi dari batang buah naga oleh Wiwik Susanah Rita, etanol 70%, metanol (CH3OH) (p.a dan teknis), kloroform (CHCl3) (p.a dan teknis), etil asetat (C4H8O2) (p.a dan teknis), n-heksana (C6H14) (p.a dan teknis), akuades, asam klorida (HCl), natrium hidroksida (NaOH), serbuk magnesium (Mg), asam sulfat (H2SO4), pereaksi Liberman-Burchard, nistatin, kentang, bubuk agar dan dextro.
Peralatan
Gunting, neraca analitik, blender, cawan petri, oven, botol vial, erlenmeyer, gelas beker, batang pengaduk, pipet volume, pipet tetes, kertas saring, seperangkat alatkromatografi kolom dan kromatografi lapis tipis, penguap putar vakum (rotary vacum evaporator), spektrofotometer UV-Vis merk double beam dan FTIR.
Cara Kerja
Ekstraksi, Fitokimia, dan Uji aktivitas Antijamur
Daun mimba segar dicuci dengan air, dipotong kecil - kecil kemudian dikeringkan pada suhu kamar. Selanjutnya potongan yang sudah kering dihaluskan hingga menjadi serbuk. Serbuk kering daun mimba sebanyak 1000 gram di
maserasi dengan etanol 70% selama 24 jam dan perlakuan tersebut dilakukan sebanyak 3 kali, dimana setiap 24 jam pelarut etanol diganti. Ekstrak yang diperoleh kemudian diuapkan hingga diperoleh ekstrak kental etanol. Kemudian ekstrak kental etanol dilarutkan dengan etanol : air ( 7:3 ) dan etanolnya diuapkan. Ekstrak air yang didapat selanjutnya dipartisi dengan menggunakan pelarut n-heksana hingga diperoleh ekstrak air dan n-heksana. Ekstrak n-heksana yang didapat diuapkan dengan penguap putar vakum. Lapisan air diekstraksi kembali dengan kloroform hingga diperoleh ekstrak air dan kloroform. Ekstrak kloroform yang didapat kemudian diuapkan dengan penguap putar. Lapisan air diekstraksi kembali dengan etil asetat hingga diperoleh ekstrak air dan ekstrak etil asetat. Ekstrak etil asetat yang didapat diuapkan dengan penguap vakum. Ekstrak hasil ekstraksi selanjutnya dilakukan uji aktivitas antijamur terhadap Fusarium sp dan uji fitokimia. (Markham, 1989).
Uji Aktivitas Antijamur dengan Varian Konsentrasi
Uji aktivitas antijamur dilakukan dengan metode sumur difusi. Tujuh buah cawan petri disiapkan, dalam satu cawan petri diisi dua lubang sumur uji. Cawan petri yang telah berisi 10 mL media PDA dan 200 μL suspensi jamur didiamkan hingga memadat. Setelah padat, dibuat sumur difusi sebanyak 2 buah dengan diameter 5 mm pada setiap cawan petri menggunakan cork borer, sebanyak 20 μL ekstrak yang positif mengandung senyawa aktif antijamur dari daun mimba dengan konsentrasi 10, 30, 50, 70, dan 100 ppm, kontrol positif (nistatin), kontrol negatif (kloroform) masing-masing dimasukkan ke dalam setiap sumur difusi (Rita, 2010).
Pemisahan dan Pemurnian
Pemisahan dengan kromatografi lapis tipis (KLT) dilakukan untuk mencari eluen terbaik yang akan digunakan dalam kromatografi kolom. Pemilihan eluen dilakukan dengan menggunakan pelarut yang memiliki polaritas berbeda hingga diperoleh pelarut terbaik yang memiliki pemisahan terbaik dan pemisahan noda terbanyak. Pemisahan dengan kromatografi kolom menggunakan fase diam yaitu silika gel GF254 dan fase gerak n-
heksana : etil asetat : kloroform (1 : 1 : 1). Fraksi hasil pemisahan yang memiliki noda pemisahan sama digabungkan dan di KLT kemurnian (Markham, 1989).
Identifikasi Senyawa aktif
Fraksi yang relatif murni secara KLT selanjutnya dilakukan uji fitokimia menggunakan pendeteksi golongan senyawa dan diidentifikasi dengan spektrofotometer Inframerah (IR) dan Ultraviolet-visible (UV-Vis) (Sastrohamidjojo, 1987).
HASIL DAN PEMBAHASAN
Hasil maserasi 1000 gram daun mimba dengan etanol menghasilkan 83,76 gram ekstrak kental etanol yang berwarna hijau pekat. Partisi terhadap 83,76 gram ekstrak kental etanol dengan menggunakan pelarut n-heksana, kloroform, dan etil asetat menghasilkan ekstrak pekat n-heksana sebanyak 8,26 gram, ekstrak kloroform sebanyak 35,57 gram, dan etil asetat sebanyak 5,22 gram. Hasil partisi menunjukkan senyawa yang paling banyak terekstrak di kloroform yaitu senyawa yang bersifat semi polar seperti terpenoid, steroid, dan flovonoid bebas (Markham, 1989). Masing-masing ekstrak etanol, n-heksana, kloroform, dan etil asetat dilakukan skrining pengujian awal aktivitas antijamur terhadap jamur Fusarium sp. dengan pengamatan selama tiga hari untuk mengetahui ekstrak yang lebih aktif dalam menghambat pertumbuhan jamur dengan konsentrasi masing-masing sebanyak 50 ppm. Hasil pengujian didapatkan bahwa ekstrak etanol, n-heksana, dan etil asetat tidak menunjukkan adanya daya hambat. Sedangkan ekstrak kloroform dapat menghambat pertumbuhan jamur Fusarium sp. dengan daya hambat sebesar 1 mm.
Berdasarkan hasil pengujian fitokimia ekstrak kloroform positif mengandung senyawa terpenoid pada saat penambahan pereaksi Liberman-Burchard, dimana terjadi perubahan warna dari hijau pekat menjadi cokelat dan tidak mengandung senyawa tannin, alkaloid, saponin, dan flavonoid. Dari hasil skrining awal pengujian aktivitas antijamur, didapatkan ekstrak kloroform lebih aktif menghambat aktivitas jamur Fusarium sp. Selanjutnya, ekstrak kloroform dilakukan uji
akivitasnya dengan varian konsentrasi yaitu pada konsentrasi 10, 30, 50, 70, dan 100 ppm. Hasil uji aktivitas menunjukkan ekstrak kloroform pada konsentrasi 10 dan 30 ppm tidak dapat menghambat aktivitas jamur Fusarium sp. Namun, pada konsentrasi 50 ppm dengan daya zona hambat sebesar 9,5 mm dengan kategori sedang menurut kategori Davis dan Stout (1971). Pada konsentrasi 70 ppm dengan zona hambat sebesar 9,75 mm dengan kategori sedang, dan pada konsentrasi 100 ppm dengan zona hambat sebesar 18,3 mm dengan kategori kuat. Kontrol positif (nistatin) yang merupakan obat antijamur memiliki zona hambat dengan kategori sangat kuat yaitu 24,2 mm dalam menghambat aktivitas jamur Fusarium sp. Berdasarkan penelitian yang dilakukan Lutfiyanti et al., (2012) terpenoid merupakan senyawa bioaktif yang dapat digunakan sebagai senyawa antijamur. Sifat toksik dari terpenoid diketahui memiliki kemampuan menghambat pertumbuhan jamur dengan cara merusak membran sel sehingga pertumbuhan jamur menjadi terhambat Hasil uji aktivitas ekstrak kloroform dengan varian konsentrasi dapat dilihat pada Tabel 1.
Pemisahan ekstrak kloroform dilakukan menggunakan kromatografi kolom dengan silika gel 60 mesh dan eluen yang digunakan yaitu n-heksana : etil asetat : kloroform (1:1:1). Hasil pemisahan diperoleh 32 fraksi dengan pola pemisahan noda yang berbeda. Pemisahan dengan noda yang sama selanjutnya digabungkan sehingga didapatkan 3 fraksi. Hasil KLT penggabungan dapat dilihat pada Tabel 2.
Fraksi 3 selanjutnya dilakukan uji kemurnian dengan menggunakan berbagai pelarut dan dapat dilihat pada Tabel 2. Hasil uji kemurnian dapat dikatakan fraksi 3 relatif murni secara KLT pemurnian. Selanjutnya fraksi 3 diuji fitokimia untuk mengetahui golongan senyawa metabolit sekundernya dan diidentifikasi dengan spektrofoto-meter inframerah dan UV-Vis. Hasil uji fitokimia menunjukkan fraksi 3 positif mengandung senyawa terpenoid yang ditandai dengan terjadinya perubahan warna menjadi cokelat ketika direaksikan dengan pereaksi Liberman-Burchard (Markham, 1989).
Tabel 1. Hasil uji aktivitas antijamur ekstrak
kloroform
|
Konsentrasi |
Diameter Daya Hambat (mm) |
|
10 ppm |
0 |
|
Sampel 30 ppm |
0 |
|
50 ppm |
9,5 |
|
70 ppm |
9,75 |
|
100 ppm |
18,3 |
|
Kontrol Positif (Nistatin) |
24,2 |
|
Kontrol Negatif (Kloroform) |
0 |
|
Tabel 2. Hasil KLT penggabungan | |
|
Fraksi Berat Jumlah Nilai |
Warna |
|
noda Rf | |
|
1 (1-12) 0,16 3 0,45 |
Hijau pekat |
|
0,48 0,83 | |
|
2 (13-22) 0,22 2 0,45 |
Hijau kecoklatan |
|
0,76 | |
|
3 (23-32) 0,24 1 0,71 |
Hijau kekuningan |
Hasil spektrum inframerah terhadap fraksi 3 dapat dilihat pada Gambar 1 dan hasil analisis spektra FTIR fraksi 3 dapat dilihat pada Tabel 3. Hasil pengukuran dengan spektrofometer inframerah terhadap fraksi 3 menunjukkan bahwa adanya gugus OH terikat, pada bilangan gelombang 3345,20 cm-1 dengan intensitas kuat pita melebar, dugaan ini didukung dengan adanya serapan lemah pada daerah bilangan gelombang 1242,16 cm-1 yang diduga merupakann C-O alkohol. Serapan pada bilangan gelombang 2926,01 cm-1 dan 2854,65 cm-1 dengan intensitas kuat diduga merupakan serapan dari C-H alifatik yaitu uluran C-H dari gugus CH3 dan CH2, dugaan ini didukung dengan adanya serapan -CH alifatik dengan intensitas sedang pada bilangan gelombang 1461,18 cm-1 dan 1375,25 cm-1 yang merupakan tekukan dari -CH2 dan -CH3 (Sastrohamidjojo, 1987).
|
Tabel 3. Hasil pemisahan dan nilai Rf | ||
|
Eluen |
Jumlah noda |
Nilai Rf |
|
Etil asetat |
2 |
0,58 |
|
0,90 | ||
|
Kloroform : alkohol |
3 |
0,26 |
|
( 9:1 ) |
0,46 | |
|
0,83 | ||
|
n-heksana : etil asetat |
3 |
0,21 |
|
( 1:2) |
0,50 | |
|
0,65 | ||
|
n-heksana : etil asetat : kloroform |
5 |
0,33 |
|
(1:1:1) |
0,70 | |
|
0,75 | ||
|
0,83 | ||
|
0,91 | ||
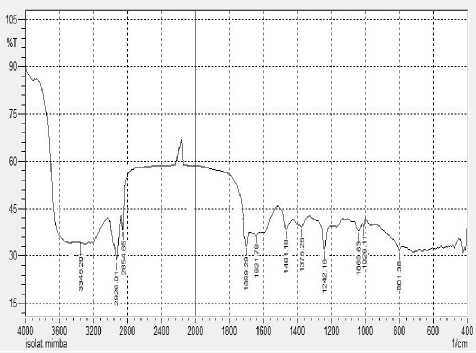
Gambar 1. Spektrum inframerah fraksi 3
Serapan pada bilangan gelombang 1699,29 cm-1 merupakan serapan dari C=C alifatik dengan intensitas sedang yang biasa muncul pada daerah panjang gelombang 1800-1620 cm-1. Serapan pada daerah panjang gelombang 1069,63 cm-1 merupakan uluran dari gugus C-O dengan intensitas tajam dan lemah yang biasa muncul pada panjang gelombang 1300-1000 cm-1. Serapan pada bilang gelombang dibawah 900 cm-1 menunjukkan adanya serapan –CH keluar bidang dari senyawa aromatik ( Fessenden dan Fessenden, 1997)
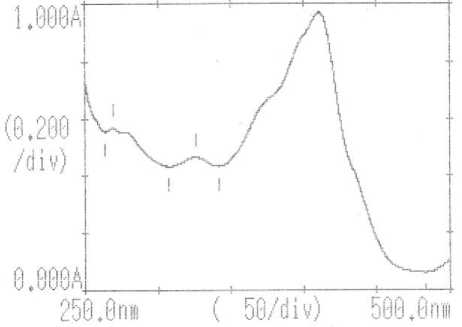
Gambar 2. Spektrum spektrofotometer Uv-Vis fraksi 3
Tabel 4. Hasil analisis spektra FTIR fraksi 3
|
Bilangan Gelombang (cm-1) |
Bentuk Pita |
Intensitas |
Kemungkinan Gugus Fungsi | |
|
Fraksi 3 |
Pustaka | |||
|
3345,20 |
3500-3200 |
Melebar |
Kuat |
O-H terikat (streching) |
|
2926,01 |
3000-2850 |
Tajam |
Kuat |
-CH Alifatik (-CH3 streching) |
|
2854,65 |
3000-2850 |
Tajam |
Lemah |
-CH Alifatik (-CH2 streching) |
|
1699,29 |
1820-1640 |
Tajam |
Sedang |
-C=O Karbonil (streching) |
|
1631,78 |
1650-1500 |
Tajam |
Sedang |
-C=C Alifatik (streching) |
|
1461,18 |
1500-1400 |
Tajam |
Sedang |
-CH Alifatik (CH2 bending) |
|
1375,26 |
1300-1000 |
Tajam |
Sedang |
-CH Alifatik (CH3 bending) |
|
1242,16 |
1300-1000 |
Tajam |
Lemah |
-C-O alkohol (bending) |
|
1069,63 |
1300-1000 |
Tajam |
Lemah |
Uluran C-O |
|
801,38 |
880-758 |
Tajam |
Lemah |
=CH siklik (bending) |
Sumber : Sastrohamidjojo, 1987
|
Tabel 5. Hasil pengukuran spektrofotometer UV-Vis | ||
|
No. |
Panjang Gelombang (nm) |
Absorbansi |
|
1. |
410,80 |
0,9697 |
|
2. |
325,60 |
0,4652 |
|
3. |
269,40 |
0,5670 |
Identifikasi dengan spektrofotometer UV-Vis memberikan tiga pita serapan maksimum pada panjang gelombang 410,80 nm, 325,60 nm, dan 269,40 nm. Serapan pada panjang gelombang 410,80 nm diduga karena adanya transisi n-π* dari kromofor C=O. Serapan pada panjang gelombang 325,60 nm diduga adanya transisi n-σ* dari auksokrom OH non bonding, Serapan pada panjang gelombang 269,40 nm diduga adanya transisi π-π* dari kromofor C=C alifatik. Berdasarkan hasil spektra inframerah dan spektrofotometer UV-Vis diduga isolat mimba merupakan senyawa terpenoid dengan gugus fungsi O-H, C-H alifatik, C=O karbonil, dan C=C alifatik (Silverstein, 1986).
SIMPULAN DAN SARAN
Simpulan
-
1. Ekstrak kloroform mimba mampu menghambat aktivitas jamur fusaium sp. pada konsentrasi 50 ppm, 70 ppm dan 100 ppm dengan kategori lemah sampai kuat.
-
2. Hasil uji fitokimia, identifikasi dengan spektrofotometer UV-Vis dan
spektrofotometer Inframerah diduga bahwa senyawa aktif yang terkandung dalam ekstrak kloroform daun mimba yaitu senyawa metabolit sekunder golongan terpenoid
Saran
Perlu dilakukan penelitian lebih lanjut mengenai uji aktivitas antijamur dengan menggunakan varian waktu untuk mendapatkan waktu optimal terhadap aktivitas jamur Fusarium sp. dan perlu dilakukan penelitian serta identifikasi lebih lanjut menggunakan teknik spektroskopi lainnya seperti NMR untuk memastikan struktur senyawa lain yang terdapat pada daun mimba yang dapat digunakan sebagai fungisida nabati.
UCAPAN TERIMA KASIH
Penulis sampaikan ucapan terima kasih kepada Putu Suarya, A.A.I.A. Mayun Laksmiwati, dan I Wayan Gede Gunawan. Penulis juga menyampaikan ucapan terima kasih kepada tim Laboratorium Penelitian Jurusan Kimia FMIPA Universitas Udayana, Laboratorium Bersama FMIPA Universitas Udayana dan Laboratorium Mikrobiologi FMIPA Universitas Udayana yang telah memberikan bantuan dan dukungan fasilitas hingga penelitian ini selesai.
DAFTAR PUSTAKA
Biu, A.A., Yusuf, S.D., and Rabo. J,S., 2009, Phytochemical screening of azadiractha indica (Neem) (Meliceae) in Maiduguri, Nigeria, Biosince Research Communication, 2: 49-57
Davis & Stout, 1971, Disc Plate Method Of Microbial Antibiotic Essay, Journal Of Microbiology, 22 (4) : 102-110
Deptan, 2007, Prospek dan Arah Pengembangan Agribisnis Bawang Merah, Departemen Pertanian, Bogor
Fessenden , J. dan Fessenden, S., 1997, Dasar-dasar Kimia Organik, Bina Aksara,
Jakarta
Kardinan A., 2002, Pestisida Nabati: Ramuan dan Aplikasi (cetakan ke 4), Penebar Swadaya, Jakarta
Kardinan A. dan Ruhayat A., 2003, Mimba
Budidaya dan Pemanfaatan, Penebar Swadaya, Jakarta
Lutfiyanti, R., Widodo Farid., dan Eko Nurcahya
Dewi., 2012, Aktivitas Antijamur Senyawa Bioaktif Ekstrak Geledium latifolium Terhadap Candida albicans, Jurnal Pengelolaan dan Bioteknologi, 1: 45-47
Markham, R.K., 1989, Cara Mengidentifikasi Senyawa Metabolit Sekunder, ITB,
Bandung
Oka, N.I., 1994, Pengendalian Hama Terpadu dan Implementasinya di Indonesia, UGM Press, Yogyakarta
Sintowati, R., Ambarwati, dan Kusumawati, Y., 2008, Efektivitas Zat Antifungi Biji Mimba (Azadiractha indica) Terhadap
Candida Albicans, Jurnal Kesehatan, 4: 56-57
Semangun, H., 1996, Pengantar Penyakit
Tumbuhan, UGM Press, Yogyakarta
Silverstein, R.M., 1986, Penyidik Spektrometik
Senyawa Organik, Edisi Keempat, a.b. A.J. Hartomo dan Anni Victor Purba, Erlangga, Jakarta
Sastrohamidjojo, H., 1987, Spektroskopi
Inframerah, Liberty, Jogjakarta
Rita, W.S., 2014, Identifikasi Senyawa Aktif
Ekstrak Daun Trembesi (Albizia saman (Jacq.) Merr) Sebagai Penghambat Pertumbuhan Fusarium Solani, Penyebab Penyakit Busuk Batang Pada Tanaman Buah Naga (Hylocereus Sp.), Disertasi, Universitas Udayana, Denpasar
203
Discussion and feedback