TOKSISITAS SENYAWA FLAVONOID DARI EKSTRAK ETANOL DAUN DEWANDARU (Eugenia uniflora Linn.) SEBAGAI SKRINING AWAL ANTIKANKER
on
ISSN 1907-9850
TOKSISITAS SENYAWA FLAVONOID DARI EKSTRAK ETANOL DAUN DEWANDARU (Eugenia uniflora Linn.) SEBAGAI SKRINING AWAL ANTIKANKER
I Made Dira Swantara*, Wiwik Susanah Rita, dan I Made Adi Suardhyana
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : m_dira_swantara@yahoo.co.id
ABSTRAK
Flavonoid merupakan senyawa yang dipercaya berpotensi sebagai antikanker. Salah satu tanaman yang mengandung flavonoid adalah tanaman Dewandaru (Eugenia uniflora Linn.). Penelitian ini bertujuan untuk melakukan identifikasi dan uji toksisitas senyawa flavonoid dari ekstrak etanol daun Dewandaru (Eugenia uniflora Linn.) yang berpotensi sebagai antikanker. Ekstraksi dilakukan dengan metode maserasi dan partisi menggunakan n-heksana, kloroform, dan etil asetat. Pemisahan fraksi kloroform dilakukan dengan kromatografi kolom silika gel menggunakan campuran pelarut kloroform : etil asetat (5:1) sebagai fase gerak. Uji toksisitas dilakukan dengan metode Brine Shrimp Lethality Test (BSLT), dan identifikasi dilakukan dengan spektrofotometer IR serta UV-Vis. Ekstraksi 1000 g serbuk daun Dewandaru dengan 10 L etanol 70% menghasilkan 273 g ekstrak pekat etanol dan proses partisi berturut – turut menghasilkan 30,14 g ekstrak pekat air, 5,58 g ekstrak pekat n-heksana, 20,57 g ekstrak pekat kloroform, dan 22,45 g ekstrak pekat etil asetat. Uji fitokimia menunjukkan bahwa keempat ekstrak positif mengandung flavonoid, namun ekstrak kloroform memiliki efek toksik yang paling tinggi. Pemisahan dengan kromatografi kolom menghasilkan 3 kelompok fraksi (Fa, Fb, dan Fc). Fraksi Fc positif flavonoid dan relatif murni serta paling toksik terhadap larva udang Artemia salina Leach dengan LC50 sebesar 63,10 ppm, isolat selanjutnya diidentifikasi dengan spektrofotometer IR serta UV-Vis. Hasil identifikasi menunjukkan isolat (Fc) merupakan senyawa golongan flavonoid jenis dihidroflavonol yang mempunyai gugus fungsi OH terikat, CH alifatik, C = O, C = C aromatik, C – O dan CH aromatik, serta terdapat gugus hidroksi pada atom C-3, C-5, dan C-7, serta mempunyai gugus orto dihidroksi pada cincin B dan memberikan serapan pada panjang gelombang (λmax) 281,0 dan 315,0 nm.
Kata kunci : Dewandaru (Eugenia uniflora Linn.), flavonoid, Brine Shrimp Lethality Test (BSLT), LC50
ABSTRACT
Flavonoid is believed to have a potency as anticancer. One of plants containing flavonoids is Dewandaru (Eugenia uniflora Linn.). This study aims to identify and test the toxicity of flavonoid from ethanol extract of Dewandaru leaf (Eugenia uniflora Linn.) which has the potential as an anticancer. Extraction was done by maceration method and partition using n-hexane, chloroform, and ethyl acetate respectively. Separation of chloroform extract was carried out by silica gel column chromatography with chloroform : ethyl acetate (5:1) as the eluent. The toxicity test with Brine Shrimp Lethality Test (BSLT) method and was identified with IR and UV-Vis spectrophotometers. Extraction of 1000 g Dewandaru leaf powder with 10 L ethanol produced 273 g of ethanol concentrated extract and partition process produced 30,14 g of concentrated water extract, 5,58 g of concentrated n-hexane extract, 20,57 g of concentrated of chloroform extract, and 22,45 g of concentrated ethyl acetate extract respectively. Phytochemical test showed that all extracts contained flavonoid, but the chloroform extract had the highest toxic effect. Separation with column chromatography produced 3 fractions namely Fa, Fb, and Fc. The fraction Fc contained flavonoid and was relatively pure. The isolate Fc was the most toxic to the shrimp larvae of Artemia salina Leach with LC50 of 63.10 ppm. Identification of isolates (Fc) showed that the flavonoid was dihidroflavonol which has functional groups of OH bonded, CH aliphatic, C = O, C = C aromatic, C - O and CH aromatic, and a hydroxy group at atom C-3, C -5, and C-7, which has the ortho dihydroxy group in B ring and gives absorption at a wavelength (λmax) of 281.0 and 315.0 nm.
Keywords : Dewandaru (Eugenia uniflora Linn.), Flavonoids, Brine Shrimp Lethality Test (BSLT), LC50
PENDAHULUAN
Penyakit yang menempati peringkat tertinggi sebagai penyebab kematian di dunia adalah penyakit kanker (Anderson et al., 2001; Indrayani et al., 2006). Tingginya pertumbuhan penyakit kanker disebabkan karena pola hidup yang tidak seimbang (Ikawati et al., 2000). Berbagai usaha telah dilakukan untuk menanggulangi berbagai penyakit kanker seperti pembedahan, radioterapi, dan kemoterapi sitostatik. Pengobatan ini dilakukan untuk membunuh sel-sel kanker, namun tidak sedikit usaha tersebut justru menimbulkan efek samping (Sukardiman et al., 2004; Jiang et al., 2004; Moeljopawiro et al., 2007). Kenyataan ini menuntut perlunya alternatif yang aman untuk pengobatan penyakit kanker dengan menggunakan bahan alami.
Obat penyakit kanker yang berasal dari alam umumnya terkandung pada tumbuhan. Salah satu tanaman asli Indonesia yang berkhasiat sebagai obat adalah Dewandaru (Eugenia uniflora Linn.). Berdasarkan skrining fitokimia, daun tanaman Eugenia uniflora L. mengandung flavonoid, saponin, dan tanin (Hutapea, 1994). Berbagai penelitian yang telah dilakukan menunjukkan bahwa Dewandaru memiliki aktivitas antibakteri, antioksidan, penangkal radikal bebas, penghambat hidrolisis dan oksidasi enzim, dan antiinflamasi yang disebabkan karena adanya senyawa flavonoid (Reynertson dan Kennelly, 2001; Utami et al., 2005). Penelitian Maryati (2006) membuktikan bahwa flavonoid yang diisolasi dari fraksi etil asetat ekstrak etanol daun sambung nyawa (Gynura procumbens (Lour.) Merr) memiliki aktivitas sitotoksik dengan IC50 sebesar 98 μg/mL terhadap sel kanker payudara T47D.
Metode yang sering digunakan untuk mengetahui potensi efek sitotoksik suatu senyawa adalah Brine Shrimp Lethality Test (BSLT). Metode BSLT tidak spesifik untuk pengujian antikanker dan sebagian aksi fisiologis, namun metode ini dapat memonitor kemungkinan adanya efek sitotoksik dengan waktu dan biaya penelitian yang lebih sedikit dibandingkan dengan pengujian sitotoksisitas menggunakan biakan sel kanker. Senyawa yang bersifat toksik pada uji BSLT belum tentu bersifat sitotoksik, sehingga perlu
dilakukan uji tingkat lanjut dengan menggunakan sel kanker. Namun, suatu senyawa yang bersifat sitotoksik akan bersifat toksik bila diuji dengan metode BSLT (Meyer et al., 1982).
Penelitian tentang sifat toksik ekstrak daun Dewandaru telah banyak dilakukan, namun belum ada publikasi penelitian tentang uji toksisitas isolat yang mengandung flavonoid, sehingga perlu dilakukan uji toksisitas dan identifikasi senyawa flavonoid dari daun Dewandaru.
MATERI DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun Dewandaru, etanol teknis 70%, etanol p.a, n-heksana p.a, kloroform p.a, air laut, pereaksi geser (NaOH 2 M, AlCl3 5%, HCl pekat, NaOAc, H3BO3), silika gel GF254 untuk kromatografi lapis tipis dan silika gel 60 untuk kromatografi kolom, larva udang (Artemia salina Leach.), akuades dan pereaksi uji fitokimia senyawa flavonoid dengan pereaksi Wilstatter (HCl pekat + serbuk Mg).
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah pisau, gunting, blender, ayakan, neraca analitik, erlenmeyer, mortar, oven, kaca arloji, cawan penguap, penyaring buchner, gelas beker, batang pengaduk, labu ukur, pipet volume, pipet tetes, plat tetes, pipet mikro, kertas saring, aluminium foil, corong pisah, penjepit, bunsen spiritus, penguap putar vakum (rotary vacum evaporator), botol vial, botol untuk maserasi, seperangkat alat kromatografi lapis tipis (KLT), kromatografi kolom, lampu penerang, lampu UV, aquarium khusus BSLT, aerator, seperangkat alat spektrofotometer UV-Vis double beam Shimadzu/ UV-1800, dan spektrofotometer FTIR Shimadzu /IR Prestige-21.
Cara Kerja
Sebanyak 1000 g serbuk kering daun Dewandaru dimaserasi dengan 10 liter etanol teknis 70% selama ± 24 jam. Hasil maserasi diuapkan dengan penguap putar vakum sehingga diperoleh ekstrak kental etanol kemudian diuji kandungan flavonoid dan toksisitasnya. Ekstrak kental etanol dilarutkan kembali dengan campuran etanol-air (7:3) kemudian etanolnya diuapkan
dengan menggunakan penguap putar vakum sehingga diperoleh ekstrak air. Ekstrak air dipartisi dengan n-heksana menghasilkan ekstrak air dan ekstrak n-heksana, ekstrak air hasil partisi dengan n-heksana dipartisi kembali menggunakan kloroform menghasilkan ekstrak air dan ekstrak kloroform, kemudian ekstrak air hasil partisi dengan kloroform dipartisi kembali menggunakan etil asetat menghasilkan ekstrak air dan ekstrak etil asetat. Ekstrak n-heksana, kloroform, etil asetat, dan air yang diperoleh selanjutnya diuji flavonoid dan toksisitasnya. Ekstrak yang positif flavonoid dan paling toksik dilanjutkan pada tahap pemisahan dan pemurnian.
Proses pemisahan dilakukan dengan KLT dan kromatografi kolom. KLT dilakukan untuk pemilihan fase gerak terbaik yang akan digunakan pada kromatografi kolom. Ekstrak yang positif flavonoid dan paling toksik dipisahkan dengan kromatografi kolom dengan fase gerak kloroform : etil asetat (5:1). Eluat dari kromatografi kolom ditampung setiap 3 mL dalam satu botol vial dan setiap botol eluat dideteksi nodanya menggunakan kromatografi lapis tipis. Eluat yang memiliki pola noda yang sama digabungkan sehingga diperoleh beberapa fraksi. Setiap fraksi diuji flavonoid, kemurnian, dan toksisitasnya. Isolat yang murni secara KLT, positif mengandung flavonoid, dan paling toksik selanjutnya diidentifikasi menggunakan spektrofotometer UV-Vis dan spektrofotometer infrared (IR).
Ekstraksi
Ekstraksi 1000 g serbuk kering daun Dewandaru menghasilkan 273 g ekstrak pekat etanol. Partisi ekstrak etanol dihasilkan 30,14 g ekstrak pekat air, 5,58 g ekstrak pekat n-heksana, 20,57 g ekstrak pekat kloroform, dan 22,45 g ekstrak pekat etil asetat. Ekstrak tersebut selanjutnya dilakukan uji flavonoid. Hasil uji flavonoid dari ekstrak air, n-heksana, kloroform, dan etil asetat disajikan pada Tabel 1.
Pada Tabel 1 menunjukkan bahwa ekstrak air, n-heksana, kloroform, dan etil asetat positif mengandung flavonoid. Kemudian dilanjutkan dengan uji toksisitas menggunakan metode BSLT. Data hasil uji toksisitas disajikan pada Tabel 2.
Nilai LC50 merupakan nilai yang menunjukkan besarnya konsentrasi suatu bahan uji yang dapat menyebabkan 50% kematian jumlah hewan uji setelah perlakuan 24 jam (Mukhtar, 2007). Senyawa dianggap toksik bila mempunyai LC50 ≤ 1000 ppm (Anderson et al., 1991). Hasil uji toksisitas menunjukkan ekstrak kloroform bersifat paling toksik yang menyebabkan kematian larva Artemia salina Leach paling banyak dibandingkan dengan ekstrak air, n-heksana, dan etil asetat dengan nilai LC50 sebesar 50,12. Hal ini kemungkinan disebabkan karena konsentrasi flavonoid pada ekstrak kloroform lebih tinggi dibandingkan dengnan ekstrak air, n-heksana, dan etil asetat. Sehingga ekstrak kloroform dilanjutkan pada proses pemisahan.
HASIL DAN PEMBAHASAN
Tabel 1. Hasil uji flavonoid dari ekstrak air, n-heksana, kloroform, dan etil asetat
|
Fraksi Pekat |
Pereaksi |
Perubahan Warna |
Keterangan |
|
Air |
Mg-HCl HCl+dipanaskan NaOH 10% |
Kuning menjadi merah Kuning menjadi merah kecoklatan Kuning menjadi merah kecoklatan |
+ Flavonoid + Flavonoid + Flavonoid |
|
n-heksana |
Mg-HCl HCl+dipanaskan NaOH 10% |
- Hijau menjadi merah kecoklatan Hijau menjadi merah kecoklatan |
- Flavonoid + Flavonoid + Flavonoid |
|
Kloroform |
Mg-HCl HCl+dipanaskan NaOH 10% |
Coklat kekuningan menjadi merah kecoklatan pekat Coklat kekuningan menjadi coklat pekat Coklat kekuningan menjadi merah kecoklatan |
+ Flavonoid + Flavonoid + Flavonoid |
|
Etil asetat |
Mg-HCl HCl+dipanaskan NaOH 10% |
Merah kekuningan menjadi ungu pekat Merah kekuningan menjadi merah kecoklatan Merah kekuningan menjadi merah kecoklatan |
+ Flavonoid + Flavonoid + Flavonoid |
Tabel 2. Hasil uji toksisitas ekstrak pekat hasil partisi
|
Ekstrak |
Konsentrasi (ppm) |
% Mortalitas |
LC50 (ppm) |
|
1000 |
88,46 | ||
|
Ekstrak air |
100 |
53,70 |
79,43 |
|
10 |
10,23 | ||
|
1000 |
90,23 | ||
|
Ekstrak n-heksana |
100 |
50,71 |
79,43 |
|
10 |
13,79 | ||
|
1000 |
94,44 | ||
|
Ekstrak kloroform |
100 |
58,52 |
50,12 |
|
10 |
17,04 | ||
|
1000 |
87,99 | ||
|
Ekstrak etil asetat |
100 |
46,47 |
79,43 |
|
10 |
13,19 |
|
Tabel 3. |
Hasil uji flavonoid isolat kromatografi kolom | |||
|
Fraksi (F) |
Wilstatter |
Perubahan Warna Bate-Smith-Metchalf |
NaOH 10% |
Diduga Jenis Flavonoid (Geissmann, 1962) |
|
A |
- |
- |
- |
- |
|
B |
Kuning kemerahan menjadi hijau |
Kuning kemerahan menjadi merah tua |
Kuning kemerahan menjadi merah bata |
Flavanon atau dihidroflavonol |
|
C |
Kuning kemerahan menjadi hijau |
Kuning kemerahan menjadi merah tua |
Kuning kemerahan menjadi merah bata |
Flavanon atau dihidroflavonol |
Hasil uji flavonoid dari fraksi hasil kromatografi kolom disajikan pada Tabel 3 serta hasil uji toksisitasnya dipaparkan pada Tabel 4. Fraksi yang positif mengandung senyawa flavonoid dan paling toksik dilanjutkan pada proses pemurnian dan identifikasi menggunakan spektrofotometer UV-Vis dan spektrofotometer IR.
Pemisahan terhadap ekstrak kloroform dilakukan untuk memperoleh senyawa golongan flavonoid yang bersifat toksik. Pemisahan ekstrak kloroform menggunakan kromatografi kolom dengan fase gerak kloroform : etil asetat (5:1) diperoleh 3 fraksi (Fa, Fb, dan Fc) dengan pola noda yang berbeda.
Berdasarkan Tabel 3, diketahui bahwa fraksi Fa tidak mengandung flavonoid karena tidak menunjukkan perubahan warna pada ketiga pereaksi. Sedangkan fraksi Fb dan Fc positif mengandung flavonoid dengan dugaan jenis flavonoid golongan flavanon atau dihidroflavonol.
Flavonoid golongan flavanon atau dihidroflavonol memberikan perubahan warna merah/magenta/ ungu/hijau/biru dengan pereaksi Wilstatter, perubahan warna orange/merah tua dengan pereaksi Bate-Smith-Metchalf, dan perubahan warna kuning/orange/merah/ungu dengan pereaksi NaOH, (Geissman, 1962). Hasil uji toksisitas fraksi hasil kromatografi kolom (Tabel 4) menunjukkan bahwa fraksi Fa bersifat tidak toksik (memiliki nilai LC50 lebih dari 1000 ppm), hal ini kemungkinan disebabkan karena fraksi Fa tidak mengandung senyawa flavonoid. Fraksi Fb dan Fc bersifat toksik (memiliki nilai LC50 lebih kecil dari 1000 ppm), namun fraksi Fc bersifat lebih toksik daripada fraksi Fb dengan nilai LC50 sebesar 63,10 ppm. Fraksi Fc bersifat paling toksik kemungkinan disebabkan karena konsentrasi senyawa flavonoid golongan flavanon atau dihidroflavonol pada fraksi Fc lebih tinggi daripada fraksi Fb.
|
Tabel 4. Hasil uji toksisitas fraksi hasil kromatografi kolom | |||
|
Fraksi |
Konsentrasi (ppm) |
% Mortalitas |
LC50 (ppm) |
|
A |
1000 |
38,22 |
45708,82 |
|
100 |
7,67 | ||
|
10 |
1,27 | ||
|
B |
1000 |
81,79 |
158,49 |
|
100 |
33,28 | ||
|
10 |
6,88 | ||
|
C |
1000 |
98,17 |
63,10 |
|
100 |
40 | ||
|
10 |
20 | ||
Tabel 5. Hasil identifikasi senyawa golongan flavonoid dalam isolat aktif dengan spektrofotometer UV-Vis
|
Sampel |
Pereaksi geser |
λ (nm) |
Besar pergeseran λ (nm) | ||
|
Pita II |
Pita I |
Pita II |
Pita I | ||
|
+Metanol |
281,0 |
315,0 |
- |
- | |
|
+Metanol |
+NaOH |
288,0 |
360,5 |
+7,0 |
+45,5 |
|
+Metanol |
+NaOH (setelah 5 menit) |
288,0 |
362,5 |
+7,0 |
+47,5 |
|
+Metanol |
+NaOAc |
284,5 |
318,5 |
+3,5 |
+3,5 |
|
+Metanol |
+NaOAc+H3BO3 |
286,0 |
320,0 |
+5,0 |
+5,0 |
|
+Metanol |
+AlCl3 |
283,0 |
315,0 |
+2,0 |
- |
|
+Metanol |
+AlCl3+HCl |
279,5 |
320,0 |
-1,5 |
+5,0 |
Fraksi Fc relatif murni secara kromatografi lapis tipis (KLT) dengan menunjukkan 1 noda dengan berbagai eluen yang digunakan seperti kloroform tunggal, kloroform : etil asetat (5:1), kloroform : etil asetat : metanol (5:1:1), dan kloroform : etil asetat (4:1).
Isolat yang relatif murni secara KLT selanjutnya diidentifikasi dengan spektrofotometer UV-Vis. Spektrum UV-Vis disajikan pada Gambar 1.
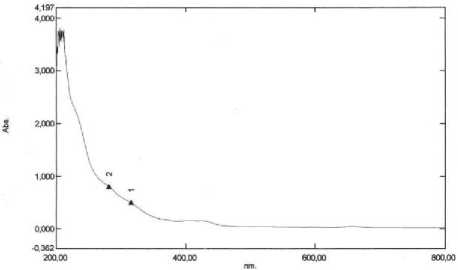
Gambar 1. Spektrum UV-Vis isolat Fc
Spektrum UV-Vis isolat dengan spektrofotometer UV-Vis menghasilkan dua serapan yaitu pita I dan II yang muncul pada panjang gelombang 315,0 dan 281,0 nm. Serapan yang terjadi pada pita II dengan panjang gelombang 281,0 nm kemungkinan disebabkan oleh terjadinya transisi elektronik π → π* dari suatu kromofor C = C pada cincin benzenoid (cincin B). Serapan pada pita I dengan panjang gelombang 315,0 nm kemungkinan disebabkan terjadinya transisi elektronik π → π* seperti C = C terkonjugasi serta n → π* berupa kromofor tunggal seperti ikatan C = O pada cincin A. Bentuk spektrum senyawa flavonoid golongan flavanon dan atau dihidroflavonol memiliki puncak pada daerah panjang gelombang 200-270 nm dan diikuti dengan bahu pada daerah panjang gelombang 275295 nm (pita II) serta 300-330 nm (pita I) (Markham, 1988).
Pola oksigenasi dan pola hidroksilasi senyawa golongan flavonoid dari isolat aktif ditunjukkan dengan penambahan berbagai macam pereaksi geser. Data panjang gelombang pada pita
I dan pita II beserta pergeseran panjang gelombangnya dapat dilihat pada Tabel 5.
Penambahan pereaksi geser NaOH menyebabkan terjadinya pergeseran batokromik pada pita II sebesar 7,0 nm yang menunjukkan adanya gugus hidroksi pada cincin A yaitu pada posisi atom C-7, hal ini diperkuat oleh adanya pergeseran batokromik pada pita I sebesar 45,5 nm yang menunjukkan adanya gugus hidroksi pada cincin A. Pada penambahan pereaksi geser NaOAc terjadi pergeseran batokromik pada pita II sebesar 3,5 nm yang menunjukkan adanya gugus 7-OH. Sedangkan penambahan H3BO3 (asam borat) akan menjembatani kedua gugus hidroksil pada gugus orto-dihidroksi sehingga terbentuk kompleks borat. Pergeseran batokromik juga terjadi pada pita I sebesar 5 nm yang menunjukkan adanya gugus orto-dihidroksi pada cincin B. Penambahan asam borat dilakukan setelah penambahan natrium asetat karena reaksinya lebih kuat sehingga dapat lebih memantapkan ada/tidaknya dan letak gugus orto-dihidroksi. Pada penambahan pereaksi geser AlCl3 terjadi pergeseran batokromik pita I sebesar 2 nm pada penambahan AlCl3 yang menunjukkan adanya kompleks yang terbentuk dari hidroksi keton (3-OH dengan atau tanpa 5-OH) dan atau orto-dihidroksi. Sedangkan pada reaksi penambahan HCl terjadi pergeseran hipsokromik
pita I sebesar 1,5 nm dari penambahan AlCl3, menunjukkan adanya kompleks yang terurai. Hasil tersebut menunjukkan adanya gugus orto-dihidroksi. Dari hasil tersebut juga dapat diketahui bahwa di dalam struktur terdapat gugus 3-OH dan atau 5-OH yang ditunjukkan dengan adanya pergeseran batokromik pada penambahan AlCl3/HCl (Markham, 1988).
Identifikasi isolat menggunakan spektrofotometer IR menghasilkan spektra yang disajikan pada Gambar 2, sedangkan data bilangan gelombang, bentuk pita, intensitas, dan penempatan gugus terkait dipaparkan pada Tabel 6.

Gambar 2. Spektra inframerah isolat Fc
Tabel 6. Hasil identifikasi senyawa golongan flavonoid dalam isolat aktif dengan spektrofotometer UV-Vis
|
Bilangan Gelombang ʋ (cm-1) |
Bentuk pita |
Intensitas |
Kemungkinan gugus fungsi | |
|
Spektra |
Pustaka | |||
|
3321,42 |
3450-3200 |
Lebar |
Kuat |
-OH terikat (stretching) |
|
3074,53 |
3100-3000 |
Tajam |
Sedang |
-CH aromatik |
|
2924,09 |
2960-2870 |
Tajam |
Kuat |
-CH alifatik (-CH3 stretching) |
|
2854,56 |
2960-2870 |
Tajam |
Kuat |
-CH alifatik (-CH2 stretching) |
|
1737,79 |
1820-1600 |
Tajam |
Kuat |
-C=O karbonil |
|
1566,20 |
1650-1450 |
Tajam |
Kuat |
-C=C aromatik |
|
1456,26 |
1500-1400 |
Tajam |
Kuat |
-CH alifatik (-CH2 bending) |
|
1373,32 |
1475-1300 |
Tajam |
Kuat |
-CH alifatik (-CH3 bending) |
|
1242,16 |
1300-1000 |
Tajam |
Kuat |
-C-O alkohol |
|
C-C | ||||
|
950,91 |
1000 - 920 |
Tajam |
Sedang |
-C=H |
|
866,04 |
840-758 |
Tajam |
Sedang |
-CH keluar bidang (bending) |
Pada spektrum inframerah terjadi serapan melebar pada daerah bilangan gelombang 3321,42 cm-1 diduga adalah vibrasi ulur gugus OH yang berikatan hidrogen yang berasal dari alkohol yang diperkuat dengan adanya serapan pada daerah 1242,16 cm-1 karena vibrasi tekuk dari C-O alcohol. Gugus C-H aromatik muncul pada daerah bilangan gelombang 3074,53 cm-1. Serapan pada daerah 2924,09 cm-1 dan 2854,65 cm-1 diduga adalah ciri khas untuk ikatan C-H alifatik (CH3 dan CH2 stretching), yang diperkuat dengan munculnya serapan pada daerah 1456,26 cm-1 dan 1373,32 cm-1 yang sama-sama memberikan serapan dengan bentuk pita tajam yang merupakan serapan CH2 bending dan CH3 bending. Gugus dari ikatan C=C aromatik ditunjukkan dengan munculnya serapan pada daerah bilangan gelombang 1566,20 cm-1, serta gugus C=O karbonil dengan serapan tajam pada daerah bilangan gelombang 1737,79 cm-1 (Silverstein, 1991).
Hasil uji fitokimia isolat aktif hasil kromatografi kolom (Fc) menunjukkan bahwa isolat mengandung senyawa flavonoid golongan flavanon atau dihidroflavonol karena memberikan perubahan warna kuning kemerahan menjadi hijau dengan pereaksi Wilstatter dan terjadi perubahan kuning kemerahan dengan pereaksi Bate-Smith-Metchalf ataupun NaOH 10% (Geissman, 1962) dan selanjutnya dianalisis menggunakan spektrofotometri UV-Visible dan Inframerah (IR). Isolat Fc memberikan 2 pita serapan yang karakteristik untuk senyawa flavonoid golongan flavanon dan dihidroflavonol, yaitu serapan pada panjang gelombang 281,0 nm (Pita II) dan 315,0 nm (Pita I). Menurut Markham (1988) senyawa flavonoid golongan flavanon dan atau dihidroflavonol mempunyai serapan pita II pada panjang gelombang 275-295 nm dan serapan pita I pada panjang gelombang 300-330 nm. Dugaan golongan flavanon dan atau dihidroflavonol dari isolat aktif (Fc) juga didukung oleh spektrum inframerah (IR) yang menunjukkan adanya serapan gugus C=O pada daerah bilangan gelombang 1737,86 cm-1, yang mana flavanon dan atau dihidroflavonol mempunyai gugus karbonil (C=O) pada kerangka dasarnya, serta didukung oleh gugus fungsi karakteristik C-H aromatik pada daerah bilangan gelombang 3074,53, C-H alifatik pada daerah bilangan gelombang 2924,09 cm-1,
C=C aromatik pada daerah bilangan gelombang 1566,20 cm-1 dan C-O alkohol pada daerah bilangan gelombang 1242,16 cm-1.
Pola oksigenasi atau kemungkinan letak substituen gugus hidroksi (OH) pada kerangka flavanon dan atau dihidroflavonol diperoleh dari beberapa pereaksi diagnosis/pereaksi geser seperti NaOH, NaOAc, NaOAc + H3BO3, AlCl3, dan AlCl3 + HCl. Hasil pergeseran panjang gelombang setelah penambahan pereaksi geser tersebut diduga bahwa kemungkinan letak substituen gugus orto-dihidroksi pada cincin A dan B dengan pergeseran batokromik pada pita I dan II. Jadi dari hasil uji fitokimia menunjukkan bahwa senyawa flavonoid yang terkandung pada isolat adalah flavanon atau dihidroflavonol. Sedangkan analisis isolat Fc menggunakan spektrofotometri UV-Vis dan spektrofotometri inframerah (IR) menunjukkan bahwa isolat flavonoid tidak memiliki ikatan CH2 serta memiliki gugus hidroksi pada atom C-3, sehingga isolat lebih cenderung merupakan senyawa flavonoid golongan dihidroflavonol. Dugaan struktur senyawa flavonoid golongan dihidroflavonol yang terdapat dalam ekstrak etanol daun Dewandaru (Eugenia uniflora Linn.) dipaparkan pada Gambar 3.
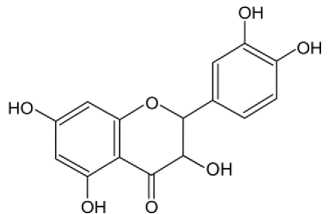
Gambar 3. Dugaan Struktur Senyawa
Dihidroflavonol
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang diperoleh dapat disimpulkan bahwa dalam ekstrak pekat etanol daun Dewandaru (Eugenia uniflora Linn.) diduga mengandung senyawa golongan flavonoid jenis dihidroflavonol yang memiliki efek toksik terhadap larva udang Artemia salina Leach dengan LC50 sebesar 63,10 ppm sehingga dapat berpotensi sebagai senyawa antikanker.
Flavonoid jenis dihidroflavonol yang terkandung pada isolat mempunyai gugus fungsi OH terikat, CH alifatik, C = O, C = C aromatik, C – O dan CH aromatik, serta terdapat gugus hidroksi pada atom C-3, C-5, dan C-7, yang
mempunyai gugus orto dihidroksi pada cincin B.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengidentifikasi isolat aktif dengan menggunakan analisis NMR dan analisis kemurnian dengan HPLC sehingga dapat ditetapkan suatu struktur usulan dari isolat aktif tersebut, serta perlu dilakukan uji aktivitas isolat aktif tersebut terhadap biakan sel kanker.
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terima kasih kepada bapak Drs. I Gusti Agung Gede Bawa, M.Si., ibu Dra. Ida Ayu Raka Astiti Asih, M.Si., bapak I Made Sutha Negara, S.Si., M.Si., serta semua pihak yang turut membantu dalam proses penyelesaian penelitian ini.
DAFTAR PUSTAKA
Anderson, J. E., Goetz, C. M., McLaughlin, J. L., and Suffness, M., 1991, A Blind
Comparison of Simple Bench-top Bioassays and Human Tumour Cell
Cytotoxicities as Antitumor Prescreens, Phytochem Analysis, 2 : 107-111
Geissman, T. A., 1962, The Chemistry of
Flavonoid Compounds, Pergamon Press, New York
Hutapea, J. R., 1994, Inventaris Tanaman Obat Indonesia, Jilid III, Departemen Kesehatan RI dan Badan Penelitian dan Pengembangan Kesehatan
Ikawati, M., Eko W. A., Sri O. N., dan Rosa A., 2000, Pemanfaatan Benalu Sebagai Agen Antikanker, Journal Farmasi Universitas Gadjah Mada, 1(1) : 1-8
Indrayani, L., Hartati, S., dan Lydia, S., 2000, Skrining Fitokimia dan Uji Toksisitas Ekstrak Daun Pecut Kuda (Stachytarpheta jamaicensis L. Vahl) Terhadap Larva
Udang Artemia salina Leach., Berkas Penelitian Hayati, 12 : 57-61
Jiang, Q., Wong, J., Fryst, H., Saba, J.D., dan Ames, B.N., 2004, γ-Tocopherol or
Combination of Vitamin E Form Induce Cell Death in Human Prostate Cancer Cell by Interrupting Sphingolipid Synthesis, PNAS, 101(51) : 17825-17830
Markham, K. R., 1988, Cara Mengidentifikasi
Flavonoid, Penerbit ITB, Bandung, 1-103
Maryati, 2006, Mekanisme Antiproliferatif Isolat Flavonoid Daun Sambung Nyawa (Gynura procumbens (Lour.) Merr.) Terhadap Sel T47D. Thesis, Sekolah Pascasarjana Universitas Gadjah Mada, Yogyakarta
Meyer B. N., Ferrigni N. R., Putman J. E., Jacabson L. B., Nichole D. E., and McLaughlin C. L., 1982, Brine Shrimp a Convenient General Bioassays For Active Plant Constituens, Planta Med., 45 : 31-34
Moeljopawiro, S., Anggelia M. R., Ayuningtyas D., Widaryanti B., Sari Y., dan Budi I. M., 2007, Pengaruh Sari Buah Merah (Pandanus conoideus Lam.) Terhadap
Pertumbuhan Sel Kanker Payudara dan Sel Kanker Usus Besar, Berkala Ilmiah Biologi, 6 (2) : 121-130
Mukhtar, M. H., Adnan A. Z., dan Pitra M. W., 2007, Uji Toksisitas Minyak Atsiri Daun Kemangi (Ocimum basilicum L.) dengan Metode Uji Brine Shrimp Lethality Bioassay, Jurnal Sains Teknologi Farmasi, 12 (1) : 1-4
Reynertson, K. A. and Kennelly, E. J., 2001, Antioxidant Polyphenols from Fruits of the Myrtaceae: A Chemotaxonomic and
Ethnomedical Approach to Discovery, Building Bridges with Traditional Knowledge II, The Society for Economic Botany, 42nd Annual Meeting and The International Society for
Ethnopharmacology, Honolulu
Silverstein, R. M., Basler, G. C, and Morril, T. C., 1991, Spectrometric Identification of Organik Compound, John Willey and Sons, Inc., New York
Sukardiman., Abdul, R., dan Fatma P. N., 2004, Uji Praskrining Aktivitas Antikanker Ekstrak Eter dan Ekstrak Metanol Marchantia planiloba Steph. dengan
Metode Uji Kematian Larva Udang dan Profil Densitometri Ekstrak Aktif, Jurnal
Farmasi Airlangga, 4 (3) : 97-100
Utami, W., Da’i, M., dan Sofiana, Y.S., 2005, Uji Aktivitas Penangkap Radikal dengan
Metode DPPH serta Penetapan Kandungan
Fenol dan Flavonoid dalam Ekstrak Kloroform, Ekstrak Etil Asetat, Ekstrak Etanol Daun Dewandaru (Eugenia uniflora L.), Pharmacon, 6 (1) : 5-9
189
Discussion and feedback