ISOLASI DAN UJI AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID DARI EKSTRAK DAUN JAMBU BIJI PUTIH (Psidium guajava Linn)
on
ISSN 1907-9850
ISOLASI DAN UJI AKTIVITAS ANTIOKSIDAN SENYAWA FLAVONOID DARI EKSTRAK DAUN JAMBU BIJI PUTIH (Psidium guajava Linn)
Egi Azikin Maulana*, I. A. R. Astiti Asih, dan Made Arsa
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : egiazikinmaulana@gmail.com
ABSTRAK
Antioksidan merupakan senyawa yang dapat menghambat aktivitas radikal bebas. Salah satu tanaman yang berpotensi sebagai antioksidan adalah tanaman jambu biji putih (Psidium guajava Linn). Penelitian ini dilakukan untuk mengidentifikasi senyawa golongan flavonoid dan mengetahui nilai IC50 ekstrak daun jambu biji putih. Ekstraksi dilakukan dengan metode maserasi. Pemisahan dan pemurnian dilakukan dengan KLT dan kromatografi kolom. Identifikasi senyawa dengan spektrofotometri FTIR dan UV-Vis, serta uji aktivitas antioksidan dengan metode DPPH.
Ekstraksi 1000 gram serbuk daun jambu biji putih dengan n-heksana diperoleh 103,40 gram ekstrak pekat n-heksana dan ekstraksi dengan etanol 70% diperoleh 128,49 gram ekstrak pekat etanol. Partisi 80 gram ekstrak etanol mengahasilkan ekstrak n-heksana 1,01 gram, kloroform 1,95 gram, dan n-butanol 3,77 gram. Ekstrak n-butanol menunjukan dominan mengandung flavonoid dari hasil uji fitokimia yang dilakukan. Hasil uji aktivitas antioksidan ekstrak n-butanol menghasilkan nilai IC50 sebesar 37,14 ppm. Ekstrak n-butanol dipisahakan dan dimurnikan dengan eluen n-heksana : etil asetat : n-butanol (8:2:1) menghasilkan 5 fraksi (A, B, C, D, E), dan fraksi C positif flavonoid. Analisis FTIR menunjukkan gugus fungsi dari isolat C yaitu CH alifatik, CH aromatik, C = C aromatik, C = O, OH dan C - O. Analisis isolat dengan UV-Vis menghasilkan 2 puncak pada λ 347,30 nm (pita I) dan λ 278,50 nm (pita II) yang diduga merupakan senyawa golongan flavon dengan kemungkinan gugus OH pada atom, C-2’, C-3 dan terdapat gugus orto dihidroksi pada atom C-4’,C-5’; C-5’,C-6, serta pada atom C-7 terdapat gugus O-glikosida.
Kata kunci : Psidium guajava Linn, flavonoid, antioksidan
ABSTRACT
Antioxidant is molecules that can inhibit the activity of free radical. White guava (Psidium guajava Linn) is one of many plants that have potential as antioxidant. This research was aimed to identify the flavonoid compounds and to determine IC50 values in the white guava leaf extract. Extraction was done by maceration method. The separation and purification was done by TLC and coloumn chromatography method. Flavonoid compound was identified using FTIR and UV-Vis spectrofotometry and antioxidant activity was tested with DPPH method.
A 1000 grams of white guava leaf powder was extracted by n-hexane produced 103,40 grams of concentrated n-hexane extract and extraction procces by ethanol 70 % produced 128,49 grams of concetrated etanol extract. Eighty grams of ethanol extract partition produced 1.01 grams of n-hexane extract, 1.95 grams of chloroform extract, and 3.77 grams of n-butanol extract. The results of phytochemical test indicated that n-butanol extract positively contained flavonoids. The results of antioxidant activity towards DPPH from n-butanol extract showed IC50 of 37,14 ppm. The separation and purification n-butanol extract with n-hexane : ethyl acetate : n-butanol (8:2:1) as the eluent resulted 5 fractions (A, B, C, D, E), with C fraction positively contained flavonoids. FTIR analysis showed C isolates contained functional groups of CH aliphatic, CH aromatic, C = C aromatic, C = O, OH, and C - O. C fraction was analyzed with UV-Vis showing 2 peaks at λ 347.30 nm (band I) and λ 278.50 nm (band II) suggesting the presence of flavones group with possibility of OH groups attached to C-3, C-2’ atoms, ortho-dihydroxy groups attached to C-5', C- 6; C-4', C-5', and O-glycoside group at C-7 atom.
Keywords : Psidium guajava Linn, flavonoids, antioxidant
PENDAHULUAN
Makhluk hidup akan mengalami proses menjadi tua secara alamiah. Proses tua terkadang terjadi tidak tepat waktu karena adanya proses penuaan dini yang terlalu cepat. Faktor penyebab terjadinya proses penuaan dini salah satunya disebabkan oleh radikal bebas (Kosasih,et al., 2006).
Radikal bebas merupakan suatu molekul yang orbital terluarnya memiliki satu atau lebih elektron yang tidak berpasangan seperti radikal hidroksil (•OH). Penyakit kanker maupun diabetes muncul karena adanya molekul tersebut, oleh karena itu organisme harus memproteksi diri dari radikal bebas. Sebagai pertahanannya organisme telah dibekali dengan antioksidan eksogen dan endogen (Chludil, et al., 2008; Mondon, et al., 1999).
Tanaman tradisonal juga beperan menghambat radikal bebas, salah satunya adalah tanaman jambu biji. Bagian daun dan buah tanaman jambu biji memiliki manfaat sebagai obat tradisional (Soedibyo, 1998). Kandungan kimia pada daun jambu biji berperan sebagai penghambat penuaan dini (Okuda, et al., 1982).
Analisis fitokimia oleh Arya (2012), ekstrak daun jambu biji putih mengandung senyawa saponin, tanin, steroid, flavonoid, alkaloid dan triterpenoid. Beberapa senyawa tersebut mempunyai aktivitas antioksidan salah satunya adalah senyawa golongan flavonoid, karena kemampuannya yang dapat mereduksi radikal bebas. Golongan flavonoid meliputi kalkon, flavon, isoflavon, flavonol, flavanon dan katekin mempunyai aktivitas sebagai antioksidan (Markham, 1988; Zuhra, et al., 2008).
Menurut Indriani (2006), daun jambu biji putih yang dimaserasi dengan etanol 70% memiliki potensi antioksidan terbaik. Menurut Tachakittirungrod (2007), ekstrak metanol daun jambu biji putih memiliki kemampuan meredam radikal bebas sebanyak 50% (IC50) yang cukup tinggi yaitu sebesar 1.20±0.02 µg/mL. Berdasarkan uraian diatas perlu dilakukan isolasi senyawa flavonoid dari ekstrak daun jambu biji putih (Psidium guajava Linn) dan menguji aktivitas antioksidannya.
MATERI DAN METODE
Bahan
Bahan sampel yang digunakan yaitu daun jambu biji putih (Psidium guajava Linn), yang didapat dari daerah Tampaksiring, Kabupaten Gianyar, Bali. Bahan kimia yang digunakan meliputi etanol 70%, etil asetat, kloroform, n-heksana, n-butanol, metanol, air, serbuk magnesium, asam klorida, asama sulfat, natrium hidroksida, natrium asetat, asam borat, alumunium klorida, silika gel GF254, silika gel 60 dan dipenilpikril hidrasil (DPPH).
Peralatan
Alat yang digunakan meliputi blender, gelas beker, kertas saring, alumunium foil, batang pengaduk, pipet tetes, penguap putar vakum, labu ukur, corong pisah, pipet mikro, botol vial, kromatografi kolom, seperangkat alat spektrofotometer inframerah (FTIR) dan spektrofotometer UV-Vis double beam.
Cara Kerja
Isolasi Flavonoid
Sebanyak 1000 g serbuk daun jambu biji diekstraksi melalui proses maserasi bertingkat dengan pelarut awal n-heksana teknis selama 24 jam kemudian disaring. Proses ini dilakukan sebanyak tiga kali. Filtrat yang diperoleh dikumpulkan kemudian diuapkan sehingga menghasilkan ekstrak kental n-heksana yang kemudian ditimbang. Residu hasil maserasi n-heksana dikeringkan, kemudian dimaserasi kembali menggunakan pelarut etanol 70% selama 24 jam. Proses ini dilakukan sebanyak tiga kali untuk mengindikasikan senyawa yang terdapat didalamnya terekstrak habis. Ekstrak etanol yang diperoleh diuapkan kemudian ditimbang. Selanjutnya, pada masing-masing ekstrak kental dilakukan uji fitokimia flavonoid.
Campuran pelarut etanol air (7:3) digunakan untuk melarutkan ekstrak kental etanol, selanjutnya penguap putar vakum digunakan untuk menguapkan etanolnya sampai tersisa ekstrak air. Ekstrak air dipartisi berturut-turut menggunakan pelarut n-heksana, kloroform dan n-butanol. Proses partisi dilakukan berulang kali sampai semua komponen senyawa yang bersifat non polar dan semi polar habis terekstraksi. Keempat ekstrak
yang diperoleh diuapkan, ditimbang, dan dilakukan uji fitokimia flavonoid. Ekstrak yang positif mengandung flavonoid kemudian dilakukan uji aktivitas antioksidan, kemudian dipisahkan dan dimurnikan secara kromatografi. (Astiti dan Setawan, 2008).
Uji Fitokimia Flavonoid
Uji fitokimia senyawa golongan flavonoid dilakukan pada ekstrak hasil maserasi, ekstrak hasil partisi, dan fraksi hasil kromatografi kolom. Pengujian dilakukan dengan beberapa pereaksi berikut (Geissman, 1962) :
-
• Uji Wilstatter: Sejumlah tertentu sampel ditambah serbuk Mg dan HCl pekat.
-
• Uji Bate Smith-Matcalfe: Sejumlah tertentu sampel ditambahkan H2SO4 pekat dan
dipanaskan selama 15 menit diatas penangas air.
-
• Uji dengan NaOH 10%: Sejumlah tertentu sampel ditambahkan beberapa tetes NaOH 10%.
Uji Aktivitas Antioksidan terhadap DPPH
Uji aktivitas antioksidan dilakukan dengan menguji larutan sampel pada konsentrasi 4, 8, 12, 16 ppm dan pengukuran blanko. Serapannya diukur pada panjang gelombang maksimumnya menggunakan spektrofotometri UV-Vis. Panjang gelombang maksimum diukur dengan cara mengukur larutan blanko yaitu DPPH 0,5 mM pada rentang panjang gelombang 400-600 nm (Zuhra, et al., 2008).
Identifikasi Isolat Aktif
Isolat flavonoid relatif murni yang diperoleh dari pemisahan dan pemurnian secara kromatografi, kemudian diidentifikasi sifat fisiko-kimia menggunakan spektrofotometer inframerah (FTIR) dan spektrofotometer UV-Vis, selanjutnya ditentukan kedudukan hidroksil pada inti flavonoid mengunakan pereaksi geser AlCl3-HCl, NaOAc-H3BO3 dan NaOH.
HASIL DAN PEMBAHASAN
Isolasi Flavonoid
Proses maserasi dilakukan secara bertingkat, ekstraksi pertama sebanyak 1000 gram serbuk daun jambu biji putih dengan menggunakan 4500 mL n-heksana selama 3 x 24 jam, dihasilkan ekstrak kental n-heksana 103,40 gram yang berwarna hijau pekat. Ekstraksi kedua daun jambu biji putih menggunakan 6000 mL etanol 70% selama 3 x 24 jam, dihasilkan ekstrak kental etanol 128,49 gram yang berwarna coklat.
Hasil uji fitokimia dari ekstrak hasil maserasi pada Tabel 1 menunjukkan bahwa ekstrak etanol positif flavonoid terhadap pereaksi NaOH 10% dan uji Bate-Smith Metcalfe dengan memberikan warna yang khas flavonoid pada masing-masing pereaksi. Sedangkan, ekstrak n-heksana menunjukkan hasil yang negatif flavonoid.
Tabel 1. Hasil uji fitokimia pada ekstrak hasil maserasi
|
Ekstrak |
Uji warna |
Keterangan | |||
|
Warna awal |
NaOH 10% |
H2SO4 pekat (Uji Bate-Smith Metcalfe) |
Mg-HCl (Uji Wilstatter) | ||
|
Etanol |
Kuning |
Orange |
Merah tua |
Coklat |
++ (Flavonoid) |
|
n-heksana |
Hijau |
Hijau |
Hijau |
Hijau |
(-) |
Tabel 2. Hasil uji fitokimia ekstrak n-heksana, kloroform dan n-butanol dan air
|
Ekstrak |
Uji warna |
Keterangan | |||
|
Warna awal |
NaOH 10% |
H2SO4 pekat (Uji Bate-Smith Metcalfe) |
Mg-HCl (Uji Wilstatter) | ||
|
n-heksana |
Hijau |
Hijau |
Hijau pekat |
hijau |
(-) |
|
kloroform |
Kuning |
coklat |
Coklat |
coklat |
+ (Flavonoid) |
|
n-butanol |
Kuning |
Kuning |
Merah tua |
Merah |
+++ (Flavonoid) |
|
Air |
Kuning |
Kuning tua |
Coklat |
Coklat |
+ (Flavonid) |
Ekstrak kental etanol daun jambu biji putih sebanyak 80 gram selanjutnya dipartisi menggunakan pelarut n-heksana, kloroform dan n-butanol. Kemudian masing-masing ekstrak diuapkan, sehingga dihasilkan ekstrak pekat n-heksana sebanyak 1,01 gram, ekstrak pekat kloroform sebanyak 1,95 gram, ekstrak pekat n-butanol sebanyak 3,77 gram dan ekstrak air adalah 10,34 gram. Terhadap masing-masing ekstrak dilakukan uji fitokimia flavonoid dan hasilnya ditampilkan pada Tabel 2. Hasil uji fitokimia pada Tabel 2 menunjukkan ekstrak kloroform, n-butanol, dan air positif mengandung flavonoid, karena terjadi perubahan warna yang khas untuk senyawa flavonid. Berdasarkan hasil tersebut ekstrak n-butanol memiliki hasil yang paling positif terhadap senyawa flavonoid. Hal ini ditunjukkan dari hasil uji fitokimia pada ekstrak n-butanol yang positif terhadap ketiga pereaksi flavonoid, dan memiliki intensitas warna yang kuat jika dibandingkan dengan ekstrak kloroform dan air, sehingga ekstrak n-butanol dilanjutkan untuk uji aktivitas antioksidan dan proses pemisahan serta pemurnian.
Uji Aktivitas Antioksidan
Ekstrak n-butanol yang positif flavonoid diukur aktivitas antioksidannya secara spektrofotometer UV-Vis dengan metode DPPH. Metode uji aktivitas antioksidan dengan DPPH merupakan pengukuran secara kuantitatif yaitu pengukuran yang dilakukan dengan penangkapan radikal DPPH oleh senyawa yang memiliki aktivitas antioksidan secara spektrofotometri UV-Vis, sehingga akan diketahui nilai IC50 (inhibition concentration) (Molyneux, 2004 ; Prakash, 2001).
Larutan DPPH 0,5 mM yang digunakan sebagai blanko ditentukan panjang gelombang maksimumnya terlebih dahulu. Penentuan panjang gelombang maksimum larutan DPPH 0,5 mM menghasilkan serapan maksimum pada panjang gelombang 516,60 nm dengan absorbansi 1,0013. Selanjutnya, pengukuran absorbansi dari ekstrak n-butanol yang dibuat dengan beberapa variasi kadar dilakukan pada panjang gelombang tersebut. Pembuatan variasi kadar bertujuan untuk menggambarkan aktivitas senyawa uji sebagai antioksidan. Seiring dengan penambahan ekstrak ke dalam larutan DPPH 0,5mM, nilai absorbansi DPPH mengalami penurunan dibandingkan dari
absorbasni blanko (Molyneux, 2004). Hal ini sesuai dengan hasil yang didapatkan pada Tabel 3. Penurunan absorbansi disebabkan tereduksinya molekul DPPH oleh senyawa antioksidan dalam ekstrak. Penurunan absorbansi juga diikuti dengan berkurangnya intensitas warna ungu dari larutan DPPH (Prakash, 2001).
Tabel 3. Hasil Uji Aktivitas Antioksidan Ekstrak n-butanol
|
Konsetrasi (ppm) |
Absorbansi |
% Peredaman |
IC50 (ppm) |
|
Blanko |
1,0013 |
0 | |
|
4 |
0,9513 |
4,99 | |
|
8 |
0,8975 |
10,37 |
37,14 |
|
12 |
0,8313 |
16,98 | |
|
16 |
0,7910 |
21,00 |
Berdasarkan Tabel 3 didapat nilai IC50 ekstrak n-butanol sebesar 37,14 ppm. Ekstrak n-butanol termasuk memiliki aktivitas antioksidan yang sangat kuat (Sinaga, 2009). Kurva regresi linier dari pengukuran aktivitas antioksidan ditunjukkan pada Gambar 1.
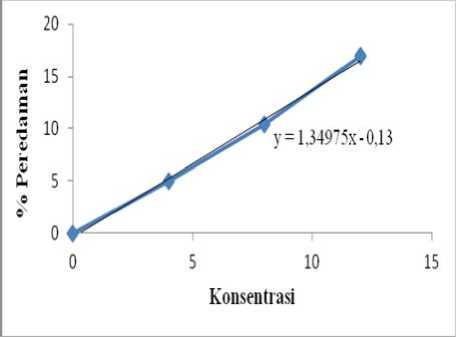
Gambar 1. Kurva Regresi Linier Ekstrak n-butanol
Kurva regresi linier ekstrak n-butanol menunjukkan bahwa bertambahnya konsentrasi ekstrak n-butanol yang dimasukkan ke dalam larutan DPPH 0,5 mM maka nilai % peredaman DPPH semakin tinggi. Hal tersebut menggambarkan bahwa senyawa flavonoid yang terdapat pada ekstrak n-butanol dapat mendonorkan atom H-nya dari gugus OH untuk meredam senyawa radikal (Prakash, 2001).
Pemisahan dan Pemurnian
Pemisahan ekstrak n-butanol daun jambu biji putih menggunakan kromatografi kolom dengan fase gerak dari campuran n-heksana : etil asetat : n-butanol (8:2:1). Hasil pemisahan dengan kromatografi kolom didapatkan 73 eluat. Eluat yang didapatkan dilihat kesamaan pola noda yang sama menggunakan KLT dan kemudian eluat digabungkan sehingga dihasilkan 5 fraksi (A, B, C, D, E). Hasil KLT ditampilkan pada Tabel 4.
Tabel 4. Hasil KLT penggabungan eluat
Fraksi Jumlah Rf Warna
noda
|
A (1-4) |
1 |
0,87 |
Kuning muda |
|
B (5-12) |
2 |
0,87 |
Kuning muda |
|
0,72 | |||
|
C (13-20) |
1 |
0,72 |
Kuning muda |
|
D (21-54) |
3 |
0,90 |
Kuning muda |
|
0,73 | |||
|
0,53 | |||
|
E (55-73) |
1 |
0,22 |
Kuning muda |
Uji fitokimia dilakukan terhadap 5 fraksi hasil kromatografi kolom untuk mengetahui fraksi yang paling positif terhadap flavonoid, seperti yang ditunjukkan pada Tabel 5. Hasil uji fitokimia pada Tabel 5 dari hasil kromatografi kolom menunjukkan hanya 3 fraksi yang positif mengandung flavonoid yaitu fraksi B, C, dan D. Hasil dominan yang menunjukan positif senyawa flavonoid terdapat pada fraksi C karena menunjukkan hasil yang positif terhadap ketiga pereaksi dan memiliki intensitas warna yang lebih kuat.
Fraksi C yang menunjukkan positif mengandung flavonoid kemudian dilakukan uji pemurnian. Pemurnian fraksi C yang positif flavonoid dilakukan dengan metode KLT dan menggunakan beberapa campuran fase gerak yaitu Kloroform : etil asetat : asam asetat (2:7:1), n-heksana : n-butanol (6:4), Etil asetat : n-butanol (2:8), n-heksana : kloroform (3:7). Hasil pemurnian menghasilkan noda tunggal yang mengindikasikan bahwa fraksi C relatif murni.
Identifikasi Isolat Aktif
Identifikasi isolat aktif (fraksi C) dengan spektrofotometeri FTIR menghasilkan spektra IR (Gambar 2) menunjukkan adanya gugus-gugus fungsi dari karakteristik flavonoid yaitu vibrasi ulur gugus –OH terikat yang muncul pada bilangan gelombang 3367,20 cm-1 dan diperkuat dengan munculnya serapan pada 1252,78 cm-1, 1161,55 cm-1, 1115,86 cm-1 yang menunjukkan adanya ulur gugus C-O alkohol. C-H aromatik pada serapan 3074,53 cm-1, dugaan ini diperkuat adanya serapan pada daerah bending 876,60 cm-1, 758,76 cm-1. Vibrasi ulur -C-H alifatik pada 2900,94 cm-1, 2821,29 cm-1 dan dugaan ini diperkuat dengan serapan 1347,39 cm-1. Serapan -C=C aromatik pada 1476,35 cm-1, 1541,65 cm-1, 1575,98 cm-1. Serapan C = O muncul pada 1755,22 cm-1 (Silverstein, 1991).
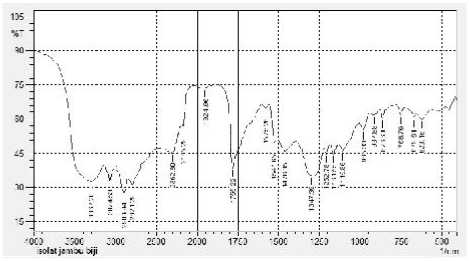
Gambar 2. Spektrum fraksi C
Identifikasi fraksi C dalam pelarut etanol dengan spektrofotometeri UV-Vis (Gambar 3) menunjukkan adanya dua pita serapan. Serapan pada panjang gelombang 347,30 nm untuk pita I dan serapan pada panjang gelombang 278,50 nm untuk pita II merupakan rentang serapan senyawa golongan flavon (Markham, 1988). Serapan pada panjang gelombang 347,30 nm untuk pita I mengindikasikan adanya suatu kromofor C=C terkonjugasi yang memiliki transisi π → π*. Serapan pada panjang gelombang 278,50 nm untuk pita II kemungkinan disebabkan oleh transisi n→π* berupa kromofor tunggal seperti C=O dan transisi π→π* dari kromofor C=C terkonjugasi (Sastrohamidjojo, 1991).
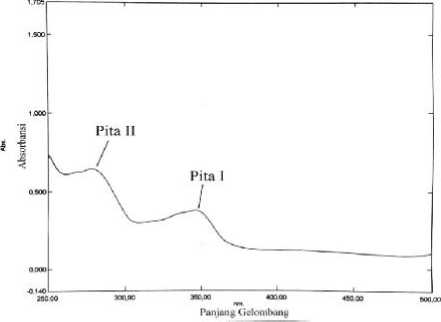
Gambar 3. Spektrum UV-Vis isolat fraksi C dalam pelarut etanol
|
Tabel 5. |
Hasil uji fitokimia dari hasil kromatografi kolom | |||||
|
Uji warna | ||||||
|
Fraksi |
Warna awal |
NaOH 10% |
H2SO4 pekat (Uji Mg-HCl (Uji Bate-Smith Metcalfe) Wilstatter) |
Keterangan | ||
|
A |
Kuning muda |
Bening |
Bening |
Bening |
(-) | |
|
B |
Kuning muda |
Kuning |
Kuning |
Bening |
+ (Flavonoid) | |
|
C |
Kuning muda |
Kuning |
Orange |
Merah |
+++ (Flavonoid) | |
|
D |
Kuning muda |
Bening |
Bening |
Kuning |
+ (Flavonoid) | |
|
E |
Bening |
Bening |
Bening |
Bening |
(-) | |
|
Tabel 6. |
Data panjang gelombang dan pergeseran panjang gelombang | |||||
|
Isolat |
Pergeseran panjang gelombang Panjang gelombang (nm) (nm) | |||||
|
Pita I |
Pita II |
Pita I |
Pita II | |||
|
Etanol |
347,30 |
278,50 |
- |
- | ||
|
Etanol+NaOH |
395,15 |
278,50 |
+47,85 |
- | ||
|
Etanol+NaOH setelah 5 menit |
395,15 |
278,50 |
+47,85 |
- | ||
|
Etanol+NaOAc |
345,40 |
277,35 |
-1,9 |
-1,15 | ||
|
Etanol+NaOAc+H3BO3 |
345,30 |
277,35 |
-1,9 |
-1,15 | ||
|
Etanol+AlCl3 |
358,65 |
278,50 |
+11,35 |
- | ||
|
Etanol+AlCl3+HCl |
358,86 |
278,47 |
+11,56 |
-0,03 | ||
Kedudukan gugus hidroksil pada inti flavonoid yang diduga merupakan senyawa golongan flavon ditentukan menggunakan pereaksi geser, seperti yang ditampilkan pada Tabel 6. Kedudukan hidroksil pada cincin A dan cincin B senyawa flavonoid masing-masing terjadi pergeseran serapan pada pita II dan Pita I (Markham,1988).
Berdasarkan Tabel 6 menunjukan bahwa setelah penambahan pereaksi geser NaOH menyebabkan terjadinya pergeseran panjang gelombang yang lebih besar (batokromik) pada pita I yaitu 47,85 nm yang mengindikasikan adanya gugus hidroksil pada cincin B sinamoil di nomor atom C-2’, C-5’atau C-6’ (Sukadana, 2010), sedangkan pada pita II tidak terjadi pergeseran batokromik ataupun hipsokromik. Penambahan pereaksi geser AlCl3 dan AlCl3-HCl memberikan pergeseran batokromik sebesar 11,35 dan 11,56 pada pita I yang kemungkinan terdapat gugus hidroksil di nomor atom C-3 dan di nomor atom C-4’,C-5’ terdapat gugus ortodihidroksi, sedangkan pada pita II terjadi pergeseran hipsokromik. Menurut Markham (1988) dan Mabry (1970), saat penambahan pereaksi AlCl3-HCl dan NaOAc-H3BO3 pada isolat meyebabkan terjadinya pergeseran hipsokromik pada pita II maka diindikasikan pada cincin A benzoil di nomer atom C-7 terdapat gugus O-glikosida yang tidak tahan asam.
SIMPULAN DAN SARAN
Simpulan
Senyawa golongan flavonoid yang teridentifikasi dalam ekstrak daun jambu biji putih (Psidium guajava Linn) merupakan golongan senyawa flavon yang memiliki gugus fungsi yaitu CH alifatik, CH aromatik, C = C aromatik, C = O, OH dan C – O, dan kemungkinan gugus OH di nomor atom C-2’, C-3 dan terdapat gugus ortodihidroksi di nomor atom C-4’,C-5’; C-5’,C-6, serta pada atom C-7 terdapat gugus O-glikosida. Hasil uji aktivitas antioksidan terhadap DPPH dari ekstrak n-butanol daun jambu biji putih (Psidium guajava Linn) dapat digunakan sebagai antioksidan karena memiliki nilai IC50 sebesar 37,1402 ppm.
Saran
-
1. Penelitian lebih lanjut perlu dilakukan untuk menganalisis senyawa flavonoid yang masih terdapat pada fraksi n-butanol, dan menguji aktivitas yang lain seperti uji toksisitas maupun uji antibakteri.
-
2. Perlu dilakukan identifikasi lebih lanjut menggunakan instrumen NMR, GC-MS untuk menentukan struktur molekulnya.
UCAPAN TERIMA KASIH
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu Ni Luh Rustini, S.Si., M.Si., Ibu Dr. Irdhawati, S.Si., M.Si., dan Ibu Ni Komang Ariati, S.Si., M.P., atas saran konstruktif, sehingga penelitian ini dapat terselesaikan
DAFTAR PUSTAKA
Arya, V., Thakur, N., and Kashyap, C.P., 2012, Preliminary Phytochemical Analysis of the Extracts of Psidium Leaves, Journal of Pharmacognosy and Phytochemistry, 1 (1) : 2278-4136
Astiti, I.A.R. dan Setiawan, I M.A., 2008, Senyawa Golongan Flavonoid pada Ekstrak n-butanol Kulit Batang Bungur (Lagerstroemia speciosa Pers.), Jurnal Kimia, 2 (2) : 111-116
Chludil, H.D., Corbino, G.B., and Leicarh, S.R., 2008, Soil Quality Effects on Chenopodium album Flavonoid Content and Antioxidant Potential. Journal of Agricultural and Food Chemistry, 56 (13) : 5050–5056
Geissman, T.A., 1962, The Chemistry of Flavonoid Compounds, Pergamon Press, New York
Indriani, S., 2006, Uji Aktivitas Antioksidan Ekstrak Daun Jambu Biji (Psidium guajava L.), Jurnal Pertanian Indonesia, 11 (1) : 13-17
Kosasih, E.N., Tony, S., dan Hendro, H., 2006, Peran Antioksidan pada Lanjut Usia. Pusat Kajian Nasional Masalah Lanjut Usia, Jakarta
Mabry, T.J., Markham, K.R., and Thomas, M.B., 1997, The Systematic Indentification of Flavonoids, Springer-Verlag New York Inc., New York
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. a.b. Kosasih Padmawinata, ITB Press, Bandung
Molyneux, P., 2004, The Use of The Stable Free Radikal Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity, Journal Science of Technology, 26 (2) : 211-219
Mondon, P., Leclercq, L., and Lintner, K., 1999, Evaluation of Free-Radical Scavenger Effects of Helianthus Annuus Extracts Using New ex Vivo Stripping Methods, Cosmetics, Aerosols & Toiletries in Australia, 12 (4) : 87-98
Okuda, T., Yoshida, T., Hatano, T., Yakazi, K., and Ashida, M., 1982, Ellagitannins of The Casuarinaceae, Stachyura-Ceae and Myrtaceae, Phytochemistry, 21 (12) : 2871-2874
Prakash, A., 2001, Antioxidant Activity, Medallion Laboratories, 19 (2) : 59-63
Sastrohamidjojo, H., 1991, Spektroskopi, Liberty, Yogyakarta
Silverstein, R.M., Basler, G.C., and Morril, T.C., 1991, Spectrometric Identification of Organic Compounds, John willey & Sons Inc., Singapore
Sinaga, I.L.H., 2009, Skrining Fitokimia dan Uji Aktivitas Antioksidan Dari Ekstrak Etanol Buah Terong Belanda (Solanum betaceum
Cav.), Skripsi, Fakultas Farmasi
Universitas Sumatra Utara, Medan
Soedibyo, M., 1998, Atlas Sumber Kesehatan Manfaat dan Kegunaan, Balai Pustaka, Jakarta
Sukadana, I M., 2010, Aktivitas Antibakteri Senyawa Flavonoid dari Kulit Akar Awar Awar (Ficus septica Burm F), Jurnal Kimia, 4 (2) : 63-70
Tachakittirungrod, S., Ikegami, F., and Okonogi, S., 2007, Antioxidant Active Principles Isolated from Psidium guajava Grown in Thailand, Scientia Pharmaceutica, 75 : 179-193
Zuhra, C.F., Tarigan, J.B., dan Sihotang, H., 2008, Aktivitas Antioksidan Senyawa Flavonoid dari Daun Katuk (Sauropus androgunus (L) Merr.), Jurnal Biologi Sumatera, 3 (1) : 7-10
168
Discussion and feedback