ISOLASI DAN IDENTIFIKASI SENYAWA SITOTOKSIK DAUN NAGASARI (Calophyllum nagassarium Burm.f.) TERHADAP LARVA Artemia salina Leach
on
JURNAL KIMIA 10 (1), JANUARI 2016: 96-102
ISOLASI DAN IDENTIFIKASI SENYAWA SITOTOKSIK DAUN NAGASARI (Calophyllum nagassarium Burm.f.) TERHADAP LARVA Artemia salina Leach
I Wayan Pramana Eka Putra*, Sri Rahayu Santi, dan Ni Luh Rustini
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : wayanpramana@gmail.com
ABSTRAK
Calophyllum nagassarium Burm.f. yang dikenal dengan nama nagasari merupakan salah satu tanaman yang sering dimanfaatkan sebagai tanaman obat seperti antiseptik, pencahar, pembersih darah, kontrol cacing, dan tonik. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi senyawa sitotoksik daun nagasari dengan cara mengekstraksi 1000 g serbuk daun nagasari dengan 10 L etanol 96% (5L x 2) menghasilkan 66,81 g ekstrak etanol (LC50=19,06 ppm). Fraksionasi ekstrak etanol-air (7:3) berturut-turut dengan 300 mL n-heksana, 400 mL kloroform, 400 mL n-butanol, dan air serta diuji tosisitasnya terhadap larva Artemia salina Leach menghasilkan 2,52 g ekstrak n-heksana (LC50=275,42 ppm), 7,06 g ekstrak kloroform (LC50=63,10 ppm), 9,54 g ekstrak n-butanol (LC50=27,54 ppm) dan 25,38 g ekstrak air (LC50=478,63 ppm). Ekstrak n-butanol bersifat paling toksik selanjutnya dipisahkan, dimurnikan dan diidentifikasi.
Pemisahan 2,0 g ekstrak n-butanol menggunakan teknik kromatografi kolom dengan fase diam silika gel 60 dan fase gerak kloroform-n-butanol (5:3) menghasilkan 5 fraksi (F1, F2, F3, F4, dan F5). Fraksi F1 paling toksik (LC50=91,20 ppm) selanjutnya dipisahkan dengan KLT preparative dan dihasilkan 2 fraksi yaitu fraksi FA dan fraksi FB, yang mana fraksi FB bersifat paling toksik dengan LC50= 83,18 ppm. Hasil identifikasi isolat (fraksi FB) dengan uji fitokimia, spektrofotometer UV-Vis dan spektrofotometer IR diduga merupakan senyawa golongan terpenoid yang mempunyai gugus fungsi karakteristik seperti O-H, O=C-OH, C-H alifatik.
Kata kunci : Calophyllum nagassarium Burm.f., toksisitas, Artemia salina Leach
ABSTRACT
Calophyllum nagassarium Burm.f. or nagasari is a kind of plant that often be used as medical plant such as for antiseptic, laxative, blood purifier, helminthic, and tonic. This study aimed to isolate and identify cytotoxic compounds of nagasari leaves by extracting 1000 g of leaf powder with 10 L of 96% ethanol (5L x 2) to produce 66.81 g of ethanol extract (LC50 = 19.06 ppm). Fractionation of the ethanol-water extract (7: 3) in a row with 300 mL of n-hexane, chloroform 400 mL, 400 mL of n-butanol, and water and toxicity tests against larvae of Artemia salina Leach generate 2.52 g of n-hexane extracts (LC50 = 275.42 ppm), 7.06 g chloroform extract (LC50 = 63.10 ppm), 9.54 g of n-butanol extract (LC50 = 27.54 ppm) and 25.38 g aqueous extract (LC50 = 478 , 63 ppm). N-buthanol extract which was the most toxic was then separated, purified and identified.
The separation of 2.0 g of n-butanol extract using column chromatography techniques with silica gel 60 as the stationary phase and chloroform- n-butanol (5: 3) as the mobile phase resulted in 5 fractions (F1, F2, F3, F4, and F5). Fraction F1 which was the most toxic (LC50 = 91.20 ppm) was then separated by preparative Thin Layer Chromatography and resulted two fractions (FA and FB). Fraction FB was the most toxic with LC50 = 83.18 ppm. UV-Vis and IR spectrophotometric analysis of FB identified a compound suspected to be terpenoides that has the characteristics of functional groups such as O-H, O = C-OH, aliphatic C-H.
Keywords : Calophyllum nagassarium Burm.f., toxicity, Artemia salina Leach
PENDAHULUAN
Indonesia adalah negara yang memiliki daerah dengan kawasan hutan yang luas dan kaya akan potensi keanekaragaman hayati. Berdasarkan penelitian terhadap keanekaragaman hayati dari hutan tropis Indonesia disimpulkan bahwa hampir 17% dari spesies di permukaan bumi terdapat di Indonesia. Keanekaragaman sumber daya alam hayati Indonesia ini merupakan sumber senyawa kimia, baik berupa senyawa metabolit primer maupun senyawa metabolit sekunder. Senyawa kimia sebagai hasil metabolit sekunder pada berbagai jenis tanaman telah banyak diteliti dan dimanfaatkan sebagai zat warna, racun, aroma, obat-obatan, dan lain sebagainya (Darwis, 2000).
Nagasari (Calophyllum nagassarium Burm.f.). adalah salah satu tanaman yang sering dimanfaatkan sebagai tanaman obat seperti antiseptik, pencahar, pembersih darah, kontrol cacing, dan tonik (Yuniarti et al, 2001). Di Thailand tumbuhan nagasari di manfaatkan untuk mengobati demam, dingin, asma, ekspektoran, kardiotonik, diuretik dan agen antipiretik, sedangkan daunnya sering digunakan sebagai obat sengatan kalajengking dan gigitan ular, sementara itu tumbuhan nyamplung (Calophyllum inophyllum L.) yang satu genus dengan tumbuhan nagasari ekstrak etanol, daunnya mengandung senyawa golongan 4-phenylcoumarins yang digunakan sebagai agen antikanker pada sel raji dan senyawa golongan calocoumarin-A sebagai penghambat tumor kulit pada tikus dalam dua tahap tes secara in vivo ; fridelin dan 3 golongan senyawa triterpena yaitu kanopilal, kanopinol dan asam kanopilik, senyawa inopinon dan isoinopinon (Mastaka et al., 2001 ; Kazuyoki et al., 1968 ; Santi, 2009).
Pendekatan kemotaksonomi menyatakan bahwa tumbuhan dengan genus yang sama umumnya mengandung senyawa yang sama maka tumbuhan nagasari (Calophyllum nagassarium Burm.f.) yang satu genus dengan nyamplung (Calophyllum inophyllum L.) kemungkinan juga mengandung senyawa yang bersifat sebagai antikanker dan antitumor. Skrining awal aktivitas antikanker dilakukan dengan menguji sifat toksiknya (McLaughlin, 1991).
Toksisitas merupakan suatu parameter untuk mengetahui gejala dan tingkat kematian hewan uji akibat pemberian suatu senyawa (Loomis, 1978). Data yang diperoleh dari uji toksisitas berupa data kuantitatif yang dinyatakan dengan LC50 (median lethal concentration). Suatu ekstrak dapat dikatakan toksik atau berpotensi sebagai antikanker apabila memiliki nilai LC50 (konsentrasi yang mampu membunuh 50% larva udang) kurang dari 1000 ppm setelah waktu kontak 24 jam (Meyer,et al., 1982).
Hasil uji pendahuluan menunjukan bahwa ekstrak etanol dari daun nagasari bersifat toksik terhadap larva Artemia salina Leach dengan nilai LC50 sebesar 19,06 ppm, sehingga berpotensi untuk dikembangkan sebagai agen antikanker. Oleh karena itu maka dalam penelitian ini akan dicoba untuk mengisolasi dan mengidentifikasi senyawa sitotoksik daun nagasari dengan metode Brine Shrimp Lethality Test (BSLT).
MATERI DAN METODE
Bahan
Bahan tanaman yang digunakan dalam penelitian ini adalah daun nagasari (Calophylum nagassarium Burm.f.) yang diambil dari daerah Sanding, Kecamatan Tampaksiring, Kabupaten Gianyar, Bali. Identifikasi tentang taksonomi tumbuhan dilakukan di LIPI- UPT. Balai Konservasi Tumbuhan Kebun Raya “Eka Karya” Bali. Bahan kimia yang digunakan dalam penelitian ini adalah etanol teknis, kloroform (CHCl3) p.a, n-heksana (CH3(CH2)4CH3) p.a, n-butanol p.a, silika gel GF254 untuk kromatografi lapis tipis, silika gel 60 untuk uji kromatografi kolom, tween 80, aquades, air laut, HCl pekat, FeCl3, Willstater, pereaksi Bate Smith-Metacalfe, pereaksi Meyer, pereaksi Wagner, pereaksi Dragendroff, dan Pereaksi Lieberman-Bruchard.
Peralatan
Alat-alat yang digunakan dalam penelitian antara lain: seperangkat alat gelas, pisau, blender, penguap putar vakum (vacum rotary evaporator), neraca elektronik, bak kaca (akuarium), batang pengaduk, pipet volume, pipet tetes, pipet mikro, kertas saring, aluminium foil, corong pisah, seperangkat alat kromatografi lapis tipis (KLT),
seperagkat alat kromatografi kolom, seperangkat alat Spektrofotometer UV-Vis Double Beam Shimadzu dan Spektrofotometer IR Shimadzu prestige-21.
Cara Kerja
Sebanyak ± 1 kg Serbuk halus daun nagasari diekstrak dengan cara maserasi menggunakan etanol sampai sampel terendam selama 24 jam. Ekstrak yang diperoleh disaring, filtratnya ditampung, sedangkan ampasnya dimaserasi kembali dengan pelarut etanol sampai semua metabolit yang terkandung didalamnya terekstraksi. Filtrat yang diperoleh dikumpulkan dan diuapkan dengan penguap putar vacum (vacum rotary evaporator) sehingga diperoleh ekstrak pekat etanol. Ekstrak pekat etanol yang diperoleh kemudian ditimbang dan diuji toksisitasnya terhadap larva Artemia salina Leach. Ekstrak pekat etanol dilarutkan dengan campuran etanol-air (7:3), kemudian etanolnya diuapkan menggunakan vacum rotary evaporator sampai habis dan diperoleh ekstrak air. Ekstrak air ini kemudian dipartisi kembali berturut-turut dengan n-heksana, klorofom dan n-butanol sehingga diperoleh empat ekstrak yaitu ekstrak n-heksana, kloroform, n-butanol dan air. Ekstrak n-heksana, kloroform, n-butanol diuapkan, kemudian ditimbang dan diuji toksisitasnya terhadap larva udang (Artemia salina Leach). Ekstrak yang paling aktif selanjutnya dipisahkan dengan kromatografi kolom dan dimurnikan dengan kromatografi lapis tipis. Hasil pemisahan menggunakan kromatografi kolom dengan fase diam silika gel 60 dan fase gerak (eluen) berupa campuran pelarut kloroform:n-butanol (5:3) di gabungkan dengan KLT penggabungan. Tiap fraksi hasil KLT
penggabungan diuji toksisitasnya dan fraksi yang paling toksik diuji kemurniannya. Isolat yang relatif murni diidentifikasi golongan senyawanya dengan uji fitokimia dan analisis fisikokimia menggunakan spektofotometer UV-Vis dan Inframerah.
HASIL DAN PEMBAHASAN
Hasil maserasi ± 1000 g serbuk daun nagasari dengan menggunakan 10 L etanol 96% (5 L x 2) menghasilkan 66,81 g ekstrak pekat etanol. Jumlah larva yang mati pada tiap konsentrasi ekstrak pekat etanol terhadap larva Artemia salina Leach dipaparkan pada Tabel 1.
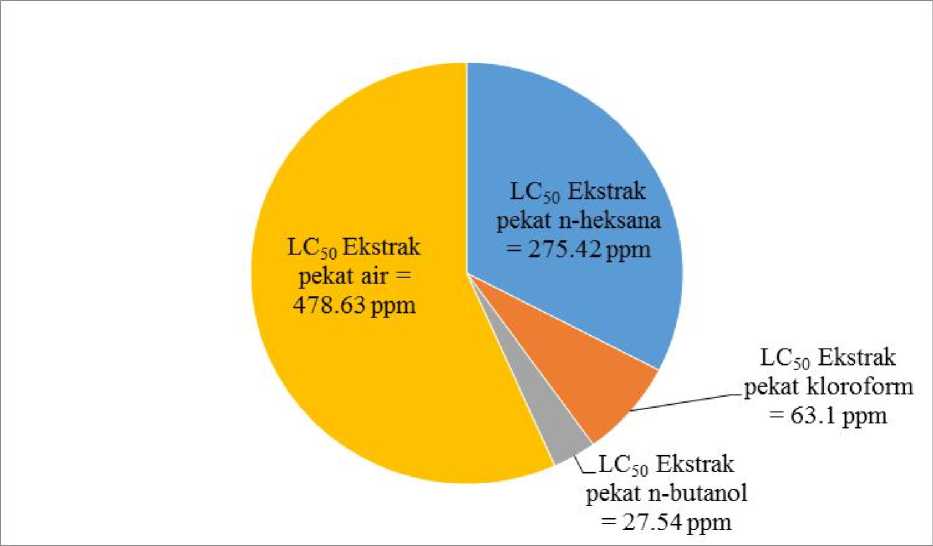
Hasil partisi ekstrak pekat etanol etanol-air (7:3) berturut-turut dengan 300 mL n-heksana (6 x 50 mL), 400 mL klorofom (8 x 50 mL) dan 400 mL n-butanol (8 x50 mL) menghasilkan berturut-turut 2,52 gram ekstrak n-heksana, 7,06 gram kloroform, 9,54 gram n-butanol dan 25,38 gram. Jumlah larva yang mati pada tiap konsentrasi ekstrak n-heksana, ekstrak kloroform, ekstrak n-butanol dan ekstrak air hasil fraksionasi dapat dilihat pada Gambar 1.
Ekstrak n-butanol memiliki nilai LC50 paling kecil dibandingkan ekstrak n-heksana, ekstrak kloroform, dan ekstrak air sehingga ektrak n-butanol bersifat paling tosik. Menurut Meyer (1982), suatu ekstrak dapat dikatakan toksik atau berpotensi sebagai antikanker apabila memiliki nilai LC50 (konsentrasi yang mampu membunuh 50% larva udang) kurang dari 1000 ppm setelah waktu kontak 24 jam. Ekstrak n- butanol yang bersifat paling toksik dilanjutkan ke tahap pemisahan dan pemurnian.
Tabel 1. Hasil uji toksisitas ekstrak pekat etanol terhadap larva Artemia salina Leach
|
Fraksi |
Konsentrasi (ppm) |
Jumlah larva yang mati |
% Mortalitas |
LC50 (ppm) | ||
|
1 |
2 |
3 | ||||
|
0 |
0 |
0 |
0 |
0 | ||
|
Ekstrak |
10 |
5 |
4 |
5 |
37,88 | |
|
pekat etanol |
100 |
7 |
8 |
8 |
84,12 |
19,06 |
|
1000 |
10 |
10 |
10 |
100 | ||
(Rumiyati et al.,2002).
VLC5O Ekstrak pekat n-butanol = 27.54 ppm
LC50 Ekstrak pekat kloroform = 63.1 ppm
LC50 Ekstrak pekat air = 478.63 ppm
LC50 Ekstrak pekat n-heksana = 275.42 ppm
Gambar 1. LC50 ekstrak pekat n-heksana, ekstrak pekat kloroform, ekstrak pekat n-butanol dan ekstrak pekat air

= 91.2 ppm
LC50 Fraksi Fl
LC50 Fraksi F5 = >1000 ppm
LC50 Fraksi F3 = 158.49ppm
LC50 Fraksi F4 = > IOOOppm
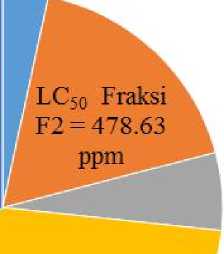
Gambar 2. LC50 Fraksi F1, Fraksi F2, Fraksi F3, Fraksi F4 dan Fraksi F5
Pemisahan 2,0 g komponen ekstrak n-butanol dilakukan menggunakan kromatografi kolom dengan fase diam silika gel 60 dan fase gerak kloroform:n-butanol (5:3) menghasilkan lima fraksi yaitu fraksi F1 (Rf = 0,97), fraksi F2 (Rf = 0,85), Fraksi F3 (Rf = 0,70 dan 0,53 ), fraksi F4 (Rf = 0,38) dan Fraksi F5 (Rf = 0,28) . Jumlah larva yang mati pada tiap konsentrasi untuk fraksi-fraksi hasil pemisahan ekstrak n-butanol terhadap larva Artemia salina Leach dapat dilihat pada Gambar 2.
Fraksi satu (F1) bersifat paling toksik terhadap larva Artemia salina Leach dengan nilai LC50 91,20 ppm. Toksisitas fraksi F1 lebih rendah dari toksisitas ekstrak n-butanol sebelumnya, hal ini berarti senyawa toksik yang terkandung dalam fraksi F1 bersifat sinergis dengan senyawa-senyawa lain yang terkandung pada ekstrak n-butanol daun nagasari. Fraksi F1 kemudian diuji kemurniannya dengan menggunakan KLT dengan berbagai eluen seperti n-butanol-kloroform (3:5), dan kloroform-etil asetat (1:1), yang menunjukkan bahwa fraksi F1 belum murni karena masih mengandung 2 noda sehingga harus dipisahkan kembali menggunakan KLT preparatif dengan fase diam silika gel pada plat KLT dan fase gerak kloroform-etil asetat (1:1).
Hasil pemisahan fraksi F1 dengan KLT preparatif menghasilkan dua fraksi yaitu fraksi A (Rf = 0,97 dan LC50 363,09 ppm) dan fraksi B (Rf = 0,85 dan LC50 83,18 ppm ). Fraksi yang paling aktif diidetifikasi dengan uji fitokimia untuk mengetahui golongan senyawanya serta dianalisis sifat fisikokimianya dengan spektrofotometer ultraviolet-sinar tampak (UV-Vis) dan spektrofoto-meter Inframerah (IR).
Identifikasi Isolat (Fraksi FB)
Hasil uji fitokimia menunjukkan fraksi B (FB) positif mengandung terpenoid yang memberikan perubahan warna dari bening menjadi ungu (Harbone, 1987). Hasil spektrum inframerah menunjukkan bahwa isolat memberikan serapan melebar pada daerah bilangan gelombang 3128,54 cm-1 diduga adalah vibrasi ulur gugus OH yang berasal dari asam karbosilat karena gugus fungsi O-H karboksilat yang berikatan hidrogen akan memberikan serapan melebar pada daerah bilangan gelombang 3300-2300 cm-1. Dugaan bahwa serapan yang dihasilkan isolat adalah serapan dari gugus fungsi karboksilat diperkuat dengan adanya serapan pada daerah 1699,00 cm-1 karena vibrasi dari C=O, dan serapan pada daerah 948,95 cm-1 karena vibrasi O-H. (Silverstain et al., 1991).
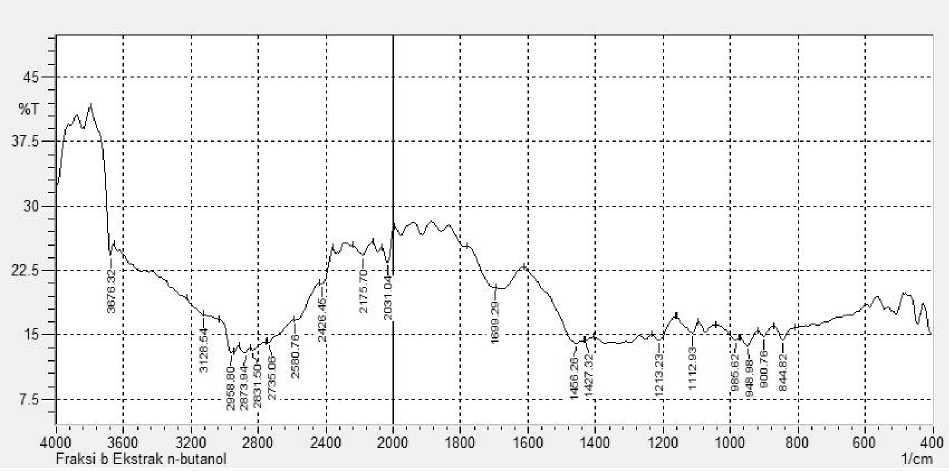
Gambar 3. Spektrum Inframerah isolat FB
Serapan pada daerah 3676,32 cm-1 diduga disebabkan oleh adanya serapan O-H bebas karena pada spektrum tidak ditemukan serapan yang disebabkan oleh vibrasi C-N ataupun N-H, diperkuat dengan munculnya serapan C-O alkohol pada daerah 1213,23 cm-1. Serapan pada daerah 2958,80 cm-1, dan 2873,94 cm-1 diduga disebabkan oleh vibrasi ulur dari C-H alifatik, yang diperkuat dengan munculnya serapan pada daerah 1456,26 cm-1 (Silverstain et al., 1991 : Soetarno,1990).
Hasil identifikasi dengan spektrofotometer inframerah ini menunjukan bahwa isolat kemungkinan mengandung gugus fungsi O-H, O=C-OH, dan C-H alifatik yang mana gugus fungsi ini juga dimiliki oleh senyawa terpenoid karbosilat (Silverstain et al., 1991; Soetarno,1990). Spektrum inframerah dari isolat dipaparkan pada Gambar 3.
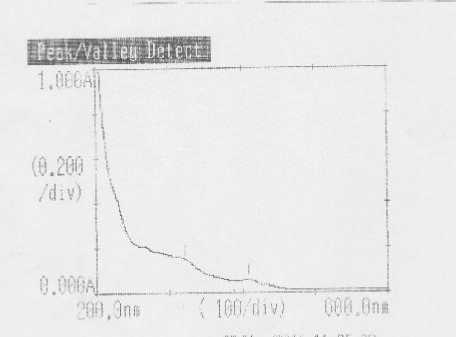
Gambar 4. Spektrum UV-Vis isolat FB
Hasil analisis Spektrum UV-Vis isolat menghasilkan dua serapan utama yang muncul pada panjang gelombang 312 dan 409 nm. Serapan yang terjadi pada panjang gelombang 312 nm kemungkinan disebabkan oleh terjadinya transisi elektronik n → σ* dari suatu auksokrom O-H yang mempunyai elektron non bonding. Dugaan ini diperkuat dari data spektrum inframerah dengan munculnya serapan dari gugus O-H asam pada daerah bilangan gelombang 3429,43 cm-1. Serapan pada panjang gelombang 409 nm kemungkinan disebabkan terjadinya transisi elektronik n → π * dari gugus C=O. Dugaan ini diperkuat dari data spektrum inframerah dengan munculnya serapan dari suatu kromofor C=O pada daerah bilangan
gelombang 1699,00 cm-1 (Silverstain et al., 1991; Sastrohamidjojo, 1991; Gandjar dan Rohman, 2012). Hasil Identifikasi isolat dengan spektrofotometer UV-Vis dipaparkan pada Gambar 4, isolat toksik daun nagasari diduga adalah senyawa golongan terpenoid karbosilat.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa isolat aktif sitotoksik daun nagasari dengan nilai LC50 sebesar 83,18 ppm adalah senyawa golongan terpenoid karbosilat
Saran
Penelitian lebih lanjut perlu dilakukan untuk mengetahui struktur dan posisi gugus-gugus fungsi dari senyawa terpenoid tersebut.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada staf laboratorium bersama MIPA, staf laboratorium jurusan kimia, Dr. Drs. I Made Sukadana, M.Si. serta kepada semua pihak yang telah membantu demi terselesainya penelitian ini.
DAFTAR PUSTAKA
Darwis, D., 2000, Uji Kandungan Fitokimia Metabolit Sekunder : Metode Lapangan dan Laboratorium, Workshop Pengembangan Sumber Daya Manusia Dalam Bidang Organik Bahan Alam Hayati, DITJEN DIKTI DEPDIKNAS,9-14 Oktober 2000, Padang
Gandjar, I. G. dan Rohman, A., 2012, Analisis Obat secara Spektrofotometri dan Kromatografi, cetakan I, Pustaka Pelajar, Yogyakarta
Harbone, J.B., 1987, Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan, Jilid II, ITB, Bandung
Kazuyoki Kawazu, Hajime Ohigashi, and Tetsuo Mitsui, 1968, The piscicidal constituents
of calophyllum inophyllum L., Tetrahedron Letters, 9 (19) : 2383-2385
Loomis, T.A., 1978, Essential of Toxicology, Edisi III, IKIP Semarang, Semarang, p. : 228233
Masataka Itogawa, Chiro Ito, Hugh T.W. Tan, Massashi Kuchide, Harukuni tokuda, Hoyoku Nishino, and Hiroshi Furukawa, 2001, Cancer chemopreventive agents, 4-phenhyl coumarins from Calophyllum inophyllum, Ancer Letters, 169 (10) : 1519
McLaughlin, J.L. 1991, Crown Gall Tumours on Potato Disc and Brine Shrimp Lethality: Two Simple Bioassay for Higher Plant Screening and Fractination. Methods in Plants Biochemistry, 6 (1) : 1-30
Meyer, B.N., Ferrigni, N.R, Putnam, J.E, Jacobsen, L.B, Nichols, D.E, dan McLaughlin, J.L, 1982, Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents. Planta Medica, 45 : 31-34
Rumiyati, Sismindari, Widyastuti, S. M., 2002, Toksisitas Ekstrak Air Tubuh Buah
Ganoderma SP. Terhadap Larva Udang Artemia salina Leach, Majalah Farmasi Indonesia, 13 (1) : 44-49
Sastrohamidjojo, H., 1991, Spektroskopi, Liberty, Yogyakarta
Silvertstein, R.M., Bassler, G.C., and Morrill, T.C., 1991, Spectrometric Identification of Organic Compounds, fifth edition, John Wiley and Sons, Singapore
Soetarno, S., 1990, Terpenoid, Pusat Antar Universitas Bidang Ilmu Hayati, Penerbit ITB, Bandung
Santi S. R., 2009, Penelusuran Senyawa Sitotoksik pada Kulit Biji Nyamplung (Calophyllum inophyllum L.) dan Kemungkinan Korelasinya sebagai Antikanker, Jurnal Kimia, 3 (2) : 101-108
Yuniarti N, Buharman, R., Kurniati, dan Yulianti, 2001, Tanaman Nagasari (Mesua ferrea L.), Atlas Benih Tanaman Hutan Indonesia Jilid II, Publikasi Khusus,Vol 2, No. 6, Balai Teknologi Perbenihan Bogor, Bogor
102
Discussion and feedback