SINTESIS SENYAWA KALKON SERTA UJI AKTIVITAS SEBAGAI ANTIOKSIDAN
on
ISSN 1907-9850
SINTESIS SENYAWA KALKON SERTA UJI AKTIVITAS SEBAGAI ANTIOKSIDAN
I Wayan Suirta
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali
*E-mail : Suirta2013@gmail.com
ABSTRAK
Telah disintesis senyawa kalkon dengan mereaksikan senyawa asetofenon dengan benzaldehid menggunakan katalis natrium hidroksida dengan pelarut air dan etanol. Hasil sintesis diuji aktifitas antioksidannya dan dianalisis strukturnya dengan GC-MS.Hasil sintesis didapatkan senyawa kalkon berbentuk kristal berwarna kuning pucat dengan titik leleh 55-570C . Dengan menggunakan katalis NaOH dengan pelarut air didapat rendemen 84,98% , terbentuknya kristal sekitar 1 jam. Dengan katalis NaOH dalam etanol didapat rendemen 87,68%, terbentuknya kristal sekitar 15 menit. Hasil uji antioksidan dengan DPPH, senyawa kalkon sebagai antioksidan dengan kekuatan lemah dengan % peredamam sekitar 50%. Hasil analisis GC-MS dibandingkan dengan data base Library Wiley 229LIB, menunjukkan senyawa yang didapat merupakan senyawa kalkon dengan kemurnian cukup tinggi.
Kata kunci : kalkon, asetofenon, benzaldehid, katalis
ABSTRACT
Synthesis chalcone compound by reaction between acetofenone and benzaldehyde using natrium hydroxide as catalyst with distil water or ethanol as solvent has been done. The yield was determined using antioxidant activity test with DPPH and GC-MS. The result of synthesis was pale yellow crystal with melting point of 55-570C. The synthesis in distil water yielded 84,98 %, and the formation of crystal was about 1 hour. The synthesis in ethanol resulted 87,68% yield, with the formation of crystal about 15 minutes. The product showed weak antioxidant activity with reduction percentage averaged at 50%. The GC-MS showed the presence of chalcone compound with sufficiently high purity.
Keywords : chalcone, acetofenone, benzaldehyde, catalyst
PENDAHULUAN
Senyawa kalkon (C15H12O), 1,3-difenil-1-propen-1-on atau benzilidenaasetofenon, merupakan senyawa yang sangat penting di alam. Senyawa kalkon yang terdapat pada tanaman merupakan precursor dari senyawa flavonoid dan isoflavonoid. Kalkon mengandung dua cincin aromatis (A dan B) dan satu atom karbon α,β- tak jenuh. Pada cincin A biasanya terdapat gugus etil, metil atau gugus alkil yang dapat meningkatkan aktivitas. Cincin B biasanya mengandung gugus-gugus hidrofob seperti halogen, nitro dan siano yang juga dapat meningkatkan aktivitas. Ikatan rangkap pada kalkon juga memegang peranan
penting dalam aktivitas, tetapi modifikasi dari ikatan ini tidak memberikan banyak pengaruh terhadap perubahan aktivitas. Substituen posisi para pada cincin B memengang peranan penting di dalam peningkatan aktivitas dibandingkan posisi orto. Adanya gugus keto dan gugus vinil pada kalkon telah diamati mempunyai fungsi meningkatkan aktivitas sebagai antioksidan (Belsare, et al.,2010; Shailendra, et al., 2007).
Kalkon sangat susah diisolasi dari tanaman karena adanya enzim kalkon sintetase (CSH) yang dengan mudah merubah kalkon menjadi flavanon. Kalkon dan turunannya memegang peranan penting di dalam bahan alam dan telah diteliti berbagai aktivitas farmakologi dan aktivitas
biologi. Kalkon dan turunannya mempunyai beberapa aktivitas pharmasi seperti: antibakteri, antiplatelet, antiulceratif, antimalaria, antikanker, antiviral, antileismanial, antioksidan, antihiper-glikemik, immunomodulator, antiinflamasi (Kishor, et al., 2009). Balsare, et al., 2010 telah meneliti aktivitas antioksidan pada beberapa turunan kalkon dan flavonoid. Hasil uji menunjukkan bahwa turunan kalkon mempunyai aktivitas antioksidan lebih rendah dari beberapa senyawa flavonoid. Kalkon juga mempunyai aktivitas biologi yang sangat penting seperti : antimikrobia, antioksidan, antiprotozoa, antikanker dan efek intestinal (Oyedapo, et al, 2008).
Senyawa kalkon diketahui sebagai kunci intermediet di dalam mensintesis senyawa-senyawa heterosiklik yang berperan penting dalam aktivitas biologi. Dalam sintesis laboratorium kalkon dapat dibuat dengan menggunakan reaksi Claisen-Schmidt dengan mereaksikan senyawa asetofenon atau turunannya dengan benzaldehid atau turunannya dengan menggunakan basa kuat seperti NaOH, KOH, Ba(OH)2, LiOH.2H2O atau NaH sebagai katalis di dalam pelarut polar. Katalis lain yang juga dapat digunakan adalah sodium posfat dan aluminium-magnesium hidroksida hidrat. Sedangkan katalis asam yang biasanya digunakan seperti: HCl, AlCl3, BF3-Et2O, TiCl4, RuCl3.( Faridz, M., 2009; Hery Suwito, et al., 2014).
Oktari S et al. (2011), telah mensintesis senyawa turunan kalkon dari 2-asetil piridin dengan metoksibenzaldehid serta uji aktivitasnya sebagai antioksidan. Sintesis dilakukan dengan menggunakan pelarut etanol absolute dan katalis larutan KOH 2N. Hasil uji aktivitas antioksidan didapat IC50 lebih dari 250 ppm yang mengindikasikan aktifitas sebagai antioksidan yang lemah. Muhamad Faridz, (2009), telah mensintesis turunan kalkon tanpa menggunakan pelarut. Sintesis dilakukan dengan menumbuk 3-nitrobenzaldehid dan 4-metoksiasetofenon bersama padatan NaOH di dalam lumpang. Rendemen yang didapat 76 – 78%. Sutiva S et al, (2012), telah mensintesis senyawa turunan kalkon serta uji aktivitasnya sebagai antikanker. Sintesis dilakukan dengan menggunakan pelarut etanol dengan katalis larutan NaOH. Sintesis ini dapat dilakukan dengan mudah dan mendapatkan rendemen sekitar 75-90%.
Dalam penelitian ini akan dilakukan sintesis kalkon dengan mereaksikan asetofenon dengan benzaldehid menggunakan katalis NaOH yang dilarutkan dalam air dengan pelarut etanol 98%. Sintesis kalkon juga dilakukan tanpa menggunakan pelarut air dengan cara melarutkan NaOH secara langsung dengan etanol 98%. Adanya pelarut air dalam reaksi kemungkinan dapat berpengaruh terhadap interaksi molekul dalam proses reaksi dan akan mempengaruhi terjadinya reaksi. NaOH yang dilarutkan secara langsung dengan etanol tanpa pelarut air akan meningkatkan karakter ionisasi. Dalam bentuk terionisasi reaksi akan lebih cepat terjadi. Dari kedua cara tersebut dapat dibandingkan hasil reaksi yang diperoleh dan kecepatan terbentuknya produk. Adanya gugus vinil dan gugus keto pada kalkon kemungkinan kalkon mempunyai aktifitas sebagai antioksidan, oleh karena itu akan dilakukan uji aktifitas antioksidan pada kalkon hasil sintesis dengan menggunakan metode DPPH.
Berdasarkan latar belakang diatas dapat diambil permasalahan ; bagaimana rendemen yang diperoleh dan kecepatan terbentuknya hasil dari reaksi sintesis kalkon dengan dan tanpa pelarut air. Apakah kalkon hasil sintesis mempunyai aktivitas sebagai antioksidan. Tujuan dari penelitian ini adalah mendapatkan kalkon dengan rendemen dan kemurnian tinggi serta mengetahui aktifitas antioksidannya.
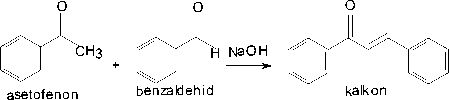
Gambar 1. Reaksi sintesis senyawa kalkon dari asetofenon dan benzaldehid
MATERI DAN METODE
Bahan
Bahan kimia yang digunakan dalam penelitian semua berderajat pro analisis meliputi: asetofenon, benzaldehid, etanol 98%,, NaOH, HCl dan DPPH.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah; Labu alas bulat ukuran 250 mL,
magnetic stirrer, gelas beker, Erlenmeyer 250 mL, elektrothermal melting point apparatus, spektrofotometer UV-Vis, Kromatografi Gas-Spektroskopi Massa (GC-MS).
Tempat
Penelitian untuk sintesis kalkon dilakukan di Laboratorium Kimia Organik Jurusan Kimia FMIPA Udayana, Uji aktifitas antioksidan dengan UV-Vis dikerjakan di Laboratorium Bersama FMIPA Udayana dan identifikasi dengan GC-MS dilakukan di Lab Organik Jurusan Kimia, FMIPA Universitas Gajah Mada.
Cara Kerja
Sintesis Kalkon
Prosedur I :
Katalis basa NaOH dibuat dengan menggerus dalam mortar sebanyak 2 g NaOH, kemudian dimasukkan ke dalam beker dan ditambah 10 mL akuades.
Prosedur II :
Katalis basa dibuat dengan menggerus dalam mortar sebanyak 2 g NaOH, kemudian dimasukkan ke dalam beker dan ditambah 10 mL etanol 98%.
Sebanyak 12 mL (0,1 mol) asetofenon dimasukkan ke dalam Erlenmeyer 250 mL kemudian ditambah 10 mL etanol 98% sambil diaduk. Kemudian ditambah larutan NaOH tetes demi tetes sambil terus diaduk. Selanjutnya ke dalam campuran dimasukkan benzaldehid sebanyak 12 mL (0,1 mol) secara bertahap sambil terus diaduk. Campuran diletakkan di dalam penangas es dan diamati sampai terbentuk kristal. Kristal yang didapat disaring dengan corong Buchner dan dicuci dengan akuades. Kristal dimurnikan dengan cara rekristalisasi menggunakan etanol. Timbang berat kristal yang didapat, uji titik lelehnya. dan kemudian diuji aktifitas anti-oksidannya. Kristal murni yang didapat diidentifikasi dengan spektrometer GC-MS.
Uji aktifitas antioksidan dengan DPPH menggunakan spektrofotometer uv-vis.
Pengenceran sampel. Sebanyak 0,08 g kristal kalkon hasil sintesis dilarutkan dalam 10 mL metanol sehingga konsentrasinya 800 ppm.
Pembuatan larutan DPPH
Sebanyak 0,005 g DPPH dilarutkan dalam 50 mL metanol sehingga konsentrasinya 100 ppm. Pengukuran absorbansi DPPH
Larutan blanko yang digunakan adalah methanol. Masukkan larutan DPPH ke dalam kuvet , kemudian setelah 5 menit dicatat absorbansinya pada ^ 497nm, 517nm, 537nm. Pengukuran absorbansi kalkon
Sebanyak 1 mL kalkon dimasukkan ke dalam kuvet kemudian ditambah 1 mL DPPH, campuran diaduk rata. Pada menit ke-5, ke-30 dan ke-60 setelah reaksi berlangsung dilakukan pencatatan absorbansi pada ^ 497nm, 517nm, 537nm. Dari data yang didapat kemudian tentukan % peredaman DPPH untuk menentukan aktivitas antioksidannya.
Identifikasi senyawa kalkon
Identifikasi senyawa kalkon hasil sintesis dianalisis dengan menggunakan Kromatografi Gas-Spektrofotometer Massa. Identifikasi dilakukan di Laboratorium Organik FMIPA UGM.
HASIL DAN PEMBAHASAN
Sintesis kalkon
Dengan prosedur 1 didapatkan berat kristal setelah rekristalisasi adalah 17,59 g , sehingga hasil rendemen 84,98%, dengan titik leleh 55 – 57 0C dan kristal berwarna kuning pucat. Awal kristal terbentuk setelah reaksi adalah sekitar 1 jam. Dengan prosedur 2 didapatkan berat kristal adalah 18,15 g , rendemen 87,68%, dengan titik leleh 55 – 57 0C dan kristal yang didapat berwarna kuning pucat. Awal kristal terbentuk setelah reaksi sekitar 15 menit. Dari prosedur 1 dan 2 didapatkan bahwa rendemen yang dihasilkan relative sama, warna dan bentuk kristalnya sama dan dengan titik leleh yang sama. Namun prosedur 2 memberikan hasil reaksi yang lebih cepat. Adanya pelarut air dalam reaksi berpengaruh terhadap kecepatan reaksi karena dapat mengurangi interaksi antara senyawa asetofenon dan benzaldehid dalam bereaksi. NaOH yang dilarutkan secara langsung dengan etanol menyebabkan terbentuknya CH3CH2ONa yang terpolarkan sehingga dalam keadaan terionkan reaksi menjadi lebih cepat terjadi.
Tabel 1. Uji aktivitas antioksidan senyawa kalkon dengan metode DPPH
|
Uji |
Waktu Absorbansi (nm) % Peredaman Rata-rata % Peredaman ^ 497 ^517 ^537 ^ 497 ^517 ^537 Radikal Bebas |
|
DPPH |
5 menit 3,0414 3,4905 2,8185 |
|
DPPH + Kalkon |
5 menit 1,4920 1,7216 1,4768 50,94 50,68 47,60 49,74 30 menit 1,4766 1,7028 1,4605 51,45 51,22 48,18 50,28 60 menit 1,4665 1,6888 1,4501 51,78 51,62 48,56 50,65 |
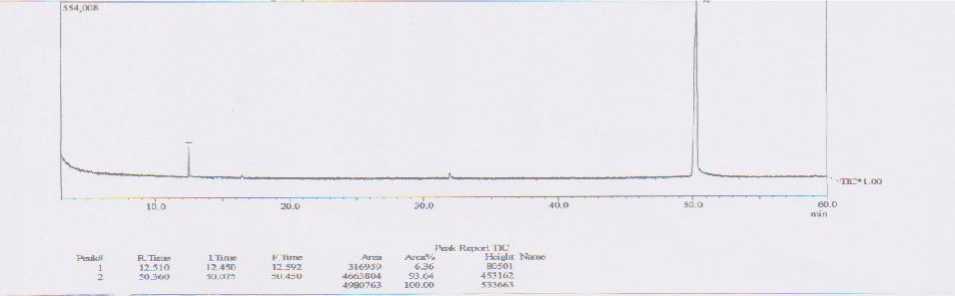
Gambar 1. Spektra hasil analisis GC senyawa kalkon hasil sintesis
IMl R⅛ft3W≡ MisltaItsJ Ra⅛¼xfcΛα^5∣135(μ50.367(5^^
BC' Mcde. Calc from Peak Group I ∙ Evtnl 1

Gambar 2. Spektra hasil analisis MS senyawa kalkon hasil sintesis

Gambar 3. Spektra MS kalkon dari data base Labrary WILEY 229 LIB
Uji aktivitas antioksidan
Hasil uji aktivitas antioksidan pada senyawa kalkon hasil sintesis dengan metode DPPH dapat dilihat pada Table 1.
Dari data yang didapat menunjukkan senyawa kalkon hasil sintesis bersifat sebagai antioksidan dengan kekuatan yang lemah hanya pada kisaran 50%. Gugus aktif antioksidan pada kalkon adalah gugus keto dan vinil. Adanya delokalisasi electron yang stabil antara gugus fenil, vinil dan keto pada kalkon memungkinkan susah untuk melepaskan electron tunggalnya sehingga mengurangi sifat antioksidannya. Tidak adanya gugus hidroksi atau halogen pada kalkon mengurangi aktifitas antioksidan. Adanya gugus hidroksi akan memudahkan memberikan radikal ion hydrogen sehingga dapat meningkatkan aktifitasnya sebagai antioksidan.
Hasil analisis GC-MS
Hasil analisis dengan GCMS-2010S SHIMADZU ; Kolom : Agilent HP 5MS panjang 30 meter, Gas pembawa Helium. Dari data GC didapat 2 puncak , puncak 1 dengan waktu retensi 12,510 dengan % Area 6,36% dan puncak 2 dengan waktu retensi 50,360 dengan % area 93,64%. Hasil analisis MS menunjukkan bahwa puncak 1 merupakan senyawa osimen yang termasuk golongan monoterpen dari terpenoid. Puncak 2 adalah senyawa kalkon. Puncak 1 muncul kemungkinan akibat dari kurang bersihnya kolom pada saat pemakaian. Sebelum analisis kalkon memang dilakukan analisis minyak atsiri sereh wangi dengan alat yang sama. Kalkon hasil sintesis yang didapat menunjukkan hasil yang cukup murni. Pada data MS puncak ion molekuler muncul pada m/e 208 yang sesuai dengan berat molekul dari kalkon. Harga m/e 131 merupakan fragmentasi dari kalkon yang kehilangan gugus fenil (C15H12O – C6H5). Harga m/e 103 muncul dari fragmentasi kalkon yang kehilangan gugus C6H5CO. Harga m/e 77 yang merupakan pucak dasar merupakan hasil fragmentasi dari gugus fenil (C6H5). Hasil analisis GC - MS ditunjukkan pada Gambar 1, 2, dan 3.
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian didapatkan bahwa:
-
1. Sintesis kalkon dengan prosedur 1 dan prosedur 2 mendapatkan rendemen yang relative sama, titik leleh sama, warna kristal sama, namun prosedur 2 (tanpa pelarut air) lebih cepat menghasilkan kristal pada saat reaksi.
-
2. Hasil uji aktivitas antioksidan menunjukkan kalkon sebagai aktivitas antioksidan yang lemah dengan % peredaman sekitar 50%.
-
3. Hasil analisis GC-MS, hasil sintesis yang didapat merupakan senyawa kalkon dengan kemurnian yang tinggi.
Saran
Berdasarkan hasil penelitian, dapat disarankan untuk menggunakan katalis lain dan uji aktivitas lain untuk meningkatkan manfaat dari hasil sintesis kalkon.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih pada Universitas Udayana dan teman-teman sejawat di Jurusan Kimia.
DAFTAR PUSTAKA
Belsare, D.P., Pal S.C., Kazi A.A., Kankate R.S., and Vanjari S.S., 2010, Evaluation of Antioxidant Activity of Chalcones and Flavonoids, Journal of ChemTech Research, 2(2) :1080-1089
Faridz, M.B.U., 2009, Solvent- Free Synthesis of Chalcone by Aldol Condensation Catalyzed by Solid Sodium Hydroxide (NaOH), Faculty of Applied Science University Technology Masa
Hery Suwito, Jumina, Mustofa, Alfinda N.K., and Ni Nyoman Tri P., 2014, Chalcones: Synthesis, Structure Diversity and Pharmacological Aspects, Journal of Chemical and Pharmaceutical Research, 6(5) : 1078-1088
Kishor V.G., Sandip V.G., Satish B.J., and Shantilal D.R., 2010, Synthesis of Some Novel Chalcones of Phthalimidoester possessing good antiinflamatory and antimicrobial activity, Indian Journal of Chemistry, 49B : 131-136
Oktari, S., Hendra, R., dan Jasril., 2011, Sintesis Kalkon Piridin dan Turunannya dari 2-asetilpiridin dengan metoksibenzaldehid serta Uji Aktifitasnya sebagai Antioksidan, Repisitori Univ Riau, 1- 11
Oyedapo O.A., Adewunmi C.O., Iwalewa E.O., and Makanju V.O. , 2008, Analgesic,
Antioxidant and Antiinflamatory Related Activities of 2’-hydroxy-2-4’-
dimethoxychalcone and 4-hydroxychalcone in Mice., J of Biological Sciences, 8(1) : 131 – 136
Shailendra M., Hemendra P.S., Gupta S.D., and
Hari N.M., 2007, Synthesis and Characterization of Some Chalcone Derivatives, Trends in Applied Sciences Research, 2 : 52-56
Suvitha, S., Siddiq I.A., Ali, M.A., and Mohan, S., 2012, Synthesis of Chalcones with Anticancer Activities, Molecules, 17 : 6179 – 6195
80
Discussion and feedback