ANALISIS ASAM AMINO PENSTIMULASI SEKRESI INSULIN DALAM BIJI KECIPIR, BIJI ASAM, DAN BIJI KELOR DENGAN HPLC
on
JURNAL KIMIA 10 (1), JANUARI 2016: 58-64
ANALISIS ASAM AMINO PENSTIMULASI SEKRESI INSULIN DALAM BIJI KECIPIR, BIJI ASAM, DAN BIJI KELOR DENGAN HPLC
Dita Rizkiyanti, Ni Made Suaniti, dan Ketut Ratnayani*
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali *E-mail : ratnayaninew@gmail.com
ABSTRAK
Biji-bijian merupakan sumber penghasil protein tertinggi jika dibandingkan dengan bagian lain pada tanaman. Dibandingkan dengan kedelai, biji kecipir, biji asam, dan biji kelor merupakan jenis biji-bijian dengan kadar protein tinggi yang masih minim pemanfaatannya. Protein tersusun dari beberapa asam amino yang saling berikatan membentuk polipeptida. Beberapa jenis asam amino telah diteliti berperan sebagai penstimulasi sekresi insulin yaitu, arginin, alanin, fenilalanin, isoleusin, leusin, dan lisin. Tujuan penelitian ini adalah untuk mengetahui potensi kandungan asam amino penstimulasi sekresi insulin tersebut dalam biji kecipir, biji asam, dan biji kelor. Berdasarkan kadar total asam amino dalam masing-masing biji, hasil penelitian menunjukkan biji kelor memiliki kadar total asam amino penstimulasi sekresi insulin tertinggi yaitu 16,4%, disusul oleh biji kecipir sebesar 16,2%, dan biji asam 12,1%. Namun jika dilihat berdasarkan kadar masing-masing asam aminonya tersendiri, maka biji kecipir rata-rata memiliki kandungan asam amino tertinggi. Kadar asam amino arginin, alanin, fenilalanin, isoleusin, dan leusin tertinggi ditemukan pada biji kecipir, sedangkan khusus asam amino lisin saja yang kadar tertingginya ditemukan pada biji kelor. Sehingga dapat disimpulkan bahwa biji kecipir paling berpotensi sebagai sumber asam amino penstimulasi insulin dibandingkan biji kelor dan biji asam yang akan bermanfaat dalam pencegahan maupun terapi penyakit diabetes melitus.
Kata kunci : asam amino, penstimulasi sekresi insulin, biji kecipir, biji asam, biji kelor
ABSTRACT
Seeds are a source of high protein when compared with other parts of the plant. Compared to soy bean, the use of winged bean seeds, tamarind seeds, moringa seeds as protein sources are still very limited. Protein composed of several amino acids bond together to form a polypeptide. Some amino acids have been investigated to act as stimulating insulin secretion, namely, arginine, alanine, phenylalanine, isoleucine, and lysine. The aim of this study was to determine the potential content of amino acids stimulating the secretion of insulin in winged bean seeds, tamarind seeds, and moringa seeds. Based on the total content of amino acids in each seeds, the results showed that moringa seeds have the highest levels of total amino acids stimulating insulin secretion (16.4%), followed by winged bean seeds (16.2%), and tamarind seeds (12.1%). But if seen by the levels of each amino acid, the winged bean seeds on average had the highest amino acid content. The highest levels of arginine, alanine, phenylalanine, isoleucine, and leucine were found in winged bean seeds, while only one specific amino acid i.e. lysine was found to be the highest level on moringa seeds. It can be concluded that the most potential seeds as a source of amino acids stimulating insulin was the winged bean seeds, that will be useful in the prevention or treatment of diabetes mellitus.
Keywords : amino acid, stimulating insulin secretion, winged bean seeds, tamarind seeds, moringa seeds
PENDAHULUAN
Biji-bijian merupakan bagian pada tanaman yang memiliki kandungan protein lebih banyak jika dibandingkan dengan bagian lainnya.
Kadar protein yang terkandung dalam kacang kacangan secara umum diperkirakan sekitar 25% dari kalori (energi). Dalam kacang-kacangan biasanya kekurangan salah satu asam amino esensial yang diperlukan untuk membentuk suatu
protein lengkap yaitu metionin (Winarno, 1993). Beberapa tanaman polong-polongan umumnya memiliki biji dengan kadar protein yang tinggi. Selain kedelai, terdapat beberapa biji-bijian lain yang memiliki kadar protein tinggi namun pemanfaatannya masih minimal yaitu di antaranya adalah biji kecipir (Psophocarpus tetragonolobus), biji kelor (Moringa oleifera) dan biji asam (Tamarindus indica). Biji kecipir telah diketahui memiliki kadar protein yang cukup besar seperti yang telah dilaporkan dalam Hertami (1986) yaitu sebesar 71,47%, sedangkan kadar protein biji kelor sebesar 38,4 % dalam Price (1993).
Asam amino sebagai monomer penyusun protein (polipeptida), secara umum memiliki atom karbon pusat (Cα) yang mengikat satu atom hidrogen, gugus amino (NH2), dan gugus karboksil (COOH). Terdapat 20 jenis asam amino penyusun protein yang dibedakan oleh rantai samping yang menempel pada Cα melalui valensinya yang keempat. Asam-asam amino tersambung ujung ke ujung selama sintesis protein dengan pembentukan ikatan polipeptida pada saat gugus karboksil di satu asam amino bergabung dengan gugus asam amino berikutnya dengan menghilangkan air. Proses ini diulang seiring dengan bertambahnya panjang rantai. Gugus amino pada asam amino pertama di suatu rantai polipeptida dan gugus karboksil pada asam amino terakhir tetap utuh. Rantai tersebut dikatakan memanjang dari ujung amino ke ujung karboksilnya (Ngili, 2013).
Beberapa jenis asam amino yang telah terbukti mampu meningkatkan stimulasi sekresi antara lain arginin (Arg), alanin (Ala), fenilalanin (Phe), isoleusin (Ile), dan lisin (Lys) (Newsholme et al.,2007., Yang et al., 2006., Sans., 2006., Van Loon et al., 2003). Secara spesifik saat ini telah diketahui bahwa asam amino mampu mengatur sekresi insulin dari sel β pankreas secara in vivo dan in vitro (Newsholme et al., 2007). Salah satu penelitian yang meneliti tentang kandungan asam amino penstimulasi sekresi insulin dalam bahan pangan yaitu ditemukan dalam kecambah kedelai (Kanetro et al., 2008). Sementara itu, Indonesia memiliki berbagai jenis kacang-kacangan, salah satu contohnya adalah kecipir. Penelitian yang telah dilakukan oleh Kanetro dan Hastuti (2006) menunjukkan bahwa protein biji kecipir hampir sama dengan kadar protein pada biji kedelai. Oleh karena itu, maka dipandang perlu dilakukan
penelitian tentang penentuan kandungan asam amino penstimulasi insulin dalam biji kecipir, biji asam, dan biji kelor dengan metode HPLC untuk mengetahui potensi dari masing-masing biji-bijian tersebut sebagai bahan pangan fungsional di bidang kesehatan).
MATERI DAN METODE
Bahan
Adapun bahan yang perlukan pada penelitian ini adalah biji kecipir, biji asam, biji kelor, orthophethaldialdehyde, natrium hidroksida, asam borat, larutan brij-30 30%, 2-merkaptoetanol, larutan standar asam amino 0,5 µmol/mL, Na-EDTA, metanol, tetrahidrofuran (THF), natrium asetat, air H.P. (Hi Pure), dan akuades.
Peralatan
Alat yang digunakan pada penelitian ini meliputi peralatan gelas, ayakan ukuran 250 mikron, neraca analitik digital, peralatan HPLC manual ICI Instrument 1988, syringe 100 µL, vial 1 mL, neraca analitik, pipet 1 mL, labu takar 1000 mL, dan kertas saring milipori.
Cara Kerja
Preparasi sampel biji-bijian
Biji kecipir, biji asam, dan biji kelor yang telah kering, dihaluskan menggunakan mortar agar menjadi serbuk. Serbuk biji diayak menggunakan saringan dengan ukuran 250 mikron untuk menghomogenkan ukuran sampel biji.
Pembuatan pereaksi OPA (Orthophethaldial-dehyde)
Sebanyak 50 mg OPA dilarutkan dalam 4 mL metanol dan ditambahkan merkaptoetanol. Campuran dikocok dengan hati-hati kemudian ditambahkan dengan larutan brij-30 dan buffer borat pH 10,4. Larutan stok ini disimpan dalam botol berwarna gelap pada suhu 4oC selam 2 minggu agar larutan stabil. Pereaksi derivatisasi dibuat dengan cara mencampurkan satu bagian larutan stok dengan dua bagian bufer kalium borat pH 10,4 dan dibuat baru setiap hari.
Pembuatan fase gerak
Bufer A terdiri dari komposisi Na-asetat, Na EDTA, THF (Tetrahidrofuran) yang dilarutkan
dalam 1 liter air Hi Pure (H.P.). Bufer disaring menggunakan kertas saring milipori 0,5 mikron yang stabil selama 5 hari pada suhu kamar. Bufer B terdiri dari metanol 95% dalam air Hi Puredan dalam pembuatannya disaring dengan kertas saring milipori 0,45 mikron.
Pengaturan kondisi alat HPLC
Kondisi alat diatur dengan kolom ultra techspere, laju aliran fase gerak 1 mL/menit, detektor fluoresen, dan fase gerak bufer A (bufer asetat 0,025 M, pH 6,5).
Analisis kadar asam amino
Serbuk biji yang telah diayak dengan saringan 250 mikron, ditimbang sebanyak 3 gram. Serbuk biji kemudian dihidrolisis dengan larutan HCl 6 N dan dipanaskan dalam suhu 110oC selama 24 jam. Sampel yang telah dihidrolisis dilarutkan dalam 5 mL HCl 0,01 N kemudian disaring dengan kertas saring milipori 0,45 mikron. Ditambahkan bufer kalium borat pH 10,4 dengan perbandingan 1 : 1. Sebanyak 10 µL sampel dimasukkan ke dalam vial kosong yang bersih dan ditambahkan 25 µL pereaksi OPA, dibiarkan hingga 1 menit agar proses derivatisasi sempurna. Hasil dari proses ini diinjeksikan ke dalam kolom HPLC sebanyak 5 µL dan pemisahan asam amino ditunggu hingga selesai. Total waktu yang diperlukan sekitar 25 menit.
Perhitungan Kadar Asam Amino
Konsentrasi asam amino (dinyatakan dalam µmol AA) dalam sampel dapat dihitung sebagai berikut :
, , , LuaspuTicaksampel , .
µmol AA =-----------Xkonsentrasistandar
LiLaspuncakstandar
µmol AA
LucLspuncaksampGl _ r ----------------X UtD Luaspuncakstanciar
,n , UmolAAxBMAAx 1CO%
KalarAsamArunG (%) =:----------------- μgr'jm sampel
HASIL DAN PEMBAHASAN
Ketiga biji-bijian (kecipir, asam, dan kelor) dianalisis dengan metode HPLC (High Perfomance Liquid Cromatography) untuk mengetahui kadar asam amino penstimulasi sekresi insulin yang terkandung dalam biji-bijian tersebut, yaitu: arginin, alanin, fenilalanin, isoleusin, leusin,
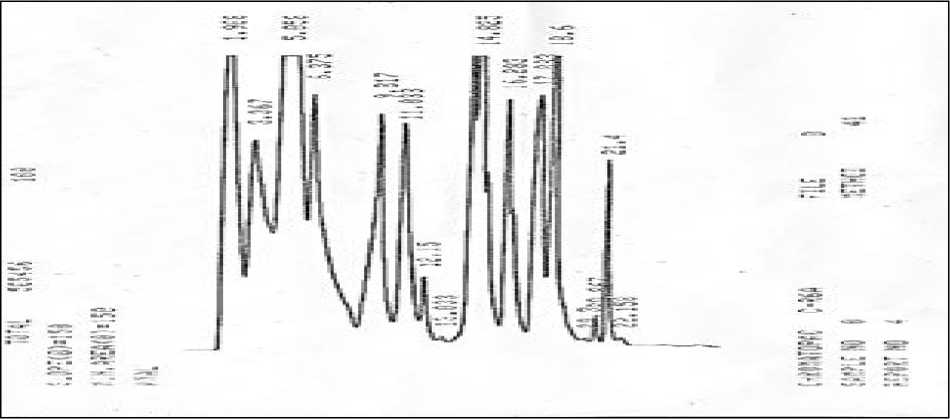
dan lisin. Pengujian diawali dengan preparasi standar asam amino sebagai pembanding kandungan asam amino dalam ketiga sampel biji-bijian (Gambar 1.) dengan waktu retensi arginin, alanin, fenilalanin, isoleusin, leusin, dan lisin berturut-turut yaitu, 12,150; 13,033; 18,600; 20,867; 21,400; 22,158 menit.
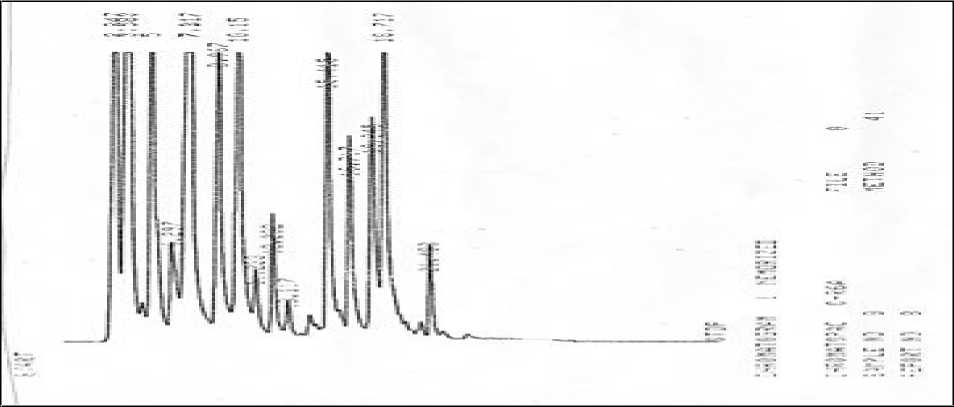
Hasil spektra uji asam amino pada sampel biji kecipir dalam Gambar 2. terdeteksi 15 macam asam amino (15 puncak/peak). Berdasarkan waktu retensi dari 6 puncak tersebut mendekati waktu retensi pada asam amino standar, diantaranya arginin (Arg), alanin (Ala), fenilalanin (Phe), isoleusin (Ile), dan lisin (Lys) berturut-turut adalah: 10,150; 11,233; 16,717; 18,045; 18,717; dan 21,488 menit.
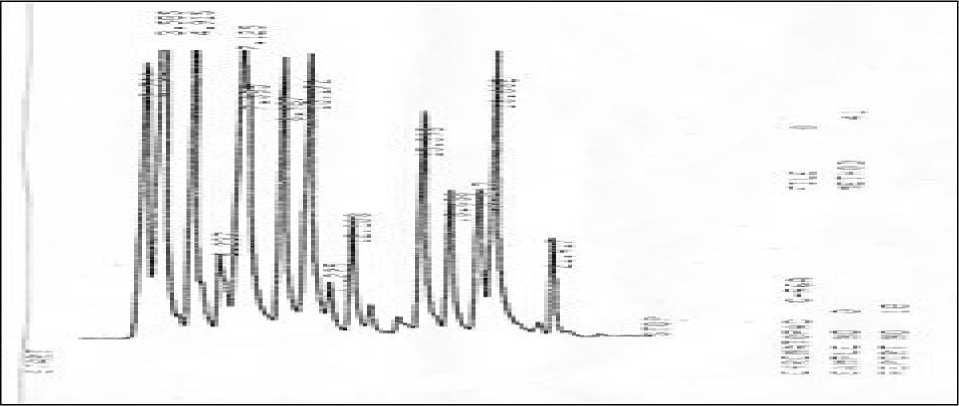
Uji asam amino dalam Gambar 3. diketahui pada sampel biji asam terlihat dalam terdeteksi 6 puncak yang mendekati waktu retensi pada asam amino standar, diantaranya arginin (Arg), alanin (Ala), fenilalanin (Phe), isoleusin (Ile), dan lisin (Lys) berturut-turut adalah: 8,987; 10,172; 16,688; 18,017; 18,682; dan 21,417 menit.
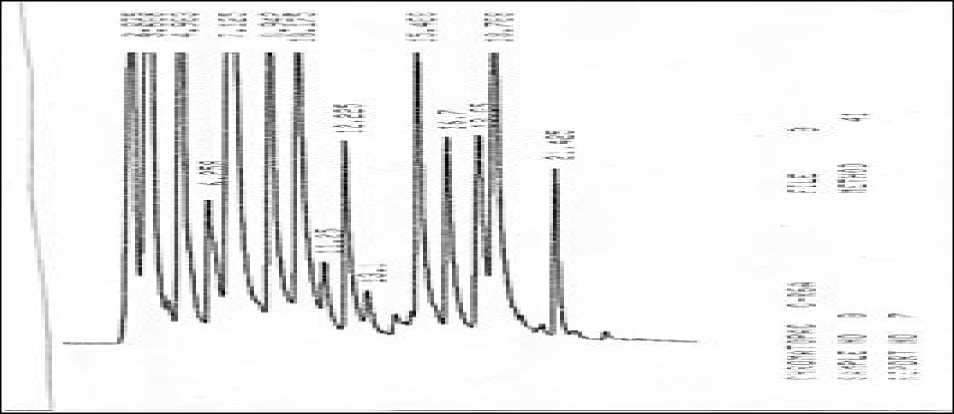
Pada biji kelor dalam Gambar 4. juga diperoleh 6 luas puncak dengan waktu retensi arginin (Arg), alanin (Ala), fenilalanin (Phe), isoleusin (Ile), dan lisin (Lys) berturut-turut adalah: 10,175; 11,250; 16,700; 18,050; 18,708; dan 21,425 menit.
Data luas puncak yang dihasilkan kemudian digunakan dalam pengukuran konsentrasi, dengan cara mengalikan luas puncak yang dihasilkan dengan konsentrasi asam amino standar. Konsentrasi yang dihasilkan kemudian dirubah dalam bentuk persen dengan cara dikalikan dengan berat molekul masing-masing asam amino dibagi dengan berat sampel (Nur et al., 1992).
Pada Tabel 2. diperoleh hasil bahwa ketiga sampel biji mengandung asam amino penstimulasi sekresi insulin. Berdasarkan kadar total asam amino dalam masing-masing biji, hasil penelitian menunjukkan biji kelor memiliki kadar total asam amino penstimulasi sekresi insulin tertinggi yaitu 16,400%, disusul oleh biji kecipir sebesar 16,233%, dan biji asam 12,101%. Namun jika dilihat berdasarkan kadar masing-masing asam aminonya tersendiri, maka biji kecipir rata-rata memiliki kandungan asam amino tertinggi. Asam
amino arginin, alanin, fenilalanin, isoleusin, dan leusin tertinggi ditemukan pada biji kecipir, sedangkan khusus asam amino lisin saja yang kadar tertingginya ditemukan pada biji kelor. Berdasarkan mekanismenya diketahui bahwa kemampuan stimulasi sekresi insulin asam amino tertinggi adalah leusin, kemudian arginin, dan terakhir adalah asam amino lainnya yaitu alanin, fenilalanin, isoleusin dan lisin (Newsholme et al.,
2007). Biji kecipir memiliki kandungan leusin (2,787 %) dan arginin lebih tinggi dari pada biji kelor (4,773 %), sehingga dapat disimpulkan bahwa biji kecipir paling berpotensi sebagai sumber asam amino penstimulasi insulin dibandingkan biji kelor dan biji asam yang akan bermanfaat dalam pencegahan maupun terapi penyakit diabetes melitus (Kanetro dan Setyowati, 2013).
Gambar 1. Analisis Asam Amino Standar
Gambar 2. Spektra HPLC Analisis Asam Amino pada Biji Kecipir
Gambar 3. Spektra HPLC Analisis Asam Amino pada Biji Asam
Gambar 4. Spektra HPLC Analisis Asam Amino pada Biji Kelor
Tabel 1. Luas Puncak Hasil Analisis HPLC
|
No. |
Asam Amino |
Luas Area | |||
|
Standar Asam Amino |
Biji kelor |
Biji asam |
Biji kecipir | ||
|
1 |
Arginin |
25349 |
29511 |
17996 |
30783 |
|
2 |
Alanin |
1875 |
3728 |
2953 |
3283 |
|
3 |
Fenilalanin |
33881 |
13173 |
8730 |
11954 |
|
4 |
Isoleusin |
19956 |
14892 |
10390 |
15773 |
|
5 |
Leusin |
28358 |
28585 |
19322 |
26702 |
|
6 |
Lisin |
11575 |
9907 |
4573 |
4215 |
Tabel 2. Komposisi Asam Amino Penstimulasi Sekresi Insulin
|
No. |
Asam Amino |
Konsentrasi (%) | ||
|
Biji kecipir |
Biji asam |
Biji kelor | ||
|
1 |
Arginin |
4,773 |
2,790 |
4,005 |
|
2 |
Alanin |
3,520 |
3,166 |
3,498 |
|
3 |
Fenilalanin |
1,315 |
0,960 |
1,268 |
|
4 |
Isoleusin |
2,339 |
1,541 |
1,933 |
|
5 |
Leusin |
2,787 |
2,017 |
2,611 |
|
6 |
Lisin |
1,499 |
1,627 |
3,085 |
|
Total |
16,233 |
12,101 |
16,400 | |
(Nur et al., 1992)
Mekanisme beberapa asam amino dalam menstimulasi pelepasan insulin berbeda-beda. Stimulasi pelepasan insulin oleh asam amino arginin dengan cara mempengaruhi transport asam amino kationik ke dalam sel yang menyebabkan depolarisasi membran. Hasil penelitian menggunakan asam amino alanin menunjukkan bahwa penambahan 10 mmol/l alanin pada konsentrasi glukosa basal meningkatkan sekresi insulin 3 kali pada sel β-BRIN-BD11 dan 1,6 kali pada islet. Asam amino leusin menstimulasi pelepasan insulin dalam sel β pankreas melalui suatu proses yang meliputi: peningkatan metabolisme mitokondria melalui aktivasi GDH, peningkatan produksi ATP melalui transaminasi leusin menjadi α-ketokaproat dan selanjutnya masuk ke dalam siklus TCA melalui asetil CoA (Nesholme et al., 2003).
SIMPULAN DAN SARAN
Berdasarkan kadar total asam amino dalam masing-masing biji, hasil penelitian menunjukkan biji kelor memiliki kadar total asam amino penstimulasi sekresi insulin tertinggi yaitu 16,400%, disusul oleh biji kecipir sebesar 16,233%, dan biji asam 12,101%. Namun jika dilihat berdasarkan kadar masing-masing asam aminonya tersendiri, maka biji kecipir paling berpotensi sebagai sumber asam amino penstimulasi insulin dibandingkan biji kelor dan biji asam yang akan bermanfaat dalam pencegahan maupun terapi penyakit diabetes melitush.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada bapak Ir. I Nyoman Nusada M.Agr, ibu Dr. Irdhawati, S.Si., ibu Dr. Ir. Sri Wahjuni, M.Kes., dan bapak Drs. I Gusti Agung Bawa, M.Si. atas saran dan kerjasamanya dalam penyelesaian tulisan ini.
DAFTAR PUSTAKA
AOAC, 1995, Official Methods of Analysis of AOAC International, 6th Ed, Association of Official Analytical Chemist, Maryland
Hertami, D.,1986, Kecipir, Budidaya Guna dan Hasil Olahannya, Simplex CV, Jakarta
Kanetro, B., dan Hastuti, S., 2006, Ragam Produk Olahan Kacang-Kacangan, Unwama
Press, Yogyakarta
Kanetro, B., Noor, Z., Sutardi dan Indrati, R., 2008, Potensi Protein Kecambah Kedelai dalam Menstimulasi Sekresi Insulin pada Pankreas Tikus Normal dan Diabetes, Agritech, 28 (2): 50-57
Kanetro, B., dan Setyowati, A.,2013, Profil Asam Amino Penstimulasi Sekresi Insulin dalam Ekstrak Sesudah Pemisahan Protein Kecambah Kacang-Kacangan Lokal, Agritech, 33 (3): 258-264
Ngili, Y., 2013, Protein dan Enzim, Rekayasa Sains, Bandung
Nur, A., M., Adijuwana, H., dan Kosasih, 1992, Teknik Laboratorium, Departemen Pendidikan Kebudayaan, IPB, Bogor
Newsholmes, P., Brennan, L., Rubi, B., dan Maechler, P., 2005, New instghts into amino acid metabolism, β-cell function and diabetes, Clinical Science, 108 (5): 185-194
Newsholmes, P., Brennan, L., dan Bender, K., 2007, Amino Acid Metabolism, Insulin Secretion, and Diabetes, Biochemical Society Treansaction, 35: 1180-1186
Price, 1993, The Moringa Tree, M.L.ECHO Technical Note A-5
Sans, M., D., Tashiro, M., dan Vogel, N., L., 2006, Leucine Activates Pancreatic Translational Machinery in Rats And Mice Through mTOR Independently of CCK and Insulin 1-3, Journal of Nutrition, 136: 1792-1799
Van Loon, L., J., Kruijshoop, M., Menheere, P., P., Sarris, W., H., M, Wagenmakers, A., J., M., dan Keizer, H., A., 2003, Amino Acids Ingestion Strongly Enhances Insulin Secretion in Patients with Long-Term Type 2 Diabetes, Diabetes Care, 26 (3): 625-630
Yang, J., Wong, R., K., Park, M., J., dan Wu, J., 2006, Leucine Regulation of Glucokinase and ATP Synthase Sensitizes Glucose-Induced Insulin Secretion in Pancreatic β-cells, Diabetes, 55 (1): 193-201
Winarno, F., G., 1993, Pangan Gizi Teknologi dan Konsumen, Gramedia Pustaka Utama, Jakarta
64
Discussion and feedback