ISOLASI DNA METAGENOMIK DARI MADU DENGAN DAN TANPA PENGAYAAN MEDIA LB (Luria-Bertani)
on
ISSN 1907-9850
ISOLASI DNA METAGENOMIK DARI MADU DENGAN DAN TANPA PENGAYAAN MEDIA LB (Luria-Bertani)
I Gusti Ngurah Bagus Andre Hartawan, Made Arsa, Ni Komang Ariati, dan I Nengah Wirajana*
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali Email : wirajana@yahoo.com
ABSTRAK
Kandungan DNA yang berasal dari mikroorganisme total dalam madu dapat dimanfaatkan untuk studi sidik jari (fingerprint) DNA dari madu. Metagenomik merupakan suatu pendekatan baru dalam analisis genom yang kompleks dari mikroorganisme total yang tidak dapat dikulturkan. Tujuan penelitian ini adalah untuk memperoleh DNA metagenomik yang diisolasi secara langsung dari sampel madu dengan dan tanpa pengayaan media tumbuh mikroorganisme LB (Luria-Bertani) dalam rangka studi sidik jari DNA madu pada penelitian berikutnya. Penelitian diawali dengan pemberian perlakuan pada sampel madu, yaitu dengan dan tanpa pengayaan media LB serta variasi waktu inkubasi 0, 24, 48, dan 72 jam. Selanjutnya dilakukan isolasi DNA metagenomik dengan metode lisis sel secara langsung. Isolat DNA yang diperoleh selanjutnya dianalisis dengan elektroforesis gel agarosa dan spektrofotometer UV-Vis pada panjang gelombang (λ) 260 dan 280 nm. DNA metagenomik berhasil diisolasi dari madu yang diberi perlakuan dengan dan tanpa pengayaan media LB. Hasil elektroforesis gel agarosa mengindikasikan sampel DNA masih terkontaminasi RNA. Hasil analisis dengan spektrofotometri UV-Vis menunjukkan isolat DNA dari semua sampel hasil perlakuan mempunyai rasio absorbansi pada λ 260/280 nm antara 1,2 – 1,6. Rasio ini menunjukkan bahwa isolat DNA diduga masih terkontaminasi protein dan fenol.
Kata kunci : Madu, DNA, Metagenomik
ABSTRACT
DNA content in total honey microorganism can be used to study DNA fingerprint of honey. Metagenomic is a new approach to analyse complex genomes from unculturable total microorganism. The aim of this research was to get DNA metagenomic isolated directly from honey samples enriched with microorganisms growing media LB (Luria-Bertani) and without enrichment of microorganisms growing media LB in order to study DNA fingerprint of honey for the next research. The study was started with incubation of the LB enriched honey samples and honey without LB samples at variation time of 0, 24, 48, and 72 hours. Following the incubation process, the DNA metagenomic form both LB enriched and unenriched honey samples were isolated with direct cell lysis method. The DNA obtained was analyzed by spectrophotometer UV-Vis and agarose gel electrophoresis. The result showed that DNA metagenomic can be isolated from LB enriched honey and without LB enriched honey samples. Analysis using the agarose gel electrophoresis indicated that the metagenomic DNA obtained from both honey samples was still contaminated with RNA. The purity ratio of metagenomic DNA from both honey samples analysed using UV-Vis Spectrophotometer at λ 260/280 nm was between 1.2 to 1.6. This ratio suggested that the metagenomic DNA isolated from both samples were contaminated with protein and fenol.
Keywords : Honey, DNA, Metagenomic
PENDAHULUAN manfaatnya. Hal ini disebabkan oleh dalam madu
terdapat kandungan gizi yang melimpah, mulai Madu merupakan salah satu bahan dari karbohidrat, protein, asam amino, vitamin, makanan yang sangat istimewa dilihat dari segi
dekstrin, pigmen tumbuhan, komponen aromatik serta kandungan berbagai enzim.
Keadaan alam di Indonesia sangat cocok untuk usaha peternakan lebah karena sangat kaya akan ragam tanaman berbunga. Hal ini memungkinkan produksi madu di Indonesia dapat terjadi sepanjang tahun (Nuryati, 2006). Madu asli yang dihasilkan masing-masing daerah memiliki kualitas, keunikan, serta ciri khas yang berbeda-beda. Hal ini tentu menimbulkan peluang dilakukannya pemalsuan madu dari daerah tertentu yang pasarannya lebih tinggi. Berdasarkan hal tersebut, karakteristik spesifik yang dimiliki madu dari masing-masing daerah sangat penting untuk digali. Salah satu caranya adalah dengan mengembangkan berbagai teknik sidik jari (fingerprint) yang secara khas dapat mencirikan profil dari suatu bahan atau produk makanan dan minuman, seperti madu.
Iurlina dan Fritz (2005) pernah mengkarakterisasi madu dari Argentina yang berasal dari berbagai sumber. Mereka menemukan sejumlah mikroorganisme yang ada dalam sampel madu, seperti Bacillus cereus, Bacillus pumilus dan Bacillus laterosporus. Keberadaan berbagai macam mikroorganisme di dalam madu kemungkinan membentuk suatu biodiversitas. Jika ditinjau dari jenisnya, madu dari masing-masing daerah diduga memiliki perbedaan biodiversitas mikroorganisme. Hal ini memberikan sebuah peluang bahwa dengan memanfaatkan biodiversitas mikroorganisme dalam madu, maka dapat diketahui pola sidik jari (fingerprint) DNA dari madu yang dihasilkan dari daerah tertentu.
Metagenomik merupakan suatu langkah baru dalam analisis genom dengan cara mengisolasi DNA genom secara langsung dari sampel atau lingkungan tertentu (Handelsman, 2004). Pada penelitian ini akan dilakukan isolasi DNA metagenomik dari sampel madu dengan pengayaan media tumbuh mikroorganisme LB (Luria-Bertani) serta variasi waktu sebagai penelitian awal dalam rangka penelitian tahapan berikutnya yang bertujuan untuk menentukan sidik jari DNA metagenomik pada madu.
MATERI DAN METODE
Bahan
Bahan penelitian yang digunakan adalah madu (masih segar/baru dipanen) yang diperoleh di Desa Seraya Tengah, Kecamatan Karangasem, Kabupaten Karangasem, Bali. Bahan-bahan kimia yang digunakan adalah, Na2EDTA.2H2O, SDS, Tris-Cl, fenol, isoamil alkohol, kloroform, Na-asetat, isopropanol, etidium bromida, etanol, basa Tris, agarosa, asam asetat glasial, loading bufer 1x [loading bufer 6x : bromophenol blue 0,25% (b/v) dan sukrosa 40% (b/v)], aquades steril, NaCl, yeast extract, dan bacto triptone.
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah pipet volum, pipet tetes, gelas beaker, gelas ukur, labu ukur, Erlenmeyer, tabung reaksi, batang pengaduk, kuvet, botol kaca, kertas indikator pH (Merck), bola hisap, spatula, glove (sarung tangan), botol semprot, mikro pipet, tip mikro biru (1000 μL), kuning (200 μL), putih (10 μL) dan tabung mikro 1,5 mL (Eppendorf), seperangkat alat elektroforesis horizontal (Mupid 2Plus), spektrofotometer UV-Vis Mini-1240 Single Beam Shimadzu, freezer, termometer, neraca analitik, autoklaf, vorteks, CentrifugeHettich EBA III, magnetic stirrer, UV Transiluminator Bioinstrument, High Speed Refrigeratored Micro Centrifuge TOMY MX-301.
Cara Kerja
Perlakuan madu dengan pengayaan media tumbuh mikroorganisme
Sebanyak 1 mL sampel madu dicampur dengan 1 mL media LB [NaCl 1% (b/v); yeast extract 0,5% (b/v); dan bacto triptone 1% (b/v)] dalam 4 buah tabung reaksi steril dan diinkubasi masing-masing dengan variasi waktu selama 0, 24, 48, dan 72 jam pada suhu 37oC. Sebanyak 1 mL sampel madu yang lain tanpa dicampur dengan media LB dan dimasukkan ke dalam 4 buah tabung reaksi steril dan dinkubasi dengan variasi waktu dan pada suhu yang sama seperti di atas. Semua perlakuan tersebut dilakukan ulangan tiga kali. Isolasi DNA metagenomik dengan lisis sel secara langsung (Metode Kuske et al., 1997)
Sebanyak 500 µL sampel madu ditambahkan 1000 µL bufer TENS (50 mM Tris, pH 8,0; 20 mM Na2EDTA; 0,1 M NaCl; SDS 1% [b/v]) dan divorteks 1 menit. Sampel diinkubasi di
dalam penangas air pada suhu 100oC selama 10 menit, kemudian disentrifugasi pada 10.000 x g selama 10 menit. Sebanyak 500 µL supernatan yang didapat disimpan dahulu. Pelet madu diresuspensi pada 500 µL bufer TEN (50 mM Tris, pH 8,0; 20 mM Na2EDTA; 0,1 M NaCl). Campuran tersebut ditempatkan dalam pendingin (freezer) pada suhu -20oC selama 10 menit dan segera dimasukkan ke dalam penangas air dengan suhu 100oC selama 1 menit, kemudian dipindahkan kembali ke dalam pendingin (thermal shock). Langkah thermal shock dilakukan sebanyak tiga set. Supernatan yang dihasilkan dari proses ini diambil sebanyak 250 µL kemudian digabung dengan supernatan yang telah disimpan pada proses sebelumnya yang akan digunakan untuk tahap selanjutnya.
Ekstraksi DNA metagenomik dari hasil lisis sel
Supernatan dari hasil lisis sel di atas ditambahkan fenol-kloroform-isoamil alkohol (25:24:1) sebanyak 1 kali volume, dan dicampur dengan cara membolak-balikan tabung 4-6 kali. Selanjutnya, campuran ini disentrifugasi selama 10 menit dengan kecepatan 5000 x g dan supernatannya diambil. Supernatan ditambahi isopropanol dingin sebanyak 1 kali volume dan natrium asetat 3 M sebanyak 0,1 kali volume. Campuran dibolak-balikkan 4-6 kali kemudian didinginkan pada suhu -20oC selama 2 jam. Selanjutnya campuran tersebut diambil dari pendingin, dan setelah cair disentrifugasi selama 10 menit dengan kecepatan 9.100 x g, dan peletnya dicuci 1 kali dengan 50 µL etanol dingin 95% (v/v), kemudian disimpan dalam pendingin -20oC selama 15 menit lalu disentrifugasi selama 15 menit pada kecepatan 9.100 x g. Peletnya dikeringkan dengan cara sentrifugasi vakum. Pelet DNA diresuspensi dalam 25 μL bufer TE 10/0,1 (10 mM Tris-HCl; 0,1 mM EDTA; pH 8,0). Isolat DNA dianalisis secara elektroforesis gel agarosa dan spektrofotometri UV-Vis pada panjang gelombang (λ) 260 dan 280 nm.
HASIL DAN PEMBAHASAN
Hasil yang dapat diamati adalah sampel madu yang diberi perlakuan tanpa pengayaan media pada inkubasi 0, 24, 48, dan 72 jam tidak memberikan perubahan yang dapat teramati,
sedangkan sampel madu yang diberi pengayaan media dan inkubasi memberikan perubahan hanya pada sampel madu dengan media LB yang diinkubasi selama 72 jam. Perubahan yang dapat diamati adalah terdapatnya materi putih diatas campuran madu dan media LB. Materi putih yang terdapat pada sampel madu belum dapat dipastikan sebagai koloni mikroba yang telah tumbuh karena belum dilakukan pemeriksaan untuk memastikan kebenaran mikroba tersebut seperti pemeriksaan dengan menggunakan mikroskop.
Hasil Tahapan Lisis Sel
Penelitian ini menggunakan metode lisis sel secara langsung, yaitu metode Kuske et al., (1997). Penelitian diawali dengan penambahan bufer TENS pada sampel madu yang telah diberi perlakuan. Bufer TENS merupakan bufer dengan komposisi Tris-Cl, EDTA, NaCl, dan SDS yang berfungsi untuk melisis sel serta jaringan mikroorganisme yang diduga terdapat pada sampel madu. Kandungan Tris pada larutan pelisis berfungsi untuk menyangga pH larutan tetap 8,0. EDTA yang terkandung dalam bufer TENS digunakan untuk menstabilkan membran sel yang memiliki kation-kation divalen seperti kalsium dan magnesium dengan cara mengikat kation-kation tersebut. NaCl dalam bufer TENS dapat mempermudah terjadinya pemekatan dan pengumpulan massa DNA. SDS yang terdapat pada bufer TENS bertindak sebagai detergen, yaitu sebagai pelarut molekul hidrofobik dan hidrofilik pada membran sel.
Penambahan madu dengan bufer TENS tidak langsung membuat madu dapat larut. Hal ini dapat diakibatkan karena viskositas dari madu lebih besar dibandingkan bufer TENS, sehingga tahap vortek sangat penting dilakukan untuk menghomogenkan madu dengan bufer TENS, agar proses lisis sel dapat berlangsung yang ditandai dengan perubahan viskositas campuran. Proses lisis sel ini ditandai dengan terjadinya penurunan viskositas larutan sesuai dengan pernyataan Sambrook et al., (1989).
Campuran kemudian diberi pemanasan dengan suhu 100oC. Pemanasan bertujuan untuk memaksimalkan terjadinya lisis sel oleh bufer lisis. Hasil yang dapat teramati adalah campuran tidak menunjukkan adanya tanda-tanda perubahan, baik perubahan fisik pada ataupun perubahan warna.
Tahap lisis dilanjutkan dengan proses sentrifugasi, yang bertujuan untuk memisahkan campuran larutan berdasarkan berat jenisnya. Endapan yang dihasilkan dapat merupakan sisa-sisa dari sarang lebah karena madu didapatkan dari pemerasan sarang lebahnya langsung, atau dapat merupakan debris sel dan mengendap sebagai pelet berwarna kekuningan setelah disentrifugasi. Keberadaan DNA pada tahap ini diasumsikan berada pada lapisan supernatan karena DNA bersifat polar, sehingga supernatan yang dihasilkan diambil sebanyak 500 µL dan disimpan terlebih dahulu.
Larutan yang tersisa kembali dilisis sel dan diberi perlakuan thermal shock. Langkah thermal shock merupakan teknik lisis secara fisik. Thermal shock dilakukan karena pada tahap lisis sel awal telah dilakukan lisis sel secara kimia dengan bufer lisis, sehingga thermal shock berfungsi untuk memecahkan sel yang belum pecah saat lisis sel secara kimia. Supernatan yang dihasilkan setelah tahap thermal shock diambil sebanyak 250 µL dan digabung dengan supernatan pada tahap sebelumnya.
Hasil Tahapan Ekstraksi DNA Metagenomik
Tahap ekstraksi diawali dengan pemberian larutan fenol: kloroform: isoamil alkohol pada supernatan. Pelarut organik ini berfungsi untuk mendenaturasi protein. Fenol berfungsi melarutkan protein, lipid, dan molekul lain seperti polisakarida, sedangkan kloroform-isoamil alkohol berperan untuk mendenaturasi protein yang telah terlarutkan oleh fenol tersebut (Sambrook, et al., 1989), tetapi DNA dan RNA tidak terdenaturasi karena tidak larut dalam pelarut organik seperti kloroform. Campuran pelarut organik ini menyebabkan pengendapan protein, tetapi asam nukleat (DNA dan RNA) tetap berada pada larutan.
Ekstraksi dilanjutkan dengan penambahan isopropanol dingin dan natrium asetat pada supernatan. DNA secara umum dapat diendapkan dengan penambahan isopropanol dingin dan natrium asetat (Sambrook, et al., 1989). Pada penelitian ini, penyimpanan pada suhu -20oC dilakukan selama 24 jam untuk mempercepat pemisahan/pengendapan DNA.
Setelah disentrifugasi, campuran tetap menyatu dan menghasilkan endapan kuning di
bagian bawah tabung. Penambahan etanol yang dilakukan tidak membuat endapan kuning yang menempel pada dasar tabung larut. Pencucian dengan etanol dilakukan agar DNA total bebas dari kontaminan protein dan sisa fenol yang masih ada pada endapan DNA.
Setelah sentrifugasi, tabung divakum untuk menguapkan etanol. Endapan kuning tetap menempel di tabung yang telah divakum, namun lebih tipis dari sebelumnya.
Pemberian bufer TE pada endapan sebagai pelarut DNA tidak membuat endapan larut dan bufer TE tetap berwarna bening. Tidak larutnya endapan dengan pemberian bufer TE yang terlihat belum dapat dijadikan acuan tidak berhasilnya DNA diisolasi karena belum adanya referensi yang mendukung hal tersebut, khususnya untuk sampel madu, sehingga analisis secara elektroforesis dan spektrofotometri akan memastikan berhasil tidaknya isolasi DNA yang dilakukan. .
Hasil Analisis DNA dengan Elektroforesis Gel Agarosa
Proses elektroforesis akan menghasilkan elektroforegram yang dapat memberikan informasi tentang bentuk pita yang dihasilkan DNA, pergerakan DNA, terdegradasi atau tidaknya DNA, serta konsentrasi DNA total secara semi-kuantitatif (Sambrook, et al., 1989). DNA total dengan keadaan utuh umumnya memperlihatkan bentuk pita yang lebar, besar, berekor, dan memiliki jarak migrasi yang tidak jauh dari sumur gel, sedangkan DNA total yang terfragmentasi serta terkontaminasi RNA umumnya memberikan pendaran tebal dan tidak tajam pada bagian bawah gel agarosa (Sambrook et al., 1989).
Pada penelitian ini, kontrol yang digunakan adalah DNA yang diisolasi dari tanah yang menunjukkan pita DNA lebar dan jarak migrasi yang tidak jauh dari sumur gel, sedangkan untuk semua sampel madu yang diberi perlakuan menunjukkan hasil bahwa DNA terfragmentasi dan masih terkontaminasi dengan RNA, karena semua pita-pita DNA yang dihasilkan oleh 8 sumur gel menunjukkan terjadinya pendaran yang tebal dan tidak tajam pada bagian bawah. Pada sumur no. 2-5, terdapat pita DNA di dekat sumur-sumur gel yang telah bermigrasi, namun tidak terlalu jelas (semir) dan bentuknya memanjang. Hal ini menunjukkan bahwa adanya DNA total
dalam keadaan tidak utuh. Khusus untuk sampel madu tanpa media LB dan waktu inkubasi 0 jam pada sumur no. 2 terlihat adanya pita DNA pada bagian tengah gel namun bentuknya tidak utuh. Jarak migrasi DNA yang dihasilkan sampel madu tanpa media LB dengan waktu inkubasi 0 jam pada sumur no. 2 lebih jauh dibandingkan jarak migrasi DNA pada sumur no. 3-5. Pada sumur no. 6-9 juga memperlihatkan adanya pita DNA yang telah bermigrasi di dekat sumur-sumur gel dengan bentuk memanjang namun tidak terlihat terlalu jelas (semir) yang menunjukkan keberadaan DNA total dalam keadaan tidak utuh. Selain itu, migrasi DNA yang dihasilkan sampel madu dengan media LB serta inkubasi 0 jam pada sumur no. 6 menghasilkan pergerakan yang lebih jauh dibandingkan migrasi DNA pada sumur no. 7-9. Pada sumur no. 7, pendaran DNA yang dihasilkan paling tipis dibandingkan pendaran DNA pada sumur lainnya. Hal ini menunjukkan bahwa konsentrasi DNA totalnya lebih kecil dibandingkan konsentrasi DNA total pada sumur lainnya. Tebal dan tipisnya pendaran yang dihasilkan DNA pada gel dapat menunjukkan konsentrasi DNA total secara semi-kuantitatif (Sambrook et al., 1989). Berdasarkan hasil elektroforegram yang diperoleh, menunjukkan bahwa DNA yang berhasil diisolasi kemungkinan
bukan DNA yang berasal dari mikroba tetapi DNA yang berasal dari sel tumbuhan atau sel hewan. Hal ini disebabkan karena tidak adanya pengaruh pemberian perlakuan pada madu dengan dan tanpa media LB serta pemberian inkubasi terhadap peningkatan atau penurunan konsentrasi DNA total pada gel elektroforesis. Tetap ada kemungkinan keberadaan mikroba pada madu, namun tidak bisa berkembang biak atau dalam keadaan telah mati.
Hasil Analisis DNA secara Spektrofotometri
Pada penelitian ini, larutan hasil isolasi DNA total diambil sebanyak 4 µL dan diencerkan 50x dengan bufer TE 10/0,1 pH 8 hingga volume totalnya 200 µL. Hasil serapan masing-masing sampel pada panjang gelombang (λ) 260 dan 280 nm seperti pada Tabel 1.
Pada penelitian ini ternyata terjadi pergeseran nilai absorbansi maksimal. Absorbansi maksimal yang diberikan sampel DNA bukan berada pada panjang gelombang (λ) 260 nm, namun berada pada panjang gelombang (λ) 257 nm. Pergeseran nilai absorbansi maksimal yang terjadi pada penelitian ini kemungkinan disebabkan karena pengaruh DNA yang masih mengandung kontaminan, serta pengaruh ikatan terkonjugasi yang terdapat pada basa purin dan pirimidin.
1 2 3 4 5 6
7 8 9
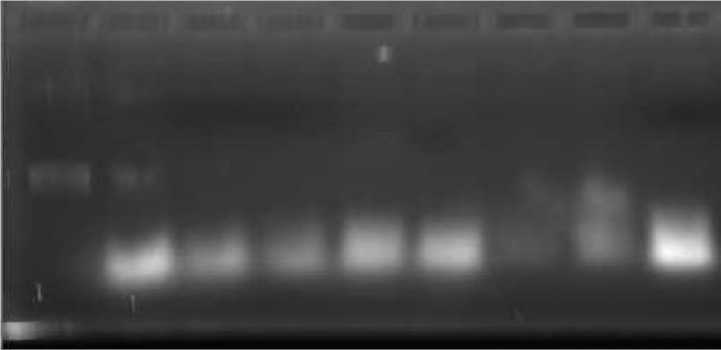
Gambar 1. Hasil elektroforegram dari sampel madu, (1) Kontrol DNA tanah, (2-5) Madu tanpa LB pada Inkubasi 0, 24, 48, dan 72 jam, (6-9) Madu dengan LB pada Inkubasi 0, 24, 48, dan 72 jam
Tabel 1. Data Absorbansi Sampel Madu dan Rasio
Kemurnian DNA
|
NO |
Perlakuan |
Absorban | ||
|
λ260 |
λ280 |
Rasio λ260/280 | ||
|
1 |
MW0 |
0,226 |
0,177 |
1,277 |
|
MW1 |
0,287 |
0,200 |
1,435 | |
|
MW2 |
0,361 |
0,249 |
1,450 | |
|
MW3 |
0,463 |
0,344 |
1,346 | |
|
2 |
LBMW0 |
0,544 |
0,333 |
1,634 |
|
LBMW1 |
0,354 |
0,263 |
1,346 | |
|
LBMW2 |
0,341 |
0,230 |
1,483 | |
|
LBMW3 |
0,269 |
0,191 |
1,408 | |
Keterangan :
MWx = Madu dengan pemberian inkubasi
LBMWx = Madu dengan pemberian media LB dan Inkubasi
0, 1, 2, 3 = waktu inkubasi 0 jam, 24 jam, 48 jam, dan 72 jam
masih terdapatnya kontaminasi protein, seharusnya pada panjang gelombang (λ) 280 nm juga membentuk sedikit puncak. Tidak didapatkannya hasil tersebut pada penelitian ini dapat disebabkan karena konsentrasi protein masih dapat tertutupi oleh konsentrasi DNA, karena apabila dengan keberadaan protein pada sampel DNA menghasilkan puncak yang dapat dengan jelas terlihat pada spektrumnya, maka rasio kemurnian dari DNA yang dihasilkan pada penelitian ini akan menjadi lebih kecil.
Konsentrasi DNA belum dapat ditentukan karena pada penelitian ini rasio kemurnian DNA yang dihasilkan sampel madu masih kurang dari 1,8 – 2,0 yang menunjukkan DNA belum dalam keadaan murni seperti pembahasan diatas. DNA hasil isolasi masih terkontaminasi RNA, protein, dan fenol.
SIMPULAN DAN SARAN
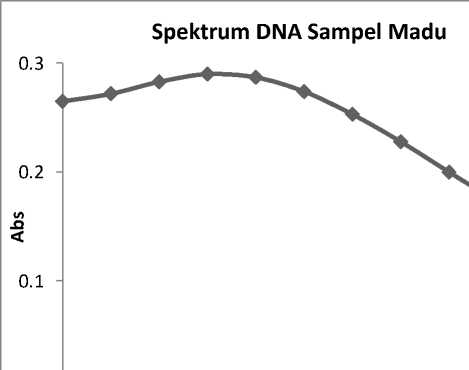
Kemurnian yang dihasilkan dari rasio A260/280 nm menunjukkan bahwa DNA yang diperoleh belum dalam keadaan murni karena rasio kemurnian yang dihasilkan dari sampel yang telah diberi perlakuan yaitu berkisar antara 1,2 – 1,6. Menurut Boyer (1993), rasio A260/280 nm untuk DNA murni berkisar antara 1,8 – 2,0.
Spektrum yang dihasilkan dari isolat DNA sampel madu pada penelitian ini secara umum memberikan gambaran seperti Gambar 2., namun karena rasio kemurnian yang dihasilkan sampel madu kurang dari 1,8 – 2,0 yang menandakan
Simpulan
Pada penelitian ini, DNA metagenomik berhasil diisolasi langsung dari madu yang diberi perlakuan dengan dan tanpa media LB dengan rasio kemurnian yang dihasilkan dari A260/280 nm adalah kurang dari 1,8.
Saran
Perlu dilakukan penelitian lebih lanjut dengan menggunakan metode lain atau memodifikasi metode yang digunakan pada penelitian ini dalam jumlah sampel yang lebih besar untuk meningkatkan kuantitas DNA yang diperoleh, serta untuk menghasilkan DNA dengan kemurnian yang lebih tinggi. Selain itu, hasil isolasi DNA metagenomik dari madu pada penelitian ini selanjutnya disarankan untuk dianalisis dengan teknik PCR (Polymerase Chain Reaction) dalam rangka penelitian lebih lanjut yang berpotensi sebagai sidik jari madu.
UCAPAN TERIMA KASIH
Terima kasih penulis ucapkan kepada Ni Luh Rustini S.Si., M.Si., dan Drs. I Gusti Agung Gede Bawa, M.Si. atas saran dan masukannya,
serta kepada semua pihak yang telah membantu terlaksananya penelitian ini.
DAFTAR PUSTAKA
Boyer, R., 1993, Modern Experimental
Biochemistry 2nd Edition, Benjamin/Cummings Publishing Company Inc., California
Handelsman J., 2004, Metagenomics: Application of Genomics to Uncultured Microorganisms, Microbiol. Mol. Biol. Rev., 68 : 669-685
Iurlina, M. O. and Fritz R., 2005, Characterization of microorganisms in Argentinean honeys from different sources, International
Journal of Food Microbiology, 105 : 297304
Kuske, C.R., Barns, S.M., dan Busch, J.D., 1997, Diverse Uncultivated Bacterial Groups from Soils of the Arid Southwestern United States That Are Present in Many Geographic Regions, Applied and Environmental Microbiology, 0099-2240 63 (9) : 3614-3621
Nuryati, S., 2006, Status dan Potensi Pasar Madu Organis Nasional dan Internasional, Aliansi Organis Indonesia, Bogor
Sambrook J., Fritsch, E. F., and Maniatis, T., 1989, Molecular Cloning: A Laboratory Manual 2nd Ed, Could Spring Harbour Laboratory Press, USA
195
Discussion and feedback