PERBANDINGAN KUALITAS DNA DENGAN MENGGUNAKAN METODE BOOM ORIGINAL DAN BOOM MODIFIKASI PADA ISOLAT Mycobacterium tuberculosis 151
on
ISSN 1907-9850
PERBANDINGAN KUALITAS DNA DENGAN MENGGUNAKAN METODE BOOM ORIGINAL DAN BOOM MODIFIKASI PADA ISOLAT Mycobacterium tuberculosis 151
Dewi Andayani Farmawati1, I Nengah Wirajana2,3, dan Sagung Chandra Yowani1,3
1Jurusan Farmasi FMIPA Universitas Udayana, Bukit Jimbaran, Bali
2Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali 3Kelompok Studi MDR & XDR-TB FMIPA Universitas Udayana, Bukit Jimbaran, Bali Email : dewi.andayani20@gmail.com
ABSTRAK
Tuberkulosis (TB) merupakan penyakit yang disebabkan oleh bakteri Mycobacterium tuberculosis. Isolasi DNA adalah tahapan yang diperlukan untuk memperoleh DNA kromosomal bakteri yang akan digunakan dalam pendeteksian M. tuberculosis menggunakan Polymerase Chain Reaction (PCR). Metode Boom merupakan metode isolasi yang umum digunakan dalam isolasi DNA M. tuberculosis. Di Bali, proses isolasi DNA M. tuberculosis dilakukan di Laboratorium Biomolekuler FK UNUD menggunakan metode Boom modifikasi. Penelitian ini bertujuan untuk membandingkan kualitas DNA yang dihasilkan oleh metode Boom dan metode Boom modifikasi. Penelitian ini diawali dengan proses isolasi DNA menggunakan metode Boom dan metode Boom modifikasi untuk selanjutnya diamplifikasi dengan metode PCR. Deteksi produk PCR dilakukan dengan metode elektroforesis. Kualitas DNA ditentukan dengan ketebalan pita DNA hasil PCR dan analisis kemurnian dengan spektrofotometri UV-Vis. Hasil yang diperoleh menunjukkan bahwa kualitas DNA isolat Mycobacterium tuberculosis 151 yang dihasilkan pada metode Boom modifikasi (Laboratorium Biomolekuler FK UNUD) relatif lebih baik dibandingkan metode Boom original (Boom et al, 1990).
Kata kunci : Tuberkulosis, Mycobacterium tuberculosis, isolasi DNA, metode isolasi, kualitas DNA
ABSTRACT
Tuberculosis (TB) is a disease caused by the Mycobacterium tuberculosis. Isolation DNA is a necessary step to obtain the bacterial chromosomal DNA used in the Polymerase Chain Reaction (PCR). Boom isolation method is an isolation method commonly used in isolation DNA of M. tuberculosis. In Bali, the isolation DNA ofM. tuberculosis conducted at the Laboratory of Biomolecular FK UNUD uses boom modification method. This research aims to compare the quality of DNA produced by the Boom methods and Boom modification methods. This research was started with the isolation process using Boom method and Boom modification and subsequently amplified by PCR. Detection of PCR products was performed with electrophoresis method. DNA quality was determined by the thickness of bands DNA PCR product and purity analysis by spectrophotometry UV-Vis. The results obtained show that the quality of DNA Mycobacterium tuberculosis 151 isolate using Boom modification method (Laboratory of Biomolecular FK UNUD) is relatively better than Boom original methods (Boom et al, 1990)..
Keywords : Tuberculosis, Mycobacterium tuberculosis, DNA isolation, isolation method, DNA quality
PENDAHULUAN
Tuberkulosis (TB) merupakan salah satu penyakit yang telah lama dikenal dan sampai saat ini masih menjadi penyebab utama kematian di
dunia (Saptawati, et al., 2012). Penyakit ini disebabkan oleh Mycobacterium tuberculosis, yang penyebarannya melalui udara pada saat pasien tuberkulosis mengalami batuk atau bersin. (Amin, et al, 2011). Pada tahun 2011, secara global jumlah
kasus tuberkulosis diperkirakan terjadi 125 kasus per 100.000 penduduk. Lima negara dengan kejadian TB terbesar pada tahun 2011 adalah India (2,0-2,5 juta), China (0,9-1,1 juta), Afrika Selatan (0,4-0,6 juta), Indonesia (0,4-0,5 juta) dan Pakistan (0,3-0,5 juta). Dari data tersebut, Indonesia berada pada peringkat ke-4 dunia (WHO, 2012).
Berbagai teknik pemeriksaan telah dilakukan untuk mendeteksi adanya Mycobacterium tuberculosis, salah satunya yang relatif baru dan sedang populer adalah Polymerase Chain Reaction (PCR). Prinsip utama teknik ini adalah amplifikasi DNA bakteri sehingga deteksi dapat dilakukan (Jasaputra, et al., 2007). Identifikasi M. tuberculosis dengan teknik PCR dapat dilakukan dengan waktu yang relatif cepat yaitu 24 jam dan tidak memerlukan jumlah bakteri yang banyak. PCR memiliki spesifisitas, sensitifitas yang tinggi dan cepat untuk diagnosis penyakit infeksi. Proses identifikasi M. tuberculosis dengan teknik PCR memerlukan DNA kromosom dari bakteri itu sendiri sehingga perlu dilakukan proses isolasi untuk memperoleh DNA M. tuberculosis. Isolasi DNA merupakan langkah penting dari sampel klinis untuk diagnosis molekuler tuberkulosis dengan PCR (Aygan, 2006).
M. tuberculosis memiliki dinding sel yang terbuat dari struktur kompleks impermeable (tidak dapat ditembus) sehingga menyebabkan lisis sel menjadi sulit. Dinding sel yang tahan terhadap lisis mengganggu metode isolasi DNA konvensional (Amaro, et al, 2008). Akibatnya, sebagian besar prosedur isolasi yang sederhana dan umum digunakan menghasilkan kualitas DNA yang buruk serta jumlahnya sedikit (Amita, et al, 2002). Ada berbagai macam metode isolasi DNA, salah satunya metode Boom yang umum digunakan dalam isolasi DNA M. tuberculosis. Diagnosis terhadap M. tuberculosis khususnya di Bali sering dilakukan di Laboratorium Biomolekuler FK UNUD, dengan menggunakan metode Boom yang telah dimodifikasi. Perlu dilakukan suatu telaah mengenai kualitas DNA yang dihasilkan dari metode Boom yang dimodifikasi (Laboratorium Biomolekuler FK UNUD) terhadap metode Boom original (Boom, et al, 1990), sehingga nantinya dapat memberikan informasi mengenai metode mana yang dapat memberikan hasil kualitas terbaik
yang dapat digunakan dalam proses isolasi DNA M. tuberculosis.
MATERI DAN METODE
Bahan
Sampel yang digunakan dalam penelitian ini adalah isolat M. tuberculosis 151 yang diperoleh dari Instalasi Mikrobiologi Klinik Rumah Sakit Umum Pusat (RSUP) Sanglah Denpasar. Larutan pelisis L6 (GuSCN, Tris-HCl, EDTA dan Triton-X), buffer L2 (GuSCN, Tris-HCl), buffer Tris-EDTA (TE) pH 8, suspensi diatom, etanol 70%, aseton, aquades steril, agarosa, etidium bromida, dan Tris-Borat-EDTA (TBE) 1x, marker 100 pb (Invitrogen).
Peralatan
Peralatan yang digunakan dalam penelitian ini adalah inkubator, vorteks, shaker rotatory, satu set pipet mikro, tabung mikro 1,5 mL, Sorvall Biofuge Primo R Centrifuge, lemari pendingin, Biological Safety Cabinet Class II, thermalcycler (Applied Biosystems), Eppendorf Microfuge, horizontal elektroforesis (Power Pac Basic™, USA), Gel Doc (Bio-Rad), Spektrofotometer UV-Vis (Pharmacia Biotech), autoklaf dan alat-alat gelas.
Cara Kerja
Isolasi DNA
Metode Boom Original (Boom et al, 1990)
Metode Boom merupakan metode yang dilakukan pertama kali oleh Boom et al (1990). Proses isolasi DNA dilakukan dengan cara sebanyak 50 µL sampel isolat M. tuberculosis ditambahkan dengan 900 µL buffer lisis L6 dan 40 µL suspensi diatom. Larutan tersebut divorteks dengan segera ± 5 detik. Tabung didiamkan selama 10 menit pada suhu ruangan, kemudian tabung reaksi divorteks kembali (5 detik) dan disentrifugasi (15 detik) dalam Eppendorf microfuge dengan kecepatan 12.000 x g. Supernatan yang diperoleh dibuang.
Pelet yang diperoleh dicuci dengan penambahan 1 mL buffer L2, divorteks, disentrifugasi dengan kecepatan 12.000 x g selama 15 detik. Supernatan yang diperoleh dibuang, diambil peletnya (proses ini dilakukan sebanyak 2
kali). Selanjutnya pelet ditambahkan 1 mL dengan etanol 70% (v/v), divorteks, disentrifugasi dengan kecepatan 12.000 x g selama 15 detik. Supernatan yang diperoleh dibuang, diambil peletnya (proses ini dilakukan sebanyak 2 kali). Pelet ditambahkan 1 mL aseton ke dalam tabung, divorteks, disentrifugasi dengan kecepatan 12.000 x g selama 15 detik. Supernatan yang diperoleh dibuang, diambil peletnya.
Setelah asetonnya dibuang, tabung reaksi dikeringkan pada suhu 56ºC dengan penutup dalam keadaan terbuka dan dipanaskan selama 10 menit. Buffer elusi (buffer TE pH 8) ditambahkan dan tabung reaksi ditutup, divorteks dengan cepat dan diinkubasi selama 10 menit pada suhu 56ºC. Tabung reaksi divorteks dengan cepat dan disentrifugasi selama 2 menit pada kecepatan 12.000 x g dan supernatan yang mengandung DNA dapat digunakan. Proses ini dilakukan di dalam Biological Safety Cabinet Class II.
Metode Boom Modifikasi (Laboratorium Biomolekuler FK UNUD, unpublished)
Metode ini merupakan metode yang dilakukan di Laboratorium Biomolekuler FK UNUD yang belum dipublikasikan. Pada metode ini telah dilakukan beberapa modifikasi dari metode Boom yang dikerjakan oleh Boom, et al (1990). Modifikasi dilakukan pada beberapa tahap yaitu jumlah isolat, jumlah buffer, kecepatan dan waktu sentrifugasi serta cara dan waktu pengeringan pelet. Sebanyak 100 µL sampel dan 40 µL suspensi diatom dimasukkan ke dalam tabung mikro yang berisi 1 mL buffer L6. Divorteks hingga homogen kemudian dikocok menggunakan shaker dengan kecepatan 100 rpm selama 15 menit. Larutan disentrifugasi selama 1 menit dengan kecepatan 12.000 rpm dan supernatan yang diperoleh dibuang sehingga diperoleh pelet.
Pelet ditambahkan dengan washing buffer L2 sebanyak 0,5 mL dan disentrifugasi selama 1 menit dengan kecepatan 12.000 rpm. Supernatan yang diperoleh dibuang kembali (langkah tersebut diulangi 1 x). Pelet dicuci dengan etanol 70% sebanyak 1 mL, disentrifugasi selama 1 menit dengan kecepatan rpm, kemudian supernatan dibuang kembali. Pelet dicuci kembali dengan aseton sebanyak 1 mL, disentrifugasi selama 1 menit dengan kecepatan rpm, kemudian supernatan dibuang. Pelet dikeringkan dalam waterbath suhu
56ºC selama 10 menit. Aquades steril ditambahkan sebanyak 50 µL, divorteks, kemudian diinkubasi selama 10 menit pada suhu 56ºC. Divorteks kembali dan kemudian disentrifugasi selama 5 menit dengan kecepatan 12.000 rpm. Suspensi dipipet dan dipindahkan ke dalam tabung mikro steril baru sehingga diperoleh DNA kromosomal. Proses ini dilakukan di dalam Biological safety cabinet class II.
Proses amplifikasi DNA dengan metode PCR
Proses amplifikasi dilakukan menggunakan alat thermalcycler (Applied Biosystems) dengan menggunakan sepasang primer oligonukleotida yaitu terdiri atas primer forward (mabA-inhA-promoter-FS) dengan urutan 5’ACATACCTGCTGCGCAAT3’ dan primer reverse (mabA-inhA-promoter-R) dengan urutan yaitu 5’CTCCGGTAACCA GGACTGAA3’ (Chen et al., 2011). Proses ini teriri dari beberapa tahap, yaitu dengan denaturasi awal pada 95°C selama 15 menit, 45 siklus amplifikasi yang terdiri dari denaturasi selama 1 menit pada 94°C, annealing selama 1 menit 20 detik pada 54°C, dan elongasi selama 1 menit 10 detik pada 72°C. Tahap akhir amplifikasi adalah elongasi akhir pada 72°C selama 10 menit.
Deteksi produk PCR dengan metode Elektroforesis
Produk PCR dianalisis dengan elektroforesis gel agarosa 1,5% b/v. Sebanyak 3 µL sampel hasil PCR dan 3 µL DNA ladder 100 pb dimasukkan ke dalam sumur yang terbentuk dari sisir. Kemudian dielektroforesis dengan running buffer TBE (Tris-Boric Acid-EDTA) 1x pada tegangan 65 volt selama 35 menit. Hasil elektroforesis kemudian divisualisasi pada alat UV Transiluminator (Gel Doc).
Analisis Kemurnian
Deteksi kemurnian DNA hasil isolasi pada kedua metode dilakukan dengan menggunakan metode spektrofotometri UV-Vis. Sampel dianalisis pada dua panjang gelombang yaitu pada panjang gelombang 260 nm dan 280 nm dengan menggunakan aquadest sebagai blanko sehingga akan diperoleh nilai absorbansinya. Nilai absorbansi sampel pada panjang gelombang 260 nm dan 280 nm dibandingkan sehingga akan diperoleh rasio Absorbansi λ260/Absorbansi λ280.
HASIL DAN PEMBAHASAN
Pada penelitian ini menggunakan sampel isolat Mycobacterium tuberculosis 151 yang diperoleh dari Instalasi Mikrobiologi Klinik Rumah Sakit Umum Pusat (RSUP) Sanglah Denpasar. Sampel terlebih dahulu disubkultur pada media Lowenstein-Jensen (LJ) dan diinkubasi pada suhu 37ºC selama 3 minggu. Metode isolasi DNA yang pertama kali dilakukan dalam penelitian ini adalah metode Boom original (Boom, et al, 1990), yang kemudian diikuti oleh metode isolasi DNA Boom modifikasi (Laboratorium Biomolekuler FK UNUD). Setiap metode dilakukan pengulangan sebanyak 3 kali.
Isolasi DNA merupakan langkah penting dari sampel klinis untuk diagnosis molekuler tuberkulosis dengan PCR (Aygan, 2006). Prinsip dasar isolasi DNA adalah serangkaian proses untuk memisahkan DNA dari komponen-komponen lainnya yang harus dilakukan dengan baik dan bebas dari kontaminasi sehingga diperoleh DNA hasil isolasi dengan kualitas yang baik (Tenriulo, et al., 2001). Salah satu metode yang umum digunakan dalam isolasi M. tuberculosis adalah metode Boom. Prinsip dari metode Boom yaitu didasarkan pada melisiskan dan menonaktifkan nuklease dari agen chaotropic guanidinium tiosianat bersama dengan sifat ikatan asam nukleat pada partikel silika atau diatom dengan adanya agen ini (Boom, et al, 1990). Proses isolasi metode Boom original dengan metode Boom modifikasi hampir sama, namun terdapat beberapa perbedaan perlakuan baik dalam jumlah larutan, waktu sentrifugasi, proses pencucian DNA dan larutan pensuspensi DNA yang digunakan.
Proses isolasi DNA dengan menggunakan metode Boom dilakukan dengan menggunakan larutan buffer lisis L6 yang terdiri dari Tris-HCl, GuSCN (Guanidine tiosianat), EDTA dan Triton-X-100. Buffer lisis L6 mengandung GuSCN sebagai chaotropic agent yang melisis sel pada sampel sehingga akan mengeluarkan DNA. GuSCN dalam konsentrasi tinggi mengakibatkan DNA akan terikat pada diatom (fosil dari dinding sel alga uniseluler) yang akan diendapkan dengan proses sentrifugasi. EDTA (Ethylenediamine Tetraacetic Acid) akan membentuk kompleks (chelate) dengan ion logam seperti Mg2+ yang merupakan kofaktor DNAase. EDTA berfungsi
sebagai perusak sel dengan cara mengikat ion magnesium (ion ini berfungsi untuk mempertahankan aktifitas enzim nuklease yang merusak asam nukleat). Triton X-100 (nonionic detergent) merupakan sejenis deterjen yang berfungsi merusak membran sel dan menyebabkan pecahnya kromosom. Suspensi diatom ditambahkan bertujuan untuk pengikatan DNA (Lina, et al., 2007; Faatih, 2009; Tenriulo, et al., 2001). Larutan tersebut divorteks untuk menghomogenkan larutan kemudian dilakukan sentrifugasi. Prinsip utama sentrifugasi adalah memisahkan substansi berdasarkan berat jenis molekul dengan cara memberikan gaya sentrifugal sehingga substansi yang lebih berat akan berada di dasar, sedangkan substansi yang lebih ringan akan terletak di atas (Faatih, 2009). DNA pada saat sentrifugasi akan berada pada pelet DNA karena DNA terikat pada diatom, sehingga pada proses ini bagian pelet diambil sedangkan supernatannya dibuang.
Pelet DNA yang diperoleh selanjutnya dicuci dengan menggunakan washing buffer (buffer L2) dan etanol 70% yang bertujuan untuk membersihkan DNA dari pengotor-pengotornya. Selain digunakan dalam tahap pencucian DNA, etanol 70% juga digunakan untuk presipitasi DNA bersama dengan aseton. Larutan divorteks, disentrifugasi dan diambil kembali bagian peletnya. Langkah akhirnya adalah dengan pemberian Tris-EDTA yang bertujuan untuk melarutkan kembali DNA untuk dipreservasi. (Faatih, 2009; Lina, et al., 2007). Pada metode Boom modifikasi digunakan aquadest steril untuk melarutkan DNA kembali. Penggunaan buffer TE atau aquadest steril ini memiliki fungsi sebagai pengelusi agar DNA terlepas dari diatom dan berada pada supernatan, sehingga tahap akhir diambil supernatan yang mengandung DNA. DNA ini selanjutnya akan digunakan sebagai DNA template pada proses amplifikasi dengan metode PCR untuk kemudian dideteksi menggunakan metode elektroforesis.
Analisis kualitas DNA dapat dilihat dari pita elektroforegram DNA hasil PCR kedua metode dengan mengamati ketebalan dan ketajaman pitanya. Selain itu, kualitas DNA juga ditentukan dengan analisis kemurnian DNA hasil isolasi pada kedua metode yang dilakukan menggunakan metode spektrofotometri UV-Vis
dengan melihat rasio Absorbansi λ260/Absorbansi λ280.
Berdasarkan hasil elektroforegram Gambar 1. menunjukkan bahwa pita DNA produk PCR menggunakan metode Boom modifikasi menghasilkan pita yang relatif lebih tebal dan tajam dibandingkan dengan pita DNA produk PCR menggunakan metode Boom original. Hal ini menandakan bahwa kualitas DNA yang dihasilkan oleh metode Boom modifikasi relatif lebih baik dibandingkan dengan DNA yang dihasilkan oleh metode Boom original.
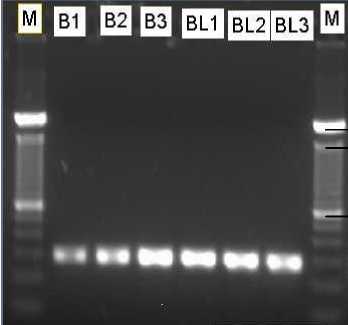
600
pb
2072
1500
Keterangan: M=Marker DNA ladder 100 pb, B1-
B3=metode Boom original, BL1-BL3=metode Boom modifikasi
Gambar 1. Elektroforegram DNA produk PCR M. tuberculosis 151 dengan 3 kali pengulangan
Tabel 1. Kemurnian DNA hasil isolasi M. tubercu-losis 151 dengan 3 kali pengulangan
Sampel 151
|
Pengu- |
Metode Boom |
Metode Boom modifikasi |
|
Langan |
Kemurnian |
Kemurnian |
|
Rasio |
Rasio | |
|
Aλ260/A λ280) |
A λ260/A λ280 | |
|
1 |
1,464 |
1,979 |
|
2 |
1,819 |
1,801 |
|
3 |
1,489 |
2,573 |
Kemurnian DNA yang baik dilihat dari hasil rasio A λ260/A λ280 sebesar 1,8-2,0 (Sambrook
and Russell, 2001). Berdasarkan hasil nilai rasio Absorbansi λ260 nm/Absorbansi λ280 nm DNA hasil isolasi pada isolat M. tuberculosis 151, diperoleh hasil 2 sampel pada metode Boom modifikasi memiliki nilai rasio kemurnian di antara 1,8-2,0 sedangkan pada metode Boom hanya 1 sampel yang berada dalam rentang nilai kemurnian. Hal ini menunjukkan bahwa kemurnian DNA yang dihasilkan oleh metode Boom modifikasi relatif lebih murni dibandingkan dengan DNA yang dihasilkan metode Boom. Nilai rasio absorbansi di bawah 1,8 menunjukkan adanya kontaminasi protein dan polisakarida (Rosilawati, 2002). Apabila DNA hasil isolasi terkontaminasi oleh fenol rasio A260/A280 lebih besar dari 2,0. Hal ini dapat terjadi karena fenol memiliki serapan maksimal di panjang gelombang 270 nm dan mampu memberi sumbangan kecil serapan di panjang gelombang 260 nm (Wirajana et al., 2013).
Berdasarkan kedua parameter yang telah dijabarkan, maka dapat dikatakan metode Boom modifikasi (Laboratorium Biomolekuler FK UNUD) menghasilkan kualitas DNA isolat Mycobacterium tuberculosis 151 yang relatif lebih baik dibandingkan dengan metode Boom original (Boom, et al, 1990).
SIMPULAN DAN SARAN
Simpulan
Dalam mengisolasi DNA pada isolat Mycobacterium tuberculosis 151, metode Boom modifikasi (Laboratorium Biomolekuler FK UNUD) menghasilkan kualitas DNA yang relatif lebih baik dari metode Boom original (Boom et al, 1990)
Saran
Pengujian terhadap kuantitas DNA yang dihasilkan oleh metode Boom original (Boom et al, 1990) dan metode Boom modifikasi (Laboratorium Biomolekuler FK UNUD) perlu dilakukan untuk lebih memastikan metode mana yang merupakan metode yang paling baik digunakan dalam mengisolasi DNA M. tuberculosis.
UCAPAN TERIMA KASIH
Pada penelitian ini penulis mengucapkan terimakasih kepada seluruh staff Laboratorium Biomolekular Fakultas kedokteran Universitas Udayana, Laboratorium Forensik Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana, serta semua pihak yang telah membantu dalam pelaksanaan penelitian ini.
DAFTAR PUSTAKA
Amaro, A., Duarte, A., Amado, A., Ferronha, H. and Botelho, A., 2008, Comparison of Three DNA Extraction Methods for Mycobacterium bovis, Mycobacterium tuberculosis and Mycobacterium avium subsp.avium, Original Article: Letters in Applied Microbiology, 47 : 8-11
Amin, I., Awan, M, Z., Shahid, M., Afzal, S., and Hussain, A., 2011, PCR could be a Method of Choice for Identification of both Pulmonary and Extra-Pulmonary Tuberculosis, BMC Research Note, 4 : 1-5
Amita, J., Vandana, T., Guleria, R. S., and Verma, R. K., 2002, Qualitative Evaluation of Mycobacterial DNA Extraction Protocols for Polymerase Chain Reaction, Molecular Biology, 3 : 43-50
Aygan, A., 2006, Nucleic Acid Extraction from Clinical Specimens for PCR Application, Turk J Biol, p. 107-120
Boom, R., Sol, C. J. A., Salimans, M. M. M., Jansen, C. L., Wertheim van Dillen, P. M. E., and van Der Noordaa, J., 1990, Rapid and Simple Method for Purification of Nucleic Acids, Journal of Clinical Microbiology, 28 (3) : 495-503
Faatih, M., 2009, Isolasi dan Digesti DNA Kromosom, Jurnal Penelitian Sains & Teknologi, 10 (1) : 61-67
Jasaputra, D. K., Widjaja, J. T., Wargasetia, T. L., dan Makangiras, I., 2007, Deteksi Mycobacterium tuberculosis dengan
Teknik PCR pada Cairan Efusi Pleura Penderita Tuberkulosis Paru, JKM, 7 (1) : 86-92
Lina R, M., Bela, B., dan Syaifudin, M., 2007, Deteksi Gen Target INH pada DNA Sputum Basil ahan Asam Positif dengan Teknik Polymerase Chain Reaction, Majalah Kedokteran Indonesia, 57 (8) : 245-250
Rosilawati, M. L., Sudarmono, P., dan Ibrahim, F., 2002, Sensitivitas Metode PCR (Polymerase Chain Reaction) dalam Mendeteksi Isolat Klinis Mycobacterium tuberculosis, J. Kedoktera Trisakti, 21 (1) : 7-14
Sambrook, J. and Russell, D. W., 2001,
Molecular Cloning: A Laboratory Manual. 3rd Edition, Cold Spring Harbor Laboratory Press, New York
Saptawati, L., Mardiastuti, Karuniawati, A., dan Rumende, C. M., 2012, Evaluasi Metode FASTPlaqueTBTM Untuk Mendeteksi
Mycobacterium tuberculosis pada Sputum di Beberapa Unit Pelayanan Kesehatan di Jakarta-Indonesia, Jurnal Tuberkulosis Indonesia, 8 (1829-5118) : 1-6
Tebriulo, A., Suryati, E., Parenregi, A., dan Rosmiat, 2001, Ekstraksi DNA Rumput Laut Kappaphycus alvarezii dengan Metode Fenol Kloroform, Marina Chimica Acta, 2 (2) : 6-10
WHO, 2012, Global Tuberculosis Report 2012, WHO Press, Switzerland, p. 8-28
Wirajana, I N., Yuliana, D. A., dan Ratnayani, K., 2013, Isolasi DNA Metagenomik dari Tanah Hutan Mangrove Pantai Suwung Bali, Jurnal Kimia, 7 (1) : 19-24
46
Discussion and feedback