AMPLIFIKASI DAN IDENTIFIKASI MUTASI PADA FRAGMEN 0,5 KB GEN rpoB ISOLAT 134 Mycobacterium tuberculosis MULTIDRUG RESISTANT DENGAN METODE NESTED POLYMERASE CHAIN REACTION
on
JURNAL KIMIA 8 (2), JULI 2014: 166-170
AMPLIFIKASI DAN IDENTIFIKASI MUTASI PADA FRAGMEN 0,5 KB GEN rpoB ISOLAT 134 Mycobacterium tuberculosis MULTIDRUG RESISTANT DENGAN METODE NESTED POLYMERASE CHAIN REACTION
Made Dharmesti Wijaya1)*, I Nengah Wirajana2), dan Sagung Chandra Yowani1)
1)Jurusan Farmasi FMIPA Universitas Udayana, Bukit Jimbaran 2)Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran *email : dharmestiwijaya@ymail.com
ABSTRAK
Telah dilakukan penelitian yang bertujuan untuk mengamplifikasi dan mengidentifikasi mutasi pada fragmen 0,5 kb gen rpoB pada isolat 134 Mycobacterium tuberculosis multidrug resistant (MDR). Amplifikasi dilakukan dengan menggunakan metode nested polymerase chain reaction (nested PCR) sedangkan sekuensing dilakukan satu arah menggunakan forward inner primer. Sekuen nukleotida yang diperoleh ditranslasi menjadi asam amino dengan menggunakan program MEGA4.
Fragmen 0,5 kb gen rpob M.tuberculosis telah berhasil diamplifikasi dengan metode nested PCR dan disekuensing. Hasil alignment menggunakan program MEGA4 menunjukkan bahwa telah terjadi missense mutation pada gen rpoB isolat 134. Perubahan dua asam amino yang terjadi pada protein rpoB adalah asam glutamat menjadi asam aspartat pada kodon 418 serta glutamin menjadi arginin pada kodon 510.
Kata kunci: rpoB, Mycobacterium tuberculosis, MDR, Nested PCR
ABSTRACT
Research has been conducted to amplify and identify mutations in the rpoB gene fragment, 0,5 kb, from the isolate 134 Mycobacterium tuberculosis multidrug resistance (MDR). Amplification was performed using the method nested polymerase chain reaction (nested PCR) while sequencing was conducted in one direction using forward inner primer. Nucleotide sequence obtained was translated into amino acids using MEGA4 program.
Amplification of M.tuberculosis rpoB gene fragment, 0,5 kb, was successfully carried out and sequenced. Alignment result by using MEGA4 program showed that there had been missense mutations in the rpoB gene. It had two amino acids changes to rpoB protein, they were glutamic acid to aspartic acid at codon 418 and glutamine to arginine at codon 510.
Keywords: rpoB, Mycobacterium tuberculosis, MDR, Nested PCR
PENDAHULUAN
Multidrug resistant tuberculosis (MDR-TB) merupakan penyakit tuberkulosis yang disebabkan oleh strain M.tuberculosis yang resisten sekurang-kurangnya terhadap rifampisin (RIF) dan isoniazid (INH), obat-obat antituberkulosis lini pertama yang paling efektif (WHO, 2010). Resistensi terhadap RIF merupakan suatu pertanda penting karena sekitar 90% isolat
yang resisten terhadap RIF juga resisten terhadap INH.
Lebih dari 96% resistensi yang terjadi pada RIF disebabkan oleh mutasi pada segmen 81bp gen rpoB, gen yang menyandi perubahan asam amino pada subunit-β dari RNA polimerase. Segmen yang sering disebut sebagai rifampicin resistant – determining region (RRDR) atau hot spot region tersebut mencakup kodon 507 hingga 533 gen rpoB (Lewis dkk, 2002; Syaifudin dkk, 2007).
Metode kultur sebagai gold standard dalam diagnosis TB sangat sensitif dan spesifik namun memerlukan waktu hingga beberapa minggu (Tessema dkk, 2012). Uji fenotip konvensional yang lambat ini membuat uji secara genotip dijadikan alternatif dalam mendeteksi MDR-TB karena kecepatannya dalam memberikan hasil, sederhana, dan sangat sensitif (Lingala dkk, 2010; Syaifudin dkk, 2007).
Uji molekular banyak dimanfaatkan dalam diagnosis MDR-TB karena kecepatannya dalam memberikan hasil. Namun, metode ini memilki kelemahan yaitu hanya didesain untuk mendeteksi polimorfisme yang paling sering terjadi pada gen rpoB isolat M.tuberculosis yaitu pada kodon 516, 526, dan 531. Hal tersebut membuat metode ini tidak dapat diterapkan secara universal karena pengaruh geografis sangat mempengaruhi perbedaan titik-titik mutasi yang terjadi (Lingala dkk, 2010).
Penelitian mengenai daerah konservatif terjadinya mutasi pada M.tuberculosis belum banyak dilakukan di Indonesia. Oleh karena itu, dilakukan penelitian ini yang bertujuan untuk mengamplifikasi dan mengidentifikasi mutasi pada fragmen 0,5 kb gen rpoB M.tuberculosis yang mencakup daerah RRDR menggunakan metode nested PCR. Hasil penelitian ini diharapkan dapat membantu pengembangan teknik-teknik molekuler dalam diagnosis MDR-TB di Indonesia pada khususnya.
MATERI DAN METODE
Bahan
Bahan yang digunakan sebagai sampel dalam penelitian ini adalah isolat 134 M.tuberculosis MDR yang diperoleh dari Instalasi Mikrobiologi Klinik Rumah Sakit Umum Pusat (RSUP) Sanglah Denpasar.
Bahan-bahan kimia yang digunakan adalah diatom, larutan pelisis L6 (GuSCN, Tris-HCl, EDTA, NaOH, dan Triton-X), washing buffer L2 (GuSCN dan Tris-HCl), etanol 70%, aseton, aquades steril, inner primer, outer primer, Go Taq Green PCR mix (Promega), agarosa (Promega), TBE (Invitrogen), dan EtBr (Promega).
Peralatan
Peralatan yang digunakan antara lain alat-alat gelas, satu set pipet mikro (0,5-100 µL), tabung mikro, vorteks, shaker rotator tipe H-SR-200, Sorvall Biofuge Primo R Centrifuge, waterbath, thermalcycler (Applied Biosystems), alat elektroforesis (BioRad), GelDoc (BioRad), dan sequencer (Applied Biosystems).
Cara Kerja
Isolasi DNA
Sampel isolat 134 M.tuberculosis MDR hasil subkultur dilarutkan dalam PBS. Isolasi DNA sampel dilakukan dengan metode Boom (Boom dkk, 1990).
Amplifikasi fragmen 0,5 kb gen rpoB M.tuberculosis dengan metode nested PCR
Amplifikasi fragmen 0,5 kb gen rpoB M.tuberculosis dilakukan dengan metode nested PCR. Reaksi PCR pertama menggunakan outer primer FndeR1 5’ GCC ATA TGA TGT CTC CGA TCG ACC ACT TC 3’ dan RBamR1 5’ GTG GAT CCT GTC GTG CAT CAC AGT GAT GTA G 3’. Reaksi dilakukan dalam tabung mikro yang berisi 20 µL campuran reaksi yang terdiri dari 10 µL PCR mix; sepasang outer primer masing-masing 0,8 µL; 6,4 µL H2O; dan 2,0 µL sampel. Proses denaturasi awal dilakukan pada suhu 950C selama 15 menit, amplifikasi sebanyak 40 siklus (1 menit pada 940C, 1 menit pada 560C, dan 1 menit pada 720C), serta elongasi akhir pada 720C selama 10 menit.
Hasil PCR dengan outer primer digunakan sebagai templat dalam tahap amplifikasi berikutnya menggunakan inner primer FrTb 5’ G TCG ACG CTG ACC GAA GAA GAC 3’ dan RrTb 5’ CC AAC ATC GGT CTG ATC GGC TC 3’. Sebanyak 2 µL templat pengenceran 100x dimasukkan dalam tabung mikro yang berisi 11,5 µL PCR mix, sepasang inner primer masing-masing 0,8 µL, dan 9,9 µL H2O. Proses denaturasi awal dilakukan pada suhu 950C selama 15 menit, amplifikasi sebanyak 45 siklus (1 menit pada 940C, 1 menit pada 600C, dan 1 menit pada 720C), serta elongasi akhir pada 720C selama 10 menit.
Deteksi hasil PCR dengan metode elektroforesis gel agarosa
Sebanyak 5,2 g agarosa dalam 35 mL trisborat EDTA (TBE) 1x dipanaskan hingga larut. Larutan didiamkan hingga hangat dan ditambahkan 2,8 µL etidium bromida (EtBr). Campuran tersebut dikocok hingga homogen kemudian dituang ke dalam cetakan dan dibiarkan hingga membeku sempurna.
Sebanyak 3 µL sampel hasil PCR dimasukkan ke dalam sumur gel agarosa 1,5%. Marker yang digunakan adalah 100 bp DNA ladder (Invitrogen) sebanyak 2,5 µL. Proses elektroforesis dilakukan dengan beda potensial sebesar 60 V selama 45 menit.
Sekuensing dan analisis data
Sekuensing produk PCR dilakukan di Laboratorium Eijkman, Jakarta, menggunakan inner primer. Sekuen nukleotida yang diperoleh ditranslasi menjadi asam amino dengan menggunakan program MEGA4 (Tamura dkk, 2007).
HASIL DAN PEMBAHASAN
Amplifikasi fragmen 0,5 kb gen rpoB M.tuberculosis
Hasil amplifikasi PCR menggunakan outer primer pada suhu 580C dapat dilihat pada Gambar 1.

2072 bp
1500 bp
600 bp
Gambar 1. Elektroforegram hasil PCR fragmen gen rpoB M.tuberculosis dengan outer primer pada suhu 580C; 1.Isolat 134, 2.Marker 100 bp
Pada Gambar 1 tersebut tidak tampak adanya pita DNA. Diduga hal ini disebabkan oleh rendahnya konsentrasi DNA dalam sampel. Oleh karena itu, dilakukan amplifikasi kembali menggunakan sampel tanpa pengenceran. Suhu annealing juga diturunkan menjadi 560C dengan harapan hibridisasi primer dengan templat terjadi dengan lebih mudah (Borah, 2011). Hasil amplifikasi PCR menggunakan outer primer pada suhu 560C dapat dilihat pada Gambar 2.
2072 bp
1500 bp
600 bp
1

Gambar 2. Elektroforegram hasil amplifikasi pertama dengan metode nested PCR; 1.Marker 100 bp, 2. Fragmen 1,7 kb gen rpoB M.tuberculosis
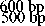
400 bp
300 bp
200 bp
100 bp
2072 bp
2072 bp

Gambar 3. Elektroforegram hasil amplifikasi kedua dengan metode nested PCR; 1.Marker 100 bp, 2. Fragmen 0,5 kb gen rpoB M.tuberculosis
Pada Gambar 2 tersebut dapat dilihat bahwa amplifikasi dengan menggunakan outer primer telah menghasilkan produk sebesar 1,7 kb. Produk PCR ini kemudian dijadikan templat untuk amplifikasi kedua menggunakan inner primer. Produk nested PCR dapat dilihat pada Gambar 3.
Sekuensing dan analisis data
Sekuensing dilakukan satu arah menggunakan forward inner primer di Laboratorium Eijkman, Jakarta. Hasil sekuensing yang terbaca untuk isolat 134 adalah sebanyak 491 basa. Hasil sekuensing ini kemudian diidentifikasi mutasi serta perubahan asam aminonya menggunakan program MEGA4 (Tamura dkk, 2007).
Hasil identifikasi menunjukkan bahwa telah terjadi mutasi pada daerah RRDR yaitu Q510R. Mutasi juga terjadi pada kodon di luar RRDR yaitu E418D.
Apabila dibandingkan dengan penelitian serupa di beberapa negara lain, mutasi yang terjadi pada isolat 134 ini termasuk jarang terjadi. Beberapa penelitian menyebutkan bahwa mutasi yang paling sering terjadi adalah pada kodon 531, 526, dan 516 (Valim dkk, 2000; Lingala dkk, 2010; Ali dkk, 2011; Yoon dkk, 2011). Mutasi di luar RRDR juga pernah dipublikasikan yaitu pada kodon 145 hingga 148 (Lingala dkk, 2010).
Mutasi pada isolat 134 ini menyebabkan terjadinya perubahan baik struktur maupun sifat asam amino. Pada kodon 418 terjadi perubahan dari GAA menjadi GAT yang menyebabkan terjadinya perubahan asam amino dari asam glutamat (E) menjadi asam aspartat (D). Sifat keasaman dan polaritas kedua asam amino ini tidak berubah, hanya saja terdapat perbedaan pada gugus samping penyusunnya. Gugus samping asam glutamat adalah karboksi etil sedangkan asam aspartat adalah karboksi metil. Perubahan lainnya adalah pada kodon 510 yaitu CAG menjadi CGG, dari glutamin (Q) yang bersifat netral menjadi arginin (R) yang bersifat basa.
Perubahan-perubahan tersebut diduga terkait dengan timbulnya fenotip yang resisten terhadap RIF. Retnoningrum dan Roga (2004) menyebutkan bahwa satu saja mutasi titik yang menyebabkan perubahan asam amino dapat mengakibatkan penurunan atau hilangnya aktivitas
pengikatan serta bertanggung jawab terhadap timbulnya fenotip yang resisten.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan sebagai berikut:
-
1. Fragmen 0,5 kb dari gen rpoB M.tuberculosis telah berhasil diamplifikasi dengan menggunakan metode nested PCR.
-
2. Mutasi yang terjadi adalah missense mutation yaitu perubahan asam amino pada kodon 418 dari asam glutamat menjadi asam aspartat serta pada kodon 510 dari glutamin menjadi arginin.
Saran
Mengingat bahwa mutasi yang ditemukan termasuk jarang terjadi, maka perlu dilakukan penelitian serupa untuk mendapatkan database daerah konservatif terjadinya mutasi pada M.tuberculosis di Indonesia pada khususnya.
UCAPAN TERIMA KASIH
Ucapan terima kasih penulis sampaikan kepada staf Laboratorium Biomolekular Fakultas Kedokteran Universitas Udayana, staf Instalasi Mikrobiologi Klinik Rumah Sakit Umum Pusat Sanglah, serta pihak-pihak yang telah membantu penelitian ini.
DAFTAR PUSTAKA
Ali, A., Rumina H., Kauser J., Nusrat J., Ejaz Q., and Zahra H., 2011, Characterization of Mutations Conferring Extensive Drug Resistance to Mycobacterium tuberculosis Isolates in Pakistan, Antimicrobial Agents and Chemotherapy, 55 (12) : 5654-5659
Boom, R., C.J.A. Sol, M.M.M. Salimans, C.L.
Jansen, P.M.E.W. van Dillen, and J. van der Noordaa, 1990, Rapid and simple method for purification of nucleic acid, Journal of Clinical Microbiology, 28 (3) : 495-503
Borah, P., 2011, Primer Designing for PCR, Sci Vis, 11 (3) : 134-136
Lewis, K., Abigail A.S., Harry W.T., and Richard G.W., 2002, Bacterial Resistance to Antimicrobials, Marcel Dekker Inc, New York
Lingala, M.A.L., Aparna S., Suman J., K.V.S.M. Rao, and P.V. Ranganadha R., 2010, Clinical and Geographical Profiles of rpoB Gene Mutations in Mycobacterium tuberculosis Isolates from Hyderabad and Koraput in India, Journal of Microbiology and Antimicrobials, 2 (2) : 13-18
Syaifudin, M., Rosilawati, M.L., Irawan, H., dan Bela, B., 2007, Identifikasi Mycobacterium tuberculosis dan Analisis Mutasi Gen RpoB dan KatG Penyebab Resistensi Ganda dengan Teknik Molekuler, Balitbang BATAN, Jakarta
Tamura, K., Dudley J., Nei M., and Kumar S., 2007, MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0, Molecular Biology and Evolution, 24, p. 1596-1599
Tessema, B., Joerg B., Frank E., Ulrich S., and Arne C.R., 2012, Analysis of Gene Mutations Associated with Isoniazid, Rifampicin and Ethambutol Resistance
Among Mycobacterium tuberculosis Isolates from Ethiopia, BMC Infectious Diseases, 2012, p.1237
Valim, A.R.M., Maria L.R.R., Marta O.R., and Arnaldo Z., 2000, Mutations in the rpoB Gene of Multidrug-Resistant Mycobacterium tuberculosis Isolates from Brazil, Journal of Clinical Microbiology, 38 (8) : 3119-3122
WHO, 2010, Multidrug and Extensively DrugResistant TB (M/XDR-TB) – 2010 Global Report on Surveillance and Response, WHO Press, Geneva
Yoon, J., Ji-Sun N., Kyung-Jin K., Yeonim C., Hyeyoung L., and Sang-Nae C., 2011, Molecular Characterization of DrugResistant and Susceptible Mycobacterium tuberculosis Isolated from Patients with Tuberculosis in Korea, Diagnostic Microbiology and Infectious Disease, 72 (2012) : 52-61
Yowani, S. C., 2012, Mutations in 1700 bp Fragment of rpoB gene of Multi-Drug Resistant Mycobacterium tuberculosis Isolate, Indonesian Journal of Biomedical Sciences, 6 (2) :
170
Discussion and feedback