SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIOKSIDAN DARI EKSTRAK ETANOL BUAH TERONG UNGU (Solanum melongena L.)
on
ISSN 1907-9850
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIOKSIDAN DARI EKSTRAK ETANOL BUAH TERONG UNGU (Solanum melongena L.)
Ni Wayan Martiningsih1*, I Nyoman Sukarta1, dan Putu Eppy Yuniana2
1Jurusan Analis Kimia FMIPA Universitas Pendidikan Ganesha 2Alumni Jurusan Analis Kimia FMIPA Universitas Pendidikan Ganesha *email : marti_chem03@yahoo.co.id
ABSTRAK
Telah dilakukan skrining fitokimia dan uji aktivitas antioksidan dari ekstrak etanol buah terong ungu (Solanum melongena L). Ekstraksi dilakukan dengan metode maserasi menggunakan etanol. Skrining fitokimia dilakukan dengan menguji secara kualitatif golongan senyawa antioksidan antara lain yaitu alkaloid, flavanoid, tannin, saponin, glikosida, antrakinon, dan steroid/triterpenoid. Hasil skrining fitokimia menunjukkan adanya senyawa alkaloid dan flavanoid. Uji terhadap aktivitas antioksidan dengan metode DPPH menggunakan spektrofotometer UV-Vis menghasilkan adanya aktivitas antioksidan peredaman DPPH optimum pada menit ke-29 dan menit ke-58 dengan panjang gelombang maksimum dari larutan DPPH yaitu 513 nm. Pengujian kekuatan antioksidan dibandingkan dengan vitamin C sebagai kontrol positif ditunjukkan dengan nilai IC50 sebesar 535,89 ppm pada menit ke-29 dan 385,06 ppm pada menit ke-58.
Kata kunci : buah terong ungu (Solanum melongena L), antioksidan, skrining fitokimia, DPPH, Vitamin C, Spektrofotometer UV-Vis
ABSTRACT
Phytochemical screening and antioxidant activity test of the ethanol extract of eggplant fruit (Solanum melongena L) have been done. Extraction is done by maceration method using ethanol. Phytochemical screening is done by testing the qualitative class of antioxidant compounds such as alkaloids, flavonoids, tannins, saponins, glycosides, anthraquinone, and steroids / triterpenoids. Phytochemical screening results indicate the presence of alkaloids and flavonoids. Test of the antioxidant activity of the ethanol extract of eggplant fruit with DPPH method using UV-Vis spectrophotometer resulted the DPPH antioxidant activity optimum in 29th minute and the 58th minute with a maximum wavelength of DPPH solution of 513 nm. Testing the power of antioxidants compared to ascorbic acid as a positive control showed by IC50 of 535.89 ppm in 29th minute and 385.06 ppm in 58th minute.
Keywords : eggplant fruit (Solanum melongena L), antioxidant, phytochemical screening, DPPH, ascorbic acid, UV-Vis spectrophotometer
PENDAHULUAN
Senyawa antioksidan merupakan suatu inhibitor yang digunakan untuk menghambat autooksidasi. Efek antioksidan senyawa fenolik dikarenakan sifat oksidasi yang berperan dalam menetralisasi radikal bebas (Panovska et al, 2005). Penggunaan senyawa antioksidan semakin berkembang baik untuk makanan maupun untuk
pengobatan seiring dengan bertambahnya pengetahuan tentang aktivitas radikal bebas (Boer, 2000). Berdasarkan sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan alami dan antioksidan buatan (sintetik) (Dalimartha dan Soedibyo, 1999). Tubuh manusia tidak mempunyai cadangan antioksidan dalam jumlah yang berlebih, sehingga jika terjadi paparan radikal berlebih maka tubuh membutuhkan antioksidan eksogen. Adanya
kekhawatiran akan kemungkinan efek samping yang belum diketahui dari antioksidan sintetik menyebabkan antioksidan alami menjadi alternatif yang sangat dibutuhkan (Rohdiana, 2001; Sunarni, 2005).
Ada berbagai macam bahan makanan yang memiliki khasiat sebagai antioksidan alami. Namun, tidak semua bahan makanan tersebut memiliki komponen kimia yang lengkap. Salah satu bahan makanan yang memiliki antioksidan alami yang lengkap adalah terong. Terdapat berbagai jenis terong, akan tetapi tidak semuanya memiliki citarasa dan kandungan gizi tinggi. Buah terong yang memiliki citarasa yang enak dan bernilai gizi adalah terong ungu. Kandungan gizi terong ungu di antaranya vitamin A, B1, B2, C, D serta fosfor, karotenoid, antosianin, dan serat (Annisas dkk, 2011).
Terong ungu memiliki antioksidan alami yang lengkap. Hal tersebut memungkinkan terong ungu untuk dimanfaatkan sebagai bahan baku pembuatan antioksidan. Terong ungu (Solanum melongena L.) merupakan keluarga Solanaceae. Terong diduga berasal dari Benua Asia, terutama India dan Birma. Selain sebagai bahan makanan, terong ungu memiliki manfaat sebagai obat tradisional, antara lain untuk obat gatal-gatal pada kulit, obat sakit gigi, wasir, tekanan darah tinggi, pelancar air seni, serta dipercaya dapat memperlancar proses persalinan jika sering dikonsumsi sebelum masa persalinan (Sastrapradja dan Rifai, 1989).
Salah satu antioksidan yang saat ini banyak digunakan adalah vitamin C (asam askorbat). Vitamin C larut dalam air dan memiliki peranan penting dalam menangkal berbagai penyakit. Vitamin C termasuk golongan vitamin yang mampu menangkal berbagai radikal bebas ekstraseluler. Karakteristiknya antara lain sangat mudah teroksidasi oleh panas, cahaya, dan logam. Vitamin C juga mampu menangkal nitrit penyebab kanker. Terong ungu memiliki kemiripan dengan vitamin C sebagai antioksidan dan juga memiliki banyak manfaat, sehingga menjadi daya tarik untuk dilakukan pengujian terhadap aktivitas antioksidannya. Terong ungu merupakan bahan yang mudah dijumpai di masyarakat dan memiliki potensi untuk dijadikan obat alternatif secara tradisional.
Berdasarkan penelitian yang telah dilakukan pada sampel terong belanda (Solanum bataceum Cav.), yaitu dengan pengujian aktivitas antioksidan dari ekstrak etanol buah terong menggunakan metode DPPH (1,1-dhipenil-2-picrylhydrazyl), maka diperoleh hasil bahwa terong belanda memiliki potensi sebagai antioksidan. Oleh sebab itu dalam penelitian ini dilakukan skrining fitokimia terlebih dahulu dan uji aktivitas antioksidannya menggunakan metode DPPH dengan vitamin C sebagai kontrol positif.
MATERI DAN METODE
Bahan
Bahan uji yang digunakan dalam penelitian ini adalah daging buah terong ungu. Bahan kimia yang digunakan adalah sebagai berikut. 1) Bahan selama proses isolasi menggunakan buah terong ungu segar dan etanol. 2) Bahan selama proses skrining fitokimia berupa reagen Meyer, reagen Dragendorff, reagen Molish, reagen Bauchardat, asam sulfat pekat, asam nitrat pekat, asam klorida, besi (III) klorida, natrium hidroksida, kloroform, isopropanol (2-propanol), eter, benzena, asam asetat anhidrat, magnesium, timbal (II) asetat, dan aquades. 3) Bahan selama uji aktivitas antioksidan berupa 1,1-dhipenil-2-picrylhydrazyl (DPPH), methanol, dan vitamin C yang dalam penelitian ini digunakan asam askorbat.
Peralatan
Alat yang digunakan dalam penelitian ini adalah UV mini 1240-spektrofotometer UV-Vis, evaporator (Stuart RE300DB), neraca digital, pisau, sendok, eksikator, kurs porselin, gelas beaker, tabung reaksi, labu ukur, batang pengaduk, spatula, labu erlenmeyer, kertas saring, botol sampel, dan pipet tetes.
Cara Kerja
Persiapan Sampel
Daging buah terong ungu dipotong kecil-kecil dan dihaluskan dengan blender hingga diperoleh daging buah yang telah halus sebanyak 210,260 gram.
Skrining Fitokimia
Sampel daging buah yang telah halus kemudian ditimbang sebanyak 10 gram. Kemudian dilanjutkan dengan pengujian skrining fitokimia untuk mengetahui kandungan antioksidan dalam terong ungu.
Pemeriksaan alkaloid dilakukan dengan tiga tahap pengujian, yaitu dengan reagen Meyer, Bouchardat, dan Dragendorff. Kandungan alkaloid dinyatakan positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan yang dilakukan (Departemen Kesehatan, 1978). Pemeriksaan glikosida dilakukan berdasarkan terbentuk tidaknya cincin ungu pada batas campuran ekstrak, air, reagen Molish dengan asam sulfat pekat.
Pemeriksaan steroid / triterpenoid dilakukan dengan mengamati ada tidaknya warna ungu atau merah yang berubah menjadi hijau pada ekstrak eter terong ungu yang direaksikan dengan pereaksi Liebermann-Burchard (Harborne, 1987). Pemeriksaan flavanoid dilakukan dengan mengamati ada tidaknya perubahan warna menjadi jingga-merah pada ekstrak yang telah ditambahkan dengan magnesium dan asam klorida (Lemba, 2010).
Pemeriksaan tannin dilakukan dengan mengamati ada tidaknya perubahan warna filtrat setelah penambahan pereaksi besi (III) klorida 1% menjadi hijau atau biru kehitaman. Pemeriksaan saponin dilakukan dengan mengamati ada tidaknya busa pada larutan terong ungu setinggi 1 – 10 cm yang stabil dalam waktu 10 menit dan tidak hilang pada penambahan asam klorida 2N. Pemeriksaan antrakinon dilakukan dengan mengamati terbentuk tidaknya lapisan air berwarna merah dan lapisan benzena yang tidak berwarna.
Maserasi
Sampel daging buah yang telah halus ditimbang sebanyak 200,260 gram dimaserasi selama 3 hari menggunakan pelarut etanol sebanyak 1500 mL. Setelah dimaserasi selama 3 hari, sampel disaring. Filtrat disimpan pada tempat yang tidak terkena sinar matahari langsung, sedangkan residunya kembali dimaserasi selama 2 hari dengan pelarut etanol sebanyak 500 mL. Setelah 2 hari, sampel disaring. Filtrat etanol hasil maserasi digabung dan diuapkan dalam evaporator sehingga didapat ekstrak kental.
Uji Aktivitas Antioksidan
Hasil evaporasi yang berupa ekstrak kental kemudian diuji aktivitas antioksidannya menggunakan metode DPPH dengan alat Spektrofotometer UV-Vis. Pada proses ini dicari operating time serapan maksimum DPPH. Operating time merupakan waktu kerja optimum DPPH. Selanjutnya dilakukan pengukuran serapan maksimum pada ekstrak etanol terhadap DPPH pada waktu serapan maksimum tersebut. Analisis kekuatan antioksidan dalam buah terong ungu dilakukan dengan mencari IC50 dengan menghitung persen peredaman radikal bebas oleh buah terong ungu dan oleh vitamin C dengan menggunakan persamaan yang diperoleh dari kurva regresi linier.
HASIL DAN PEMBAHASAN
Skrining Fitokimia
Untuk mengetahui kandungan antioksidan dalam buah terong ungu, maka dilakukan skrining fitokimia. Hasil uji skrining fitokimia dapat dilihat pada Tabel 1.
Tabel 1. Hasil Pemeriksaan Skrining Fitokimia
|
No |
Uji Fitokimia |
Pereaksi |
Hasil Uji |
Kesimpulan |
|
1 |
Alkaloid |
Meyer |
tidak ada perubahan |
- |
|
Bouchardat |
endapan kecoklatan |
+ | ||
|
Dragendorff |
endapan jingga |
+ | ||
|
2 |
Flavonoid |
Mg + HCl 2% |
Jingga |
+ |
|
3 |
Tanin |
FeCl3 1% |
kuning muda |
- |
|
4 |
Saponin |
Air panas + HCl |
tidak terbentuk busa stabil |
- |
|
5 |
Glikosida |
Pereaksi Molish + H2SO4 pekat |
tidak terbentuk cincin ungu |
- |
|
6 |
Antrakinon |
H2SO4 + benzene |
dua lapisan tidak berwarna |
- |
|
7 |
Triterpenoid/Steroid |
Lieberman-Burchard |
tidak ada perubahan |
- |
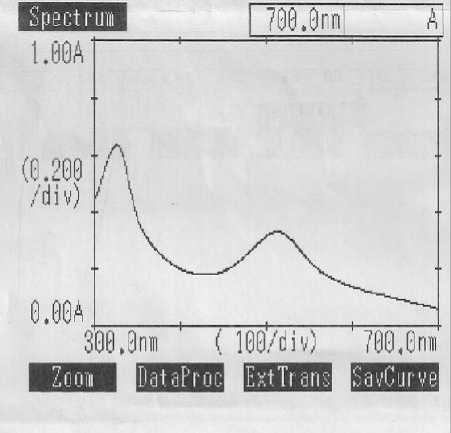
(a)

(b)
Gambar 1. (a) Spektrum Serapan Maksimum Larutan DPPH 40 ppm dalam Metanol (b) Puncak Serapam Maksimum Larutan DPPH 40 ppm dalam Metanol
Hasil uji skrining fitokimia menunjukkan bahwa ekstrak etanol buah terong ungu mengandung senyawa golongan alkaloid dan flavanoid. Data tersebut menunjukkan kemungkinan senyawa yang bertanggung jawab terhadap aktivitas antioksidan adalah alkaloid dan flavonoid.
Penentuan Operating Time Larutan DPPH dalam Metanol
Penentuan operating time larutan DPPH 40 ppm dalam metanol dilakukan pada panjang gelombang maksimum, yaitu 513 nm (ditunjukkan oleh Gambar 1). Waktu serapan maksimum larutan DPPH diukur dalam rentang waktu 60 menit, sehingga diperoleh data waktu serapan maksimum. Kurva serapan untuk operating time larutan DPPH dalam metanol dapat dilihat pada Gambar 2.
Berdasarkan Gambar 2 diperoleh bahwa serapan maksimum terhadap DPPH terjadi pada menit ke-29 dengan absorbansi 0,3357 dan menit ke-58 dengan absorbansi 0,3308. Hal ini memberikan informasi bahwa operating time DPPH yang digunakan adalah menit ke-29 dan menit ke-58. Berdasarkan operating time ini maka
pengujian aktivitas antioksidan dilakukan pada waktu tersebut.
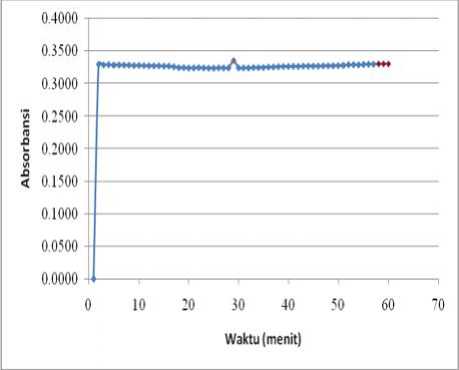
Gambar 2. Kurva Absorbansi Operating Time Larutan DPPH dalam Metanol
Analisis Aktivitas Antioksidan Sampel Ekstrak
Etanol Buah Terong Ungu dan Vitamin C
Larutan DPPH ditambahkan dengan sampel uji dan metanol dibuat dalam 4 konsentrasi,
yaitu 40 ppm, 80 ppm, 120 ppm, dan 160 ppm. Sampel uji dengan berbagai konsentrasi tersebut dibandingkan dengan kontrol DPPH (tanpa penambahan sampel atau vitamin C). Sedangkan aktivitas antioksidan dari vitamin C dianalisis berdasarkan hasil pengukuran absorbansi DPPH pada waktu maksimum yaitu pada menit ke-29 dan menit ke-58. Larutan DPPH ditambahkan dengan vitamin C yang juga dibuat dalam 4 konsentrasi yaitu 40 ppm, 80 ppm, 120 ppm, dan 160 ppm.
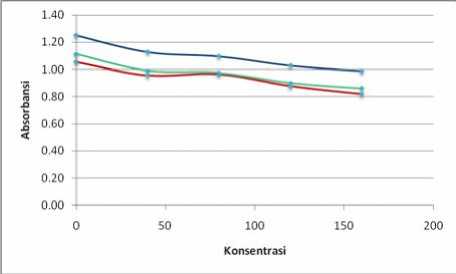
Keterangan:
Biru = panjang gelombang 513 nm
Hijau = panjang gelombang 534 nm
Merah = panjang gelombang 494 nm
Gambar 3. Hasil Analisis Aktivitas Antioksidan Sampel Ekstrak Etanol Buah Terong Ungu pada Menit ke-29
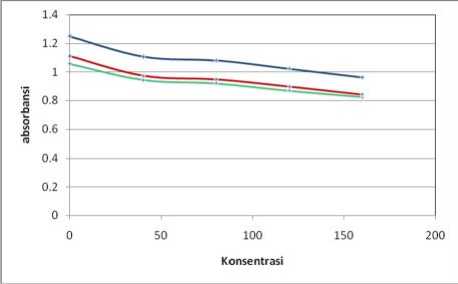
Keterangan:
Biru = panjang gelombang 513 nm
Hijau = panjang gelombang 534 nm
Merah = panjang gelombang 494 nm
Gambar 4. Hasil Analisis Aktivitas Antioksidan Sampel Ekstrak Etanol Buah Terong Ungu pada Menit Ke-58
Berdasarkan Gambar 3 dan Gambar 4 (ekstrak etanol buah terong ungu) serta Gambar 5 dan Gambar 6 (vitamin C) dapat dilihat terjadi penurunan nilai absorbansi DPPH yang diberi sampel uji terhadap kontrol pada setiap kenaikan konsentrasi. Penurunan nilai abosrbansi DPPH ini mengindikasikan bahwa telah terjadi penangkapan atau peredaman radikal bebas DPPH oleh sampel uji. Penurunan nilai absorbansi DPPH tersebut menunjukkan adanya aktivitas antioksidan dari ekstrak etanol buah terong ungu dan vitamin C. Jadi, dapat disimpulkan bahwa ekstrak etanol buah terong ungu memiliki aktivitas antioksidan.
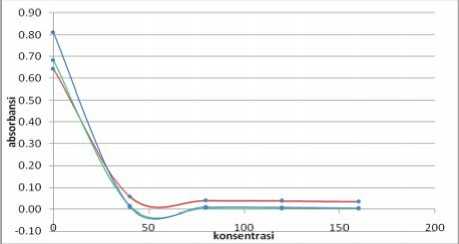
Keterangan:
Biru = panjang gelombang 513 nm
Hijau = panjang gelombang 534 nm
Merah = panjang gelombang 494 nm
Gambar 5. Hasil Analisis Aktivitas Antioksidan
Vitamin C pada Menit Ke-29
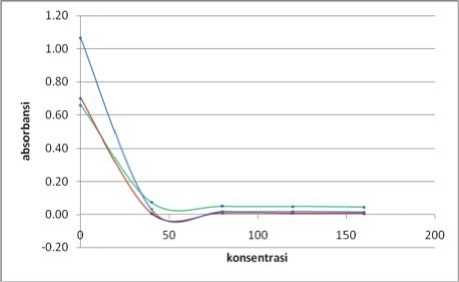
Keterangan:
Biru = panjang gelombang 513 nm
Hijau = panjang gelombang 534 nm
Merah = panjang gelombang 494 nm
Gambar 6. Hasil Analisis Aktivitas Antioksidan
Vitamin C pada Menit Ke-58
Penentuan Kekuatan Antioksidan Ekstrak Etanol Buah Terong Ungu
Analisis peredaman radikal bebas oleh sampel uji dapat diperoleh dengan terlebih dahulu menghitung nilai Ahitung sampel uji (absorbansi hitung). Peredaman radikal bebas oleh vitamin C (kontrol positif) juga ditentukan dengan cara yang sama (dalam hal ini vitamin C sebagai sampel). Berdasarkan analisis yang dilakukan, diperoleh nilai persen peredaman pada setiap kenaikan konsentrasi sampel uji ditunjukkan dalam Tabel 2. Hasil analisis peredaman radikal bebas oleh vitamin C ditunjukkan dalam Tabel 3.
Berdasarkan Tabel 2 (ekstrak etanol terong ungu) dan Tabel 3 (vitamin C) dapat dilihat bahwa
setiap kenaikan konsentrasi dan dengan bertambahnya waktu menunjukkan peningkatan peredaman radikal bebas DPPH oleh sampel uji. Hal ini menunjukkan bahwa terdapat hubungan antara konsentrasi sampel uji dengan peningkatan peredaman radikal bebas DPPH. Hubungan tersebut diberikan oleh persamaan regresi linier sampel uji.
Hubungan antara konsentrasi sampel uji (ppm) dengan persen peredaman radikal bebas DPPH dapat diperoleh dengan memplot nilai persen peredaman dan konsentrasi sampel uji. Hal ini dapat dilihat pada Gambar 7 untuk ekstrak etanol buah terong ungu dan untuk vitamin C.
Tabel 2. Hasil Analisis Peredaman Radikal Bebas oleh Ekstrak Etanol Buah Terong Ungu
|
Menit ke- |
Sampel |
A494 |
A534 |
A513 |
AHitung |
%Peredaman |
|
DPPH |
1.0544 |
1.1123 |
1.2504 |
0.1670 |
- | |
|
40 |
0.9559 |
0.9894 |
1.1269 |
0.1542 |
7.6624 | |
|
29 |
80 |
0.9636 |
0.9753 |
1.0964 |
0.1269 |
24.0048 |
|
120 |
0.8766 |
0.8998 |
1.0285 |
0.1403 |
16.0132 | |
|
160 |
0.8193 |
0.8613 |
0.9865 |
0.1462 |
12.4813 | |
|
DPPH |
1.0566 |
1.1112 |
1.2501 |
0.1662 |
- | |
|
40 |
0.9434 |
0.9736 |
1.1072 |
0.1487 |
10.5295 | |
|
58 |
80 |
0.9209 |
0.9488 |
1.0806 |
0.1458 |
12.3044 |
|
120 |
0.8686 |
0.8973 |
1.0228 |
0.1398 |
15.8544 | |
|
160 |
0.8236 |
0.8420 |
0.9622 |
0.1294 |
22.1420 |
|
Tabel 3. Hasil Analisis Peredaman Radikal Bebas oleh Vitamin C | ||||||
|
Menit ke- |
Sampel |
A494 |
A534 |
A513 |
AHitung |
%Peredaman |
|
DPPH |
0.6436 |
0.6843 |
0.8129 |
0.1490 |
- | |
|
40 |
0.0579 |
0.0148 |
0.0108 |
0.0256 |
82.8466 | |
|
29 |
80 |
0.0394 |
0.0037 |
0.0090 |
0.0126 |
91.5744 |
|
120 |
0.0381 |
0.0029 |
0.0073 |
0.0132 |
91.1380 | |
|
160 |
0.0342 |
0.0020 |
0.0033 |
0.0148 |
90.0638 | |
|
DPPH |
0.6582 |
0.7002 |
1.0640 |
0.3848 |
- | |
|
40 |
0.0735 |
0.0062 |
0.0311 |
0.0088 |
97.7261 | |
|
58 |
80 |
0.0496 |
0.0098 |
0.0179 |
0.0118 |
96.9335 |
|
120 |
0.0484 |
0.0084 |
0.0167 |
0.0117 |
96.9595 | |
|
160 |
0.0446 |
0.0057 |
0.0132 |
0.0120 |
96.8945 | |
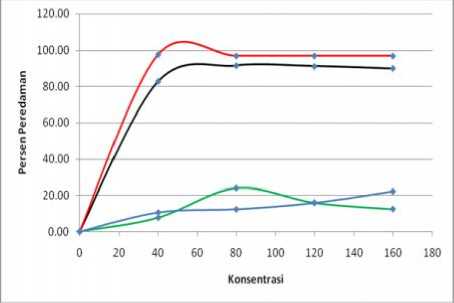
Keterangan:
Hitam = peredaman vitamin C pada menit ke-29
Orange = peredaman vitamin C pada menit ke-58
Hijau = peredaman ekstrak terong ungu pada menit ke-29
Biru = peredaman ekstrak terong ungu pada menit ke-58
Gambar 7. Hubungan Konsentrasi Ekstrak Etanol Buah Terong Ungu dan Vitamin C terhadap Persen Peredaman pada Menit ke-29 dan Menit ke-58
Kekuatan Antioksidan Ekstrak Etanol Buah Terong Ungu Dibandingkan dengan Vitamin C sebagai Kontrol Positif
Kekuatan antioksidan ekstrak etanol buah terong ungu ditentukan berdasarkan perbandingan antara nilai IC50 sampel uji dan IC50 dari vitamin C. Analisis nilai IC50 dihitung berdasarkan persamaan regresi linier yang didapatkan dengan memplot konsentrasi larutan uji dan persen peredaman DPPH sebagai parameter aktivitas antioksidan. Konsentrasi larutan uji sebagai absis dan persen peredaman sebagai ordinat. Hasil persamaan regresi linier yang diperoleh untuk ekstrak etanol buah terong ungu adalah Y = 5,370 + 0,083X pada menit ke-29 dan Y = 2,244 + 0,124X pada menit ke-58. Sementara itu, persamaan regresi sederhana untuk vitamin C adalah Y = 33,441 + 0,471X pada menit ke-29 dan Y = 39,098 + 0,482X pada menit ke-58.
Berdasarkan persamaan regresi sederhana yang telah diperoleh, maka nilai IC50 dapat dihitung dengan menentukan konsentrasi sampel uji yang menyebabkan persentase peredaman sebesar 50%. Nilai IC50 dari ekstrak etanol buah
terong ungu dan vitamin C pada menit ke-29 dan menit ke-58 dapat dilihat pada Tabel 4.
Tabel 4. Nilai IC50 Ekstrak Etanol Buah Terong Ungu dan Vitamin C
|
Menit ke- |
Sampel |
IC50 (µg/mL) |
|
29 |
Ekstrak etanol buah terong ungu Vitamin C |
535,89 35,15 |
|
58 |
Ekstrak etanol buah terong ungu Vitamin C |
385,06 22,59 |
Berdasarkan Tabel 4 dapat diketahui bahwa ekstrak etanol buah terong ungu memiliki aktivitas yang jauh lebih lemah jika dibandingkan dengan vitamin C sebagai kontrol positifnya yang memiliki aktivitas antioksidan yang sangat kuat. Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 µg/mL, kuat untuk IC50 bernilai 50-100 µg/mL, sedangkan jika IC50 bernilai 100-150 µg/mL, dan lemah jika IC50 bernilai 151-200 µg/mL (Sinaga, 2009). Hal ini dikarenakan aktivitas antioksidan pada ekstrak etanol buah terong ungu hanya ditentukan oleh senyawa-senyawa antioksidan yang dapat larut (terekstraksi) dalam etanol (pelarut polar) seperti senyawa golongan polifenol. Sedangkan senyawa-senyawa lain yang memiliki aktivitas antioksidan yang terdapat dalam buah terong ungu seperti beta karoten dan vitamin C kemungkinan tidak ikut terekstraksi dalam ekstrak etanol. Vitamin C kemungkinan tidak ikut terekstraksi dalam ekstrak etanol. Hal ini disebabkan karena vitamin C mudah larut di dalam air, tetapi agak sukar larut dalam etanol. Vitamin ini sangat peka, mudah rusak apabila terkena cahaya, panas, udara, dan oksigen (Kumalaningsih, 2006).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat disimpulkan beberapa hal sebagai berikut.
-
1) Golongan antioksidan yang teridentifikasi terkandung dalam buah terong ungu (Solanum
melongena L.) adalah golongan alkaloid dan flavanoid.
-
2) Aktivitas antioksidan dari ekstrak etanol buah segar terong ungu (Solanum melongena L.) teridentifikasi pada menit ke-29 dan menit ke-58.
-
3) Besarnya aktivitas antioksidan yang diperoleh dari ekstrak etanol buah segar terong ungu (Solanum melongena L.) sangat lemah jika dibandingkan dengan aktivitas antioksidan vitamin C sebagai kontrol positif, yang ditunjukkan dengan nilai IC50 sebesar 535,89 µg/mL pada menit ke-29 dan 385,06 µg/mL pada menit ke-58.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui struktur senyawa flavonoid dan alkaloid yang terkandung dalam buah terong ungu (Solanum melongena L.).
DAFTAR PUSTAKA
Arifin Annisas, J., Nurul S., dan Putri P., 2011, Terung Ungu (Solanum melongena L.) sebagai Tablet Kontrasepsi Hisap Khusus Pria dalam Mendukung Program KB (Keluarga Berencana), Tersedia pada http://repository.ipb.ac.id/bitstream /handle/123456789/44233/PKM-GT-11-IPB-Januar-Terung%20Ungu%20Seba-gai.pdf?sequence=2, Diakses pada 17 Juni 2011
Boer, Y., 2000, Uji Aktivitas Antioksidan Ekstrak Kulit Buah Kandis (Garcinia parvifolia Miq), Jurnal Matematika dan IPA, 1 (1) : 26-33
Dalimartha, S. dan Soedibyo, M., 1999, Awet Muda Dengan Tumbuhan Obat dan Diet
Suplemen, Trubus Agriwidya, Jakarta, h. 36-40
Departemen Kesehatan RI, 1978, Materia Medika Indonesia, Jilid II, Depkes RI, Jakarta
Harborne, J.B., 1987, Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan, Edisi II, a.b. K. Padmawinata, ITB Press, Bandung
Kumalaningsih, 2006, Antosianin Alami, Trubus Agrisarana, Surabaya
Lemba, A.P., 2010, Pengaruh Jenis Pelarut dan Pengolahan Terhadap Aktivitas Antioksidan Pada Produk Olahan Kentang (Solanum tuberosum L.), Tersedia pada http://repository.upi.edu, Diakses pada 10 Juni 2011
Panovska, T.K., Kulevanova, S., and Stefova, 2005, In Vitro Antioxidant Activity of Some Teucrium Species (Lamiaceae), Acta Pharm, 55 : 207-214
Rohdiana, D., 2001, Aktivitas Daya Tangkap Radikal Polifenol Dalam Daun Teh, Majalah Jurnal Indonesia, 12 (1) : 53-58
Sastrapradja, S.D. dan Rifai, M.A., 1989, Mengenal Sumber Pangan Nabati dan Plasma Nutfahnya, Puslitbang Bioteknologi-LIPI, Bogor
Sinaga, I., 2009, Skrining Fitokimia dari Uji Aktivitas Antioksidan dari Ekstrak Etanol Buah Terong Belanda (Solanum betaceum Cav.), Tersedia pada http://repository.usu. ac.id/bitstream/123456789/14449/1/09E026 36.pdf. Diakses pada 15 Februari 2011
Sunarni, T., 2005, Aktivitas Antioksidan Penangkap Radikal Bebas Beberapa Kecambah Dari Biji Tanaman Familia Papilionaceae, Jurnal Farmasi Indonesia, 2 (2) : 53-61
152
Discussion and feedback