Pemanfaatan Rizobakteri Penghasil Indole Acetic Acid Sebagai Agens Penginduksi Ketahanan Tanaman Tembakau Terhadap Cucumber Mosaic Virus (CMV)
on
J. Agric. Sci. and Biotechnol.
ISSN: 2302-0113
Vol. 8, No. 1, Juli 2019
Pemanfaatan Rizobakteri Penghasil Indole Acetic Acid Sebagai Agens Penginduksi Ketahanan Tanaman Tembakau Terhadap Cucumber Mosaic Virus (CMV)
Ni Luh Gede Sriyanti1, Khamdan Khalimi2*), I Gede Rai Maya Temaja3
-
1Program Magister Bioteknologi Pertanian, Program Pascasarjana Universitas Udayana
-
2Laboratorium Biopestisida Fakultas Pertanian Universitas Udayana 3Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Udayana *)Corresponding author: khamdankhalimi@yahoo.com
Abstract
Tobacco is a high economic value commodity, in order to meet the demand for tobacco in the market it requires good quantity and quality. One of the disease that often causes harm to tobacco is Cucumber Mosaic Virus (CMV). The utilization of indole acetic acid (IAA)-producing rhizobacteria can be used to increase plant growth and resistance from pathogenic infection. The aim of this study was to determine the effectiveness of IAA producing rhizobacteria formula in increasing the growth of tobacco plants in greenhouses, and to determine the effectiveness of rhizobacterial formulations in increasing tobacco plant resistance against the infection of CMV.
Identification of compounds in tobacco leaves that infected with CMV was carried out to determine the effectiveness of rhizobacteria in inducing plant resistance. Compound analysis was carried out using Gas Mass Chromatography Spectroscopy (GCMS). The effectiveness of rhizobacteria in increasing plant growth and resistance was conducted in a greenhouse. Based on the results of the study, four of IAA-producing rhizobacteria isolates were Stenotrophomonas maltophilia Sg3, Proteus mirabilis BjB17, Bacillus thuringiensis TNJbx3.3, and Bacillus cereus GR12, all the rhizobacterial isolates were effective in increasing plant height, leaf number, leaf chlorophyll content, wet weight and dry weight leaf. Based on the results of the rhizobacterial effectiveness test, all rhizobacterial isolates were effective in increasing plant resistance as indicated by a lower intensity of infection. Based on the analysis of the tobacco leaves compounds content showed that rhizobacteria S. maltophilia Sg3 and P. mirabilis BjB17 were able to induce resistance to tobacco plants by forming antiviral compounds namely 2-Naphthalene-sulfonic acid and rhizobacteria Bacillus cereus GR12 can stimulate the formation of 1-Naphthalene-sulfonic acid compounds and 2-Naphthalene-sulfonic acid in tobacco as a form of induction of resistance to CMV infection.
Keywords: IAA producing rhizobacteria, resistance, CMV
Tembakau merupakan salah satu komoditas yang strategis dan memiliki nilai ekonomi tinggi, sehingga untuk memenuhi kebutuhan tembakau dipasaran produksi dan mutu yang baik menjadi pertimbangan utama dalam tehnik budidaya tembakau. Gangguan hama dan penyakit merupakan kendala untama yang dihadapi petani tembakau di Indonesia, karena dapat menurunkan hasil produksi dan merugikan dari segi ekonomis. Salah satu patogen yang paling sering dijumpai pada pertanaman tembakau di Indonesia yaitu adanya infeksi Cucumber mosaic virus (CMV). Tembakau yang terinfeksi CMV mengalami gejala mosaik, berkerut atau menggulung, kloroplas rusak, mesofilnya kurang mengalami diferensiasi, terjadi penurunan kandungan pati pada daun sehingga warna daun menjadi pucat (Wahyuni, 2005).
CMV sampai saat ini masih sulit dikendalikan karena virus ini memiliki banyak jenis tanaman inang, memiliki keragaman genetik yang tinggi (Schneider and Roossinck, 2001) dan tanaman yang telah terinfeksi oleh tidak dapat disembuhkan (Palukaitis et al.,1992), sehingga sampai saat ini belum diketahui senyawa kimia yang secara spesifik dapat mengendalikan perkembangan virus tanpa mempengaruhi tanaman inangnya. Salah satu upaya yang dapat dilakukan dengan memanfaatkan potensi rizobakteri penghasil IAA untuk penginduksi ketahanan tanaman tembakau terhadap infeksi CMV. Beberapa penelitian telah membuktikan bahwa penggunaan rizobakteri penghasil IAA mampu meningkatkan pertumbuhan dan ketahanan tanaman. Raupach et al. (1996) melaporkan benih metimun dan tomat yang diberi perlakuan dengan rizobakteria menghasilkan induksi ketahan sistemik terhadap infeksi sistemik CMV. Chivasa et al (1997) melaporkan bahwa perlakuan dengan rizobakteri dapat menghambat genom replikasi TMV pada daun tembakau, sehingga terjadinya penundaan gejala sistemik. Berdasarkan uraian di atas, maka penelitian ini dilaksanakan untuk meneliti kefektifan beberapa isolat rizobakteri penghasil Indole Acetic Acid (IAA) dalam meningkatkan pertumbuhan dan ketahanan tanaman tembakau terhadap serangan CMV.
Penelitian ini dilaksanakan di Laboratorium Biopestisida dan di Kebun Percobaan Fakultas Pertanian Universitas Udayana dari bulan September 2018 sampai dengan bulan Pebruari 2019.
-
2.2 Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah isolat rizobakteri Stenotrophomonas maltophilia Sg3, Proteus mirabilis BjB17, Bacillus thuringiensis TNJbx3.3, dan Bacillus cereus GR12 yang diperoleh dari koleksi Laboratorium Biopestisida Fakultas Pertanian Universitas Udayana, inokulum CMV, benih tembakau, media nutrient agar, media nutrient broth, tryptopan, carborundum, buffer fosfat, methanol, dan etil asetat. Alat yang digunakan dalam penelitian ini adalah, cawan petri, tabung reaksi, gelas ukur, pipet mikro, autoklaf, laminar air flow, timbangan digital, oven, mortal, dan Chlorophyllmeter Minolta-SPAD 502.
-
2.3 Persiapan Benih Tembakau
Benih tembakau direndam dengan air hangat selama 48 jam, kemudian di semai pada cawan petri yang telah dialasi dengan tisu basah, dan letakkan di dalam inkubator pada suhu 35oC selama 3-5 hari hingga berkecambah. Selanjutnya bibit di pindahkan ke potray yang sudah berisi media tanam.
-
2.4 Perendaman akar Tanaman Menggunakan Formulasi Rizobakteri
Rizobakteri dibiakan dalam medium nutrient broth selama 24 jam. Untuk memacu sintesis IAA ke dalam masing-masing media ditambahkan asam amino L-tryptopan 0,2 nM. Biakan rizobakteri di encerkan dengan konsentrasi 10% (400 ml air + 10 ml suspensi bakteri), selanjutnya akar tanaman tembakau yang berumur 4 minggu direndam dengan formulasi rizobakteri selama 4 jam kemudian ditanam dalam polibag.
-
2.5 Inokulasi Virus Secara Mekanis Pada Tanaman Tembakau
Inokulasi CMV dilakukan 14 hari setelah perlakuan perendaman akar menggunakan rizobakteri, selanjutnya daun yang menunjukkan gejala CMV diambil (dipanen) dijadikan ekstrak dicampur dengan buffer fosfat pH 7 (BF pH 7). Perbandingan daun segar dengan BF pH 7 1:10 yaitu 10 g daun segar dicampur dengan 100 ml BF pH 7. Daun diiris halus kemudian dihaluskan menggunakan mortal dengan menambahkan BF pH 7 dan disaring menggunakan kain kasa. Sap diinokulasikan ke daun termuda yang telah membuka penuh. Sebelum diinokulasi daun ditaburi dengan carborundum sebagai bahan abrasif kemudian Sap dioleskan pada permukaan daun dengan menggunakan cotton bud.
-
2.6 Deteksi CMV secara Serologi
Deteksi virus dilakukan pada 2 minggu setelah inokulasi dengan metode serologi DAS-ELISA dengan menggunakan antiserum CMV (Agdia). Hasil DAS-ELISA dianalisis secara kuantitatif dengan ELISA reader (Bio-RAD model 550-microplate reader, Tokyo, Japan) pada panjang gelombang 405 nm. Sampel dinyatakan positif jika nilai absorbansi ELISA (NAE) sampel uji 2 kali lebih besar dari pada NAE kontrol negatif ELISA (tanaman sehat). 1 g daun muda tanaman
tembakau yang terinfeksi CMV dan tidak terinfeksi dihomogenisasi dengan mortar dan 1 ml PBS (10 mM Na2HPO4, 0,1 M NaCl, pH = 7,0) 1:10 (g: ml). Homogenat disaring dengan kertas saring dan filtrat dikumpulkan. Sumur pelat ELISA dilapisi dengan anti-CMV immunoglobin g (IgG) pada 1,5 μg / ml dalam buffer lapisan (35 mM Na2HCO3, 15 mM Na2CO3, 0,2% serum albumin (BSA), dan 2% polivinil pirolidon, pH 9,6, 100 μl /well), dan diinkubasi pada suhu 4 ° C selama 12 jam. Pelat dicuci tiga kali dengan PBS yang mengandung 0,05% Tween-20 (PBST). Sumur kemudian dimuat dengan ekstrak daun (100 μl / well) dan diinkubasi pada suhu 4° C selama 12 jam dan dicuci tiga kali seperti sebelumnya. IgG terkonjugasi alkali fosfatase pada pengenceran 1: 2000 dalam buffer konjugat ditambahkan (100 μl /well). Pelat diinkubasi pada suhu 37 ° C selama 1 jam. Pelat dicuci seperti yang dijelaskan sebelumnya dan substrat P-nitrofenil fosfat pada 1 mg / ml dalam 10% dietilamina pH 9,8 ditambahkan (100 μl /sumur) dan nilai absorbansi pada 405 nm.
-
2.7 Analisis Senyawa dalam Daun dengan Meggunakan Kromatografi Gas-Spektroskopi Massa (GC-MS)
Deteksi senyawa antivirus dilakukan 15 hari setelah perlakuan inokulasi CMV dengan cara 10 g daun tembakau dihancurkan dalam nitrogen cair dan bubuk yang dihasilkan dilarutkan dalam 100 ml larutan ekstraksi yang terdiri dari methanol dan etyl asetat dengan perbandingan 1:1. Setelah 48 jam larutan dievaporasi menggunakan Vacum Rotary Evaporator pada suhu 40oC. Ekstrak selanjutnya dipartisi menggunakan methanol dan hexane dengan perbandingan 1:1, larutan fase methanol dan hexane dievaporasi menggunakan Vacum Rotary Evaporator pada suhu 40oC. Selanjutnya dilakukan deteksi senyawa yang terkandung dalam ekstrak daun dengan menggunakan Kromatografi Gas– Spektroskopi Massa (GC-MS QP2010 Ultra Shimadzu). Hasil deteksi dilakukan melalui kecocokan bobot molekul dan pola fragmentasi dari senyawa hasil isolasi dengan senyawa yang ada pada pustaka GC-MS.
-
2.8 Pengamatan Komponen Pertumbuhan
-
1. Tinggi tanaman maksimum
Tinggi tanaman didapat dengan mengukur tinggi batang utama dari pangkal batang tepat di permukaan tanah sampai titik tumbuh. Tinggi tanaman maksimum didapatkan setelah tanaman memasuki fase generatif dan tingginya tidak bertambah lagi, pengamatan dilakukan setiap minggu.
-
2. Jumlah daun maksimum
Jumlah daun maksimum didapat dari pengamatan mulai dari tanaman memasuki fase generatif sampai daun tidak mengalami penambahan jumlah lagi. Dihitung sebagai daun bila daun trifoliate telah membuka sempurna dan berwarna hijau. Pengamatan dilakukan setiap minggu dengan pengamatan pertambahan jumlah daun.
-
3. Berat Basah dan Berat Kering Daun
Pengukuran berat basah daun dilakukan dengan menimbang seluruh daun tanaman yang telah dipanen. Berat kering daun ditentukan dengan menimbang seluruh daun yang telah dikeringkan.
-
4. Kadar Klorofil Daun
Pengukuran kadar klorofil yang ada pada daun dilakukan dengan menggunakan alat Chlorophyllmeter Minolta -SPAD 502. Pengukuran klorofil daun dilakukan pada daun ke-2 dan ke-3 dari pucuk.
-
2.9 Penghitungan Intensitas Penyakit:
Pengamatan intensitas penyakit dilakukan dengan mengukur skor keparahan penyakit. untuk menghitung intensitas serangan cmv menggunakan rumus:
I=∑ × 100%
z.n
Dengan I: intensitas penyakit (%), n: jumlah daun dalam tiap kategori serangan, N: banyaknya daun yang diamati, V: nilai skala dari tiap kategori serangan, Z: nilai skala dari tiap kategori serangan yang tertinggi.
-
2.10 Analisis Data
Data yang diperoleh dalam penelitian ini dianalisis secara kuantitatif dengan menggunakan analysis of varians (ANOVA). Apabila data yang diperoleh menunjukan perbedaan secara nyata, maka dilanjutkan dengan uji Duncans Multiple Range Test (DMRT). Analisis statistik dengan bantuan software SPSS for windows version 17.0 tahun 2009.
Hasil penelitian menunjukkan bahwa perlakuan formula rizobakteri berpengaruh terhadap komponen hasil tanaman tembakau yang diinokulasi CMV. Perlakuan isolat S. maltophilia Sg3, P. mirabilis BjB17, B. thuringiensis TNJbx3.3, dan B. cereus GR12 memiliki nilai tinggi tanaman, jumlah daun dan kadar klorofil lebih tinggi jika dibandingkan dengan kontrol. Tanaman tembakau yang diberi perlakuan formula rizobakteri mampu mentoleransi infeksi CMV. Hal ini dibuktikan dengan hasil rata-rata tinggi tanaman yang terinfeksi CMV memberikan hasil yang lebih tinggi jika dibandingkan dengan perlakuan kontrol. Perlakuan S. maltophilia Sg3 mampu mentoleransi infeksi CMV paling baik jika dibandingkan dengan keempat perlakuan lainnya. Pada parameter tinggi tanaman perlakuan S. maltophilia Sg3 memiliki daya protektif sebesar 65,51%. Perlakuan P. mirabilis BjB17, B. cereus GR12 dan perlakuan B. thuringiensis TNJbx3.3 memiliki daya protektif secara berturut-turut sebesar 29,38%, 16,81%, dan 8,57% jika dibandingkan dengan kontrol (Tabel1). Pada parameter jumlah daun, perlakuan S. maltophilia Sg3 memiliki daya protektif sebesar 30,76%, perlakuan P. mirabilis BjB17 memiliki daya protektif sebesar 23,07%, perlakuan B. thuringiensis
TNJbx3.3 sebesar 7,69%, dan perlakuan B. cereus GR12 sebesar 15,38% jika dibandingkan dengan kontrol.
Daun tembakau dengan perlakuan formula rizobakteri memiliki kandungan klorofil yang lebih tinggi dibandingkan dengan tanpa perlakuan rizobakteri. Pada parameter kandungan klorofil daun perlakuan S. maltophilia Sg3 memiliki daya proteksi sebesar 51,43%, diikuti oleh perlakuan B. cereus GR12 dengan daya proteksi sebesar 28,99%, perlakuan P. mirabilis BjB17 dengan daya proteksi sebesar 14,20%, dan perlakuan B. thuringiensis TNJbx3.3 dengan daya proteksi sebesar 11,63% jika dibandingkan dengan kontrol. Tanaman yang terinfeksi virus mengalami perubahan aktivitas hormon pertumbuhan dan menyebabkan berkurangnya kemampuan tanaman dalam menyerap nutrisi dari dalam tanah. Penurunan fisiologi tanaman seperti tingginya laju transpirasi akibat rusaknya daun dan penurunan jumlah klorofil menyebabkan rendahnya proses fotosintesis, sehingga rusaknya sistem metabolisme tanaman menyebabkan pertumbuhan yang abnormal dan tanaman menjadi kerdil (Akin, 2006). Tanaman yang diberikan perlakuan rizobakteri akan membentuk sistem pertahanan yang mampu menghambat multiplikasi virus dan menurunkan konsentrasi virus, sehingga dengan konsentrasi virus yang lebih rendah, tanaman yang terinfeksi CMV mampu untuk tumbuh tanpa adanya penurunan hasil yang signifikan jika dibandingkan dengan tanaman sakit pada perlakuan kontrol (Chasanah, 2007).
Tabel 1. Pengaruh formula rizobateri terhadap komponen pertumbuhan dan hasil
tanaman tembakau
|
Perlakuan |
Tinggi Tanaman (cm) |
Jumlah Daun |
Kloropil Daun (SPAD unit) |
Berat Basah (g) |
Berat Kering (g) |
|
Kontrol |
49,0 e* |
13,0 c |
32,66 d |
120,4 e |
17,7 e |
|
Sg3 |
81,1 a |
17,0 a |
49,46 a |
321,6 a |
42,7 a |
|
(65,51%)** |
(30,76%) |
(51,43%) |
(167,1%) |
(141,2%) | |
|
BjB17 |
63,4 b |
16,0 ab |
37,30 c |
298,6 b |
39,0 b |
|
(29,38%) |
(23,07%) |
(14.20%) |
(148%) |
(120%) | |
|
TNJbx3.3 |
53,2 d |
14,0 bc |
36,46 cd |
208,8 d |
32,4 c |
|
(8,57%) |
(7,69%) |
(11,63%) |
(73,42%) |
(83,0%) | |
|
GR12 |
57,24 c |
15,0 abc |
42,13 b |
210,2 c |
30,9 d |
|
(16,81%) |
(15,38%) |
(28,99%) |
(74,58%) |
(74,57%) |
Keterangan: *Nilai yang diikuti huruf yang sama pada kolom yang sama
menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5% **Nilai dalam kurung menunjukkan persentase peningkatan.
Pada parameter hasil tanaman menunjukkan bahwa semua perlakuan formula rizobakteri mampu memproteksi tanaman terhadap infeksi CMV yang ditunjukkan dengan berat basah dan berat kering daun yang lebih tinggi dibandingkan dengan kontrol. Perlakuan rizobakteri S. maltophilia Sg3 memiliki daya protektif sebesar 167,1% dan 141,2 %, diikuti oleh perlakuan P. mirabilis
BjB17 dengan daya protektif sebesar 148% dan 120%, perlakuan B. cereus GR12 dengan daya protektif sebesar 74,58% dan 74,57%, perlakuan B. thuringiensis TNJbx3.3 dengan daya protektif sebesar 73,42% dan 83,0% jika dibandingkan dengan kontrol. Tanaman tembakau dengan perlakuan perendaman rizobakteri memberikan pengaruh yang lebih baik jika dibandingkan tanpa perendaman formulasi rizobakteri. Proses pertumbuhan pada fase vegetatif akan menentukan hasil panen tanaman, sehingga sesuai dengan hasil analisa sebelumnya bahwa aplikasi ke empat perlakuan rizobakteri penghasil IAA mampu meningkatkan jumlah dan kandungan klorofil daun tembakau. Kemampuan tanaman menghasilkan jumlah daun yang banyak dengan kandungan klorofil yang tinggi, akan meningkatkan aktivitas fotosintesis, sehingga biomasa tanaman yang merupakan akumulasi fotosintat memberikan hasil lebih tinggi dibandingkan dengan perlakuan kontrol. hasil penelitian Surette et al. (2003) menunjukkan bahwa bakteri Pseudomonas penghasil IAA dapat meningkatkan tinggi tanaman sebesar 56,6%, jumlah daun, diameter batang 11% dan pembentukan cabang sebesar 35,7%. Sejalan dengan hasil penelitian Khalimi (2017) bahwa rizobakteri S. maltohilia Sg3 dan B. cereus GR12 penghasil hormon IAA dapat meningkatkan kandungan klorofil daun tanaman edamame sebesar 21,26% dan 13,88% Diyansah et al. (2013) melaporkan bahwa perlakuan B. subtilis yang diaplikasikan tanaman B. juncea dapat meningkatkan bobot basah daun sebesar 36,08%, sedangkan perlakuan menggunakan P. fluorescens dapat meningkatkan bobot kering daun sebesar 21,12 % jika dibandingkan dengan perlakuan kontrol.
Berdasarkan hasil analisis menunjukkan semua perlakuan formula rizobakteri mampu memproteksi tanaman terhadap infeksi CMV. Pada parameter intensitas penyakit, perlakuan S. maltophilia Sg3 memiliki daya protektif sebesar 58,86%, diikuti oleh perlakuan B. cereus GR12 dengan daya protektif sebesar 31,91%, perlakuan P. mirabilis BjB17 dengan daya protektif sebesar 27,65%, dan perlakuan B. thuringiensis TNJbx3.3 dengan daya protektif sebesar 19,85%, jika dibandingkan dengan kontrol (Tabel 2).
Tabel 2. Pengaruh rizobakteri terhadap Nilai Absorbansi ELISA dan intensitas
penyakit CMV
|
Perlakuan |
Nilai Absorbansi ELISA |
Intensitas Penyakit (%) |
|
Kontrol |
2,825 a |
70,5 a |
|
Sg3 |
0,152 d |
29,0 d (58,86%) |
|
BjB17 |
0,554 c |
51,0 bc (27,65%) |
|
TNJbx3.3 |
0,889 b |
56,5 b (19,85%) |
|
GR12 |
0,321 cd |
48,0 c (31,91%) |
Keterangan: Nilai yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata berdasarkan uji DMRT 5%
Perlakuan formula rizobakteri mampu meningkatkan sistem ketahanan tanaman tembakau sehingga dapat mengurangi tingkat keparahan penyakit berdasarkan perkembangan gejala, dan mengurangi akumulasi virus pada tanaman tembakau berdasarkan nilai absorbansi ELISA pada 405 nm. Perlakuan S. maltophilia Sg3 mampu mereduksi akumulasi virus dalam tanaman berdasarkan nilai absorbansi ELISA pada 405 nm yaitu dari 2,825 menjadi 0,152. Perlakuan B. cereus GR12 mereduksi akumulasi virus dari 2,825 menjadi 0,321, perlakuan P. mirabilis BjB17 dan perlakuan B. thuringiensis mampu mereduksi akumulasi virus dari 2,825 menjadi 0,554 dan 0,889 (Tabel 2).
Adanya akumulasi virus pada tanaman yang diinokulasikan CMV menyebabkan pertumbuhan tanaman menjadi terganggu. Gejala yang ditimbulkan pada daun tembakau akibat infeksi CMV beragam mulai dari gejala mosaik, klorosis, malformasi, daun berkerut dengan tepi daun menggulung. Sejalan dengan pernyataan Lucas (1975) daun yang terserang CMV menunjukkan perubahan warna secara nyata, daun menyempit dan mengalami distorsi. Variasi gejala yang timbul akibat inokulasi CMV disajikan pada Gambar 1.

Gambar 1. Variasi gejala daun tembakau yang terserang CMV
A. Perlakuan kontrol, B. Perlakuan S. maltophilia Sg3, C. Perlakuan B. cereus GR12, D. Perlakuan B. thuringiensis TNJbx3.3, E. Perlakuan P. mirabilis BjB17
Gejala yang muncul pada daun dengan perlakuan formula rizobakteri lebih sedikit jika dibandingkan dengan daun pada perlakuan kontrol, hal ini disebabkan oleh mekanisme ketahanan yang diinduksi dari perlakuan keempat rizobakteri penghasil IAA yang membantu sistem metabolisme tanaman, sehingga ketika inokulasi CMV tanaman merespon cepat dengan memobilisasi metabolit sekunder yang dapat mengurangi penyebaran virus ke jaringan yang lain (A’yun et al. 2013). Tanaman tembakau dengan perlakuan rizobakteri menunjukkan bahwa tanaman yang terinfesi CMV tidak menyebabkan terjadinya kehilangan hasil yang tinggi jika dibandingan dengan tanaman yang tanpa diberian perlakuan rizobakteri, hal
tersebut terbukti dari hasil analisa pertumbuhan tanaman yaitu tinggi tanaman, jumlah daun, kandungan klorofil daun, berat basah dan kering daun, yang menunjukkan bahwa keempat perlakuan rizobakteri memiliki nilai rata-rata yang lebih tinggi jika dibandingan dengan nilai rata-rata pada perlakuan kontrol. Rizobakteri membantu untuk menginduksi sistem ketahanan pada tanaman dengan meningkatkan metabolit tanaman inang dan merubah fisiologis tanaman melalui sintesis senyawa fitoaleksin (Compant et al., 2005).
Hasil analisis menggunakan Gas Chromatography Spektroskopi Massa dari esktrak daun tembakau pada perlakuan kontrol menunjukkan bahwa terdapat 4 peak yang mengindikasikan terdapat 4 senyawa pada ekstrak daun tembakau pada perlakuan kontrol (Gambar 2). Dari hasil analisis menunjukkan bahwa keempat senyawa yang teridentifikasi pada perlakuan kontrol yaitu 4-Aminothiophenol (C6H7NS), Nicotine (C10H14N2), Cis/trans-spiro[1,2-Dihydro-1-oxoacenaphthylene-2,7’-8’-oxabicyclo[4,2.0]octane] (C9H27AsO3Si3), dan 2-Methyl-5H-dibenz[b,f]azepine (C15H13N). Dari keempat senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan kontrol tidak ada yang memiliki aktivitas antivirus.
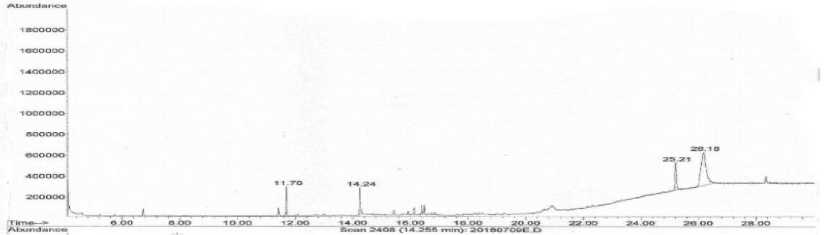
Gambar 2. Kromatogram hasil GCMS senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan kontrol
Dari hasil Gas Chromatography ekstrak daun tembakau pada perlakuan S. maltophilia Sg3 menunjukkan terdapat 8 peak yang mengindikasikan terdapat 8 senyawa yang teridentifikasi (Gambar 3). Hasil analisis senyawa dengan mass spectrometric analysis menunjukkan bahwa esktrak daun pada perlakuan S. maltophilia Sg3 teridentifikasi 7 senyawa yaitu 2-Pentanone, 4-methoxy-4-methyl-,1-ISOPROPYL-4-METHYL-3-CYCLOHEXEN-1-OL, Beta-Phellandrene, Nicotine, Naphthalene,decahydro-4a-methyl-1-methylene-7-(1-methylethenyl)-, [4aR-(.alpha., 7.alpha., 8a.beta.)], 2-Naphthalene-sulfonic acid, dan Diethyl-1-(carb-n-butoxy) propylphosphonate. Sesuai dengan referensi dan hasil analisis menunjukkan dari tujuh senyawa yang telah terindentifikasi dalam ekstrak daun tembakau, terdapat satu senyawa yang memiliki aktivitas antivirus yaitu senyawa 2-Naphthalene-sulfonic acid.
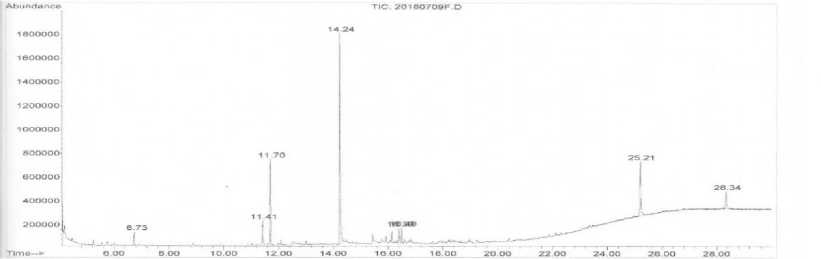
Gambar 3. Kromatogram hasil GCMS senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan S. maltophilia Sg3.
Hasil Gas Chromatography ekstrak daun tembakau pada perlakuan P. mirabilis BjB17 menunjukkan terdapat 23 peak yang mengindikasikan terdapat 23 senyawa yang teridentifikasi pada ekstrak daun tembakau (gambar 4). Hasil analisis senyawa dengan mass spectrometric analysis menunjukkan bahwa ekstrak daun tembakau pada perlakuan P. mirabilis BjB17 teridentifikasi sembilan belas senyawa yaitu Acetic acid, Acetamide,N-butyl-, 3-Cyclohexen-1-ol,4-methyl-1-(1-methylethyl)-(R), 4(10)-Thujene, 4-(2-Methoxypropan-2-yl)-1-methylcyclohex-1-ene, Nicotine, Pyridine,2-(1-methyl-2-pyrrolidinyl)-, Bicyclo [7.2.0] undec-4-ene,-trimethyl-8-methylene-(E)-(1R,9S)-(-)-,1,4,7,-Cycloundecatriene,1,5,9,9-tetramethyl, Gamma-muurolene, Beta-selinene, 2-Isopropenyl-4A,8-dimethyl-4,4A,5,6,8A-octahydronaphthalene, 2-Naphthalene-sulfonic acid, methyltris-(trimethylsiloxy) silane, Arsenous acid, tris (trimethylsilyl) ester, Cyclotrisiloxane, hexamethyl, Diethyl-1-(carb-n-butoxy)propylphosphonate, 5-nitrobenzofuran-2-carboxylic acid, 5,8-Epoxy-15-nor-labdane. Berdasarkan hasil analisis dari sembilan belas senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan P. mirabilis BjB17 ditemukan satu senyawa yang terindetifikasi yaitu 2-Naphthalene-sulfonic acid sebagai senyawa antivirus.

Gambar 4. Kromatogram hasil GCMS senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan P. mirabilis BjB17
Hasil Gas Chromatography ekstrak daun tembakau yang diberi perlakuan formula B. thuringiensis TNJbx3.3 menunjukkan terdapat 17 peak yang mengindikasikan terdapat 17 senyawa yang teridentifikasi (Gambar 5). Hasil mass spectrometric analysis pada esktrak daun tembakau perlakuan B. thuringiensis TNJbx3.3 teridentifikasi 13 senyawa yaitu Ethanamine, 2-methoxy-, 2-Methyl-2-cyclopenten-1-ol, 2-Pentanone,4-hydroxy-4-methyl-, 1-Nitro-2-acetamido-1,2-dideoxy-d-mannitol, 2-Pentanone,4-methoxy-4- methyl-, 3-Cyclohexen-1-ol,4-methyl-1-(1-methylethyl)-(R), 4(10)Thujene, Nicotine, 1,2-Benzenedicarboxylic acid, dibutyl ester, 4-Methyl-2-trimethylsilyloxy-acetophenone, Diethyl-1-(carb-n-butoxy)propylphosponate, 1,2-Benzisothiazol-3-amine,derivative, 5,8-Epoxy-15-nor-labdane. Dari tiga belas senyawa yang berhasil teridentifikasi dalam ekstrak daun tembakau perlakuan B. thuringiensis TNJbx3.3 BjB17 tidak ditemukan senyawa yang memiliki aktivitas antivirus.

Gambar 5. Kromatogram hasil GCMS senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan B. thuringiensis TNJbx3.3
Hasil Gas Chromatography ekstrak daun tembakau pada perlakuan B. cereus GR12 menunjukkan terdapat 27 peak yang mengindikasikan terdapat 27 senyawa yang teridentifikasi (Gambar 6). Berdasarkan hasil analisis menunjukkan terdapat 23 senyawa yang teridentifikasi, yaitu Silver acetate, 2-Pentanone-4-hydroxy-4-methyl-, Acetamide, N-butyl-, 3-Cyclohexen-1-ol,4-methyl-1-(1-methylethyl)-, 4(10)-Thujene, Chavicol, 3,4-Dimethyl cyclopentenolone, Nicotine, Pyridine,3-(1-methyl-2-pyrrolidinyl)-,(S)-, Acetamide,N-(1 methylpropyl)-, 1-Pyridineacetamide,4-(aminocarbonyl)-N-(2-cyano-4,5-dimethoxyphenyl) hexa hydro-, Beta-Selinene, Phenol,2-methoxy-4-(2-propenyl)-acetate, Urea, N-methyl-N-nitroso, 1H-Indole,5-methyl-2-phenyl-, N-methyl-1-adamantaneacetamide, Cyclotrisiloxane, hexamethyl-, 2-Naphthalene-sulfonic acid, 1-Naphthalene-sulfonic acid, Diethyl-1(carb-n-butoxy) propylphosphonate, Methyltris(trimethylsiloxy)silane, Cyclotrisiloxane, hexamethyl-, 5-isopropenyl-2,7-dimethyl-1,8-nonadiene, 5,8-Epoxy-15-nor-labdane. Dari 23 senyawa yang berhasil teridentifikasi dalam ekstrak daun tembakau perlakuan B. cereus GR12,
terdapat 2 senyawa yang memiliki aktivitas antivirus yaitu 2-Naphthalene-sulfonic acid dan 1-Naphthalene-sulfonic acid.

Gambar 6. Kromatogram hasil GCMS senyawa yang teridentifikasi dalam ekstrak daun tembakau pada perlakuan B. cereus GR12
1-Naphthalene sulfonic acid memiliki berat molekul 208,231 g/mol dengan rumus molekul C10H8O3S dan 2-Naphthalene sulfonic acid memiliki berat molekul 226.246 g/mol dengan rumus molekul C10H10O4S merupakan senyawa yang terindentifikasi pada ekstrak daun tembakau yang memiliki aktivitas sebagai antivirus. Hasil kromatogram menunjukkan dalam ekstrak daun tembakau perlakuan bakteri S. Maltophilia Sg3 terdeteksi senyawa 2-Naphthalene sulfonic acid yang muncul pada puncak ke 7 pada retensi waktu 25,21 menit dengan persentase area 16,94%. Hasil kromatogram perlakuan bakteri B. cereus GR12 senyawa 1-Naphthalene sulfonic acid muncul pada puncak 19 dengan retensi waktu 23,47 menit dengan persentase area 0,46% dan senyawa 2-Naphthalene sulfonic acid muncul pada puncak ke 18 dengan retensi waktu 24,34 menit dengan persentase area 0,75%. Senyawa 2-Naphthalene sulfonic acid juga terdeteksi pada ektrak daun dengan menggunakan perlakuan formula bakteri P. mirabilis BjB17, yang muncul di puncak ke 13 pada retensi waktu 21,89 menit dengan persentase area 3,69%.
Hiyama (1952) melaporkan bahwa senyawa turunan Hydroxynaphthalene Sulfonic Acid seperti 1-Naphthol 2-(3-, 4-, 5-) sulfonic acid, 1-naphthol-3, 6-(3, 8) disulfonic acid, 1-(2-) naphthol-3, 6, 8trisulfonic acid, 2-naphthol-l-(6-, 7-) sulfonic acid, 2-naphthol-3, 6-(6, 8-) disulfonic acid, 1 2-dihydroxynaphthalene-4-sulfonic acid, 1, 2-naphthoquinone-4-sulfonic acid, 2-amino-naphthol-4-sulfonic acid, l-naphthol-4-sulfonamide, l-ethoxynaphthalene-4-sulfonamide, dan N-(3-hydroxy-4-oxo-l-naphthylidene)-naphthionic acid memiliki aktivitas sebagai antibakteri dan antivirus. 1-Naphthalene-sulfonic acid dan 2-Naphthalene-sulfonic acid merupakan sinonim dari senyawa Naphthalene sulfonate yang memiliki aktivitas antivirus. Rusconi et al., (1996) melaporkan bahwa Naphthalene sulfonate dapat menghambat replikasi HIV tipe 1 pada sel Lymphoblastoid. Senyawa Naphthalene sulfonate dapat menghambat enzim RNA-dependent RNA polymerase pada Norovirus, virus penyebab diare pada manusia (Tarantino et al.,
2014). Dari hasil penelitian menunjukkan bahwa perlakuan formulasi bakteri S. maltophilia Sg3, B. cereus GR12, dan P. mirabilis BjB17 yang diaplikasikan pada tanaman tembakau dapat menginduksi terbentuknya senyawa antivirus yaitu 1-Naphthalene-sulfonic acid dan 2-Naphthalene-sulfonic acid.Senyawa Naphthalenesulfonic acid diketahui memiliki aktifitas antivirus terhadap virus-virus yang menginfeksi manusia dan hewan. Tetapi dari hasil penelitian yang dilakukan membuktikan bahwa, perlakuan dengan menggunakan bakteri S. maltophilia Sg3, B. cereus GR12, dan P. mirabilis BjB17 penghasil IAA dapat menginduksi ketahanan tanaman dengan membentuk satu senyawa anti virus yaitu Naphthalenesulfonic acid, sehingga mampu mereduksi akumulasi virus CMV dan gejala penyakit akibat infeksi virus pada tanaman tembakau.
Perlakuan formula rizobakteri penghasil IAA efektif meningkatkan komponen pertumbuhan, komponen hasil tanaman dan ketahanan tanaman tembakau. Hasil analisis GC-MS pada ekstrak daun tembakau menunjukkan bahwa bakteri S. maltophilia Sg3, B. cereus GR12, dan P. mirabilis BjB17 mampu menginduksi sistem ketahanan tanaman dengan merangsang pembentukan senyawa antivirus Naphthalene sulfonic acid.
Daftar Pustaka
Akin, H.M. 2006.Virologi Tumbuhan. Penerbit Kanisius. Yogyakarta.
A’yun, K.Q., T. Hadiastono, M. Martosudiro. 2013. Pengaruh Penggunaan PGPR (Plant Growth Promoting Rhizobacteria) terhadap Intensitas TMV (Tobacco Mosaic Virus), Pertumbuhan, dan Produksi pada Tanaman Cabai Rawit (Capsicum frutescens L.). Jurnal Hama dan Penyakit Tumbuhan. 1(1).47-56
Chasanah, U. 2007. Pemanfaatan Rizobakteri Pemacu Pertumbuhan Tanaman (rppt) untuk Menginduksi Resistensi Sistemik Mentimun terhadap Zucchini Yellow Mosaic Potyvirus (zymv). Tesis; Institut pertanian Bogor
Chivasa, S., Murphy A M, M. Naylor, JP. Carr. 1997. Salicylic Acid Interferes With Tabacco Mosaic Virus Replication Via a Novel Salicylhydroxamic Acid Sensitive Mechanism. Plant Cell 9: 547-555.
Compant, S., Duffy B, Nowak J, Clement C, and E.A Barka. 2005. Use of Plant Growth Promoting Bacteria for Biocontrol of Plant Diseases; rinciples, Mechanisms of Action, and Future Prospects. Applied and Environmental Microbiology 71:4951-4958.
Diyansah, B., Aini, L.Q., and Hadiastono, T. 2003. The effect of PGPR (plant growth promoting rhizobacteria) Pseudomonas fluorescens and Bacillus subtilis on leaf mustard plant (Brassica juncea L.) infected by TuMv (Turnip Mosaic Virus). J Trop. Plant Prot.1(1):30-38
Hiyama, M. 1952. Studies on Naphthalene Sulfonic Acid derivatives. II. Aminonaphthalene Sulfonamide derivatives; Syntheses and test for their
effects on bacteria and viruses. The Kanto Districts Meeting of the Pharmaceutical Society of Japan.72: 1368-1370.
Khalimi, K. 2017. Pemanfaatan Rizobakteri sebagai Biostimulan untuk Meningkatkan Kuantitas dan Kualitas Hasil Kedelai Edamame (Glycine max L. Merrill). (Disertasi). Denpasar: Universitas Udayana.
Lucas, G.B. 1975. Disease of Tobacco. Harold E, Parker and Sons Printer; North Carolina.
Palukaitis, P., M. J. Roossinck, R. G. Dietzgen, R. I. B. Francki.1992. Cucumber mosaic virus. Adv. Virus Res. 41: 281-348.
Raupach, G.S., L. Liu, J.F. Murphy, S. Tuzun, J.W. Kloepper. 1996. Induced Systemic Resistance in Cucumber Mosaic Cucumovirus Using Plant Growth Promoting Rhizobacteria (PGPR). Plant Diseses. 80:891-895.
Rusconi, S., Mona, M., Debra, P.M., Peter, V.P., Edith, A.N., Shyam, K.S., Kevin, J.W., Marcia, S.O., Albert, T.P., James, C.J., Martin, S.H. 1996. Naththalene sulfonate polymers with CD4-blocking and anti-human immunodeficiency virus type 1 activities. Antimicrobial Agents and Chemotherapy 40 (1): 234236.
Schneider, W.L., Roossinck, M.J. 2001. Genetic diversity in RNA virus quasispecies is controlled by host-virus interactions. Journal of Virology 75 (14): 6566-6571.
Surette MA, Stunz A.V., Lara R.R, Nowak J. 2003. Bacterial Endophytes in Processing Carrots (Ducus carota L. Var. Satvus): Their Localization, Population Density, Biodiversity and Their Effects on Plant Growth.Pe. Soil. 253:381-390.
Tarantino, D., Margherita, P., Eloise, M., Romina, C., Jacques, R., Ivonne, R., Martino, B., Mario, M. 2014. Naphthalene Sulfonate Inhibitors of Human Norovirus RNA-dependent RNA Polymerase. Antiviral Research.102: 2328.
Wahyuni, W.S. 2005. Dasar -Dasar Virologi Tumbuhan. Gadjah Mada University Press. Yogyakarta.
https://ojs.unud.ac.id/index.php/JASB
21
Discussion and feedback