MANFAAT BEBERAPA JENIS MIKROBA YANG DIISOLASI DARI KAYU LARU (Peltophorum pterocarpum.) DAN MUR SEBAGAI STARTER DALAM PEMBUATAN LARU DAN SOPI DI PULAU TIMOR
on
J. Agric. Sci. and Biotechnol.
ISSN: 23020-113
Vol. 5, No. 1, Juli 2016
MANFAAT BEBERAPA JENIS MIKROBA YANG DIISOLASI DARI KAYU LARU (Peltophorum pterocarpum.) DAN MUR SEBAGAI STARTER DALAM PEMBUATAN LARU DAN SOPI
DI PULAU TIMOR
Regina I. M BanoEt, I Made Sudana*, dan I.G.N. Alit Susanta Wirya
Program Magister Bioteknologi Pertanian, Program Pascasarjana Universitas Udayana
Jl. PB. Sudirman Denpasar Bali Indonesia
* Corresponding author’s email : imadesudana74@yahoo.com
Abstract
The traditional knowledge of farmers in producing alcohol from palm sap can be used as a basis to produce high-value economic products such as medical alcohol, industrial alcohol and ethanol. Food products and traditional fermented beverage are one of the main sources to obtain the potential microbe for microbial fermentation industry. Information on the wood of laru role as agents of microbial cultures and mur for a starter in the making of laru and sopi has not been much identified.
The research was conducted in three stages. The first stage of the research, namely the microbial isolation of seven basic materials of making laru and sopi. The identification of microbes by using the API 20C AUX kits and a selection of microbes which have the ability to perform fermentation. The second stage of the research is the production test and gin laru utilize the selection and identification of microbes of, to find the best treatment combination that produces the highest alcohol content. The third stage of the research is the identification of molecular of microbes of culture results that have the best fermentation activities. The first and the third stages were exploratory studies by using the experimental design in the laboratory. The data were collected by means of direct observation. The theoretical analysis was made to describe the experimental results. The second stage of the testing of making laru and sopi to determine the percentage of alcohol content produced. The second stage was an experimental study, designed in the basic experimental design of RAL. The obtained data were analyzed with analysis of variance (ANOVA) to determine the real level of treatment effects, followed by LSD test to determine the level of significant differences between treatments. Each treatment combination was repeated four times. Two controls were used i.e; nira, palm sap without addition of a starter, and a solution of sugar with addition of the laru wood starter. The study was conducted in Labotory of Microbiology and Analytical Chemistry of The Food and Drug Administration Center for Kupang, East Nusa Tenggara.
The experimental results showed that the microbes of laru wood and Mur are from the group of yeast. For the making of effective laru and sopi which to be sources of the microbes is red Mur and white Laru. The microbial species were identified as Saccharomyces cerevisiae. The resulting alcohol content on the microbes fermentor of Saccharomyces cerevisiae in the test of making red laru was 8.43%, white laru was 7.05%, sopi and nira/palm wine were 21.44%, and
sopi from the aer sugar solution was 23.20%. Saccharomyces cerevisiae can also be combined with wood of laru as a starter in the making of laru and sopi. The combination of the two was the best treatment, resulted in the highest alcohol content at 8.90% of red laru, white laru at 8.40%, sopi from nira at 23.38%, and sopi from aer sugar solution at 23.91%.
Key words : Fermentation of alcohol, Laru, Sopi, Saccharomyces cerevisiae, Peltophorum pterocarpum.
Suku-suku yang ada di Propinsi Nusa Tenggara Timur (NTT) mempunyai minuman khas tradisional yang mengandung alkohol. Pengetahuan tradisional petani menghasilkan minuman beralkohol dari nira lontar dapat dimanfaatkan sebagai dasar untuk menghasilkan produk ekonomi bernilai tinggi yaitu bioetanol.
Dalam pembuatan laru dan sopi ,starter diperoleh dari mur atau kayu laru. Mur adalah endapan hasil fermentasi yang terbentuk empat hari setelah kayu laru dimasukkan dalam nira atau larutan gula aer. Rahmansyah (1998) dalam Naiola (2008) melaporkan kadar alkohol laru putih 4,8% - 5,8%, Laru Merah 5,8% -7,7% dan sopi 19,5% - 20,6%.
Produk makanan dan minuman hasil fermentasi tradisional merupakan salah satu sumber utama mendapatkan mikroba berpotensi untuk industri fermentasi makanan dan minuman. Mikroba pada substrat atau beberapa tahapan proses fermentasi dapat diisolasi serta diskrining kemampuan enzimnya. Isolat terseleksi dari proses tradisional perlu dimurnikan, dipelihara di suatu culture collection yang profesional agar setiap waktu dapat dimanfaatkan dan sifat unggulnya tidak mengalami perubahan (Ganjar, 2007).
Informasi peran kayu laru sebagai agen biakan mikroba dan mur untuk starter dalam pembuatan laru dan sopi belum banyak teridentifikasi. Untuk itu maka diperlukan penelitian untuk mengidentifikasi keragaman kandungan jenis mikroba yang berasosiasi dengan kayu laru sebagai agen biakan dan mur sebagai starter dalam menghasilkan alkohol pada minuman laru dan sopi.
Isolasi mikroba sebagai fermentor pada pembuatan laru dan sopi dari kayu laru, gula aer, nira, laru putih, laru merah, mur laru putih dan mur laru merah dilaksanakan dengan cara sebagai berikut :
-
2.2 Mikroba dari kayu laru
Kayu laru sebanyak 25 g direndam dalam aguades sebanyak 250 ml selama lima hari (120 jam). Isolasi mikroba dilakukan setelah lima hari. Diambil cairan hasil perendaman kayu laru sebanyak satu loop ose dan diinokulasikan kedalam cawan petri yang berisi 5 ml media PDA dengan penambahan 100 mg/1 (chloramphenicol). Biakan diinkubasi selama tiga sampai empat hari (72 – 96 jam) pada suhu 20 – 220C. Koloni mikroba yang tumbuh dipindahkan pada media PDA baru dengan metode penggoresan. Koloni yang tumbuh pada goresan terakhir merupakan koloni yang murni. Koloni ini dipindahkan ke dalam agar miring untuk digunakan sebagai bahan penelitian selanjutnya.
-
2.3 Mikroba dari nira
Diambil sebanyak 250 ml Nira segar dari petani penyadap nira. Isolasi mikroba dari nira dilakukan sama dengan cara isolasi mikroba dari kayu laru.
-
2.4 Mikroba dari gula aer
Diambil gula aer yang baru dimasak dari penyadap nira yang memasak nira menjadi gula aer sebanyak 250 ml. Isolasi mikroba dari gula aer dilakukan sama dengan cara isolasi mikroba dari kayu laru.
-
2.5 Mikroba dari laru putih dan mur laru putih
Laru putih dan mur laru putih hasil fermentasi 120 jam diambil dari petani yang memproduksi laru putih sebanyak 250 ml. Isolasi mikroba dari laru putih dan mur laru putih dilakukan sama dengan cara isolasi mikroba dari kayu laru.
-
2.6 Mikroba dari laru merah dan mur laru merah
Laru merah dan mur laru merah hasil fermentasi 120 jam diambil dari petani yang memproduksi laru merah sebanyak 250 ml. Isolasi mikroba dari laru merah dan mur laru merah dilakukan sama dengan cara isolasi mikroba dari kayu laru.
-
2.7 Identifikasi mikroba
Mikroba-mikroba yang diperoleh dari hasil isolasi di atas, setelah dimurnikan diidentifikasi mengunakan Kit API 20C AUX.
-
2.8 Seleksi mikroba sebagai fermentor pada pembuatan laru dan sopi
Masing-masing mikroba yang diperoleh dari hasil isolasi, dibiakkan dalam media PDA pada cawan petri dan diinkubasi selama 3 – 4 hari. Diambil satu ose dari masing-masing biakan, diinokulasikan pada 5 ml nira segar dan 5 ml larutan gula aer dan diinkubasi 120 jam. Setiap 24 jam diamati karakteristik kemampuan fermentasi masing-masing mikroba. Karakteristik yang diamati adalah: Adanya aroma alkohol, Terbentuknya buih, Perubahan warna dan Adanya endapan pada cairan
-
2.9 Analisis kadar alkohol laru dan sopi
Analisis kadar alkohol pada laru putih, laru merah dan sopi menggunakan metode Kromatografi Gas (GC) dilakukan di laboratorium Kimia Analitik BPOM Kupang.
-
2.10 Identifikasi molekuler mikroba
Identifikasi molekuler pada mikroba dengan hasil karakteristik fermentasi terbaik dilakukan secara molekuler berdasarkan analisis genetika dengan menggunakan daerah internal transcribed spacer (ITS) yang terdiri dari ITS 1 dan ITS2 serta 5.8S rRNA. Ekstraksi DNA menggunakan DNA PhythopureTM Kit Extraction (GE Healthcare, UK).
Amplifikasi PCR menggunakan ITS_5F:5`--GGAAGTAAAAGTCGTA ACAAGG--3`dan ITS_4R:5`TCCTCCGCTTATTGATATGC--3` (White et al. 1990). Amplifikasi ini dilakukan pada volume 25 ml dengan komposisi reaksi yaitu: nuclease free water 10 µl, Go taq green mastermixTM 12.5 µl, ITS5 dan ITS4 masing-masingnya 0.5 µl, DMSO 0.5 µl, dan DNA template 1 µl. Amplifikasi PCR untuk daerah ITS terdiri dari: predenaturasi 95º C selama 90 detik, dilanjutkan dengan 35 siklus 95ºC selama 30 detik, annealing 55ºC dalam 30 detik, extension 72ºC dalam 90 detik, dan final extension 72ºC selama 5 menit. Dan product yang dihasilkan dipurifikasi untuk dilanjutkan ketahapan sekuensing
Sekuensing atau analisis pembacaan urutan pasang basa menggunakan automated DNA sequencer (ABI PRISM 3130 Genetic Analyzer) (Applied Biosystems). Data mentah hasil sekuensing selanjutnya di trimming dan di assembling menggunakan program ChromasPro version 1.5. Data yang telah di assembling selanjutnya di BLAST dengan data genom yang telah didaftarkan NCBI/ National Center for Biotechnology Information ( http://www.ncbi.nlm. nih. Gov/BLAST/ ). Beberapa data sekuen hasil blast yang merupakan spesies terdekat dan merupakan Type Strain dari masing-masing spesies tersebut diambil dari data gen bank di NCBI. Kemudian data di analisis kembali dengan mengaligment sekuen tersebut dengan menggunakan program MEGA v. 5.0 (Tamura et al. 2011) dan bootstrap yang digunakan adalah 1000 ulangan (Felsenstein 1985).
Identifikasi mikroba menggunakan Kit API 20C AUX pada lima bahan sumber mikroba; kayu laru, laru putih, laruh merah, mur laru merah dan laru putih, yang dilakukan dalam penelitian ini berhasil mengidentifikasi sebanyak lima spesias mikroba dari golongan khamir (Tabel 1.).
Empat Spesies khamir yang diidentifikasi antara lain: Cryptococcus laurentii, Cryptococcus humicola, Trichosporon mucoides, dan Candida famata, dalam pengujian kemampuan fermentasi tidak menunjukkan karakteristik fermentasi (adanya buih, aroma alkohol, endapatan dan perubahan warna). Hasil uji penelitian ini sama dengan yang dilaporkan oleh Ellis et.al (2007), bahwa keempat spesies menunjukkan karakteristik fermentasi negatif (-) pada physiological tests terhadap bahan makanan dengan kandungan utama Glucose, Galactose dan Sucrose. Dilaporkan juga bahwa keempat spesies berperan aktif pada fermentasi susu dan olahannya serta fermentasi daging dan olahannya.
Tabel 1. Spesies mikroba hasil identifikasi menggunakan API 20C AUX dari bahan gula aer, nira, laru putih, laru merah, mur laru putih, mur laru merah dan kayu laru (Peltophorum pterocarpum.)
No. Bahan Sumber Kingdom Genus Spesies ID %
-
1 Gula Aer - - - -
2
Kayu Laru
Khamir
Cryptococcus
C.laurentii
54.70%
Khamir
Cryptococcus
C.humicola
35.90%
Khamir
Trichosporon
T.mucoides
9.10%
Khamir
Candida
C.famata
0.10%
3
Nira
Khamir
Saccharomyces
S.cerevisiae 1
98.80%
Khamir
Saccharomyces
S.cerevisiae 2
0.60%
4
Laru Merah
Khamir
Saccharomyces
S.cerevisiae 1
98.80%
Khamir
Saccharomyces
S.cerevisiae 2
0.60%
5
Mur Laru Merah
Khamir
Saccharomyces
S.cerevisiae 1
98.80%
Khamir
Saccharomyces
S.cerevisiae 2
0.60%
6
Laru Putih
Khamir
Saccharomyces
S.cerevisiae 1
98.80%
Khamir
Saccharomyces
S.cerevisiae 2
0.60%
7
Mur Laru Putih
Khamir
Saccharomyces
S.cerevisiae 1
98.80%
Khamir
Saccharomyces
S.cerevisiae 2
0.60%
3000
2000
1500
1000
750
500
250
M 1
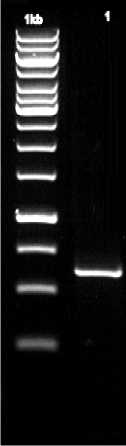
Produk PCR ~580 bp
Gambar 1. Amplifikasi PCR terhadap gen ITS dengan primer ITS_5F ; M = marker 1 Kb (fermentas) ; 1 = produk PCR sampel Saccharomyces.
Uncultured Ascomycota clone 112
Hypocreales sp. LM512
Uncultured endophytic fungus clone 40-15-25
9 Uncultured soil fungus clone RS5M5c3P
Uncultured fungus clone L042880-122-060-E01
99
Fusarium oxysporum f. sp. bulbigenum isolate NW687A
Fusarium camptoceras isolate NW643c
Colletotrichum sp. Q043
Colletotrichum simmondsii
Glomerella acutata strain HNZJ001
Glomerella acutata strain ATCC MYA-4518
Colletotrichum sp. Q043(2)
Sampel Saccharomyces
Saccharomyces cerevisiae strain DQY2
100
Saccharomyces cerevisiae strain JN40
66
Saccharomyces cerevisiae strain JN37
Saccharomyces cerevisiae strain JN23
Saccharomyces cerevisiae strain JN22
-------------------------------------1
0.2
Gambar 2 . Pohon filogenik isolat yang diidentifikasi sebagai Saccharomyces cerevisiae
Identifikasi mikroba menggunakan Kit API 20C AUX didukung oleh hasil analisis molekuler dan pensejajaran sekuen database Genbank terhadap mikroba yang yang memiliki karakteristik kemampuan fermentasi terbaik membuktikan bahwa mikroba teridentifikasi memiliki tingkat kekerabatan 99%. Deskripsi kekerabatan dan hubungan kekerabatan dapat dilihat pada pohon filogenetik dengan nilai bootstrap 1000x sebesar 100 (Gambar 1. dan Gambar 2).
Persentasi kadar alkohol yang dihasilkan pada uji pembuatan laru dan sopi; laru merah 8,43% - 8,90%, laru putih 7,05% - 8,40% dan sopi dari larutan gula aer 23,20% - 23,91%. Kadar alkohol ini lebih tinggi dibandingkan dengan hasil analisis kadar alkohol yang dilaporkan oleh Rahmansyah (1998) dalam Naiola (2008), bahwa kadar alkohol laru merah 5,8% - 7,7%, laru putih 4,8% -5,8% dan sopi dari nira lontar 21,44% - 23,38%. Kadar alkohol sopi yang dihasilkan dalam penelitian ini juga lebih tinggi dibandingkan dengan produksi alkohol berbahan baku gaplek ubi singkong menggunakan ragi merk NKL yang menghasilkan kadar alkohol hanya 16-16,5% (Atmodjo, 2008).
Kadar alkohol paling tinggi didapat pada waktu fermentasi 120 jam karena terjadi fase statis dari pertumbuhan mikroba dimana ketersediaan unsur hara berupa gula untuk mikroba Sacharomyces cereviseae telah habis terurai pada proses fermentasi. Novelina, dkk (2005) melaporkan bahwa pertambahan sel Saccharomyces cerevisiae akan meningkat pesat sampai 48 jam awal, terhitung mulai dari diinokulasi pada media. Setelah 48 jam pertambahan sel akan stabil atau cenderung menurun tergantung pada pH, konsentrasi nutrisi, dan konsentrasi alkohol media. Dilaporkan juga oleh Priest dan Campbell (1996), bahwa konsentrasi sel biakan murni Saccharomyces cerevisiae dalam proses fermentasi alkohol pada waktu propagasi 24 jam – 48 jam dapat mencapai 1,5 x 108 sel per ml media.
Kombinasi perlakuan starter Saccharomyces cerevisiae dan starter kayu laru pada fermentasi nira lontar menjadi laru putih dan didestilasi menjadi sopi, serta fermentasi larutan gula aer menjadi laru merah dan didestilasi menjadi sopi merupakan kombinasi perlakuan yang terbaik. Kombinasi ini merupakan perlakuan terbaik pada proses fermentasi laru dan sopi karena terukur dari indikator tingginya kadar alkohol yang dihasilkan, indikator cepat atau pendeknya kombinasi perlakuan melewati waktu fase adaptasi dan lambatnya starter kayu laru melewati fase adaptasi terbantu oleh biakan murni Saccharomyces cerevisiae yang mempunyai kemampuan cepat atau pendeknya melewati waktu untuk melewati fase adaptasi.
Penggunaan biakan murni Saccharomyces cerevisiae sebagai starter dapat memperpendek waktu produksi laru dan sopi, dimana dari delapan hari proses produksi menjadi lima hari. Sebagaimana hasil wawancara dengan petani bahwa pada tahap awal memproduksi laru dan sopi sebelum terbentuk mur (endapan fermentasi akan berjalan lambat). Fermentasi akan berjalan optimum mulai hari keempat pada saat telah terbentuk mur. Setelah terbentuk mur dibutuhkan empat hari fermentasi lagi agar laru dapat diminum atau didestilasi untuk menghasilkan sopi.
Untuk memenuhi kebutuhan pasar medis, industri dan bahan bakar, kadar alkohol hasil penelitian ini belum sesuai standar sehingga masih perlu dilakukan penelitian lanjutan terhadap proses fermentasi dan alat destilasi. Proses fermentasi
dan penggunaan tipe alat destilasi dapat berpengaruh terhadap kadar alkohol yang dihasilkan. Puslit Biologi-LIPI melaporkan bahwa analisis terhadap hasil fermentasi dan destilasi sopi menunjukkan kadar alkohol 66,18% (tanpa disaring). Setelah disaring dengan karbon aktif kadar alkohol meningkat menjadi 76,33% (Sulistyo, 2005).
4. Simpulan
Dari percobaan penelitian ini dapat dibuat simpulan Mikroba yang berasosiasi dengan kayu laru dan mur dalam proses pembuatan laru dan sopi dari nira tanaman Borassus flabellifer L. dari golongan khamir. Spesies mikroba yang memiliki kemampuan fermentasi terbaik teridentifikasi sebagai Saccharomyces cerevisiae. Persentasi kadar alkohol yang dihasilkan laru merah 8,43%, laru putih 7,05%, sopi dari nira 21,44%, dan sopi dari larutan gula aer 23,20%. Untuk pembuatan laru dan sopi yang efektif menjadi sumber mikroba Saccharomyces cerevisiae adalah mur dari laru merah dan laru putih. Pembuatan laru dan sopi dapat hanya dengan memanfaatkan mikroba Saccharomyces cerevisiae hasil isolasi dan koleksi biakan (culture collection) dari mur laru merah dan mur laru putih. Saccharomyces cerevisiae dapat di kombinasikan dengan kayu laru pada fermentasi nira lontar dan larutan gula aer. Kombinasi keduanya menghasilkan Persentasi kadar alkohol yang dihasilkan lebih tinggi: laru merah 8,90%, laru putih 8,40% dan sopi dari nira 23,38%, dan sopi dari larutan gula aer 23,91%.
Daftar pustaka
Atmodjo, P. K. 2008, Pengaruh Pengaruh Ragi dan Waktu Fermentasi terhadap Produksi Alkohol secara Fermentasi Berbahan Baku Gaplek Ubi Kayu (Manihot utilisima) . Biota XIII (1): 47-52.
Bulan, Rumondang, 2004, Esterifikasi Patchouli Alkohol Hasil Isolasi Dari Minyak Daun Nilam (Patchouli Oil), http://www.library.usu.ac.id pdf diakses 20 Februari 2012.
Davis, T.A. dan D.V. Johnson. 1987. Current Utilization and Further Development of the Palmyra Palm (Borassus falabellifer L. Arecaceae) in Tamil Nandu State. India. Economic Botany 41: 247 -266.
Ellis, D. Davis, S. Alexiou, H. Handke, R. Bartley, R. 2007. Descriptions of Medical Fungi. Bibliography. Mycology Unit Women’s and Children’s Hospital North Adelaide, 5006. AUSTRALIA.
Felsenstein, J. 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39(4): 783–791.
Ganjar,I. 2007. Pengelolaan Plasma Nutfah Mikroorganisme sebagai Aset Pemenuhan Kebutuhan Manusia. Jakarta : Komisi Nasional Sumber Daya Genetik ( KNSDG ).
Mardoni dan T.Yetty. 2009. “Perbandingan Metode Kromatografi Gas dan Berat Jenis Pada Penetapan Kadar Etanol Dalam Minuman Anggur”. Jurnal Fakultas Farmasi USD.162 -172.
Naiola, E. 2008. Mikroba Amilolitik pada Nira dan Laru dari Timor, Nusa Tenggara Timur. Jurnal Biodiversitas 9(3):165-168.
Novelina, Soewarno, T. Soekarto, Betty Sri L.J. Susono, S. Maggy, T.S. 2005. Chemoreaction Drying of Saccharomyces cerevisiae Culture With CaO and the influence of Moisture Sorption Upon Stress and Death of the Dried Culture. Jurnal Teknol dan Industri Pangan, 16(1):IPB Bogor.
Priest F.G and Campbell I. 1996. Brewing Microbiology. Journal 2nd Edition. Chapman & Hall. London, Glagow, Weiham, New York, Tokyo, Melbourne, Madras.
Saono, S dan Basuki,T.1978. The amylolytic, lipolytic and proteolytic activities of yeast and micelial molds from ragi and some Indonesia foods. Annales Bogoriensis. VI: 207-209.
Sulistyo, 2005. Pengembangan agroindustri bieotanol nira lontar dan kecap lajanus cajan bebas aflatoksin (BAF) di kabupaten Belu dan Rote-Ndao NTT. Laporan kumulatif Pusat Penelitian Biologi - LIPI. Bogor
Tambunan, P. 2010. Potensi dan Kebijakan Pengembangan Lontar Untuk Menambah Pendapatan Penduduk. Jurnal Analisis Kebijakan Kehutanan,7(1):27-45.
Tamura, K.; D. Peterson, N. Peterson, G. Stecher, M. Nei & S. Kumar. 2011. MEGA5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Molecular Biology and Evolution 28(10): 2731-2739.
White TJ, Bruns T, Lee, Taylor SJ. 1990 Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In MA Innis, DH Gelfand, JJ Sninsky; T. J. White, (eds). PCR Protocols: a Guide To Methods and Applications. Pp. 315-322.
http://ojs.unud.ac.id/index.php/JASB
48
Discussion and feedback