PENGENDALIAN PENYAKIT VIRUS PADA TANAMAN CABAI RAWIT (CAPSICUM FRUTESCENS L.) DENG¬AN MULSA PLASTIK HITAM DAN PERAK
on
J. Agric. Sci. and Biotechnol.
ISSN: 23020-113
Vol. 4, No. 1, Juli 2015
PENGENDALIAN PENYAKIT VIRUS PADA TANAMAN CABAI RAWIT (CAPSICUM FRUTESCENS L.) DENGAN MULSA PLASTIK HITAM DAN PERAK
I Dewa Nyoman Darmayasa1, I Gede Rai Maya Temaja2, I Dewa Nyoman Nyana2*), Gede Suastika3
-
1Program Magister Bioteknologi Pertanian, Program Pascasarjana Universitas Udayana
-
2Laboratorium Penyakit Tumbuhan, Fakultas Pertanian, Universitas Udayana
3
-
3Laboratorium Virologi Tumbuhan, Institut Pertanian Bogor
*) Corresponding Author : Jl. PB. Sudirman Denpasar 80362 Bali
E-mail: dewanyana@yahoo.com
Abstract
The research of virus diseases management in chili pepper plant (Capsicum frutescens L.) by utilizing black and silver plastic mulch, was conducted in order to find the capability of black and silver plastic mulch in controlling virus diseases in chili pepper plant and also to find the capability of black and silver mulch in increasing yield of chili pepper plant. This research used randomized block design with 3 treatments and 9 replications. The result of the research shows that utilization of silver plastic mulch had ability to control virus diseases indirectly. The yield of chili pepper has incrising up to 143% with silver plastic mulch treatments.
Key word : Chili pepper, plastic mulch, virus
Produksi cabai di Indonesia belum dapat memenuhi kebutuhan cabai nasional sehingga pemerintah harus mengimpor cabai yang mencapai lebih dari 16.000 ton per tahun (DBPH, 2009). Rataan produksi cabai nasional baru mencapai 4,35 ton/ha, sementara potensi produksi cabai dapat mencapai lebih 10 ton/ha (Direktorat Jenderal Hortikultura, 2010). Kendala biologis yang diakibatkan oleh serangan patogen virus pada tanaman cabai, masih merupakan penyebab utama kegagalan atau rendahnya panen yang didapat para petani. Serangan virus dapat menyebakan turunnya kuantitas dan kualitas buah cabai (Nyana, 2012). Hasil penelitian Nyana (2012) didapatkan bahwa ada dua jenis virus utama yang menyerang tanaman cabai di Bali, yaitu dengan gejala mosaik (57,4%) yang
berasosiasi dengan infeksi tiga jenis virus yang berbeda, yaitu TMV dari golongan Tobamovirus, CMV dari golongan Cucumovirus atau ChiVMV dari golongan Potyvirus dan gejala kuning (9,2%) yang diinduksi oleh PepYLCV, dari golongan Begomovirus. Berdasarkan hasil penelitian Suastika et al., (2012) di samping kedua gejala virus yang menginfeksi tanaman cabai di Bali, juga ditemukan adanya virus baru yang menginfeksi tanaman cabai yang hanya dijumpai di Desa Kerta, Kecamatan Payangan dengan gejala klorosis yang diinduksi oleh Polerovirus.
Virus terus-menerus menjadi masalah di daerah tropis. Hal ini disebabkan oleh inokulum tersedia sepanjang tahun, vektor berlimpah dan aktif setiap waktu, serta tidak adanya isolasi antara kebun yang satu dengan kebun yang lainnya. Serangga merupakan vektor virus tumbuhan terpenting. Tahun 1991 diketahui ada sekitar 700 jenis virus tumbuhan, 426 jenis diantaranya ditularkan oleh serangga (Frankci et al., 1991). Spesies-spesies kutu daun yang sudah diteliti ternyata hampir semuanya menghindari pantulan cahaya perak (Blackman and Eastop, 2000). Sifat repellent dari cahaya perak ini memberi peluang kepada kita untuk menggunakan mulsa plastik hitam perak sebagai pemantul cahaya yang bersifat repellent terhadap serangga. Cara pengendalian yang perlu dilakukan dan pendekatan yang digunakan dalam penelitian ini adalah mencegah kontak antara kutu daun infektif membawa virus (viruliferous) dengan tanaman cabai yang dibudidayakan. Pencegahan dapat dilakukan dengan menggunakan mulsa plastik hitam perak.
Metode serologi yang diterapkan dalam penelitian ini adalah DAS-ELISA dengan mengikuti prosedur dalam kit antiserum yang digunakan (Agdia, USA). Nilai absorban diukur pada 405 nm dengan ELISA Reader.
-
2.2 Deteksi dengan PCR
Hasil cDNA dan DNA hasil ekstraksi kemudian diamplifikasi melalui proses PCR, menggunakan pasangan primer spesifik untuk masing-masing virus (Tabel 1). Semua primer tersebut mengaplifikasi DNA gen coat protein untuk masing-masing virus.
Tabel 1. Nama primer yang mengamplifikasi gen coat protein masing-masing virus
|
Nama Virus |
Primer (5’-‘3) |
Produk PCR |
Pustaka |
|
ChiVMV |
ChiVMV F Ind AACCTGAGCGTATAGTTTCA ChiVMV R Ind TACGCTTCAGCAAGATTGCT |
900 bp |
Jan et al (2000) |
|
GenBank | |||
|
CMV |
CMV-CP-F ATGGACAAATCTGAATCAACCAGTG CMV-CP-R TCAAACTGGGAGCACCCCAGA TGTG |
657 bp |
dengan nomor asesi FR820451 |
|
PepYLCV |
CPPROTEIN-V1 TAATTCTAGATGTCGAAGCGACCCGCCGA CPPROTEIN-C1 GGCCGAATTCT TAATTTTGAACAGAATCA |
700 bp |
Rojas et al (1993) |
|
Polerovirus |
Primer F AATTAAGGATCCAATACGGGAGGGGTTAGGAGAAAT primer R AATTAACTGCAGTTTCGGGTTGTGCAATTGCACAGTA |
650 bp |
Corre^a et al (2005) |
Volume PCR yang digunakan pada penelitian ini adalah 25 µl yang terdiri dari 8,5 µl H2O, 12.5 µl GoTag Green Master Mix 2x (Fermentas USA), 1 µl primer F1, 1 µl primer R, dan 2 µl cDNA. Kondisi reaksi PCR untuk mengamplifikasi gen coat protein untuk masing-masing virus yaitu untuk virus ChiVMV, amplifikasi dengan PCR dilakukan sebanyak 35 kali dengan tahapan sebagai berikut: tahap I predenaturasi pada suhu 94°C selama 5 menit, tahap II denaturasi pada suhu 94°C selama 1 menit, tahap III annealing terjadi pada suhu 50oC selama 1 menit, tahap IV sintesis DNA terjadi selanjutnya pada tahap elongasi/ekstensi pada suhu 72°C selama 2 menit, tahap V kemudian tahap pemanjangan akhir terjadi pada suhu 72oC selama 5 menit dan suhu 4 oC untuk suhu penyimpanan (Jan et al., 2000). Amplifikasi dengan PCR untuk virus CMV, dilakukan sebanyak 35 kali dengan tahapan sebagai berikut: tahap I predenaturasi pada suhu 93,5°C selama 3 menit, tahap II denaturasi pada suhu 93,5°C selama 45
detik, tahap III annealing terjadi pada suhu 55oC selama 45 detik, tahap IV sintesis DNA terjadi selanjutnya pada tahap elongasi/ekstensi pada suhu 72°C selama 1 menit, tahap V kemudian tahap pemanjangan akhir terjadi pada suhu 72oC selama 5 menit dan suhu 4 oC untuk suhu penyimpanan. Amplifikasi dengan PCR untuk Polerovirus terdiri dari 35 kali (siklus) dengan beberapa tahap sebagai berikut, denaturasi pada 94 0C selama 45 detik, primer annealing pada 550C selama 45 detik, ekstensi 72 0C selama 90 detik, dilanjutkan dengan ekstensi final pada 72 0C selama 10 menit. Amplifikasi dengan PCR untuk PepYLCV terdiri dari atas 35 siklus dengan tahapan: predenaturasi pada suhu 940C selama 1 menit, annealing pada suhu 500C selama 2 menit, amplifikasi (sintesis untaian DNA baru) pada suhu 720C selama 3 menit dan tahapan extention pada suhu DNA 720C selama 5 menit.
-
2.3 Visualisasi Hasil PCR
Produk PCR dan DNAmarker, masing-masing 10 µl dimasukkan ke dalam sumuran yang telah disiapkan pada gel Agarose. Elektroforesis dilakukan selama 60 menit dengan tegangan 50 Volt DNA yang telah dielektroforesis kemudian divisualisasi dengan UV transiluminator.
-
2.4 Analisis Data
Untuk mengetahui pengaruh dari perlakuan yang diberikan, maka data hasil pengamatan ditabulasikan sehingga diperoleh nilai rata-rata, selanjutnya dilakukan analisis keragaman sesuai rancangan yang digunakan. Apabila perlakuan berpengaruh nyata maka dilanjutkan dengan uji beda nilai rata-rata dengan uji Duncan 5%.
Berdasarkan hasil uji DAS-ELISA (Tabel 2) di dapatkan bahwa sampel yang dikoleksi berdasarkan atas gejala yang diamati terbukti positif terinfeksi virus. Hasil
uji ELISA pada penelitian ini ditemukan ada beberapa jenis virus yang berasosiasi dengan penyakit mosaik pada tanaman cabai yaitu CMV, TMV, dan ChiVMV.
Tabel 2. Persentase tanaman terinfeksi virus pada gejala mosaik dari hasil uji DAS-ELISA terhadap sampel tanaman yang bergejala pada pengamatan 10 mst
Perlakuan Rata-rata Jumlah Persentase Tanaman Terinfeksi Virus*
Tanaman yang Bergejala Mosaik (tanaman)
|
Mosaik |
CMV |
TMV |
ChiVMV | |
|
NT |
0,6 |
54,55 |
14,55 |
25,45 |
|
Mulsa Plastik Hitam |
0,2 |
40,91 |
18,18 |
36,36 |
|
Mulsa Plastik Perak |
0,1 |
40 |
20 |
40 |
Hasil PCR menunjukkan bahwa sampel tanaman yang diujikan positif terinfeksi virus ChiVMV, PepYLCV, Polerovirus dan CMV yang ditandai dengan
terbentuknya pita DNA dari masing-masing isolat yang diujikan dengan panjang
basa sesuai dengan primer yang digunakan (Gambar 1).
900 bp
700 bp
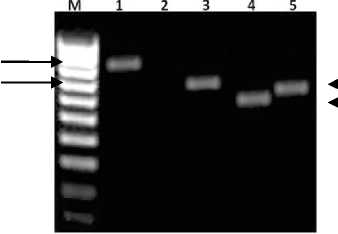
657 bp
650 bp
Gambar 1. Hasil amplifikasi gen CP dengan metode PCR. M=Marker DNA 100 bp (BioRad); (1)=ChiVMV; (2)= kontrol negatif, (3)= PepYLCV, (4)= Polerovirus, (5)= CMV.
Pasangan primer untuk ChiVMV yaitu : ChiVMV F Ind (5’-AACCTGAGCGTA TAGTTTCA-3’) dan ChiVMV R Ind (5’-TACGCTTCAGCAAGATTGCT -3’), kedua pasangan primer tersebut merupakan primer yang dapat mengamplifikasi bagian coat protein (CP) virus yang berukuran 900 bp (Jan et al., 2000), dan hasil PCR untuk virus ChiVMV ini sekitar 900 bp yang bersesuaian dengan prediksi dari primer yang didesain. Pasangan primer untuk PepYLCV yaitu CPPROTEIN-V1 yaitu (5’-TAATTCTAGATGTC GAAGCGACCCGCCGA-‘3) sedangkan CPPROTEIN-C1 yaitu: (5’-GGCCGAATTCTTAATTTTGAACAGAATCA-‘3) (AVRDC, Taiwan), kedua pasangan primer tersebut berukuran 700 bp, dan hasil PCR untuk virus PepYLCV ini sekitar 700 bp yang sangat bersesuaian dengan prediksi dari primer yang didesain. Pasangan primer untuk Polerovirus yaitu primer spesifik menurut Corre^a et al. (2005) yaitu primer F dengan susunan basa atau sekuen nukleotida (5’-AATTAAGGATCCAATACGGGAGGGGTTAGGAGAAAT-3’) dan primer R dengan sekuen nikleotida (5’-AATTAACTGCAGTTTCGGGTTGTG CAATTGCACAGTA-3’). Kedua primer tersebut berukuran 650 bp (Corre^a et al.,
2005), dan hasil PCR untuk Polerovirus ini sekitar 650 bp yang bersesuaian dengan prediksi dari primer yang didesain. Pasangan primer spesifik untuk virus CMV digunakan pasangan primer CMV-CP-F (5’-ATGGACAAATCTGAATC AACCAGTG-3’) dan CMV-CP-R (5’-TCAAACTGGGAGCACCCCAGATGTG-3’) yang didesain berdasarkan sikuen nukleotida RNA-2 dari CMV isolat cabai asal Thailand yang tersedia di GenBank dengan nomor asesi FR820451. Pasangan primer ini diprediksi sepanjang 657 bp, dan hasil PCR untuk virus CMV ini sekitar 657 bp yang bersesuaian dengan prediksi dari primer yang didesain.
-
3.2 Hasil Panen
Hasil pengamatan terhadap hasil tanaman menunjukkan bahwa hasil panen tertinggi (Tabel 3) terdapat pada perlakuan mulsa plastik perak (12,28 ton/ha) yang diikuti oleh perlakuan mulsa plastik hitam (8,11 ton/ha) dan paling rendah ditunjukkan pada perlakuan kontrol (5,05 ton/ha). Hasil analisis menunjukkan bahwa hasil panen pada perlakuan mulsa plastik perak dan mulsa plastik hitam berbeda nyata dengan kontrol, dan mulsa plastik perak berbeda nyata dengan perlakuan mulsa plastik hitam dan kontrol, berdasarkan uji Duncan pada taraf 5%. Hasil panen mulsa plastik perak dan mulsa plastik hitam dibanding dengan kontrol mengalami peningkatan berturut-turut sebesar 143% dan 61%.
Tabel 3 Pengaruh perlakuan terhadap hasil/ha
|
Perlakuan |
Hasil/ha (ton/ha) |
|
Kontrol |
5,05 c |
|
Mulsa plastik hitam |
8,11 b |
|
Mulsa plastik perak |
12,28 a |
Keterangan : Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan berbeda nyata pada uji Duncan pada taraf 5%.
Rendahnya rata-rata jumlah tanaman yang bergejala virus (Tabel 2) dan
tingginya hasil panen (Tabel 3) pada perlakuan mulsa plastik perak dibandingkan
dengan perlakuan mulsa plastik hitam dan kontrol dikarenakan penggunaan mulsa plastik perak, memiliki beberapa keuntungan yaitu memiliki efektifitas dalam melindungi tanah dari terpaan langsung butir hujan, mencegah percikan butir tanah ke tanaman, mencegah pencucian hara, mempertahankan kegemburan tanah-tanah di bawahnya, memperlambat pelepasan karbon dioksida tanah hasil respirasi aktivitas mikroorganisme, memelihara temperatur tanah, mencegah penguapan air tanah, memelihara kandungan bahan organik tanah, mengendalikan pertumbuhan gulma yang merupakan pesaing utama tanaman dalam pengambilan unsur hara dan juga berperan sebagai inang virus, serta memiliki kemampuan menekan populasi serangga vektor virus karena mulsa plastik perak memiliki kemampuan memantulkan sekitar 33 persen cahaya near ultra violet (Fahrurrozi and Stewart, 1994), gelombang cahaya yang disukai oleh kebanyakan serangga, sehingga serangga akan mengikuti arah pantulan dan meninggalkan pertanaman (Kring, 1974), dengan adanya kemampuan menekan populasi vektor virus dapat menekan pula terjadinya infeksi virus pada tanaman, sehingga tanaman cabai dapat tumbuh dengan baik yang dicirikan dengan meningkatnya tinggi tanaman, pembentukan cabang primer dan meningkatnya hasil tanaman (Fahrurrozi, 1995 ).
Berdasarkan hasil penelitian dan pembahasan yang telah diuraikan, maka dapat disimpulkan hal-hal sebagai berikut: (1) Penggunaan mulsa plastik perak mampu mengendalikan penyakit virus paling baik dibandingakan dengan mulsa plastik hitam pada pertanaman cabai rawit. (2) Penggunaan mulsa plastik perak mampu meningkatkan hasil tanaman cabai rawit sebesar 143%.
Ucapan terima kasih yang tulus penulis sampaikan kepada Fitrianingrum Kurniawati, S.P., M.Si dan teman-teman virologi di Laboratorium Virologi Tumbuhan, Institut Pertanian Bogor yang sudah mengajarkan teknik uji ELISA dan
PCR selama penulis melakukan penelitian di Laboratorium Virologi Tumbuhan, Institut Pertanian Bogor.
Daftar Pustaka
Blackman R.L, Eastop VF. 2000. Aphids on the World’s Crop. An identification and Information Guide 2nd eds. New York : John Wiley and Sons.
Corre^a, R. L.,T. F. Silva, J. L. Simo^es-Ara^ujo, P. A. V. Barroso, M. S. Vidal, M. F. S. Vaslin. 2005 Moleculer Characterization of a Virus from the Family Luteoviridae Associated with Cotton Blue Disease. Arc Virol. (150) 7 : 13571367.
[DBPH] Direktorat Jenderal Bina Produksi Hortikultura. 2009. Luas Panen, Rata-rata Hasil dan Produksi Tanaman Hortikultura di Indonesia. Departemen Pertanian, Jakarta.
Direktorat Jenderal Hortikultura. 2010. Statistik Hortikultura Tahun 2010. Direktorat Jenderal Hortikultura, Departemen Pertanian, Jakarta.
Fahrurrozi and K.A. Stewart. 1994. Effects of mulch optical properties on weed growth and development. HortScience 29 (6):545.
Fahrurrozi. 1995. Pengaruh mulsa plastik terhadap pertumbuhan dan hasil Paprika (Capsicum annuum L.) jenis Bell dan populasi aphid. Jurnal Penelitian Universitas Bengkulu 2 (4) : 1 - 8.
Frankci, R.I.B., Fauquet, C.M., Knudson, D.L. dan Brown, F 1991. Clasification and Nomenclature of Viruses. 5th report of the International Committee on Taxonomy of Viruses. Archives of Virology 2. Springer, New York.
Jan, F.J., C. Fagoaga, S.Z. Pang, and D. Gonsalves. 2000. A single chimeric transgene derived from two distinct viruses confers multi-virus resistance in transgenic plants through homology dependent gen silencing. J. Gen. Virol. 81:2103-2109.
Kring, J.B. 1964. New ways to repel aphids. Frontier of Plant Science. 17:6-7.
Nyana, D.N. 2012. Isolasi dan Identifikasi Cucumber Mosaic Virus Lemah untuk Mengendalikan Penyakit Mosaik pada Tanaman Cabai (Capsicum frutescens L.). Disertasi. Program Studi Ilmu Pertanian Program Pascasarjana Universitas Udayana. Denpasar.
Rojas, M.R., R.L. Gilbertson, D.R. Russel, and D.P. Maxwel. 1993. Use of degenerate primers in the polymerase chain reaction to detect whitefly trasmitted geminiviruses. Plant Disease. 71:340-347.
Suastika, G., H. Sedyo, I D. N. Nyana, T. Natsuaski. 2012. Laporan Pertama tentang Infeksi Polerovirus pada Tanaman Cabai di Daerah Bali, Indonesia. J. Fitopatologi Indonesia 20(5) : 151-154.
http://ojs.unud.ac.id/index.php/JASB
17
Discussion and feedback