Ketahanan Isolat Bakteri Asam Laktat Indigenus Kombucha dan Dadih Terhadap Antibiotik
on
Itepa: Jurnal Ilmu dan Teknologi Pangan,
Ida Bagus Jaya Sukarya dkk. /Itepa 10 (4) 2021 734-745
ISSN : 2527-8010 (Online)
Ketahanan Isolat Bakteri Asam Laktat Indigenus Kombucha dan Dadih Terhadap Antibiotik
Antibiotic Resistance of Indigenous Lactic Acid Bacteria Isolates of Kombucha and Dadih
Ida Bagus Jaya Sukarya1, I Desak Putu Kartika Pratiwi1*, Ni Made Indri Hapsari A.1, Ni Nyoman Puspawati1
Program Studi Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana Kampus Bukit Jimbaran, Badung-Bali
*Penulis korespondensi: I Desak Putu Kartika Pratiwi, Email: kartika.pratiwi@unud.ac.id
Abstract
Lactic Acid Bacteria must pass several tests to increase their potential as probiotics, one of which is to test their resistance to antibiotics. This study was aimed to determine the resistance of the indigenous lactic acid bacteria (LAB) isolates from kombucha and dadih against amoxicillin, tetracycline, and chloramphenicol, and measure their levels of resistance against amoxicillin, tetracycline, and chloramphenicol. There were 2 treatments that are done in this study such as the type of isolates, and the type of antibiotics used. LAB growth inhibition zones against antibiotics were tested using disk diffusion method and analyzed using quantitative descriptive method. Based on the result of this study, it was found that L. plantarum RN9, L. plantarum I MK2, and L. plantarum I ML7 had an intermediate resistance against amoxicillin, while all the isolates tested are resistant to tetracycline and chloramphenicol. L. pentosus MS21 had the most resistance against amoxicillin. L. plantarum I MK2 had the most resistance against tetracycline. and L. plantarum I ML7 had the most resistance against chloramphenicol.
Keywords: Lactic acid bacteria, kombucha isolates, dadih isolates, antibiotic resistance
PENDAHULUAN
Probiotik menurut FAO dan WHO (2002) adalah mikroorganisme yang dalam jumlah tertentu dapat memberikan efek kesehatan pada host yang mengonsumsi bahan pangan mengandung probiotik. Mikroorganisme probiotik seperti Bifidobacterium dan bakteri asam laktat (BAL) akan memberikan efek kesehatan apabila mampu bertahan hidup melalui sistem pencernaan, mampu mengolonisasi usus, mampu menjaga keseimbangan mikroflora usus, dan mampu menghasilkan zat anti mikroba (bakteriosin) (Salminen et al., 2004). Sebelum menjadi bakteri probiotik, BAL akan melewati beberapa pengujian secara in vitro untuk meningkatkan potensinya sebagai probiotik, diantaranya adalah uji ketahanan
terhadap asam lambung, uji ketahanan terhadap garam empedu, uji aktivitas antimikroba terhadap mikroorganisme patogenik, dan juga sifat resistensinya terhadap antibiotik. Salah satu pengujian penting dalam peningkatan potensi BAL adalah resistensi terhadap antibiotik. Strain bakteri probiotik yang memiliki ketahanan terhadap antibiotik sangat berguna untuk memulihkan mikrobiota usus setelah penggunaan antibiotik (Gueimonde et al , 2013).
Antibiotik adalah suatu jenis senyawa antibakteri, baik alami maupun sintetik yang mempunyai efek menekan atau menghentikan suatu proses biokimia di dalam organisme. (Black, 2004). Beberapa contoh antibiotik yang sering digunakan adalah amoxicillin, tetracycline, dan chloramphenicol. Antibiotik amoxicillin
merupakan jenis antibiotik beta-laktam dengan spektrum luas karena mampu menghambat pertumbuhan atau membunuh bakteri Gram positif dan Gram negatif (Black, 2004). Mekanisme kerja dari amoxicillin dengan cara membunuh bakteri secara langsung yaitu dengan cara mengganggu tahap terakhir sintesis dinding sel atau reaksi transpeptidase (Lowy, 1986). Tetracycline merupakan jenis antibiotik yang menghambat sintesis protein dengan mencegah masuknya transfer RNA (tRNA) aminoasil ke ribosom 30S. Antibiotik ini dapat digunakan untuk mengatasi infeksi yang disebabkan oleh E coli enteropati, Staphylococcus, maupun Enterococcus (Berger, 1986). dan Chloramphenicol merupakan antibiotik yang bekerja dengan cara memodifikasi atau menghambat sintesis protein melalui penghambatan pengikatan mRNA kepada ribosomal 50S sehingga mampu menghambat sel untuk berkembang biak (Berger, 1986).
Resistensi bakteri asam laktat terhadap amoxicillin sebelumnya telah diteliti oleh Sujadmiko dan Wikandari (2017) dengan menguji tingkat resistensi L plantarum B1765 sebagai kandidat kultur probiotik terhadap antibiotik jenis amoxicillin clavulanat generik dengan metode kertas cakram. Berdasarkan hasil penelitian diketahui bahwa strain BAL tersebut dapat bertahan terhadap amoxicillin pada konsentrasi 50ppm. Selain itu telah dilakukan penelitian mengenai ketahanan BAL L fermentum yang diisolasi dari feses manusia, produk susu komersial dan juga pada obat-obatan untuk mengetahui sifat resistensi terhadap tetracycline, penyebab resistensi, dan juga kemampuan transfer gen
pembawa sifat resistensi antibiotik kepada bakteri lain. Dari 6 isolat L fermentum, terdapat 5 isolat yang memiliki sifat resisten terhadap antibiotik tetracycline. Ditemukan juga beberapa BAL seperti Lactobacillus dan Lactococcus memiliki sifat resisten terhadap tetracycline Ketahanan BAL terhadap antibiotik tetracycline diketahui akibat BAL memiliki gen tet(K) dan tet(M) (Fadl et al., 2014; Anisimova dan Yarullina, 2018)
Kemampuan resistensi beberapa jenis BAL terhadap antibiotik dari berbagai jenis produk pangan telah banyak diteliti, akan tetapi penelitian mengenai tingkat ketahanan isolat BAL indigenus dari kombucha dan dadih terhadap antibiotik belum pernah dilakukan. Dari penelitian sebelumnya, ditemukan sebanyak 13 isolat BAL yang berasal dari kombucha dan dadih yang memiliki potensi sebagai probiotik berdasarkan dari sifat ketahanannya terhadap pH rendah, dan tahan terhadap garam empedu (Puspawati et al , 2016; Puspawati et al , 2018; Puspawati dan Arihantana, 2018). Berdasarkan hal tersebut maka perlu dilakukan penelitian mengenai tingkat ketahanan isolat BAL indigenus dari kombucha dan dadih terhadap antibiotik sehingga dapat meningkatkan potensinya sebagai probiotik.
METODE PENELITIAN
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Pangan Program Studi Teknologi Pangan, Gedung Agrokompleks. Lantai 3, Fakultas Teknologi Pertanian, Universitas Udayana. Penelitian dilakukan pada akhir bulan Juli 2020 hingga pertengahan Oktober 2020.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah 5 isolat kombucha (L pentosus MB23, L pentosus MS21, L paracaseii spp paracasei 1 RK41, dan L plantarum 1 RB210) dan 8 isolat dadih susu sapi yang diisolasi dari berbagai jenis bambu (L pentosus MK42, L pentosus RL2, L plantarum RN9, L plantarum I MK2, L rhamnosus MY2, L pentosus RG5, L plantarum I MA1, L plantarum I ML7, dan L plantarum I RJ1) yang disimpan pada Laboratorium Mikrobiologi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana. de Man, Rogosa, and Sharpe Agar (Oxoid), de Man, Rogosa, and Sharpe Broth (Oxoid), paper disk blank (Oxoid CT0998B), antibiotik (amoxicillin, chloramphenicol, dan tetracycline), NaCl (Merck), alkohol 96% (OneMed), alkohol 70% (OneMed), H2O2 (3%), kit pengecatan gram (kristal violet, lugol, etanol 95%, dan safranin), tisu, kapas, aquades (Bratachem), aluminium foil, kertas label, plastik, dan kertas buram.
Alat yang digunakan dalam penelitian ini adalah autoklaf (HiClave HVE50), beaker glass (Pyrex), cawan petri (Anumbra), ultra low temperature freezer (New Brunswick Scientific), freezer (Sharp), erlenmeyer (Pyrex), gelas ukur (Pyrex), kompor, laminar air flow (Kojair), jangka sorong, inkubator (Memmert), tabung reaksi (IWAKI), jarum ose, bunsen, batang bengkok, batang pengaduk, gelas objek, effendorf, mikrotip (OneMed), mikropipet (DragonLab), timbangan analitik (Shimadzu ATY224), vortex (Maxi-MIX II), dan mikroskop (Nikon E-100).
Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental dengan 2 perlakuan yaitu: (1) jenis isolat dan (2) jenis antibiotik. Terdapat 13 jenis isolat yang digunakan yaitu: 5 isolat kombucha (L pentosus MB23, L pentosus MS21, L paracaseii spp paracasei 1 RK41, L pentosus MK42, dan L. plantarum 1 RB210) dan 8 isolat dadih susu sapi (L pentosus RL2, L plantarum RN9, L plantarum I MK2, L. rhamnosus MY2, L pentosus RG5, L plantarum I MA1, L plantarum I ML7, dan L plantarum I RJ1). Jenis antibiotik terdiri dari 3 jenis antibiotik yaitu: amoxicillin, chloramphenicol, dan tetracycline
Masing-masing perlakuan dilakukan pengulangan sebanyak 3 kali dengan total perlakuan sebanyak 39 perlakuan. Data hasil pengujian dianalisis menggunakan metode deskriptif kuantitatif dan disajikan dalam bentuk tabel dan gambar.
Pelaksanaan Penelitian
Tahapan penelitian ini meliputi: penyegaran 13 jenis isolat, pembuatan kultur kerja, uji konfirmasi dengan metode pengecatan gram, pengamatan morfologi bakteri, dan uji katalase (Harrigan dan McCance, 1998). Selanjutnya dilakukan perhitungan total BAL dengan metode TPC (total plate count) (Fardiaz, 1993), dan dilanjutkan dengan pengujian ketahanan 13 jenis isolat bal kombucha dan dadih terhadap antibiotik amoxicillin (konsentrasi 10µg), chloramphenicol (konsentrasi 30µg), dan tetracycline (konsentrasi 30µg) dengan metode kertas cakram sehingga dihasilkan zona hambat (Liasi et al, 2009).
Penyegaran
Penyegaran isolat BAL indigenus kombucha dan dadih dilakukan dengan cara menginokulasi 1 ose biakan ke kultur induk ke dalam 5 ml media MRSB steril, kemudian diinkubasi pada suhu 37°C selama 24-48 jam. Hasil ditandai dengan adanya kekeruhan pada media (Juniarthati, 2011). Isolat yang telah dilakukan penyegaran selanjutnya dipindahkan ke media agar miring untuk dijadikan kultur kerja. Tujuan penyegaran isolat adalah untuk memperbanyak jumlah bakteri yang selanjutnya akan digunakan untuk diuji.
Pengecatan Gram
Pengecatan Gram dilakukan dengan tahapan sebagai berikut: Sebanyak satu ose air steril diteteskan pada gelas objek ditambah dengan satu ose isolat kultur kerja yang disebarkan hingga rata, selanjutnya di fiksasi di atas nyala api bunsen. Preparat ditambah satu tetes kristal ungu dan didiamkan selama 1 menit, selanjutnya dicuci menggunakan air mengalir dengan posisi miring kemudian dikeringkan dengan kertas tisu. Preparat ditambah satu tetes lugol dan didiamkan selama 2 menit, kemudian dicuci menggunakan air mengalir dengan posisi miring dan dikeringkan dengan kertas tisu. Preparat ditambah etanol 95% dan didiamkan selama 10-20 detik kemudian dicuci dengan air serta dikeringkan. Preparat ditambah satu tetes safranin dan didiamkan selama 10-20 menit kemudian dibilas dengan air. Preparat ditetesi minyak imersi dan diamati dibawah mikroskop hingga perbesaran 1000 kali. Isolat bersifat Gram positif jika sel berwarna ungu dan Gram negatif jika sel berwarna merah. Isolat yang
mempunyai sifat Gram positif digunakan untuk pengujian selanjutnya (Harrigan dan McCance, 1998).
Pengamatan Morfologi Bakteri
Pengamatan bentuk bakteri dilakukan dengan tahapan sebagai berikut: Preparat Gram yang diperoleh dari pengecatan Gram diamati di bawah mikroskop dengan pembesaran 1000 x. Mikroba yang mempunyai bentuk kokus, streptokokus, basil pendek, basil panjang, basil bergandengan dan berbentuk basil mirip huruf Y kemudian dilanjutkan ke pengujian berikutnya (Harrigan dan McCance, 1998).
Uji Katalase
Uji katalase dilakukan dengan tahapan sebagai berikut: diambil broth kultur kerja sebanyak 100ul, kemudian diteteskan pada kaca preparat. Kaca preparat yang berisi kultur ditetesi dengan larutan H2O2 3%. Hasil pengujian positif ditandai dengan terbentuknya gelembung gas pada preparat, sedangkan hasil pengujian negatif ditandai dengan tidak terbentuknya gelembung gas pada preparat (Harrigan dan McCance, 1998).
Total Bakteri Asam Laktat
Perhitungan total bakteri asam laktat dilakukan dengan metode TPC (total plate count) yaitu dengan menumbuhkan masing-masing isolat pada media MRSA pada pengenceran 10-6 sampai pengenceran 10-8. Koloni yang tumbuh dihitung seluruhnya hingga didapatkan jumlah koloni yang selanjutnya digunakan untuk menghitung total bakteri asam laktat yang memiliki jumlah antara 25-250. Satuan yang digunakan dalam perhitungan jumlah bakteri adalah cfu/ml (Fardiaz, 1993). Jumlah bakteri per ml dihitung dengan cara :
jumlah koloni dikalikan dengan 1 per faktor pengeceran.
Ketahanan BAL terhadap Antibiotik
Pengujian ketahanan BAL dilakukan dengan tahapan sebagai berikut: BAL diinokulasikan dalam MRSB dan diinkubasi pada suhu 37oC selama 24 jam, selanjutnya sebanyak 100 µl ditumbuhkan pada media MRSA, kemudian disebar menggunakan batang bengkok secara merata. Ketahanan dari 13 isolat BAL terhadap amoxicillin, tetracycline dan chloramphenicol diuji dengan metode kertas cakram (Bauer et al , 1966). Preparasi antibiotik dilakukan dengan cara sebagai berikut: diencerkan chloramphenicol dan tetracycline hingga konsentrasinya mencapai 30 µg/ml, amoxicillin diencerkan hingga konsentrasinya mencapai 10 µg/ml. Kertas cakram direndam selama 1 menit ke dalam larutan antibiotik sehingga meresap. Setelah itu, kertas
cakram diletakan diatas media MRSA yang telah diinokulasi dengan isolat BAL dan selanjutnya diinkubasi pada suhu 37oC selama 24 jam. (Liasi et al., 2009)
Hasil bakteri sensitif terhadap antibiotik dinyatakan apabila zona penghambatan terbentuk sebesar ≥ 21 mm dengan kode S; intermediet dengan zona penghambatan sebesar 16-20 mm dengan kode I; dan resisten apabila zona penghambatan ≤ 15 mm dengan kode R. (Vlkova et al , 2006)
HASIL DAN PEMBAHASAN
Uji Konfirmasi
Uji konfirmasi dilakukan dengan beberapa tahap, yaitu uji katalase, pengamatan morfologi, dan juga pengecatan gram. Hasil pengujian dapat dilihat pada Tabel 1
Tabel 1. Hasil uji konfirmasi isolat BAL yang diisolasi dari kombucha dan dadih
|
No |
Isolat |
Karakteristik yang Diamati | ||
|
Katalase |
Bentuk Sel |
Cat Gram | ||
|
1 |
MB23 |
Negatif |
Basil |
Gram + |
|
2 |
RB210 |
Negatif |
Basil |
Gram + |
|
3 |
MK42 |
Negatif |
Basil |
Gram + |
|
4 |
MK2 |
Negatif |
Basil |
Gram + |
|
5 |
MY2 |
Negatif |
Basil |
Gram + |
|
6 |
RK41 |
Negatif |
Basil |
Gram + |
|
7 |
RG5 |
Negatif |
Basil |
Gram + |
|
8 |
RN9 |
Negatif |
Basil |
Gram + |
|
9 |
MS21 |
Negatif |
Basil |
Gram + |
|
10 |
MA1 |
Negatif |
Basil |
Gram + |
|
11 |
ML7 |
Negatif |
Basil |
Gram + |
|
12 |
RJ1 |
Negatif |
Basil |
Gram + |
|
13 |
RL2 |
Negatif |
Basil |
Gram + |
Berdasarkan hasil pengujian pengecatan gram, morfologi bakteri, dan katalase keseluruhan isolat yang digunakan dalam penelitian ini yang dapat dilihat pada Tabel 1 yaitu : L pentosus
MB23, L pentosus MS21, L paracaseii spp paracasei 1 RK41, L plantarum 1 RB210, L pentosus MK42, L pentosus RL2, L plantarum
RN9, L plantarum I MK2, L rhamnosus MY2, L
pentosus RG5, L plantarum I MA1, L plantarum I ML7, dan L plantarum I RJ1 memiliki karakteristik katalase negatif, bentuk morfologi basil (batang) dan merupakan bakteri gram positif. Hal ini sesuai dengan penelitian Puspawati et al, (2016) yang melaporkan hasil uji konfirmasi isolat BAL teh kombucha MB23, MS21, RK41, RB210, MK42 bersifat katalase negatif, berbentuk batang, dan bersifat gram positif. Selanjutnya dilaporkan, isolat dadih susu sapi dari berbagai jenis bambu yaitu isolat RL2, RN9, MK2, MY2, RG5, MA1, ML7, dan RJ1 memiliki hasil uji konfirmasi yang serupa yaitu bersifat katalase negatif, berbentuk batang, dan bersifat gram positif (Puspawati et al., 2018).
Menurut Surono (2004) dan Salminen et al., (2004) bakteri asam laktat merupakan kelompok bakteri gram positif yang tidak memiliki enzim katalase, berbentuk kokus atau batang, tidak memiliki sitokrom, tidak berspora, dan pertumbuhannya bersifat anaerobik atau anaerobik fakultatif.
Katalase negatif ditandai dengan tidak terbentuknya gelembung gas O2 yang dihasilkan melalui degradasi senyawa H2O2 oleh enzim katalase yang dapat dihasilkan oleh bakteri. Menurut Surono (2004), enzim katalase dapat memecah senyawa H2O2 menjadi H2O dan O2. Uji katalase yang dilakukan pada isolat untuk mengetahui kemampuan isolat dalam menghasilkan enzim katalase. Katalase merupakan enzim yang dapat mengatalis proses konversi hidrogen peroksida yang bersifat toksik bagi sel menjadi air dan oksigen. Bakteri asam laktat dengan genus Lactobacillus merupakan kelompok
bakteri yang tidak menghasilkan enzim katalase, tetapi memiliki enzim peroksidase untuk mengubah H2O2 yang bersifat toksik menjadi H2O (Salminen et al., 2004).
Hasil pengecatan gram pada keseluruhan isolat menunjukkan bakteri merupakan bakteri gram positif akibat warna yang diserap oleh bakteri merupakan warna biru keunguan. Perbedaan struktur dinding sel bakteri gram positif dan negatif menyebabkan terjadinya perbedaan warna yang diserap oleh sel bakteri. Dinding bakteri gram positif banyak mengandung peptodiglikan, sedangkan dinding pada bakteri gram negatif banyak mengandung lipopolisakarida (Sylvia, 2008). Bakteri gram positif mengandung peptidoglikan sebanyak 90% pada dinding selnya, sedangkan gram negatif hanya 5-20%, lapisan lainnya terdiri dari protein, lipoprotein, dan lipopolisakarida (Pelczar dan Chan, 2005).
Total Bakteri Asam Laktat Isolat Kombucha dan Dadih
Perhitungan total bakteri asam laktat dilakukan dengan menghitung koloni yang terbentuk dari penyegaran bakteri dari kultur isolat. Total BAL isolat kombucha dan dadih dapat dilihat pada Tabel 2.
Berdasarkan hasil pengamatan yang dilakukan pada total bakteri asam laktat yang dapat dilihat pada Tabel 2, diketahui bahwa isolat dengan populasi tertinggi adalah isolat MK2 dengan total BAL sebanyak 1,9×109 cfu/ml, sedangkan total BAL terendah didapatkan pada isolat MS21 dengan total BAL sebanyak 6,4×107 cfu/ml.
Ketahanan BAL Isolat Kombucha dan Dadih terhadap Amoxicillin
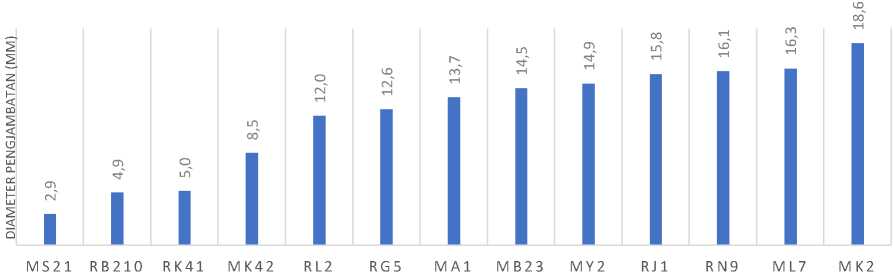
Amoxicillin bekerja dengan cara membunuh bakteri secara langsung yaitu dengan cara mengganggu tahap terakhir sintesis dinding sel atau reaksi transpeptidasi. Antibiotik ini bersaing dengan enzim transpeptidase karena strukturnya yang menyerupai terhadap ujung karboksi subunit glikopeptida murein (dinding sel) (Lowy, 1986). Berikut merupakan hasil pengujian berupa sensitivitas isolat BAL pada tabel 3, dan juga grafik diameter penghambatan yang dapat dilihat pada Gambar 1. Data hasil pengujian keseluruhan isolat bakteri asam laktat terhadap antibiotik jenis amoxicillin menunjukkan bahwa beberapa isolat bakteri asam laktat seperti RN9, ML7, dan MK2 memiliki sifat ketahanan intermediet dengan diameter penghambatan 16,1mm, 16,3mm, dan 18,6mm, sedangkan isolat MS21, RB210, RK41, MK42, RL2, RG5, MA1, MB23, MY2, dan RJ1 bersifat resisten dengan diameter penghambatan ≤15mm.
Isolat BAL MS21, RB210, RK41, MK42, RL2, RG5, MA1, MB23, MY2, dan RJ1 memiliki sifat resisten terhadap antibiotik amoxicillin Beberapa jenis bakteri bersifat resisten terhadap antibiotik tertentu akibat sifat intrinsik dari bakteri yaitu dapat menghasilkan enzim inaktivasi
senyawa antibiotik. Amoxicillin merupakan antibiotik β-laktam yang dapat dihambat
aktivitasnya oleh enzim β-laktamase dengan mendegradasi senyawa tersebut sehingga aktivitas bakterisidal dapat terhambat dan mendukung bakteri untuk tetap tahan terhadap antibiotik tersebut, amoxicillin biasanya diberikan bersamaan dengan inhibitor beta-laktamase seperti asam
klavulanat pada amoxicillin clavulanate untuk mencegah hidrolisis oleh beta-laktamase (Kemenkes RI, 2011)
Dinding sel bakteri asam laktat dapat menjadi pertahanan lain apabila bakteri tidak mampu menghasilkan enzim inaktivasi atau enzim inaktivasi yang dihasilkan tidak mampu menghambat senyawa antibiotik yang terkandung dalam konsentrasi yang cukup tinggi. Struktur dinding sel BAL yang tersusun atas beberapa lapisan peptidoglikan yang tebal selain berfungsi untuk memberi integritas dan bentuk sel dapat juga menghambat masuknya senyawa antibiotik dengan cara menurunkan permeabilitas membran sehingga dapat menurunkan kemungkinan masuknya komponen antibiotik ke dalam sitoplasma sel (Sujadmiko dan Wikandari, 2017).
Sujadmiko dan Wikandari (2017) melaporkan isolat L plantarum B1765 yang diisolasi dari hasil fermentasi bekasam ikan bandeng mampu menghasilkan enzim β-laktamase sehingga tahan terhadap amoxicillin pada konsentrasi 50ppm. Hal ini dapat menjadi dasar bahwa bakteri asam laktat dalam kondisi tertentu dapat memiliki kemampuan untuk menghasilkan enzim β-laktamase yang menyebabkan adanya sifat resistensi yang dimiliki oleh isolat BAL yang diuji. Ketahanan BAL Isolat Kombucha dan Dadih terhadap Tetracycline
Tetracycline merupakan antibiotik yang bekerja dengan cara menghambat sintesis protein melalui pencegahan masuknya transfer RNA (tRNA) aminoasil ke ribosom 30S (Berger, 1986). Berikut merupakan hasil pengujian berupa sensitivitas isolat BAL pada Tabel 4 dan grafik
diameter penghambatan yang dapat dilihat pada Gambar 2.
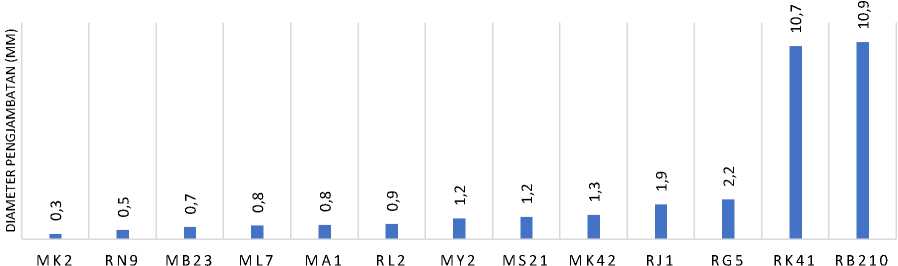
Berdasarkan hasil pengujian pada isolat bakteri asam laktat terhadap antibiotik jenis
tetracycline diketahui bahwa seluruh isolat bakteri asam laktat memiliki sifat resisten terhadap tetracycline HCl generik dengan konsentrasi 30µg/ml dengan diameter penghambatan ≤15mm.
Tabel 2. Total bakteri asam laktat isolat kombucha dan dadih
|
Isolat |
Total BAL (cfu/ml) |
|
MB23 |
4,1×108 |
|
RB210 |
7,2×108 |
|
MK42 |
4,9×107 |
|
MK2 |
1,9×109 |
|
MY2 |
9,1×107 |
|
RK41 |
4,7×108 |
|
RG5 |
6,5×107 |
|
RN9 |
3,3×108 |
|
MS21 |
6,4×107 |
|
MA1 |
1,6×108 |
|
ML7 |
8×107 |
|
RJ1 |
8,4×107 |
|
RL2 |
6,5×107 |
Tabel 3. Sensitivitas isolat bal kombucha dan dadih terhadap amoxicillin
|
Isolat |
MS21 |
RB210 |
RK41 |
MK42 |
RL2 |
RG5 |
MA1 |
MB23 |
MY2 |
RJ1 |
RN9 |
ML7 |
MK2 |
|
Sensitivitas |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
I |
I |
I |
AMOXICILLIN
ISOLAT
Gambar 1. Grafik diameter penghambatan isolat bal kombucha dan dadih terhadap amoxicillin
Tabel 4. Sensitivitas isolat bal kombucha dan dadih terhadap tetracycline
|
Isolat |
MK2 |
RN9 |
MB23 |
ML7 |
MA1 |
RL2 |
MY2 |
MS21 |
MK42 |
RJ1 |
RG5 |
RK41 |
RB210 |
|
Sensitivitas |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
TETRACYCLINE
ISOLAT
Gambar 2. Grafik diameter penghambatan isolat bal kombucha dan dadih terhadap tetracycline
Anisimova dan Yarullina (2018) melaporkan isolat L fermentum memiliki ketahanan terhadap antibiotik tetracycline akibat adanya gen tet(K), tet(M), tet(W), tet(S), dan tet(L) pada bakteri tersebut. Isolat L fermentum memiliki gen tet(K) yang dapat mengkodekan pompa effluks, dan tet(M) yang membantu dalam perlindungan ribosomal sel bakteri. Terdapatnya kode genetika yang dapat meningkatkan kemungkinan sel bakteri asam laktat untuk bertahan hidup dapat menjadi alasan mengapa bakteri asam laktat bersifat tahan terhadap antibiotik jenis tetracycline. Berdasarkan laporan tersebut dapat membuktikan bahwa bakteri asam laktat Lactobacillus memungkinkan untuk memiliki sifat resistensi terhadap antibiotik tetracycline.
Penelitian lain mengenai resistensi BAL terhadap antibiotik juga pernah dilakukan pada produk pangan sosis fermentasi kering salami. Ditemukan bahwa dari 60 strain Lactobacillus dengan spesies L sakei, L curvatus, dan L plantarum, sekitar 45 (75%) dari isolat tersebut memliki sifat resistensi terhadap tetracycline. Diperkirakan bahwa bakteri asam laktat mendapatkan sifat resistensi tersebut melalui proses transfer genetik yang dilakukan oleh bakteri lain yang terdapat pada produk sosis fermentasi kering tersebut seperti contohnya: Staphylococcus. Berdasarkan hasil uji PCR ditemukan bahwa BAL tersebut sebagian besar memiliki gen resistensi tet(M) yang menyebabkan BAL tersebut tahan tetracycline. Dalam studi tersebut juga disebutkan kemungkinan BAL yang resisten terhadap
antibiotik untuk melakukan transfer genetik masih kecil kemungkinannya. (Zonenschain et al , 2009)
Ketahanan BAL Isolat Kombucha dan Dadih terhadap Chloramphenicol
Chloramphenicol merupakan antibiotik yang menghambat sintesis protein dengan cara
mencegah pengikatan mRNA ke ribosom 50S (Berger, 1986). Berikut merupakan hasil pengujian berupa sensitivitas isolat BAL pada tabel 5, dan juga grafik diameter penghambatan yang dapat dilihat pada Gambar 3.
Tabel 5. Sensitivitas isolat bal kombucha dan dadih terhadap chloramphenicol
|
Isolat |
ML7 |
MK2 |
RG5 |
MS21 |
MK42 |
MA1 |
RJ1 |
RB210 |
RL2 |
MB23 |
RK41 |
RN9 |
MY2 |
|
Sensitivitas |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
R |
CHLORAMPHENICOL
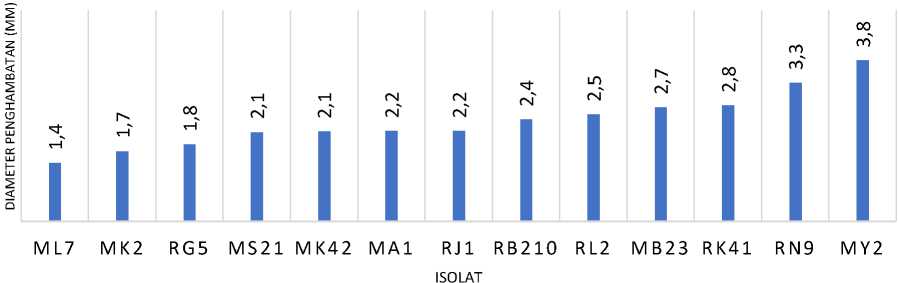
Gambar 3. Grafik diameter penghambatan isolat bal kombucha dan dadih terhadap chloramphenicol
Hasil pengujian keseluruhan isolat bakteri asam laktat terhadap antibiotik jenis chloramphenicol menunjukkan bahwa seluruh isolat bakteri asam laktat memiliki sifat resisten terhadap chloramphenicol generik (konsentrasi 30µg/ml) dengan diameter penghambatan ≤15mm.
Kemampuan bakteri untuk tahan terhadap antibiotik chloramphenicol dapat terjadi akibat gen cat yang dimiliki oleh sel. Gen ini dapat menyebabkan bakteri untuk dapat menghasilkan enzim chloramphenicol acetyltransferase yang mampu menginaktivasi senyawa antibiotik yang masuk ke dalam sel sebelum terjadinya
penghambatan sintesis protein dalam sel bakteri (Schwarz et al., 2004).
Hummel et al , (2007) telah menemukan bahwa gen cat dapat dimiliki oleh isolat lactobacillus yang bersifat sensitif terhadap chloramphenicol, namun biasanya gen cat yang dimiliki oleh bakteri sering kali tidak terlihat sifatnya dari segi RNA baik dalam keadaan yang dapat mendorong bekerjanya gen ini maupun tidak. Penulis menyebutkan bahwa mutasi pada beberapa bagian pada genetik bakteri mungkin menyebabkan terjadinya penghambatan ekspresi
gen cat pada isolat yang bersifat sensitif terhadap chloramphenicol
Pada umumnya BAL dengan genus Lactobacillus tidak memiliki ketahanan bawaan terhadap antibiotik chloramphenicol (Abriouel et al., 2015). Namun penelitian telah dilakukan untuk mengetahui resistensi BAL terhadap antibiotik chloramphenicol pada beberapa jenis makanan lokal Indonesia seperti bekasam, tempoyak, dadih, dan tape ketan yang menunjukkan bahwa dari 120 sampel isolat BAL yang diuji, ditemukan bahwa sebanyak 54 isolat telah memiliki gen cat yang menunjukkan bahwa BAL tersebut memiliki resistensi tertentu terhadap antibiotik chloramphenicol.
KESIMPULAN DAN SARAN Kesimpulan
Lactobacillus plantarum RN9, L plantarum I MK2, L plantarum I ML7 memiliki ketahanan intermediet terhadap amoxicilin. Keseluruhan isolat kombucha dan isolat dadih susu sapi memiliki resistensi terhadap tetracycline dan chloramphenicol. Lactobacillus pentosus MS21 (d = 2,9mm) memiliki tingkat resistensi tertinggi terhadap antibiotik amoxicillin. L plantarum I MK2 (d = 0,3mm) memiliki tingkat resistensi tertinggi terhadap antibiotik tetracycline. dan L plantarum I ML7 (d = 1,4mm) memiliki tingkat resistensi tertinggi terhadap antibiotik chloramphenicol.
Saran
Perlu dilakukan penelitian lanjutan mengenai mekanisme ketahanan BAL terhadap
antibiotik dari segi genetika bakteri asam laktat pada masing-masing isolat, dan juga pengujian ketahanan BAL terhadap antibiotik dengan metode MIC (Minimum Inhibitory Concentration) untuk mengetahui konsentrasi minimum penghambatan antibiotik terhadap BAL tersebut.
DAFTAR PUSTAKA
Abriouel, H., C, Muñoz., LL, Lerma, P, Montoro., W, Bockelman., R, Pichner,. (2015). New insights in antibiotic resistance of Lactobacillus species from fermented foods. Food Research International, 78, 465-481.
Anisimova, E., dan Y, Dina. (2018).
Characterization of Erythromycin and Tetracycline Resistance in Lactobacillus fermentum strains. International Journal of Microbiology, 1-9.
Bauer, A., W. M, Kirby., J. C., Sherris., dan M, Turck,. (1966). Antibiotic susceptibility testing by a standardized single disk method. American Journal of Clinical Pathology, 45, 493-496.
Behnsen, J., E., Deriu, M., Sassone-Corsi dan M., Raffatellu (2013). Probiotics: Properties, Examples, and Specific Applications. Cold Spring Harb Perspect Med, 3(a010074), 1-15.
Berger, S. A. (1986). Antibiotika dan Infeksi (Edisi pertama). Jakarta: CV. EGC Penerbit Buku Kedokteran.
Black, G. J. 2004. Microbiology: Principles and Exploration (Edisi ke-6). Virginia: Ed. John Wiley and Sons, Inc.
Fadl, G., H., Abdel, dan Z., Farag (2014). Antibiotic resistance in lactic acid bacteria isolated from some pharmaceutical and dairy products. Braz J Microbiol, 45, 1-12.
FAO dan WHO. (2002). Guidelines for the Evaluation of Probiotics in. Ontario: Joint FAO/WHO Working Group.
Fardiaz, S. (1993). Mikrobiologi Pangan I. Jakarta: PT. Gramedia Pustaka Utama.
Gueimonde, M., B., Sanchez, G, G. D., Clara, dan A., Margolles (2013). Antibiotic resistance in probiotic bacteria. Front Microbiol, 4(9), 202.
Harrigan, W., dan M. E., McCance. (1998). Laboratory Methods in Food Microbiology
(Ketiga ed.). United Kingdom: Academic Press.
Hummel, A., C., Hertel, W., Holzapfel, dan C. Franz/ (2007). Antibiotic resistances of starter and probiotic strains of lactic acid bacteria. Appl Environ Microbiol, 73(9), 730.
Juniarthati, P. (2011). Skrining Bakteri Asam Laktat Isolat Susu Sapi Bali Penghasil Bakteriosin penghambat Bakteri Patogen E.coli Penyebab Diare Akut. Bali: Skripsi Jurusan Farmasi Universitas Udayana.
Kementerian Kesehatan Republik Indonesia. 2011. Pedoman Umum Penggunaan Antibiotik. Berita Negara Republik Indonesia, hal. 60.
Liasi, S., T, Azmi,. M, Hassan,. dan M., Shuhaimi. (2009). Antimicrobial acitivity and antibiotic sensitivity of three isolates of lactic acid bacteria from fermented fish product, Budu. Malaysian Journal of Microbiology, 5(1), 3337.
Lowy, F. (1986). Antibiotika dan Infeksi (edisi pertama). Jakarta: CV. EGC Penerbit Buku Kedokteran
O'May, G., N, R., Smith, A. R., dan A, Kennedy. (2005). Effect of pH and antibiotics on microbial overgrowth in the stomachs and duodena of patients undergoin percutaneous endoscopic gastronomy feeding. J. Clin. Microbiol, 43(7), 3059-3065.
Pelczar, M., dan R, Rheid. (1986). Microbiology. New York: McGraw-Hill Book Co.
Prado, F. C., J. L. Parada, A., Pandey, dan C. R., Soccol. (2008). Trends in non-diary probiotic beverages. Food Res. Int., 41, 111-123.
Puspawati, N. N., N. M. I. H., Arihantana, I M, Sugitha. (2016). Identifikasi Fenotif Lactobacillus Sebagai Probiotik Unggul dari Minuman Fungsional Teh Kombucha dengan Analytical Profile Index (API) 50 CHL. Laporan Hasil Penelitian Hibah Unggulan Program Studi. Badung; Universitas Udayana.
Puspawati, N. N., N. M. I. H., Arihantana. (2016). Viability of Lactic Acid Bacteria Isolated from Kombucha Tea Against Low pH and Bile Salt. Media Ilmiah Teknologi Pangan. 3(1), 19-26
Puspawati, N. N., N. M. I. H., Arihantana., A. S., Duniaji. (2018). Aplikasi Awal dan
Identifikasi Bakteri Asam Laktat Sebagai Starter Dadih/Susu Fermentasi Dari Berbagai Jenis Bambu (Bambusa sp) Yang Tumbuh di Bali. Laporan Hasil Penelitian Hibah Penelitian Strategis Nasional Institusi (PSNI). Badung: Universitas Udayana.
Salminen, S., A.V, Wright., dan, A, Ouwehand. (2004). Lactic Acid Bacteria: Microbiology and Functional Aspects (3rd ed.). New York: Marcel Dekker, Inc.
Schwarz, S., C., Kehrenberg, B., Doublet, dan A., Cloeckaert. (2004). Molecular basis of bacterial resistance to chloramphenicol and florfenicol. FEMS Microbiol, 28(5), 519.
Sujadmiko, W. K., dan, P. R., Wikandari. (2017). Resistensi Antibiotik Amoksisilin pada Strain Lactobacillus plantarum B1765 Sebagai Kandidat Kultur Probiotik. UNESA Journal of Chemistry , VI(1), 54-58.
Surono, I. (2004). Probiotik - Susu Fermentasi dan Kesehatan. Jakarta: Tri Cipta Karya.
Sylvia, T. P. (2008). Mikrobiologi Farmasi. Jakarta: Erlangga.
Vlkova, E., V., Rada, P., Popelarova, dan I, Trojanova. (2006). Antimicrobial
susceptibility of bifidobacteria isolated from gastrointestinal tract of calves. Livestock Science, 105, 253-259.
Volk, W. A., dan, M. F., Wheeler. (1993). Mikrobiologi Dasar Edisi Kelima (Kelima ed.). PT. Gelora Aksara Pratama, Erlangga.
Widyastuti, Y., dan E., Sofarianawati. (1999). Bakteri Asam Laktat Enterococcus sp. yang diisolasi dari saluran pencernaan ternak. Jurnal Mikrobiologi Indonesia, 4, 50-53.
745
Discussion and feedback