Aktivitas Antijamur Ekstrak Kecombrang (Etlingera elatior) Terhadap Aspergillus Flavus FNCC 6109
on
Jurnal Itepa, 9 (2) Juni 2020, 127-135
ISSN : 2527-8010 (Online)
Aktivitas Antijamur Ekstrak Kecombrang (Etlingera elatior) Terhadap Aspergillus Flavus FNCC 6109
Antifungal Activity of Torch Ginger Part Extract (Etlingera elatior) on Aspergillus flavus FNCC 6109
Yovanda Rizky Nasution*, Agus Selamet Duniaji, Ni Made Indri Hapsari Arihantana
Program Studi Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana, Jl. Raya Kampus Unud, Jimbaran, Kuta Selatan, Badung-Bali *Penulis korespondensi: Yovanda Rizy, Email: yovandarizky1331@gmail.com
ABSTRACT
The aim of this research was to determine the concentration of phenol compounds and antifungal activity of torch ginger (Etlingera elatior) on Aspergillus flavus FNCC 6109. This research was a completely randomized design with 10 concentrations of shoot, flower, and fruit extract which were 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, and 100%. The data were analyzed with variance analysis then followed by Duncan Multiple Range Test (DMRT). Analysis were repeated 2 times resulting in 20 experimental units. Result showed that each concentration of shoot, flower, and fruit extract had significantly effect (P<0,05) in inhibition of Aspergillus flavus FNCC 6109. Shoot, flower, and fruit extract of torch ginger contained phenol compounds of 154,56 mgGAE/g, 127,22 mgGAE/g, and 261,52 mgGAE/g. The best antifungal activity for shoot extract of torch ginger was at 70% concentration with a diameter inhibition of 7,9 mm category medium, for flower extract of torch ginger was at 90% concentration with a diameter inhibition of 5,65 mm category medium, and for fruit extract of torch ginger was at 80% concentration with a diameter inhibition of 13,75 mm category strong. Fruit extract of torch ginger had the highest phenol compound which could inhibit Aspergillus flavus FNCC 6109.
Keyword : Phenol, torch ginger, antifungal, Aspergillus flavus
PENDAHULUAN
Aspergillus flavus merupakan salah satu jamur parasit yang menghasilkan mikotoksin dan menyebabkan penyakit Aspergillosis (Yuliana, 2005). Mikotoksin yang dihasilkan oleh A. flavus adalah aflatoksin yang mencemari bahan pangan yang sering dikonsumsi sehari-hari yaitu kacang-kacangan, serealia, minyak sayur, rempah-rempah, dan produk olahan susu (Reddy dan Waliyar, 2000). Aflatoksin yang dihasilkan oleh A. flavus dapat menyebabkan penyakit bagi manusia dan hewan
sehingga diperlukan adanya penanganan yang tepat dengan menghambat pertumbuhan A. flavus sehingga pencemaran bahan pangan oleh aflatoksin dapat dicegah. Pengendalian pertumbuhannya dapat menggunakan senyawa aktif yang berasal dari tumbuhan, salah satunya yaitu senyawa golongan fenol.
Tumbuhan yang mengandung senyawa fenol adalah kecombrang (Etlingera elatior) yang dikenal sebagai salah satu tumbuhan herbal yang mengandung senyawa alkaloid, triterpenoid, steroid,
glikosida, flavonoid dan fenol yang dapat dijumpai hampir pada semua bagiannya yaitu pada bunga, daun, batang, serta rimpangnya (Naufalin et al., 2005). Naufalin et al., (2012) juga menyatakan bahwa secara kualitatif buah kecombrang positif kuat mengandung senyawa fenol. Kemampuan senyawa fenol dalam menghambat pertumbuhan jamur dengan menghentikan siklus pada jamur pada fase replikasi (Ashour et al., 2011). Naufalin (2005) menyatakan ekstrak etanol bunga kecombrang dengan konsentrasi 30% dapat menghambat pertumbuhan spora Aspergillus flavus pada 24 jam inkubasi dengan persentase penghambatan pertumbuhan sebesar 53,8%. Selain itu, Yusran (2018) menyatakan ekstrak buah kecombrang dengan konsentrasi 10% sudah mampu menghambat pertumbuhan bakteri Staphylococcus aureus dengan diameter zona hambat sebesar 4,5 mm. Berdasarkan uraian diatas, diperlukan penelitian untuk mengetahui kadar senyawa fenol dan aktivitas antijamur terhadap Aspergillus flavus FNCC 6109 dari masing-masing ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior).
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Pangan dan Laboratorium Analisis Pangan Program Studi Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian, Universitas Udayana. Penelitian dilaksanakan dari April – Juli 2019.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas, bunga, dan buah kecombrang yang diperoleh dari Pasar Kuta, Bali, isolat Aspergillus flavus (FNCC 6109) yang diperoleh dari Pusat Pangan dan Gizi Universitas Gadjah Mada, aquades steril, etanol 70%, media Potato dextrose-agar (PDA), alkohol 95%, ketokonazol, reagen Folin-Ciocalteu, standar asam galat, dan AlCl3.
Alat-alat yang digunakan dalam penelitian ini adalah oven, ayakan 60 mesh, evaporator, spektrofotometer (Genesys 10s UV-Vis), pisau, batang L, timbangan analitik, mikropipet, waterbath, freezer, inkubator, tip, laminar flow cabinet (Kojair), bunsen, tabung durham, vortex, mikroskop, cawan petri (Pyrex), jarum ose, tabung reaksi (Pyrex), gelas beker (Pyrex), erlenmeyer (Pyrex), gelas ukur (Pyrex), jangka sorong, kertas label, tabung effendorf, batang bengkok, tissue, plastik HDPE, kertas saring, kertas Whatman no.1, dan alumunium foil (Klin Park).
Rancangan Percobaan
Penelitian ini menggunakan metode eksperimental Rancangan Acak Lengkap (RAL) dengan perlakuan pengenceran pada ekstrak tunas, bunga, dan buah kecombrang dengan konsentrasi 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, dan 100%. Seluruh perlakuan diulang 2 kali sehingga diperoleh 20 unit percobaan. Penelitian ini menggunakan pembanding yaitu kontrol positif (ketokonazol 0,1%) dan kontrol negatif (aquades steril). Penggunaan ketokonazol sebagai kontrol
positif dan aquades steril sebagai kontrol negatif adalah sebagai pembanding dengan kemampuan daya hambat masing-masing ekstrak terhadap pertumbuhan jamur Aspergillus flavus FNCC 6109.
Pelaksanaan Penelitian
Persiapan Sampel
Tunas, bunga dan buah kecombrang dibersihkan dan disortasi kemudian dikeringkan dengan menggunakan oven pada suhu 50oC selama 14 jam. Selanjutnya dilakukan penghancuran menggunakan blender lalu diayak menggunakan ayakan 60 mesh sehingga didapatkan bubuk yang homogen.
Ekstraksi Sampel
Ekstraksi ketiga bahan menggunakan metode maserasi. Masing-masing bubuk diambil sebanyak 50 gram lalu dimasukkan ke dalam etanol 70% sebanyak 250 mL (1:5) dan didiamkan selama 24 jam. Setelah itu ekstrak disaring menggunakan kertas Whatman no. 1 lalu didapatkan filtratnya kemudian dievaporasi pada suhu 40oC sampai tidak ada pelarut yang menetes lagi sehingga didapatkan ekstrak kental (Naufalin, 2005 yang dimodifikasi).
Uji Kadar Senyawa Fenol
Penentuan kadar senyawa fenol dilakukan dengan menggunakan metode Folin-Ciocalteau berdasarkan metode Garcia et al., (2007) dalam Widarta dan Arnata (2017) yang dibandingkan dengan standar asam galat.
Uji Konfirmasi
Uji konfirmasi dilakukan dengan mengambil 2-3 ose koloni A. flavus yang berwarna hijau ke dalam 9 mL aquades steril, kemudian dipipet 0,1 mL lalu disebar diatas media PDA di dalam cawan petri. Selanjutnya diinkubasi selama 5 hari pada suhu 30oC.
Uji Aktivitas Antijamur terhadap Aspergillus flavus
Pengujian aktivitas antijamur diawali dengan menuang media PDA steril ke dalam cawan petri steril sebanyak 15-20 mL lalu didiamkan sampai memadat. Selanjutnya, dibuat larutan suspensi fungi dengan mengambil 1 ose koloni jamur kemudian dimasukkan ke dalam tabung reaksi yang telah berisi 10 mL aquades steril. Setelah itu, dipipet 0,1 mL larutan suspensi jamur uji kemudian disebar di atas media PDA lalu diratakan dengan batang L. Media tersebut didiamkan selama ±15 menit kemudian dilubangi menggunakan tabung durham dengan diameter 4 mm lalu diisi dengan masing-masing ekstrak sesuai dengan perlakuan sebanyak 50 µL dan diinkubasi selama 48 jam dengan suhu 30oC (Syahruramadhan et al., 2016 yang dimodifikasi).
HASIL DAN PEMBAHASAN Uji kuantitatif senyawa fenol
Pengujian senyawa fenol dilakukan untuk mengetahui kandungan fenol dari ekstrak tunas, bunga, dan buah kecombrang secara kuantitatif. Hasil pengujian kadar senyawa fenol ekstrak tunas,
bunga, dan buah kecombrang dapat dilihat pada Tabel 1.
(2003), etanol memiliki polaritas yang tinggi yang dapat mengekstrak bahan lebih banyak dibandingkan jenis pelarut lain.
Tabel 1. Kandungan Senyawa Fenol
|
Bahan |
Ulangan (mgGAE/g) |
Hasil Rataan (mgGAE/g) | ||
|
I |
II | |||
|
Tunas |
155,42 |
153,69 |
154,56 ± |
1,2 |
|
Bunga |
128,01 |
126,44 |
127,22 ± |
1,1 |
|
Buah |
261,71 |
261,32 |
261,52 ± |
0,2 |
Berdasarkan Tabel 1, kandungan senyawa fenol tertinggi terdapat pada ekstrak buah kecombrang sebesar 261,52 mgGAE/g, ekstrak tunas kecombrang sebesar 154,56 mgGAE/g, dan terendah pada ekstrak bunga kecombrang sebesar 127,22 mgGAE/g menggunakan pelarut etanol. Berdasarkan hasil penelitian Naufalin et al., (2012), secara kualitatif bubuk buah kecombrang positif kuat mengandung senyawa fenol dan ekstrak air bunga kecombrang mengandung senyawa fenol (Naufalin, 2005). Tingginya kandungan fenol pada ekstrak buah kecombrang karena buah merupakan tempat penyimpanan cadangan makanan pada tumbuhan, sehingga kandungan senyawa aktif pada buah lebih banyak dibanding bagian tumbuhan lainnya. Kandungan senyawa fenol dalam suatu bahan dipengaruhi oleh pelarut yang digunakan. Etanol merupakan salah satu pelarut yang bersifat polar yang mampu melarutkan fenol dengan baik (Moein dan Mahmood, 2010). Menurut Sudarmadji
Uji Konfirmasi
Hasil pengamatan secara makroskopis menunjukkan bahwa Aspergillus flavus memliki koloni berwarna hijau muda dengan bentuk koloni granular dan kompak. Hal ini sesuai dengan Elmer et al., (1978) yang menyatakan bahwa isolat murni Aspergillus flavus memiliki koloni berwarna hijau kekuningan atau kuning kecoklatan. Hasil isolasi Aspergillus flavus dapat dilihat pada Gambar 1.

Gambar 1. Aspergillus flavus pada media PDA
Hasil pengamatan morfologi Aspergillus flavus memiliki ciri-ciri yaitu bentuk vesikula yang
bulat dan bentuk konidia yang halus. Hal ini sesuai dengan Koneman et al., (1992) yang menyatakan bahwa Aspergillus flavus memiliki konidiofora, vesikel yang berbentuk bulat, pialida yang berada diatas vesikel dan memiliki konidia yang bulat, halus, atau kasar. Hasil pengamatan morfologi A. flavus dapat dilihat pada Gambar 2.
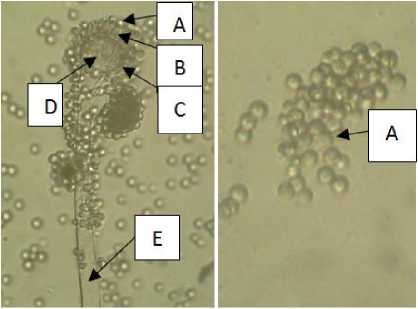
Keterangan: (A): Konidia, ( B): Pialida, (C): Metula, (D): Vesikel, (E): Konidiofora
Gambar 2. Aspergillus flavus diamati menggunakan mikroskop pada pembesaran 400x
Aktivitas Antijamur terhadap Aspergillus flavus FNCC 6109
Pengujian aktivitas antijamur terhadap Aspergillus flavus FNCC 6109 menggunakan metode difusi sumur yang menunjukkan adanya penghambatan dengan terbentuknya zona bening disekitar sumur. Menurut Davis dan Stout (1971), kategori daya hambat pada diameter penghambatan dikelompokkan menjadi 4 kategori, yaitu <5 mm lemah, 5-10 mm sedang, 10-20 kuat dan >20 mm sangat kuat. Berdasarkan penelitian yang telah dilakukan, ekstrak tunas, bunga, dan buah kecombrang mampu menghambat pertumbuhan Aspergillus flavus FNCC 6109 pada inkubasi 48 jam. Rata-rata diameter penghambatan ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior) serta kontrol positif dan negatif terhadap Aspergillus flavus FNCC 6109 pada inkubasi 48 jam dapat dilihat pada Tabel 2 dan Tabel 3.
Tabel 3. Rata-rata diameter penghambatan ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior) terhadap pertumbuhan Aspergillus flavus FNCC 6109 pada inkubasi 48 jam
|
Konsentrasi |
Rata-rata Diameter Penghambatan (mm) | ||
|
Jenis Ekstrak | |||
|
Tunas |
Bunga |
Buah | |
|
10% |
0 ± 0 a |
0 ± 0 a |
1,4 ± 0 a |
|
20% |
1,3 ± 0,1 b |
0 ± 0 a |
2,8 ± 0,1 b |
|
30% |
2,5 ± 0,2 c |
1,6 ± 0 b |
3,2 ± 0,3 b |
|
40% |
3,7 ± 0,1 d |
1,7 ± 0,07 b |
4,5 ± 0,07 c |
|
50% |
4,6 ± 0,6 e |
2 ± 0 b |
6,4 ± 0 d |
|
60% |
7 ± 0 f |
2,7 ± 0,3 c |
7,9 ± 0,6 e |
|
70% |
7,9 ± 0,1 g |
3,9 ± 0 d |
11,4 ± 0,8 f |
|
80% |
8,4 ± 0,5 g |
4,6 ± 0,6 e |
13,8 ± 0,3 h |
|
90% |
6,4 ± 0,3 f |
5,7 ± 0,07 f |
12,3 ± 0,5 g |
|
100% |
5 ± 0,28 e |
4,9 ± 0,07 e |
10,5 ± 0,3 f |
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama berbeda tidak nyata menurut uji Duncan (α=5%)
Tabel 2. Rata-rata diameter penghambatan kontrol positif dan kontrol negatif terhadap pertumbuhan Aspergillus flavus FNCC 6109 pada inkubasi 48 jam.
|
Kontrol |
Rata-rata Diameter | |
|
Penghambatan (mm) |
Kategori Daya Hambat | |
|
(+) Positif |
17,9 ± 0,84 |
Kuat |
|
(-) Negatif |
0 ± 0 |
Tidak ada |
Aktivitas Antijamur Ekstrak Tunas Kecombrang (Etlingera elatior) terhadap Aspergillus flavus FNCC 6109
Hasil analisis sidik ragam menunjukkan perlakuan konsentrasi ekstrak tunas kecombrang memberikan pengaruh nyata (P<0,05) terhadap daya hambat Aspergillus flavus FNCC 6109. Berdasarkan Tabel 2, ekstrak tunas kecombrang mampu menghambat pertumbuhan A. flavus FNCC 6109 pada konsentrasi 20% sampai 100%. Ekstrak bunga kecombrang memiliki kandungan fenol sebesar 154,56 mgGAE/g sehingga dapat menghambat A.flavus FNCC 6109 dengan rata-rata diameter penghambatan sebesar 1,3 mm sampai 8,35 mm. Kategori daya hambat pada konsentrasi 60-100% termasuk kategori sedang, konsentrasi 20-50% kategori lemah, dan konsentrasi 10% tidak membentuk zona hambat. Rata-rata diameter penghambatan tertinggi terdapat pada konsentrasi 80% sebesar 8,35 mm yang berbeda tidak nyata terhadap konsentrasi 70% sebesar 7,9 mm, sehingga
konsentrasi terbaik dalam menghambat pertumbuhan A. flavus FNCC 6109 terdapat pada konsentrasi 70% karena lebih efisien dalam menghambat pertumbuhan A. flavus FNCC 6109. Bila dibandingkan, diameter penghambatan terbaik lebih kecil dibandingkan kontrol positif yang digunakan. Diameter penghambatan mengalami peningkatan sampai konsentrasi 80% dan mengalami penurunan pada konsentrasi 90% sampai 100% karena ekstrak yang terlalu pekat tidak mampu berdifusi dengan baik (Maleki, 2008). Terbentuknya zona hambat oleh ekstrak buah kecombrang terhadap A. flavus FNCC 6109 dapat dilihat pada dilihat pada Gambar 3.

Gambar 3. Zona hambat ekstrak tunas kecombran
Aktivitas Antijamur Ekstrak Bunga Kecombrang (Etlingera elatior) terhadap Aspergillus flavus FNCC 6109
Hasil analisis sidik ragam menunjukkan perlakuan konsentrasi ekstrak bunga kecombrang memberikan pengaruh nyata (P<0,05) terhadap daya hambat Aspergillus flavus FNCC 6109. Berdasarkan Tabel 2, ekstrak bunga kecombrang mampu menghambat pertumbuhan A. flavus FNCC 6109 pada konsentrasi 30% sampai 100%. Ekstrak bunga kecombrang memiliki kandungan fenol sebesar 127,22 mgGAE/g sehingga dapat menghambat A.flavus FNCC 6109 dengan rata-rata diameter penghambatan sebesar 1,6 mm sampai 5,65 mm. Kategori daya hambat pada konsentrasi 90% termasuk kategori sedang, konsentrasi 30 sampai 80% dan 100% kategori lemah, serta konsentrasi 10% dan 20% tidak membentuk zona hambat. Konsentrasi terbaik dalam menghambat pertumbuhan A. flavus FNCC 6109 terdapat pada konsentrasi 90% sebesar 5,65 mm. Bila dibandingkan, diameter penghambatan terbaik lebih kecil dibandingkan kontrol positif yang digunakan. Diameter penghambatan mengalami peningkatan sampai konsentrasi 90% dan mengalami penurunan pada konsentrasi 100% karena ekstrak yang terlalu pekat tidak mampu berdifusi dengan baik (Maleki, 2008). Terbentuknya zona hambat oleh ekstrak bunga kecombrang terhadap A. flavus FNCC 6109 dapat dilihat pada Gambar 4.

Gambar 4. Zona hambat ekstrak bunga kecombrang
Aktivitas Antijamur Ekstrak Buah Kecombrang (Etlingera elatior) terhadap Aspergillus flavus FNCC 6109
Hasil analisis sidik ragam menunjukkan perlakuan konsentrasi ekstrak buah kecombrang memberikan pengaruh nyata (P<0,05) terhadap daya hambat Aspergillus flavus FNCC 6109. Berdasarkan Tabel 2, ekstrak buah kecombrang mampu menghambat pertumbuhan A. flavus FNCC 6109 pada konsentrasi 10% sampai 100%. Ekstrak buah kecombrang memiliki kandungan fenol sebesar 261,52 mgGAE/g sehingga dapat menghambat A. flavus FNCC 6109 dengan rata-rata diameter penghambatan sebesar 1,4 mm sampai 13,75 mm. Kategori daya hambat pada konsentrasi 80-100% termasuk kategori kuat, konsentrasi 50% dan 60% kategori sedang, dan konsentrasi 10-40% kategori lemah. Konsentrasi terbaik dalam menghambat pertumbuhan A. flavus FNCC 6109 terdapat pada konsentrasi 13,75 mm. Bila dibandingkan, diameter penghambatan terbaik dari lebih kecil dibandingkan kontrol positif yang digunakan. Diameter penghambatan mengalami peningkatan sampai konsentrasi 80% dan mengalami penurunan pada
konsentrasi 90% sampai 100% karena ekstrak yang terlalu pekat tidak mampu berdifusi dengan baik (Maleki, 2008). Terbentuknya zona hambat oleh ekstrak buah kecombrang terhadap A. flavus FNCC 6109 dapat dilihat pada Gambar 5.
Gambar 5. Zona hambat ekstrak buah kecombrang
Ekstrak buah kecombrang memiliki 0% 20% 30% 40% 50% 60%
kandungan senyawa fenol tertinggi dibandingkan ekstrak tunas dan bunganya. Tingginya kandungan fenol 70%m e80% 90%uah 100%mbrang mampu memberikan penghambatan tertinggi terhadap Aspergillus flavus FNCC 6109. Peranan senyawa fenol dalam menghambat pertumbuhan jamur adalah dengan masuk ke dalam sel dan membentuk ikatan dengan protein membran sel. Senyawa fenol akan berinteraksi dengan protein membran sel melalui proses absorbsi yang menyertakan ikatan hidrogen dengan cara terikat pada bagian hidrofilik dari membran sel. Kompleks protein dengan senyawa yang berikatan lemah akan mengalami peruraian kemudian diikuti penetrasi senyawa fenolik ke dalam membran sel yang menyebabkan presipitasi dan terdenaturasinya protein membran sel. Kerusakan pada membran sel menyebabkan perubahan permeabilitas pada membran sel yang kemudian mengakibatkan hancurnya membran sel
jamur, sehingga semakin tinggi kadar senyawa fenol dalam suatu bahan maka semakin kuat bahan tersebut untuk menghambat pertumbuhan jamur (Parwata dan Dewi, 2008).
KESIMPULAN DAN SARAN
Kesimpulan
-
1. Ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior) memiliki kandungan fenol berturut-turut sebesar 154,56 mgGAE/g, 127,22 mgGAE/g dan 261,52 mgGAE/g.
-
2. Perlakuan konsentrasi pada masing-masing ekstrak tunas, bunga, dan buah kecombrang memberikan pengaruh nyata terhadap daya hambat Aspergillus flavus FNCC 6109. Daya hambat terbaik pada esktrak tunas kecombrang terdapat pada konsentrasi 70% sebesar 7,9 mm dengan kategori sedang, ekstrak bunga kecombrang pada konsentrasi 90% sebesar 5,65 mm dengan kategori sedang, dan ekstrak buah kecombrang pada konsentrasi 80% sebesar 13,75 mm dengan kategori kuat.
-
3. Buah kecombrang memiliki kandungan fenol tertinggi sehingga dapat menghambat pertumbuhan Aspergillus flavus FNCC 6109 lebih tinggi dibanding ekstrak tunas dan bunga kecombrang.
Saran
-
1. Perlu dilakukan uji kuantitatif senyawa aktif lain pada ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior) dan uji aktivitas antijamur dengan metode lain dan jamur yang lain.
-
2. Perlu dilakukan penelitian lebih lanjut untuk melakukan penerapan ekstrak tunas, bunga, dan buah kecombrang (Etlingera elatior) sebagai pengawet alami dalam produk pangan yang banyak ditemui tercemar oleh Aspergillus flavus.
DAFTAR PUSTAKA
Ashour, M.S.E., G.F. Gad, dan R.A.I. Aly. 2011. Microbial evaluation of some non-sterile pharmaceutical preparations commonly used in the Egyptian market. Trop J Pharm Res 10: Hal: 437-445.
Davis, W.W., dan T.R. Stout. 1971. Disc Plate Method of Microbiological Antibiotic Assay, Appl. Microbiol. 4 (22), 666-670
Elmer, W.K., D.R. Glenn, dan E.W Sara. 1978. Practical Laboratory Mycologi 2nd Edition. The Williams and wilkins co. United States of Amerika. 7-96p
Jay, J.M. 1996. Modern Food Microbiology. Van Nostrand Reinhold Publ. New York.
Koneman E.W. 1992. Color Atlas and Textbook of Diagnostic Microbiology. Lippincot Williams & Wilkims, Philadelphia, h. 452454.
Maleki. 2008. Antibacterial Activity of The Fluid of Iranian Torilis Leptophylla Against Some Clinical Pathogen. Pakistan Journal of Biologycal Science. 11, (9), 1286-1289.
Moein S., dan R.M. Mahmood. 2010. Relationship between antioxidant properties and phenolics in Zhumeria majdae. Journal of Medicinal Plants Research (7): 517-521.
Naufalin R., B.S.L. Jenie, F. Kusnandar, M. Sudarwamto, dan H. Rukmini. 2005.
Aktivitas Antibakteri Ekstrak Bunga
Kecombrang terhadap Bakteri Patogen dan Perusak Pangan. Jurnal Teknologi dan Industri Pangan. Vol. XVI No.2.
Naufalin, R. 2005. Aktivitas Antikapang Ekstrak Etil Asetat dan Etanol Bunga Kecombrang. Institut Pertanian Bogor.
Naufalin R., Tobari, dan H.S. Rukmini. 2012. Karakterisasi Nanoenkapsulan Buah Kecombrang (Nicolaia speciosa). Jakarta.
Parwata, O.A., dan P.S. Dewi. 2008. Isolasi dan Uji Aktivitas Antibakteri Minyak Atsiri dari Rimpang Lengkuas (Alpina galangal L.). Jurnal Fak.MIPA. Jur. Kimia Universitas Udayana. Bukit, Jimbaran.
Reddy, S.V., dan F. Waliyar. 2000. Properties of Aflatoxin and It Producing Fungi. International Crops Research Institute for the semi-arid Tropics.
Sudarmadji, S. 2003. Analisa Bahan Makanan dan Pertanian. Edisi ke 2 Vol:III. Liberty. Yogyakarta.
Syahruramadhan, M., N.A Yanti., dan L. Darlian. 2016. Aktivitas Antijamur Ekstrak Daun Kelor (Moringa oleifera Lamck.) dan Daun Kirinyuh (Chromolaena odorata L.) terhadap Candida albicans dan Aspergillus flavus. J. AMPIBI 1(2) hal. 7-12.
Tjay, T.H., dan Rahardja, K. 2007. Obat-obat penting : khasiat, penggunaan, dan efek-efek sampingnya, Edisi IV.
Widarta, I.W.R., dan I.W. Arnata. 2017. Ekstraksi Komponen Bioaktif dengan Bantuan Ultrasonik pada Berbagai Jenis dan Konsentrasi Pelarut. AGRITECH. Vol. 37 No.2.
Yuliana, P. 2015. Distribusi Jamur Aspergillus flavus pada bumbu pecel instan dalam kemasan tanpa merk yang dijual di pasar gedong tataan kabupaten pesawaran : Politeknik Kesehatan Tanjungkarawang.
Yusran, A., Muhammad, F. 2018. Daya Hambat Ekstrak Buah Patikala (Etlingera elatior (Jack) R.M.Sm) terhadap pertumbuhan Staphylococcus aureus. Makassar Dent
7(2): 95-99.
135
Discussion and feedback