Pengujian Daya Hambat Ekstrak Bubuk Temu Putih (Curcuma zedoaria (Berg.) Roscoe) Terhadap Aspergillus flavus
on
Itepa: Jurnal Ilmu dan Teknologi Pangan,
Hana Kusuma Brahmasari dkk. /Itepa 12 (3) 2023 707-715
ISSN : 2527-8010 (Online)
Pengujian Daya Hambat Ekstrak Bubuk Temu Putih (Curcuma zedoaria (Berg. Roscoe Terhadap Aspergillus flavus
Inhibitory Test of White Turmeric (Curcuma zedoaria (Berg.) Roscoe) Herbal Tea Powder Extract against Aspergillus flavus
Hana Kusuma Brahmasari, Luh Putu Trisna Darmayanti*, I Putu Suparthana
Program Studi Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Udayana Kampus Bukit Jimbaran, Badung-Bali
*Penulis korespondensi: Luh Putu Trisna Darmayanti, Email: trisnadarmayanti@unud.ac.id
Abstract
This study aimed to determine the extract of concentration of white turmeric powder in inhibiting the growth of the fungus A. flavus and to determine of active substances contained in the white turmeric powder. The parameters bioactive compounds observed total phenol contains, total flavonoids contains, and curcumin contains. White turmeric powder was extracted using 96% ethanol. The extraction method used is maceration. This study used a Completely Randomized Design with several concentrations of concentrated extract of white turmeric powder consisting of 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%. All treatments were repeated twice to obtain 20 experimental units and the data obtained were analyzed by descriptive analysis and interpreted with tables and figures.. The test results showed that the concentrated extract of white turmeric powder was not effect to inhibit the growth of the fungus A. flavus. The results showed that white turmeric powder contained phenol 576.225 mg GAE/100g, flavonoids 1.090.65 mg/100g, and curcumin 14.35 mg CE/100g.
Keywords : white turmeric powder, inhibition, Aspergillus flavus
PENDAHULUAN
Temu putih (Curcuma zedoaria (Berg.) Roscoe) adalah salah satu tanaman yang sering digunakan oleh sebagai salah satu obat tradisional umunya irisan, bubuk, dan ekstrak temu putih biasa digunakan sebagai tambahan makanan untuk mengawetkan makanan dan minuman, membunuh bakteri penyebab busuk, penghilang bau amis pada ikan, dan meningkatkan nilai organoleptic (rasa, aroma, dan warna) pada makanan (Roektiningsih et al, 2010). Bubuk temu putih merupakan salah satu cara pengolahan untuk
memperpanjang umur simpan dan tidak menghilangkan komponen bioaktif yang terkandung dalam rempah-rempah dapat diolah menjadi jamu, teh herbal, dan obat tradisional yang memiliki manfaat yang baik bagi tubuh manusia. Salah satu rempah-rempah yang biasa diolah menjadi bubuk adalah temu putih. Menurut Komariah et.al (2021) temu putih yang diolah menjadi teh herbal dengan pengolahan pengeringan pada suhu 50˚C memiliki kandungan komponen bioaktif yaitu kurkumin, fenol dan flavonoid. Menurut Nurhayati (2010) hasil ekstrak
Itepa: Jurnal Ilmu dan Teknologi Pangan, Hana Kusuma Brahmasari dkk. /Itepa 12 (3) 2023 707-715 metanol temu putih memiliki aktivitas antibakteri terhadap Klebsiella pneumoniae senyawa fenolik yang terkandung pada temu putih diketahui berpotensi sebagai antibakteri.
Metode daya hambat jamur merupakan suatu metode untuk menentukan tingkat kerentanan jamur terhadap zat antijamur dan mengetahui senyawa murni yang memiliki aktivitas antijamur (Husen, 2018). A. flavus merupakan jamur patogen yang sering mengkontaminasi bahan baku makanan yang menghasilkan mikotoksin sebagai metabolitnya dan dapat membuat keracunan makanan. Kontaminasi jamur ini sering terjadi saat penyimpanan bahan pangan dan pengolahan bahan pangan. Menurut Harbone (1987) senyawa kimia yang terkandung dalam temu putih (Curcuma zedoaria (Berg.) Roscoe) meliputi polimer fenol, polifenol (tanin, melanin, lignin, kuinon sebagai alkanoid). Menurut Windono et al. (2002), rimpang Curcuma zedoaria mengandung kurkuminoid (Diarilheptanoid), minyak atsiri, polisakarida. Kemampuan komponen bioaktif pada temu putih dapat menghambat aktifitas jamur, virus dan bakteri, baik Gram positif ataupun Gram negatif. Sejumlah penelitian menunjukan bahwa pada kunyit memiliki senyawa metabolit sekunder yang mampu menghambat pertumbuhan miselium jamur (Hartati, 2013). A. flavus dapat tumbuh subur pada suhu 10-40℃, pH 58, kelembaban 80%-90% dengan kadar air
16%-17%. Spora yang dihasilkan oleh jamur ini dapat tersebar oleh udara dan dapat mengkontaminasi berbagai bahan pangan. Aspergilosis merupakan penyakit yang disebabkan karena keracunan jamur Aspergillus (Safika, et al., 2014). Aflatoksin merupakan hasil metabolisme sekunder Aspergillus. Efek yang dihasilkan karena kontaminasi Aspergillus pada bahan pangan adalah kontaminasi mikotoksin yaitu aflatoksin. Menurut Busman, et al. (2019) pada daya hambat ekstrak rimpang putih (Curcuma zedoaria) terhadap Streptococcus mutans dengan konsentrasi 40% 16,96 mm dan pada bakteri Staphylococcus aureus dengan konsentrasi 80% sebesar 23,98 mm.
Ekstraksi temu putih dapat menggunakan pelarut etanol 96%. Pelarut etanol merupakan salah satu pelarut yang aman digunakan untuk pangan. Metode maserasi merupakan metode yang memiliki keuntungan yaitu mudah dan tidak perlu pemanasan, pemisahan senyawa dengan cara perendaman menggunakan pelarut pada temperatur ruangan (Koirewoa et al., 2012) sehingga kecil kemungkinan bahan alam menjadi rusak atau terurai. Berdasarkan hal tersebut penelitian ini dapat dilakukan.
METODE
Bahan Penelitian
Bahan-bahan yang digunakan pada peneletian ini adalah: rimpang temu putih
dengan umur panen 9 bulan yang diperoleh dari Madiun Jawa Timur, aluminium foil, etanol 96%, aquadesh, Sabouraud Dextrose Agar (SDA) Merck, NaCl 0,9%, gliserol 30%, biakan murni A. flavus yang didapat dari Lab Kesehatan Provinsi Bali, ketokonazol, aquadesh steril, kertas label.
Alat Penelitian
Alat-alat yang digunakan pada peneletian ini adalah: pisau, baskom, loyang, oven, vortex, blender (National), saringan 60 mesh (Sieve), kertas saring no 42 125mm (Whatman), kertas cakram diameter 6 mm (Oxoid), panci, cawan petri, Erlenmeyer (Pyrex), Ose bulat, gelas ukur (Pyrex), tabung reaksi, timbangan digital (I-2000), oven, pinset, laminar air flow, kulkas, inkubator (Memmert), aluminium foil, plastik, timbangan analitik (Shimadzu), evaporator (Buchi) autoclave, spectrophotometer (Genesys 10S UV-Vis).
Rancangan Percobaan
Rancangan prcobaan yang dilakukan pada penelitian kali ini adalah Rancangan Acak Lengkap (RAL) dengan perlakuan konsentrasi ekstrak temu putih yang terdiri dari 10 taraf sebagai berikut yaitu: P1= 10% ekstrak bubuk temu putih; P2= 20% ekstrak bubuk temu putih; P3= 30% ekstrak bubuk temu putih; P4= 40% ekstrak bubuk temu putih; P5= 50% ekstrak bubuk temu putih; P6= 60% ekstrak bubuk temu putih; P7= 70% ekstrak bubuk temu putih; P8= 80% ekstrak
bubuk temu putih; P9= 90% ekstrak bubuk temu putih; P10= 100% ekstrak bubuk temu putih. Setiap taraf dilakukan pengulangan sebanyak 2 kali sehingga diperoleh 20 unit percobaan. Data yang diperoleh kemudian dianalisis secara deskriptif dan diinterpretasikan dengan tabel dan gambar (Sugiyono. 2013).
Pelaksanaan Penelitian
Pembuatan bubuk temu putih
Penelitian ini mengguanakan sampel berupa temu putih (Curcuma zedoaria (Berg.) Roscoe) berumur panen 9 bulan didapatkan di Madiun, Jawa Timur. Persiapan yang dilakukan pada sampel temu putih dicuci untuk membersihkan tanah yang menempel kemudian disortasi, dikupas dan dicuci, kemudian ditiriskan untuk diproses menjadi bubuk.
Temu putih yang telah bersih diiris, didiamkan untuk proses pelayuan, kemudian dilakukan pengeringan, penghalusan, pengayakan. Proses pengirisan dilakukan dengan ukuran ± 2 cm × 2 cm dengan ketebalan 2 mm dan diletakkan pada loyang untuk selanjutnya sampel ditiriskan selama 1,5 jam dengan suhu 30˚C. Sampel kemudian dikeringkan menggunakan oven dengan suhu 50°C dalam waktu 24 jam (Komariah et al., 2021). Tahap berikutnya adalah penghalusan dengan blender dilanjutkan pengayakan dengan saringan 60 mesh. Bubuk temu putih yang telah lolos ayakan dilanjutkan pada
proses penimbangan dan disimpan dalam wadah.
Ekstraksi bubuk temu putih
Bubuk temu putih diekstraksi menggunakan metode maserasi dengan perlakuan konsentrasi 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, dan 100%. Bubuk yang telah ditimbang sesuai perlakuan dilarutkan dengan 100 ml pelarut etanol 96%, kemudian sampel dimaserasi selama 24 jam dalam suhu ruang. Larutan sampel yang telah dimaserasi kemudian disaring menggunakan kertas Whatman no.42. Setelah penyaringan, filtrat akan dipekatkan menggunakan rotary vacum evaporator dalam suhu 40ºC. Ekstrak kemudian dianalisis daya hambat terhadap A. flavus.
Pengujian Fitokimia Bubuk Temu Putih
Analisis fitokimia pada sampel bubuk temu putih meliputi total fenol menggunakan metode Folin-ciocalteu berdasarkan (Sakanaka et al., 2003), total flavonoid merujuk pada prosedur Rahman, et.al. (2006) dengan menggunakan kuersetin sebagai standar, dan total kurkumin menggunakan metode kurkumin sebagai standar berdasarkan (Harini et al., 2012)
Uji daya hambat A. flavus
Metode yang digunakan untuk pengujian daya hambat menurut Kirby-Bauer yaitu standart prosedur untuk evaluasi aktivitas antimikroba dengan difusi agar menggunakan kertas cakram (Disc diffusion)
atau difusi cakram (Cappuccino and Sherman, 1992). Tahap pertama pengujian memasukan cawan petri yang telah berisi media agar ke dalam inkubator pada suhu 37ºC selama 20 menit dengan penutup dalam kondisi sedikit terbuka, masing-masing penutup diberikan label dengan nama mikroba uji yang akan diinokulasikan yaitu A. flavus, kemudian isolat jamur A. flavus diinokulasikan pada media agar lalu didiamkan selama 5 menit, kertas cakram dicelupkan ke dalam ekstrak pekat bubuk temu putih dengan menggunakan pinset kemudian diletakkan dan ditekan pada permukaan agar yang telah diinokulasikan A. flavus, semua agar yang telah berisi sampel diinkubasi dalam watu 24 jam dengan suhu 37ºC, kemudian area bening disekitar kertas cakram diamati dan diukur kemudian dibandingkan dengan standar diameter zona hambat Tabel 1. Kemampuan daya hambat ditentukan berdasarkan kategori diameter zona bening.
Penentuan Konsentrasi Hambat (KHM)
Konsentrasi Hambat Minimal merupakan konsentrasi minimal yang mampu dilakukan zat antimikrroba untung menghambat pertumbuhan mikroba setelah dilakukan inkubasi selama 24 jam, pengujian ini dilakukan dengan cara mengukur diameter zona bening yang dihasilkan dengan jangka sorong. Klasifikasi respon hambatan pertumbuhan mikroba menggunakan metode difusi cakram pada Tabel 1.
Tabel 1. Klasifikasi Respon Hambatan Pertumbuhan Mikroba
|
Diameter Zona Bening |
Respon Hambatan Pertumbuhan |
|
>20mm 16-20mm 10-15mm <10mm |
Kuat Sedang Lemah Kurang Efektif |
Sumber: Pratama, (2008)
Parameter yang diamati
Parameter yang diamati dalam penelitian ini meliputi total fenol menggunakan metode Folin-ciocalteu berdasarkan (Sakanaka et al., 2003). Total flavonoid merujuk pada prosedur (Rahman et al., 2006) dengan menggunakan kuersetin sebagai standar. Total kurkumin menggunakan metode kurkumin sebagai standar berdasarkan (Harini et al., 2012). Pengujian daya hambat menggunakan metode Kirby-Bauer yaitu standart prosedur untuk evaluasi aktivitas antimikroba dengan difusi agar menggunakan kertas cakram (Disc diffusion) atau difusi cakram (Cappuccino dan Sherman, 1992).
HASIL DAN PEMBAHASAN Fitokimia Bubuk Temu Putih (Curcuma zedoaria (Berg.) Roscoe)
Hasil penelitian nilai total fenol, flavonoid dan kurkumin temu putih segar dan bubuk temu putih dapat dilihat pada Tabel 2. Pada Tabel 2 pada temu putih segar ditemukan
mengandung fenol, flavonoid dan kurkumin. Setelah diolah menjadi bubuk, bubuk temu putih juga diketahui masih mengandung zat aktif yaitu fenol, flavonoid, dan kurkumin. Pada Tabel 2 dapat dilihat bahwa temu putih segar memiliki kandungan fenol 1.146,62 mg GAE/100g, flavonoid 2.220,7 mg/100g, kurkumin 14,77 mg CE/100g. Bila dibandingkan dengan temu putih segar, setelah diolah menjadi bubuk, komponen bioaktif yang terkandung mengalami penurunan yaitu total fenol sebanyak 576,225 mg GAE/100g, flavonoid 1.090,65 mg/100g, kurkumin 14,35 mg CE/100g.
Penurunan pada komponen bioaktif bubuk temu putih ini dikarenakan proses pengolahan dengan cara pengovenan pada suhu 50°C selama 24 jam. Menurut Tonnsen dan Karlsen (1985) senyawa kurkumin memiliki kepekaan terhadap pH, suhu, cahaya dan radikal sehingga mudah mengalami degadrasi. Oksidasi akibat proses pemanasan akan terjadi lebih cepat serta mampu mengurangi kestabilan pada kurkumin.
|
Tabel 1. Nilai total fitokimia bubuk temu putih (Curcuma zedoaria (Berg) Roscoe) | ||
|
Zat aktif |
Hasil | |
|
Temu putih segar |
Bubuk temu putih | |
|
Fenol (mg GAE/100g) |
1.146,62±3,328 |
576,225±7,715 |
|
Flavonoid (mg/100g) |
2.220,7±22,345 |
1.090,65±29,912 |
|
Kurkumin (mg CE/100g) |
14,77±0,047 |
14,35±0,637 |
Keterangan: Nilai rata-rata ± standar deviasi (n=2)
Vatai et al., (2009) menyatakan dalam penelitiannya kandungan senyawa fenolik sangat sensitif, kurang stabil dan sangat rentan terdegadrasi. Faktor utama penyebab degradasi adalah temperatur, kandungan oksigen dan cahaya. Kerusakan sebagian besar senyawa fenolk disebabkan oleh suhu pemanasan (Tumiah et al., 2004).
Uji Daya Hambat A. flavus
Pengujian daya hambat berbagai konsentrasi ekstrak pekat bubuk temu putih (Curcuma zedoaria (Berg.) Roscoe) terhadap pertumbuhan jamur A. flavus dengan metode pengujian paper disk dapat dilihat pada Tabel 3. Pengujian Zona Hambat Ekstrak Pekat Bubuk Temu Putih dapat dilihat pada Gambar 1. Berdasarkan Tabel 3, hasil pengujian menunjukkan bahwa ekstrak pekat bubuk temu putih pada konsentrasi 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, dan 100% tidak mampu menghambat pertumbuhan jamur A. flavus. Kandungan bioaktif yang terdapat pada ekstrak pekat bubuk temu putih tidak mampu menghambat pertumbuhan jamur A. flavus. Hal ini terbukti disekitar
kertas cakram tidak terbentuk zona bening. Pada sejumlah penelitian diketahui bahwa ekstrak dari rimpang kunyit memiliki kemampuan sebagai antifungal. Beberapa fungi yang dapat dihambat seperti Trichophyton, Epidermophyton, Microsporum, Sporothrix dan Exophiala (Sharma et al., 2010).
Hasil penelitian bubuk temu putih ini berbeda dengan beberapa penelitian yang dilakukan, pada penelitian ini menunjukkan bahwa ekstrak pekat bubuk temu putih kurang efektif untuk menghambat pertumbuhan jamur A. flavus. Menurut Moghadamtousi et. al. (2014) kadar kurkumin menunjukan efek yang signifikan untuk menghambat pertumbuhan Paracoccidioides brasiliensis daripada menggunakan flukonazol. Namun pada penelitian ini kurkumin tidak mempengaruhi pertumbuhan A. flavus. Menurut Katzung (1955) terjadinya mekanisme pertahanan oleh kapang terhadap senyawa-senyawa yang terkandung dalam ekstrak menjadi kemungkinan kapang tidak dapat dihambat pertumbuhannya.
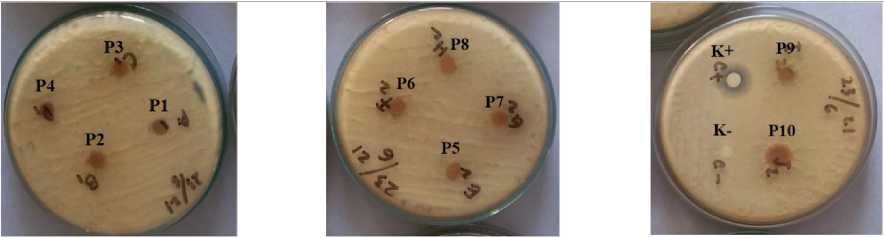
Gambar 1. Pengujian Zona Hambat Ekstrak Pekat Bubuk Temu Putih
Tabel 3. Hasil pengukuran zona hambat ekstrak pekat bubuk temu putih (Curcuma zedoaria (Berg.) Roscoe) terhadap pertumbuhan Jamur A. flavus.
|
Konsentrasi |
Waktu Pengamatan |
Diameter Zona Hambat (mm) |
Interpretasi |
|
Kontrol (+) |
24 jam |
17,60±0,565 |
Sedang |
|
Kontrol (-) |
24 jam |
0 |
Kurang efektif |
|
P1 (10%) |
24 jam |
0 |
Kurang efektif |
|
P2 (20%) |
24 jam |
0 |
Kurang efektif |
|
P3 (30%) |
24 jam |
0 |
Kurang efektif |
|
P4 (40%) |
24 jam |
0 |
Kurang efektif |
|
P5 (50%) |
24 jam |
0 |
Kurang efektif |
|
P6 (60%) |
24 jam |
0 |
Kurang efektif |
|
P7 (70%) |
24 jam |
0 |
Kurang efektif |
|
P8 (80%) |
24 jam |
0 |
Kurang efektif |
|
P9 (90%) |
24 jam |
0 |
Kurang efektif |
|
P10 (100%) |
24 jam |
0 |
Kurang efektif |
Keterangan:
Kuat : > 20 mm
Sedang : 16 - 20 mm
Lemah : 10 – 15 mm
Kurang efektif : < 10 mm
Rusaknya senyawa antimikroba disebabkan oleh enzim yang dihasilkan oleh mikroba. Enzim yang dihasilkan oleh mikroba dapat merubah permeabilitas serta dapat mengembangkan suatu perubahan struktur sasaran terhadap zat antimikroba, mikroba dapat mengembangkan suatu perubahan struktur sasaran bagi zat yang berfungsi sebagai antimikroba, mikroba juga mampu
mengganggu zat antimikroba dengan mengembangkan perubahan metabolisme serta mengembangkan suatu enzim yang bisa merubah khasiat zat antimikroba (Katzung, 1955).
Maleki et. al. (2008), dalam penelitiannya menyatakan ekstrak Torilis leptophylla sulit berdisfusi secara maksimal ke dalam medium yang mengandung
inokulum disebabkan oleh ekstrak yang terlalu pekat. Hal ini menyebabkan komponen bioaktif yang terkandung dalam ekstrak tidak terlarut sempurna karena kejenuhan yang dipicu oleh konsentrasi ekstrak yang lebih besar.
KESIMPULAN
Konsentrasi ekstrak pekat bubuk temu tidak berpengaruh terhadap daya hambat jamur A. flavus. Bubuk temu putih mengandung senyawa bioaktif yaitu fenol (576,225mg GAE/100g), flavonoid
(1.090,65mg/100g) , dan kurkumin (14,77 mg CE/100g) . Kadar senyawa bioaktif pada bubuk temu putih mengalami penurunan, karena proses pengolahan dengan pengovenan pada suhu 50ºC dalam waktu 24 jam. Ekstrak temu putih dengan komponen bioaktif seperti fenolik, flavonoid, kurkumin belum mampu menghambat A. flavus.
DAFTAR PUSTAKA
Busman, E., & Wirahmi, S. D. 2019. Daya hambat ekstrak rimpang temu putih (Curcuma zedoaria) terhadap Streptococcus mutans dan Staphylococcus aureus. Menara
Ilmu, 13(6).
Harini, B.W., R. Dwiastuti. dan L. C. Wijayanti. 2012. Aplikasi Metode
Spektrofotometri Visibel Untuk
Mengukur Kadar Kurkuminoid Pada Rimpang Kunyit (Curcuma domestica). Prosiding Seminar Nasional Aplikasi Sains & Teknologi (SNAST) Periode III.
Hartati, S. Y. 2013. Khasiat kunyit sebagai obat tradisional dan manfaat lainnya. Warta Penelitian dan pengembangan tanaman industri, 19(2), 5-9.
Horn, B. W., Greene, R. L., Sorensen, R. B., Blankenship, P. D., Dorner, J. W. 2001. Conidial movement of nontoxigenic Aspergillus flavus and A. parasiticus in peanut fields following application to soil. Mycopathologia, 151(2), 81-92.
Katzung, B.G. 1955. Farmakologi dasar dan klinik edisi 3. EGC:Jakarta hal .66
Komariah, R., Darmayanti, L. T., Arihantana, N. I. H. 2021. Pengaruh Pengeringan terhadap Karakteristik Teh Herbal Celup Rimpang Temu Putih (Curcuma zedoaria Rosc.) The Effect of Drying on The Characteristics of Herbal Tea Bag Zedoary Rhizome (Curcuma zedoaria Rosc.). Jurnal Ilmu dan Teknologi Pangan Vol. 10(2): 281-292.
Maleki, S. Sayyednejad, S.M., Damabi, N.M., Motamedi. H. 2008. Antibacterial Activity of The Fluid of Iranian Torilis Leptophylla Against Some Clinical Pathogen. Pakistan Journal of Biologycal Science. 11, (9), 1286-1289.
Moghadamtousi S.Z., Kadir H.A., Hassandarvish P, Tajik H, Abubakar S, Zandi K. 2014. A Review on antibacterial, antiviral, and antifungal activity of curcumin. BioMed Research International. ID 186864. 12p. doi: 10.1155/2014/186864
Nurhayati. N. 2010. Isolasi Identifikasi dan Uji Aktivitas Antibakteri Senyawa Fenolik dari Rimpang Temu Putih (Curcuma zedoaria Rosc). Universitas Airlangga
Roektiningsih, Alamsyah A. Mundhisari. 2010. Uji Antimikroba Ekstrak Etanol Rimpang Temu Putih (Curcuma zedoaria [Berg.] Roscoe) Terhadap Staphylococcus aureus (0162-P) Secara in Vivo. Jbioa.fmipa.unad.ac.id
Sakanaka, S., Y. Tachibana., Y. Okada. 2003. Preparationandantioxiant properties of
extracts of japanese persimo leaf tea (kakinocha-cha). Food chemistry. 89:569-575.
Sharma, M., Manoharlal, R., Negi, A. S., Prasad, R. 2010. Synergistic anticandidal activity of pure polyphenol curcumin I in combination with azoles and polyenes generates reactive oxygen species leading to apoptosis. FEMS yeast research, 10(5), 570-578.
Sugiyono. 2013. Metode Penelitian Kuantitatif, Kualitatif, da R&D. Bandung: CV Alfabeta.
Tonnesen, H. H., and Karlsen, J. 1985. Studies on curcumin and curcuminoids. V. Alkaline degradation of
curcumin. Zeitschrift für Lebensmittel-Untersuchung und-Forschung, Vol.
180(2), 132-134.
Tuminah, S. 2004. Teh (Camellia sinensis) Sebagai Salah Satu Sumber Antioksidan. Cermin Dunia Kedokteran No. 144:5254.
Vatai, T., Škerget, M., and Knez, Ž. 2009. Extraction of phenolic compounds from elder berry and different grape marc varieties using organic solvents and/or supercritical carbon dioxide. Journal of Food Engineering, 90(2), 246-254
Windono, M.S. Parfiani, N. 2002. Curcuma zedoaria Rosc., Kajian Pustaka Kandungan Kimia dan Aktivitas Farmakologik, Artocarpus, 2(1):1-10
715
Discussion and feedback