Potensi Photodynamic Therapy (PDT) Berbasis Inhalable Curcumin sebagai Modalitas Terapi COVID-19
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2022), Volume 20, Number 2:12-21 P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI PHOTODYNAMIC THERAPY (PDT) BERBASIS INHALABLE CURCUMIN SEBAGAI MODALITAS TERAPI COVID-19
Aizar Vesa Prasetyo,1 Putri Ayu Wulandari,1 Putu Sinta Elix Wahyuni1
ABSTRAK
Pendahuluan: COVID-19 telah menjadi krisis kesehatan baru yang mengancam dunia. Upaya preventif sepert edukasi dan vaksinasi telah dilakukan. Satu-satunya pilihan yang tersedia adalah penggunaan obat antivirus spektrum luas, tetapi beberapa obat tersebut cenderung mahal dan memiliki efek samping yang berbahaya. Curcumin memiliki efek terapeutik potensial untuk COVID-19 karena efek antivirus dan anti-inflamasinya. Curcumin dapat dikemas dalam bentuk inhalable dengan memformulasinya menjadi bubuk kering. Penggunaan photodynamic therapy (PDT) dapat meminimalisasi toksisitas sistemik dan efek samping yang tidak diinginkan. Pembahasan: Curcumin telah terbukti menghambat replikasi virus dengan menghambat glikoprotein S dan ACE 2, menghambat aksi TMPRSS2, Main protease (Mpro), dan menurunkan ekspresi pompa vakuolar (ATPase). Curcumin juga dapat menurunkan respon inflamasi dengan menghambat aktivasi translokasi NF-kB yang dimedias STAT3. Formulasi terapi inhalasi Curcumin sebagai produk serbuk kering dapat meningkatkan bioavailabilitas Curcumin dan kepatuhan pasien. Curcumin-PDT pada sel Vero yang terinfeksi SARS-CoV2 memberikan efek anti-COVID-19 secara in vitro tanpa menyebabkan sitotoksisitas dan apoptosis dalam sel, dan tidak memiliki efek buruk pada kualitas plasma.
Simpulan: Inhalable Curcumin berbasis terapi fotodinamik berpotensi sebagai inovasi terapi COVID-19.
Kata kunci: Covid-19, Curcumin, Inhalable, Terapi Fotodinamik
ABSTRACT
Introduction: COVID 19 has become a new health crisis that threatens the world. Preventive efforts such as education and vaccination have been carried out. The only option available is the use of broad spectrum antiviral drugs, but some of them tend to be expensive and have dangerous side effects. Curcumin has potential therapeutic effects for COVID 19 because of its antiviral and anti inflammatory effects. Curcumin can be packaged in an inhalable form by formulating it into a dry powder. Applications using photodynamic therapy (PDT) can minimize systemic toxicity and unwanted side effects.
Discussion: Curcumin has been shown to inhibit viral replication by inhibiting glycoprotein S and ACE 2, inhibiting the action of TMPRSS2, Main protease (Mpro), and decreasing the expression of the vacuolar pump (ATPase). Curcumin also can decrease the inflammatory response by inhibiting STAT3 mediated activation of NF kB translocation. The formulation of curcumin inhalation therapy as a dry powder product can increase curcumin bioavailability and patient compliance. Curcumin PDT on Vero cells infected with SARS CoV2 exerted an anti COVID 19 effect in vitro without causing cytotoxicity and apoptosis in cells, and had no adverse effect on plasma quality.
Conclusion: Photodynamic therapy based inhalable curcumin has potential as a therapeutic innovation for COVID 19.
Keywords: Covid 19, Curcumin, Inhalable, Photodynamic Therapy
1 Fakultas Kedokteran Universitas Udayana
PENDAHULUAN
Penyebaran virus corona atau Severe Acute Respiratory Syndrom Coronavirus 2 (SARS-CoV-2) menjadi krisis kesehatan baru yang mengancam dunia. Wabah virus corona terus menyebar luas d berbagai negara setelah sebelumnya pertama kal dilaporkan terjadi di Wuhan, China pada Desember 2019.[1] Virus corona menyebar dengan sangat cepat hingga ke daerah yang jauh dari pusat terjadinya wabah dan banyak negara dari berbagai belahan dunia mengonfirmasi kasus positif COVID-19.[2] World Health Organization (WHO) telah menyatakan COVID-19 sebagai pandemi global. Pada tanggal 7 Agustus 2021 WHO mencatat jumlah kasus terkonfirmasi positif COVID-19 di dunia mencapai 200 juta orang dan angka kematian mencapai 4 juta kasus.[3] Di Indonesia pada tanggal 7 Agustus 2021 total kasus positif terkonfirmasi mencapai 3 juta dengan 104 ribu kasus kematian.[4]
Gejala infeksi COVID-19 muncul setelah inkubasi selama kurang lebih 5,2 hari. Periode dar
awal kemunculan gejala COVID-19 hingga terjadinya kematian berkisar antara 6 - 41 hari. Periode tersebut juga dipengaruhi oleh usia dan sistem imun pasien.[5] Coronavirus merupakan virus penyebab COVID-19 yang berupa virus RNA untai positif dan menyerang saluran pernafasan.[6] Pada kasus yang berat virus in dapat menyebabkan peningkatan mediator proinflamasi (TNF-α, IL1, IL6, IL8) sehingga menjad tidak terkontrol dan mengakibatkan acute distress respiratory syndrome (ARDS) yang akan menyebabkan kerusakan pada paru dan dapat berujung pada kematian.[7]
Salah satu upaya perawatan berupa isolas diberikan untuk menghindari transmisi dari satu orang yang terkonfirmasi positif COVID-19 ke orang lainnya.[5] Upaya preventif seperti edukasi dan pemberian vaksin telah dilakukan. Berdasarkan data dari WHO hingga tanggal 5 Agustus 2021 sudah tercatat sebanyak 3,9 juta vaksin telah diadministrasikan di seluruh belahan dunia.[3] Sementara itu, di Indonesia hingga tanggal 7 Jul 2021 tercatat sebanyak 49 juta orang telah
melakukan vaksinasi pertama dan sebanyak 22 juta telah melakukan vaksin kedua.[4] Namun, efektivitas dari vaksin belum memuaskan akibat mutasi yang terus terjadi pada virus COVID-19.[8] Oleh karena itu, saat ini kasus positif COVID-19 masih terus bertambah.[3,4]
Hingga saat ini, belum terdapat obat antivirus khusus untuk menghadapi infeksi COVID-19 dan dapat digunakan sebagai terapi potensial bag manusia.[5,6] Satu-satunya pilihan yang tersedia adalah dengan menggunakan obat antivirus spektrum luas, seperti Nucleoside analogues dan HIV-protease inhibitor yang dapat melemahkan infeksi virus meskipun tidak spesifik untuk pengobatan COVID-19.[6] Studi lain juga menunjukkan bahwa remdesivir, chloroquine, dan hydroxychloroquine yang tergolong antivirus spektrum luas juga digunakan dalam mengendalikan infeksi COVID-19 secara in vitro.[6,9] Namun, selain harga dari antivirus spektrum luas yang cenderung mahal beberapa memiliki efek samping yang berbahaya seperti chloroquine yang dapat menimbulkan kerusakan jaringan, immune suppression, terhambatnya reaksi antigen-antibod serta dapat menyebabkan komplikasi yang serius seperti cardiomyopathy.[10] Hydroxychloroquine juga dikaitkan dengan risiko yang jauh lebih tinggi untuk terjadinya kematian di rumah sakit, serangan jantung, perpanjangan interval QT, dan kelainan elektrokardiogram lainnya.[11]
Curcumin merupakan senyawa polifenol hidrofobik yang banyak terkandung pada tanaman lokal Indonesia seperti kunyit dan temulawak.[12,13] Curcumin berpotensi digunakan sebagai terap COVID-19 karena memiliki efek antivirus dan anti-inflamasi.[14,15] Salah satunya curcumin dapat mencegah replikasi dari SARS-CoV. Selain itu, curcumin juga dapat menurunkan sirkulasi dari IL-6 dan TNF-α yang merupakan kunci dari mediator inflamasi.[15,16] Meskipun demikian, bioavailabilitas oral curcumin sebagai agen terapeutik masih rendah sehingga administrasi agen terapeutik melalui paru dapat menawarkan peningkatan bioavailabilitas dar curcumin karena dapat melewati proses metabolisme yang kompleks pada saluran pencernaan.[17]
Curcumin dapat dikemas dalam bentuk yang mampu dihirup (inhalable) dengan memformulasikannya menjadi dry powder sehingga memudahkan pasien untuk patuh dalam penggunaannya. Formulasi penghantaran menggunakan dry powder dapat digunakan dalam meningkatkan bioavailabilitas.[18] Dengan pengaplikasian menggunakan Photodynamic Therapy (PDT) dapat meminimalisasi toksisitas sistemik dan efek samping yang tidak diinginkan.[19] PDT juga memiliki efektivitas yang tinggi serta tidak terdapat laporan terkait timbulnya resistens pengobatan.[20] Berdasarkan uraian tersebut, penulis tertarik menulis tinjauan pustaka dengan metode studi literatur yang judul “Potensi Photodynamic Therapy (PDT) berbasis Inhalable Curcumin sebaga Modalitas Terapi COVID-19”.
PEMBAHASAN
Patogenesis COVID-19
Coronavirus yang merupakan penyebab dar COVID-19 merupakan virus RNA rantai tunggal dan positif yang termasuk ke dalam keluarga coronaviridae. SARS-CoV2 yang merupakan
penyebab COVID-19 termasuk ke dalam kelompok betacoronavirus yang serupa dengan SARS-CoV dan MERS-CoV. Virus ini menyerang saluran pernafasan dan menggunakan sel epitel serta mukosa saluran nafas sebagai target awal infeksi.[21] Coronavirus memiliki selubung dengan partikel bulat dan berbentuk pleomorfik. Bagian dinding dar coronavirus dilapisi oleh protein S yang merupakan protein antigen utama yang dapat berikatan dengan reseptor pada tubuh host.[22] Protein S ini akan berikatan dengan reseptor ACE2 yang diekspresikan pada epitel permukaan paru-paru, jantung, ginjal, sel endotel, enterosit usus halus, dan pada beberapa struktur sistem saraf pusat.[23] Virus akan menduplikasi materi genetik dan protein yang dibutuhkan di dalam sel serta akan membentuk virion baru di permukaan sel.[24] Antigen virus yang masuk ke dalam sel akan dipresentasikan ke antigen presenting cell (APC) dan akan merespon sistem imun humoral dan seluler yang dimediasi oleh sel T dan sel B. Sistem imun humoral akan membentuk IgM dan IgG.[25] Virus dapat menghindari sistem imun dengan menginduksi vesikel membran ganda yang tidak memiliki pattern recognition receptors (PRRs) dan bereplikasi di dalamnya sehingga tidak dikenal oleh sel imun.[26] Pasien COVID-19 dengan gejala klinis yang ringan akan menunjukkan peningkatan sel T terutama CD8+, adanya T helper folikular dan antibody secreting cells (ASCs), peningkatan IgM/IgG secara progresif, penurunan jumlah monosit CD14+ dan CD16+.[25,27] Pada pasien COVID-19 dengan gejala klinis yang berat ditemukan hasil hitung limfosit, monosit, basofil, dan eosinofil yang rendah, peningkatan mediator proinflamasi (TNF-α, IL1, IL6, IL8), serta penurunan T helper, T suppressor, dan T regulator. Peningkatan mediator proinflamasi atau badai sitokin yang tidak terkontrol akan mengakibatkan terjadinya acute distress respiratory syndrome (ARDS) yang akan mengakibatkan kerusakan pada paru dengan terbentuknya jaringan fibrosis yang akan menimbulkan kegagalan fungs dan dapat berakibat pada kematian.[7]
Gambaran Umum dan Manfaat Senyawa Curcumin
Curcumin merupakan suatu senyawa polifenol hidrofobik yang menjadi penyusun aktif dari rimpang Curcuma longa.[28,29] Curcumin memiliki beberapa efek farmakologis, seperti antioksidan, antikanker, antibakteri, antivirus, antidiabetes, dan anti-inflamasi.[14,15,30,31] Curcumin memiliki efek sebaga antivirus dengan mencegah replikasi dari SARS-CoV dan menghambat 3Cl protease dalam sel Vero E6 serta dapat menghambat efek sitopatogenik SARS-CoV dalam sel Vero E6 secara signifikan.[32] Transformasi curcumin menjadi titik kuantum karbon dapat meningkatkan efek antivirus dari curcumin dan titik kuantum karbon saja efektif melawan virus corona manusia (HCoV) dengan menghambat reseptor masuk HCoV-229E.[33,34] Dua meta-analisis sebelumnya menunjukkan bahwa curcumin dapat menurunkan sirkulasi dari IL-6 dan TNF-α yang merupakan kunci dari mediator inflamasi.[15,16] Curcumin juga dapat menurunkan ekspresi dari IL-1β di makrofag M1.[35] Curcumin juga dapat melindung sel epitel mukosa genital dengan menghambat aktivasi dari kemokin proinflamasi, seperti IL-8 dan melawan replikasi HIV-1.[36]
Mekanisme Konstruksi Inhalable Curcumin dan PDT
Curcumin memiliki banyak potensi untuk digunakan sebagai terapi seperti yang telah disebutkan sebelumnya. Namun, curcumin sebaga agen terapeutik memiliki hambatan berupa bioavailabilitas oral yang rendah dan hidrofobik yang terlihat dari solubilitas yang rendah.[36] Solubilitas air yang rendah dari curcumin memiliki keterkaitan secara langsung terhadap pembersihan molekul yang cepat dalam tubuh yang mengakibatkan rendahnya penyerapan di saluran pencernaan dan bioavailabilitas oral rendah.[18,37] Maka dari itu, diperlukan adanya strategi untuk mengatasi hal tersebut. Administrasi agen terapeutik melalui paru dapat menawarkan aksi awal yang cepat karena dapat melewati metabolisme yang kompleks pada saluran pencernaan. Paru juga memiliki area permukaan untuk penyerapan yang besar terhadap bahan aktif yang mencapai sekitar 100 m2. Hal in tentunya dapat meningkatkan bioavailabilitas sehingga mengurangi dosis yang diperlukan daripada rute administrasi lainnya.[38] Selain itu, mengurang dosis yang diperlukan juga dapat mengurangi risiko efek samping yang tidak diinginkan. Umumnya, formulasi terapi inhalasi memiliki bentuk produks sebagai dry powder karena stabilitas dan kepatuhan pasien yang tinggi, serta biaya produksi yang rendah.[18] Sebagian besar formulasi kering untuk administrasi paru meliputi pembawa (carrier) yang biasanya berbasis gula, seperti laktosa, trehalosa, dan mannitol. Siklodekstrin yang dimodifikasi telah diusulkan sebagai pembawa dalam formulasi obat paru karena memiliki sifat toksik yang rendah dan dapat meningkatkan kemampuan aliran serbuk serta sifat disolusi senyawa hidrofobik. Penggunaan hidroksipropil-β-siklodekstrin (HPβCD) yang termasuk ke dalam turunan hidroksipropilasi di antara siklodekstrin yang dimodifikasi dapat menunjang peningkatan bioavailabilitas saat pengaplikasian pada paru sebanyak 80%. Selain itu, HPβCD juga dapat menunjang aerosolisasi dan memiliki efek toksisitas rendah pada paru dan ginjal.[39] Pengaplikasian dry powder membutuhkan suatu karakteristik partikel tertentu, seperti diameter aerodinamis antara 1-5 µm. Untuk menghasilkan partikel dengan sifat yang diinginkan dapat digunakan teknik rekayasa partikel.[40] Pengaplikasian teknolog berbasis superkritis telah diteliti untuk mengembangkan produk seperti siklodekstrin.[41]
PDT telah muncul sebagai salah satu strateg terapi dengan profil keamanan yang tinggi dan sifat minimal invasif. PDT juga menawarkan beberapa keunggulan dibandingkan dengan terap konvensional yang terkait dengan toksisitas sistemik dan efek samping yang tidak diinginkan.[21] Keunggulan PDT tersebut juga diperlihatkan pada studi yang dilakukan oleh Pourhajibagher (2021) yang menunjukkan bahwa tidak ada perubahan yang terlihat pada sel dan apoptosis setelah diberikan antimicrobial photodynamic therapy. Antimicrobial photodynamic therapy (aPDT) menunjukkan aktivitas anti-COVID-19 in vitro dalam plasma yang diobat yang mengandung SARS-COV-2 tanpa apoptosis sel Vero dan efek buruk apapun pada kualitas plasma dalam plasma yang terpapar aPDT.[42] PDT melibatkan administrasi suatu zat fotoaktif, yaitu photosensitizer. PDT ini menggunakan cahaya dengan panjang gelombang tertentu menggunakan bronkoskop serat optik fleksibel untuk menyinar
target. Teknik ini menawarkan keuntungan dar sitotoksisitas selektif terhadap target dengan kerusakan minimal pada jaringan sehat d sekitarnya.[43] PDT telah efektif digunakan untuk mengobati beberapa jenis kanker paru. Formulas nano yang dimuat dengan photosensitizer memilik banyak keuntungan, seperti menjadi rute administras yang noninvasif dan dosis yang diberikan lebih rendah.[44] Namun, formulasi nano ini harus memilik sifat fisikokimia, seperti ukuran partikel aerodinamis yang sesuai untuk mengatasi hambatan biologis paru.[45] Maka dari itu, diperlukan strategi untuk mengubah nanocarriers ke dalam bentuk inhalable yang dapat diberikan menggunakan inhaler dry powder atau nebulizer.[46]
Nano in Microparticles (NiMps) muncul sebaga pembawa obat yang memiliki sifat aerodinamis superior dan deposisi yang lebih tinggi di paru. NiMps terdiri dari dua komponen utama, yaitu nanopartikel dan eksipien (mannitol atau trehalosa) yang berfungs sebagai bahan dinding untuk menstabilkan mereka selama proses atomisasi yang digunakan untuk menghasilkan bentuk dry powder yang lebih stabil.[47] Spray drying merupakan metode persiapan utama NiMps dikarenakan sesuai untuk zat yang termolabil.[48] Beberapa studi sebelumnya juga telah menunjukkan mengenai kelayakan dalam persiapan NiMps dengan spray drying nanopartikel untuk menghasilkan dry powder untuk inhalasi dan mempertahankan karakteristik fisikokimia dar nanopartikel asli.[49-51]
Di bidang PDT curcumin telah dipilih sebaga photosensitizer alami dengan aplikasi yang beragam.[14] Curcumin telah dienkapsulasi dalam formulasi nano, seperti liposom atau nanopartikel untuk meningkatkan selektivitasnya dan memperluas aplikasinya.[52-54] Nanopartikel yang mengandung curcumin disiapkan dengan mengalami beberapa karakterisasi untuk menentukan ukuran, muatan permukaan, morfologi, dan efek fototoksik. Selanjutnya, nanopartikel curcumin ditransformasikan menjadi bentuk dry powder untuk inhalasi menggunakan spray drying.[55]
Mekanisme Kerja Curcumin sebagai Antiviral terhadap COVID-19
Pada infeksi SARS-CoV-2, glikoprotein berperan dalam interaksi antara virus dan sel inang dengan mendorong fusi dan internalisasi virus melalu reseptor ACE2. Curcumin memiliki efek antiviral terhadap COVID-19, dimana curcumin dapat menghambat glikoprotein S dan ACE2. Berdasarkan penelitian in silico, curcumin memiliki afinitas tingg untuk berinteraksi dengan glikoprotein S melalu pembentukan enam ikatan hidrogen. Curcumin menunjukkan afinitas yang lebih baik untuk glikoprotein S dan ACE2 dibandingkan senyawa kontrol seperti hidroksiklorokuin dan kaptopril.[56] Selain itu, curcumin juga dapat menghambat kerja enzim transmembrane protease serin 2 (TMPRSS2) yang berperan memfasilitasi masuknya SARS-CoV-2 dari protein spike, dengan membentuk empat interaksi hidrofobik dan ikatan H dengan TMPRSS2.[57]
Main protease (Mpro) dari SARS-CoV-2 sangat diperlukan dalam pematangan dan replikasi virus. Protein yang dimatangkan oleh Mpro, yaitu RNA dependent RNA polymerase (RdRp, Nsp12) dan helicase (Nsp13).[58] Oleh karena itu, penghambatan Mpro untuk mencegah replikasi virus dapat menjad
target yang menarik untuk pengobatan COVID-19.[59] Studi in silico menemukan bahwa curcumin dapat membentuk ikatan paling stabil dengan Mpro SARS-CoV-2.[60] Curcumin juga telah terbukti dapat menurunkan ekspresi pompa vakuolar ATPase (V-ATPase) yang berperan dalam mengatur pH endosome, dimana masuknya virus SARS-CoV-2 melalui endosome membutuhkan pH asam.[61,62]
Mekanisme Kerja Curcumin sebagai Anti Inflamasi terhadap COVID-19
Jalur nuclear factor kappa beta (NF-κB) terlibat langsung dalam proses inflamasi pada infeks COVID-19. Penelitian telah menunjukkan bahwa NF-κB dapat diaktifkan oleh SARS-CoV-2 melalui Toll like receptor (TLR) dan sistem renin angiotensin aldosteron (RAAS).[63] Penempelan SARS-CoV-2 pada ACE2 menurunkan regulasi ACE2 dan berakibat pada aktivasi angiotensin II-AT1R sehingga menyebabkan aktivasi NF-κB.[64] Peningkatan AngII merangsang fosforilasi subunit p65 pada NF-κB, yang menyebabkan pelepasan sitokin IL-6, IL-1ß, IL-10, dan TNF-α. AngII-AT1R mengaktifkan disintegrin dan metalloprotease 17 (ADAM17) dan memproses bentuk membran IL-6Rα menjadi bentuk larut (sIL-6Rα) melalui epidermal growth factor (EGFR). Kompleks sIL-6Rα-IL-6 kemudian mengaktivas STAT3 yang dimediasi gp130[65,66], dimana aktivas simultan STAT3 dan NF-κB akan berakibat pada hiperaktivasi NF-κB dengan IL-6 dan memicu terjadinya cytokine storm.[63] Curcumin dapat menghambat aktivasi NF-kB yang dimediasi STAT3 dan menurunkan produksi sitokin pro-inflamasi. Selain itu, curcumin juga dapat menghambat translokasi NF-κB melalui penghambatan fosforilas IκB sehingga berujung pada penurunan sitokin inflamasi seperti IL-1α, IL-6, dan TNF-α.[67-69]
Mekanisme Kerja PDT terhadap COVID-19
Mekanisme PDT didasarkan pada kemampuan photosensitizer (PS) menyerap energ dari cahaya dan mentransfer energi tersebut ke molekul oksigen. Pada aPDT, cahaya yang digunakan adalah laser biru dengan gelombang ±450 nm, yang telah terbukti dapat menginaktivas berbagai mikroorganisme. Penyerapan cahaya oleh PS, dari foton pada panjang gelombang yang sesua menyebabkan produksi molekul PS yang tidak stabil dan tereksitasi. Keadaan PS tereksitasi ini dapat bereaksi melalui dua cara, yaitu dengan memula reaksi fotokimia yang secara langsung menghasilkan reactive oxygen species (ROS) (jalur tipe I), atau secara tidak langsung dengan transfer energi ke molekul oksigen (jalur tipe II) yang membentuk singlet oksigen. Proses ini menghasilkan spesies toksik yang bertanggung jawab atas kerusakan oksidatif yang tidak dapat diperbaiki pada target biologis.[70]
Mekanisme tipe I melibatkan transfer elektron antara PS tereksitasi dan substrat, menghasilkan radikal bebas. Radikal ini dapat bereaksi dengan oksigen untuk membentuk spesies oksigen aktif, seperti superoxide radical anion. Superoksida tidak terlalu reaktif dalam sistem biologis, tetapi ketika terprotonasi, dapat menghasilkan hidrogen peroksida dan oksigen atau hidroksil radikal yang sangat reaktif. Fotooksidasi tipe II tidak sekompleks tipe I dan secara umum produk yang dihasilkan jauh lebih sedikit. Dalam jalur ini, keadaan PS triplet tereksitasi (3PS*) dapat mentransfer kelebihan energi ke molekul oksigen (3O2) dan menciptakan molekul oksigen
singlet tereksitasi (1O2).[71] Dalam hal ini, oksigen singlet (1O2) bereaksi dengan molekul yang ada d struktur luar sel, seperti asam amino triptofan dan residu metionin.[70]
Reactive oxygen species (ROS) menargetkan nukleotida guanin untuk menghambat replikasi virus. Gugus hidroksil dan oksigen singlet radikal bereaks berbeda terhadap targetnya. Oksigen singlet bereaks lebih efisien pada virus daripada radikal lain dan secara efektif menargetkan residu guanin dan tirosin; histidin dan triptofan. Diperkirakan bahwa PDT, melalui ROS dan oksigen singlet, mungkin menargetkan residu guanin dan sistein, L-histidin, tirosin, metionin, dan triptofan untuk menghancurkan virus SARS-CoV-2 dan membatasi penyebaran COVID-19. Lipid tak jenuh juga merupakan target utama 1O2 dan radikal bebas. Reaksi peroksidas lipid yang terjadi kemudian dapat mengubah protein, asam nukleat, dan molekul lain pada virus.[70]
Efek Klinis Curcumin - PDT terhadap COVID-19 Curcumin memiliki potensi sebaga tatalaksana baru COVID-19. Dari penelitian uji klinis oleh Saber-Moghaddam (2021), formulasi oral nanocurcumin yang diberikan pada pasien COVID-19 ringan dan sedang 2 kali sehari selama 14 hari dapat menurunkan gejala seperti demam, takipnea, dan batuk lebih cepat secara signifikan dibandingkan kelompok kontrol. Selain itu, juga ditemukan saturas oksigen yang meningkat serta durasi penggunaan oksigen suplementasi dan masa rawat inap yang lebih singkat pada kelompok perlakuan. Perburukan infeksi tidak terjadi pada pasien yang diberikan curcumin, namun terjadi pada 40% pasien d kelompok kontrol.[72]
Berdasarkan penelitian in vitro oleh Pourhajibagher et al., nanopartikel curcumin-PDT dapat mencegah sitotoksisitas sel oleh virus. Uji MTT dilakukan pada sel Vero terinfeksi plasma yang mengandung virus SARS-CoV2 dan dibagi menjad lima kelompok, yaitu kelompok kontrol, kelompok tanpa perlakuan, kelompok dengan Cur-NP, kelompok dengan laser biru, dan kelompok dengan Cur-aPDT. Dari uji tersebut, ditemukan adanya pengurangan sel yang signifikan pada sel Vero d kelompok tanpa perlakuan. Sitotoksisitas sel juga terdapat pada kelompok dengan 10% Cur-NP dan kelompok dengan sinar laser biru (kepadatan energ pada 522,8J/cm2) masing-masing sebesar 52,2% dan 68,7%. Namun, kelompok dengan perlakuan aPDT (10% wt. Cur -NPs dan sinar laser biru pada 522,8 J/cm2) tidak memberikan efek sitotoksik pada garis sel Vero (Gambar 1.).[20]
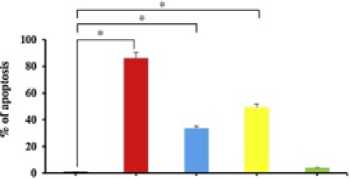
Uji flow cytometry juga dilakukan untuk menelit efek Cur-NP, laser biru, dan Cur-PDT terhadap apoptosis sel Vero yang terinfeksi SARS-CoV2. Analisis flow cytometry menunjukkan bahwa paparan plasma yang mengandung SARS-CoV-2 memilik efek apoptosis yang signifikan (86,1%) pada sel Vero. Terdapat juga peningkatan yang signifikan dalam populasi apoptosis sel Vero yang diberi perlakuan dengan Cur-NPs dan sinar laser saja (masing-masing 33,7% dan 49,3%) dibandingkan dengan kelompok kontrol. Di sisi lain, tidak seperti sel Vero yang terinfeksi dengan plasma yang mengandung SARS-CoV-2, efek apoptosis tidak terlihat pada sel Vero terinfeksi yang diberi Cu-PDT (Gambar 2.). Dar pemeriksaan plasma, kandungan protein plasma total, PT, APTT, dan titer antibodi anti-A dan/atau anti-B tidak menunjukkan perubahan yang signifikan
(P> 0,05) dalam plasma yang diberi PDT dibandingkan dengan plasma yang tidak diber perlakuan. Maka dari itu, dapat disimpulkan bahwa pemberian Cur-PDT pada sel Vero yang terinfeks SARS-CoV2 memberikan efek anti COVID-19 secara in vitro tanpa menyebabkan terjadinya sitotoksisitas dan apoptosis pada sel, serta tidak berefek buruk pada kualitas plasma.[20]
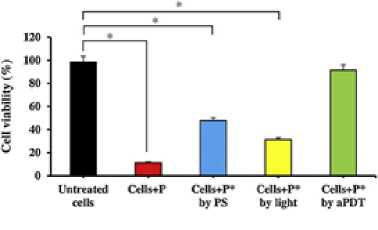
Gambar 1. Hasil Uji Sitotoksisitas Curcumin-PDT Terhadap Sel Vero[20]
Untreated CeIteP CrtIteV CrtheV CeIheV
Crtk b, PS b)l⅛bi b>aprιτ
Gambar 2. Hasil Uji Apoptosis Curcumin-PDT Terhadap Sel Vero[20]
PDT dengan photosensitizer telah dibuktikan dapat menghambat virus COVID-19 secara klinis. Penelitian oleh Weber et al. menggunakan PDT dengan riboflavin sebagai photosensitizer yang diberikan menggunakan spray dan tablet pada 20 pasien COVID-19 dengan gejala ringan (kelompok perlakuan), yang kemudian dibandingkan dengan 20 pasien yang menerima perawatan konvensional (kelompok kontrol). Viral load kedua kelompok diperiksa menggunakan tes QPCR dan dilakukan pengamatan pada gejala klinis selama 7 hari. Hasil penelitian menunjukkan bahwa kelompok perlakuan mengalami perbaikan gejala klinis dan viral load yang signifikan 5 hari pasca PDT. Seluruh pasien dari kelompok perlakuan mengalami penurunan gejala klinis yang signifikan seperti demam, batuk kering, dan nyeri dada. Selain itu, pemeriksaan QPCR menunjukkan 70% pasien di kelompok perlakuan memiliki hasil tes negatif setelah 5 hari dan 30% lainnya menunjukkan penurunan viral load yang signifikan ke tingkat rendah atau sedang, sehingga dapat menurunkan kemungkinan rawat inap dan perawatan intensif.[73]
Terdapat juga beberapa penelitian lain yang membuktikan bahwa PDT dan photosensitizer memiliki efek terhadap Coronavirus secara in vitro yang telah dicantumkan pada lampiran.[74-76]
SIMPULAN
Curcumin berpotensi sebagai terapi COVID-19 karena memiliki efek antivirus dan anti-inflamasi.
Sebagai antivirus, curcumin dapat menghambat glikoprotein S dan ACE 2, menghambat kerja protein transmembran serin protease 2 (TMPRSS2), penghambatan Main protease (Mpro) dan menurunkan ekspresi pompa vakuolar ATPase (V-ATPase). Sebagai antiinflamasi curcumin dapat menghambat aktivasi NF-kB yang dimediasi STAT3 dan menghambat translokasi NF-κB melalu penghambatan fosforilasi IκB sehingga dapat menurunkan sitokin pro-inflamasi.
Munculnya hambatan berupa bioavailabilitas oral yang rendah dari curcumin dapat diatasi dengan pengadministrasian melalui paru dalam bentuk dry powder yang diformulasikan sebagai terapi inhalasi. Selain dapat meningkatkan bioavailabilitas dan meminimalisir efek samping formulasi terapi inhalas dalam bentuk dry powder dapat meningkatkan kepatuhan pasien pada terapi COVID-19. Serta dengan pengaplikasian menggunakan PDT akan dapat meminimalisasi sitotoksisitas sistemik dan efek samping yang tidak diinginkan serta meningkatkan efektivitas pengobatan. Sehingga dapat dikatakan penggunaan PDT berbasis inhalable curcumin memiliki potensi yang besar sebagai inovasi terap pada pasien COVID-19.
SARAN
Diperlukan penelitian lebih lanjut yang membahas mengenai efektivitas photodynamic therapy berbasis inhalable curcumin secara klinis dan efek samping yang dapat ditimbulkan dari modalitas baru ini
DAFTAR PUSTAKA
-
1. Singhal T. A Review of Coronavirus Disease-2019 (COVID-19). J Pediatr.
2020;87(April):281–6.
-
2. Co H, Nazmiye Y, Gündüz S. Science of the Total Environment The spread of COVID-19 virus through population density and wind in Turkey cities. 2021;751.
-
3. World Health Organization. Available online: https://www.who.int/emergencies/diseases/nov el-coronavirus-2019 (accessed on 07 Agustus 2020).
-
4. Covid19 (2020). Peta Sebaran Available online:
https://covid19.go.id/peta-sebaran (accessed on 11 Agustus 2020).
-
5. Rothan HA, Byrareddy SN. The epidemiology and pathogenesis of coronavirus disease ( COVID-19 ) outbreak. J Autoimmun [Internet]. 2020;(February):102433. Available from: https://doi.org/10.1016/j.jaut.2020.102433
-
6. Gennaro F Di, Pizzol D, Marotta C, Antunes M, Racalbuto V, Veronese N, Smith L. Coronavirus Diseases (COVID-19) Current Status and Future Perspectives: A Narrative Review. J Environ Res Public Heal. 2020;(September 2012).
-
7. Zumla A, Hui D, Azhar E, Memish Z, Maeurer M. Reducing mortality from 2019-nCoV: host-directed therapies should be an option. Lancet. 2020;395(January):35–6.
-
8. Belizário JE. Immunity, virus evolution, and effectiveness of SARS-CoV-2 vaccines.
Brazilian Journal of Medical and Biological Research. 2021 Mar 15;54
-
9. Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, Shi Z, Hu Z, Zhong W, Xiao G. Remdesivir and Chloroquine Effectively Inhibit the Recently Emerged Novel Coronavirus (2019- nCoV) in Vitro. Cell research. 2020;30:269-271.
-
10. Tang D, Li J, Zhang R, Kang R, Klionsky DJ. Chloroquine in fighting COVID-19: good, bad, or both?. Autophagy. 2020 Dec 1;16(12):2273-5.
-
11. Chitalia VC, Munawar AH. A painful lesson from the COVID-19 pandemic: the need for broadspectrum, host-directed antivirals. Journal of translational medicine. 2020 Dec;18(1):1-6
-
12. Silalahi M. PEMANFAATAN Curcuma longa (L.) OLEH MASYARAKAT LOKAL DI INDONESIA DAN KANDUNGAN METABOLIT SEKUNDERNYA. Jurnal Pro-Life: Jurnal Pendidikan Biologi, Biologi, dan Ilmu Serumpun. 2017 Oct 19;4(3):430-40.
-
13. Syamsudin RA, Perdana F, Mutiaz FS. TANAMAN TEMULAWAK (Curcuma xanthorrhiza Roxb) SEBAGAI OBAT TRADISIONAL. Jurnal Ilmiah Farmako Bahari. 2019 Jan 21;10(1):51-65.
-
14. Zorofchian Moghadamtousi S, Abdul Kadir H, Hassandarvish P, Tajik H, Abubakar S, Zandi K. A review on antibacterial, antiviral, and antifungal activity of curcumin. Biomed Res Int. 2014;2014.
-
15. Cheng K, Yang A, Hu X, Zhu D, Liu K. Curcumin attenuates pulmonary inflammation in
lipopolysaccharide induced acute lung injury in neonatal rat model by activating peroxisome proliferator-activated receptor γ (PPARγ) pathway. Med Sci Monit. 2018;24:1178–84.
-
16. Sahebkar A, Cicero AFG, Simental-Mendía LE, Aggarwal BB, Gupta SC. Curcumin
downregulates human tumor necrosis factor-α levels: A systematic review and meta-analysis ofrandomized controlled trials. Pharmacol Res [Internet]. 2016;107:234–42. Available from: http://dx.doi.org/10.1016/j.phrs.2016.03.026
-
17. Derosa G, Maffioli P, Simental-Mendía LE, Bo S, Sahebkar A. Effect of curcumin on circulating interleukin-6 concentrations: A systematic review and meta-analysis of randomized controlled trials [Internet]. Pharmacological Research. 2016;111:394–404 p. Available from: http://dx.doi.org/10.1016/j.phrs.2016.07.004
-
18. Ma Z, Wang N, He H, Tang X. Pharmaceutical strategies of improving oral systemic bioavailability of curcumin for clinical application. Journal of Controlled Release. 2019 Dec 28;316:359-80.
-
19. Chvatal A. Formulation and aerodynamic evaluation of carrier-free dry powder inhalation systems containing meloxicam. International Journal of Pharmaceutics. 2019;559:68-75.
-
20. Pourhajibagher M, Azimi M, Haddadi-asl V, Ahmadi H. Robust antimicrobial photodynamic therapy with curcumin-poly (lactic-co-glycolic acid) nanoparticles against COVID-19: A preliminary in vitro study in Vero cell line as a
model. Photodiagnosis Photodyn Ther. 2021;34(1–12).
-
21. Alves LA, Ferreira LB, Pacheco PF, Mendivelso EA, Teixeira PC, Faria RX. Pore forming channels as a drug delivery system for photodynamic therapy in cancer associated with nanoscintillators. Oncotarget. 2018 May 18;9(38):25342.
-
22. Susilo A, Rumende CM, Pitoyo CW, Santoso WD, Yulianti M, Sinto R, Singh G, Nainggolan L, Nelwan EJ, Chen LK, Widhani A, Wijaya E, Wicaksana B, Maksum M, Anissa F, Jasirwan COM, Yunihastuti E. Coronavirus Disease 2019: Tinjauan Literatur Terkini Coronavirus Disease 2019: Review of Current Literatures. 2020;7(1):45–67.
-
23. Wang Z, Qiang W, Ke H. A Handbook of 2019-nCoV Pneumonia Control and Prevention. Hubei Sci Technol Press. 2020;1–108.
-
24. Roberts N, Brown R, Buja L, Weerasinghe P. Molecular Mechanisms of Curcumin in COVID-19 Treatment and Prevention: A Global Health Perspective. Med Res Arch. 2020;8(10).
-
25. Zhang T, Wu Q, Zhang Z. Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak. Curr Biol.
2020;30(7):1346-1351.e2.
-
26. Li G, Fan Y, Lai Y, Han T, Li Z, Zhou P, Pan P, Wang W, Hu D, Liu X, Zhang Q, Wu J. Coronavirus infections and immune responses. J Med Virol [Internet]. 2020;92(4):424–32. Available from:
http://dx.doi.org/10.1002/jmv.25685
-
27. Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal [Internet]. 2020;10(2):102–8. Available from:
https://doi.org/10.1016/j.jpha.2020.03.001
-
28. Wang C, Horby PW, Hayden FG, Gao GF. A novel coronavirus outbreak of global health concern. Lancet. 2020;395(10223):470–3.
-
29. Soleimani V, Sahebkar A, Hosseinzadeh H. Turmeric (Curcuma longa) and its major constituent (curcumin) as nontoxic and safe substances: Review. Phyther Res.
2018;32(6):985–95.
-
30. Akbar MU, Rehman K, Zia KM, Qadir MI, Akash MSH, Ibrahim M. Critical review on curcumin as a therapeutic agent: From traditional herbal medicine to an ideal therapeutic agent. Crit Rev Eukaryot Gene Expr. 2018;28(1):17–24.
-
31. Fan Z, Yao J, Li Y, Hu X, Shao H, Tian X. Antiinflammatory and antioxidant effects of curcumin on acute lung injury in a rodent model of intestinal ischemia reperfusion by inhibiting the pathway of NF-Kb. Int J Clin Exp Pathol. 2015;8(4):3451–9.
-
32. Zhu JY, Yang X, Chen Y, Jiang Y, Wang SJ, L Y, Wang XQ, Meng Y, Zhu MM, Ma X, Huang C, Wu R, Xie CF, Li XT, Geng SS, Wu JS, Zhong CY, Han HY. Curcumin Suppresses Lung Cancer Stem Cells via Inhibiting Wnt/β-catenin and Sonic Hedgehog Pathways. Phyther Res. 2017;31(4):680–8.
-
33. Pillaiyar T, Manickam M, Namasivayam V, Hayashi Y, Jung S-H. An overview of severe acute respiratory syndrome–coronavirus 45.
(SARS-CoV) 3CL protease inhibitors:
peptidomimetics and small molecule chemotherapy. J Med Chem. 2016;59(14):6595–628.
-
34. Łoczechin A, Séron K, Barras A, Giovanelli E, Belouzard S, Chen YT, Metzler-Nolte N, Boukherroub R, Dubuisson J, Szunerits S. Functional Carbon Quantum Dots as Medical Countermeasures to Human Coronavirus. ACS 46. Appl Mater Interfaces. 2019;11(46):42964–74.
-
35. Lin CJ, Chang L, Chu HW, Lin HJ, Chang PC, Wang RYL, Unnikrishnan B, Mao J-Y, Chen SY, Huang C-C. High Amplification of the Antiviral Activity of Curcumin through Transformation into 47. Carbon Quantum Dots. Small. 2019;15(41):1– 14.
-
36. Palizgir MT, Akhtari M, Mahmoudi M, Mostafaei
S, Rezaiemanesh A, Shahram F. Curcumin reduces the expression of interleukin 1β and the production of interleukin 6 and tumor necrosis 48. factor alpha by M1 macrophages from patients with Behcet’s disease. Immunopharmacol Immunotoxicol [Internet]. 2018;40(4):297–302.
Available from:
https://doi.org/10.1080/08923973.2018.147492 1
-
37. Ferreira VH, Nazli A, Dizzell SE, Mueller K, 49. Kaushic C. The anti-inflammatory activity of curcumin protects the genital mucosal epithelial barrier from disruption and blocks replication of HIV-1 and HSV-2. PLoS One. 2015;10(4):1–18.
-
38. Yallapu MM, Jaggi M, Chauhan SC. Curcumin nanoformulations: A future nanomedicine for 50. cancer. Drug Discov Today. 2012;17:71–80.
-
39. Chaturvedi NP, Solanki H. Pulmonary drug delivery system: Review. Int J Appl Pharm. 2013;5:7–10.
-
40. Kurniawansyah F, Mammucari R, Foster NR. 51. Inhalable curcumin formulations by supercritical technology. Powder Technol [Internet].
2015;284:289–98. Available from:
http://dx.doi.org/10.1016/j.powtec.2015.04.083
-
41. Wu X, Hayes DJ, Zwischenberger JB, Kuhn RJ, Mansour HM. Design and physicochemical 52. characterization of advanced spray-dried tacrolimus multifunctional particles for inhalation. Drug Des Devel Ther. 2013;7:59–72.
-
42. Kankala RK, Zhang YS, Wang S, Lee C, Chen
-
A. Supercritical fluid technology: an emphasis 53. on drug delivery and related biomedical applications. Adv Healthc Mater. 2017;6(16):1700433.
-
43. Xu F, Song J, Xu B, Wang J, Mao J, Liu H, Li X, Deng A. Clinical study of systemic chemotherapy combined with bronchoscopic 54. interventional cryotherapy in the treatment of lung cancer. BMC Cancer. 2020 Nov;20(1):1089.
-
44. Liang Z, Ni R, Zhou J, Mao S. Recent advances in controlled pulmonary drug delivery. Drug Discov Today [Internet]. 2015;20(3):380–9. 55.
-
Available from:
http://dx.doi.org/10.1016/j.drudis.2014.09.020 Abdelaziz HM, Gaber M, Abd-Elwakil MM, Mabrouk MT, Elgohary MM, Kamel NM, Kabary DM, Freag MS, Samaha MW, Mortada SM, Elkhodairy KA, Fang JY, Elzoghby AO. Inhalable particulate drug delivery systems for lung cancer therapy: Nanoparticles, microparticles, nanocomposites and nanoaggregates. J Control release. 2018;269:374–92.
Zhang J, Wu L, Chan HK, Watanabe W. Formation, characterization, and fate of inhaled drug nanoparticles. Adv Drug Deliv Rev [Internet]. 2011;63(6):441–55. Available from: http://dx.doi.org/10.1016/j.addr.2010.11.002 Wang Y, Beck-Broichsitter M, Yang M, Rantanen J, Bohr A. Investigation of nanocarriers and excipients for preparation of nanoembedded microparticles. Int J Pharm [Internet]. 2017;526(1–2):300–8. Available from: http://dx.doi.org/10.1016/j.ijpharm.2017.05.008 Baghdan E, Pinnapireddy SR, Vögeling H, Schäfer J, Eckert AW, Bakowsky U. Nano spray drying: A novel technique to prepare well-defined surface coatings for medical implants. J Drug Deliv Sci Technol [Internet]. 2018;48:145– 51. Available from:
https://doi.org/10.1016/j.jddst.2018.09.008 Lebhardt T, Roesler S, Uusitalo HP, Kissel T. Surfactant-free redispersible nanoparticles in fast-dissolving composite microcarriers for drypowder inhalation. Eur J Pharm Biopharm [Internet]. 2011;78(1):90–6. Available from: http://dx.doi.org/10.1016/j.ejpb.2010.12.002
Tewes F, Ehrhardt C, Healy AM. Superparamagnetic iron oxide nanoparticles ( SPIONs ) -loaded Trojan microparticles for targeted aerosol delivery to the lung. 2014;86(1):98-104.
Torge A, Grützmacher P, Mücklich F, Schneider M. The influence of mannitol on morphology and disintegration of spray-dried nano-embedded microparticles. Eur J Pharm Sci [Internet]. 2017;104:171–9. Available from: http://dx.doi.org/10.1016/j.ejps.2017.04.003 Bakowsky U. Photo-Enhanced Delivery of Genetic Material Using Curcumin Loaded Composite Nanocarriers. Photo-Enhanced Deliv Genet Mater Using Curcumin Loaded Compos Nanocarriers. 2017;2(1).
Duse L, Pinnapireddy SR, Strehlow B, Jedelská J, Bakowsky U. Low level LED photodynamic therapy using curcumin loaded tetraether liposomes. Eur J Pharm Biopharm [Internet]. 2018;126:233–41. Available from: http://dx.doi.org/10.1016/j.ejpb.2017.10.005 Duse L, Baghdan E, Pinnapireddy SR, Engelhardt KH, Jedelská J, Schaefer J, Quendt P, Bakowsky U. Preparation and Characterization of Curcumin Loaded Chitosan Nanoparticles for Photodynamic Therapy. Phys Status Solidi Appl Mater Sci. 2018;215(15):1–5. Baghdan E, Duse L, Schüer JJ, Pinnapireddy SR, Pourasghar M, Schäfer J, Schneider M,
Bakowsky U. Development of inhalable curcumin loaded Nano-in-Microparticles for bronchoscopic photodynamic therapy. Eur J Pharm Sci [Internet]. 2019;132:63–71. Available from: https://doi.org/10.1016/j.ejps.2019.02.02
-
56. Maurya VK, Kumar S, Prasad AK, Bhatt MLB, Saxena SK. Structure-based drug designing for potential antiviral activity of selected natural products from Ayurveda against SARS-CoV-2 spike glycoprotein and its cellular receptor. Virusdisease. 2020;31(2):179-193.
doi:10.1007/s13337-020-00598-8
-
57. Motohashi N, Vanam A, and Gollapudi R. In Silico Study of Curcumin and Folic Acid as Potent Inhibitors of Human Transmembrane Protease Serine 2 in the Treatment of COVID-19. INNOSC Theranostics Pharmacol. Sci. 2020;3:3–9. doi:10.36922/itps.v3i2.935
-
58. Rut W, Groborz K, Zhang L, Sun X, Zmudzinsk M, Pawlik B, Wang X, Jochmans D, Neyts J, Młynarski W, Hilgenfeld R, Drag M. SARS-CoV-2 Mpro inhibitors and activity-based probes for patient-sample imaging. Nat Chem Biol.
2021;17(2):222-228. doi:10.1038/s41589-020-00689-z
-
59. Zhang S, Liu Y, Wang X, Yang L, Li H, Wang Y, Liu M, Zhao X, Xie Y, Yang Y, Zhang S, Fan Z, Dong J, Yuan Z, Ding Z, Zhang Y, Hu L. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J Hematol Oncol. 2020;13(1):120. Published 2020 Sep 4. doi:10.1186/s13045-020-00954-7
-
60. Huynh T, Wang H, Luan B. In Silico Exploration of the Molecular Mechanism of Clinically Oriented Drugs for Possibly Inhibiting SARS-CoV-2's Main Protease. J Phys Chem Lett. 2020;11(11):4413-4420.
doi:10.1021/acs.jpclett.0c00994
-
61. Aslam M, Ladilov Y. Targeting the sAC-Dependent cAMP Pool to Prevent SARS-Cov-2 Infection. Cells. 2020;9(9):1962. doi:10.3390/cells9091962
-
62. Khan N, Chen X, Geiger JD. Role of Endolysosomes in Severe Acute Respiratory Syndrome Coronavirus-2 Infection and Coronavirus Disease 2019 Pathogenesis: Implications for Potential Treatments. Front. Pharmacol. 2020;11:1–13.
doi:10.3389/fphar.2020.595888
-
63. Mahmudpour M, Roozbeh J, Keshavarz M, Farrokhi S, Nabipour I. COVID-19 cytokine storm: The anger of inflammation. Cytokine. 2020;133:155151.
doi:10.1016/j.cyto.2020.155151
-
64. Crowley SD, Rudemiller NP. Immunologic Effects of the Renin-Angiotensin System. J Am Soc Nephrol. 2017;28(5):1350-1361. doi:10.1681/ASN.2016101066
-
65. Eguchi S, Kawai T, Scalia R, Rizzo V. Understanding Angiotensin II Type 1 Receptor Signaling in Vascular Pathophysiology. Hypertension. 2018;71(5):804-810.
doi:10.1161/HYPERTENSIONAHA.118.10266
-
66. Murakami M, Kamimura D, Hirano T. Pleiotropy and Specificity: Insights from the Interleukin 6
Family of Cytokines. Immunity. 2019;50(4):812-831. doi:10.1016/j.immuni.2019.03.027
-
67. Wang Y, Tang Q, Duan P, Yang L. Curcumin as a therapeutic agent for blocking NF-κB activation in ulcerative colitis. Immunopharmacol Immunotoxicol.
2018;40(6):476-482.
doi:10.1080/08923973.2018.1469145
-
68. Cheemanapalli S, Chinthakunta N, Shaikh NM, Shivaranjani V, Pamuru RR, Chitta SK. Comparative Binding Studies of Curcumin and Tangeretin on Up-Stream Elements of NF-kB Cascade: a Combined Molecular Docking Approach. Netw. Model. Anal. Health Inform. Bioinforma. 2019;8:1–11. doi:10.1007/s13721-019-0196-2
-
69. Rattis BAC, Ramos SG, dan Celes MRN. Curcumin as Potential Treatment for COVID-19. Front. Pharmacol. 2021. doi:10.3389/fphar.2021.675287
-
70. Tariq R, Khalid UA, Kanwal S, Adnan F, Qasim M. Photodynamic Therapy: A Rational Approach Toward COVID-19 Management. Journal of Exploratory Research in Pharmacology.
2021;6:2. doi: 10.14218/JERP.2020.00036
-
71. Costa L, Faustino MAF, Neves MGPMS, Cunha Â, Almeida A. Photodynamic Inactivation of Mammalian Viruses and Bacteriophages. Viruses. 2012;4(7):1034–1074.
doi:10.3390/v4071034
-
72. Saber-Moghaddam N, Salari S, Hejazi S, Amin M, Taherzadeh Z, Eslami S, Rezayat SM, Jaafari MR, Elyasi S. Oral nano-curcumin formulation efficacy in management of mild to moderate hospitalized coronavirus disease-19 patients: An open label nonrandomized clinical trial. Phyther Res. 2021;35(5):2616–23. Available from:
https://onlinelibrary.wiley.com/doi/full/10.1002/p tr.7004
-
73. Weber HM, Mehran YZ, Orthaber A, Saadat HH, Weber R, Wojcik M. Successful Reduction of SARS-CoV-2 Viral Load by Photodynamic Therapy (PDT) Verified by QPCR-A Novel Approach in Treating Patients in Early Infection Stages Background. Med Clin Res.
2020;5(11):311–25. Available from:
-
74. Jin C, Yu B, Zhang J, Wu H, Zhou X, Yao H, Liu F, Lu X, Cheng L, Jiang M, Wu N. Methylene blue photochemical treatment as a reliable SARS-CoV-2 plasma virus inactivation method for blood safety and convalescent plasma therapy for COVID-19. BMC Infect Dis [Internet]. 2021 Dec 1 [cited 2021 Aug 17];21(1). Available from: /pmc/articles/PMC8050991/
-
75. Svyatchenko VA, Nikonov SD, Mayorov AP, Gelfond ML, Loktev VB. Antiviral photodynamic therapy: Inactivation and inhibition of SARS-CoV-2 in vitro using methylene blue and Radachlorin. Photodiagnosis Photodyn Ther [Internet]. 2021 Mar 1 [cited 2021 Aug 17];33:102112. Available from: /pmc/articles/PMC7690324/
-
76. Keil SD, Bowen R, Marschner S. Inactivation of Middle East respiratory syndrome coronavirus (MERS-CoV) in plasma products using a riboflavin-based and ultraviolet light-based photochemical treatment. Transfusion. 2016;56(12):2948. Available from: /pmc/articles/PMC7169765/
LAMPIRAN
Tabel 1. Efek PDT dan Photosensitizer Terhadap Coronavirus
|
Peneliti (Tahun) |
Jenis Penelitian |
Target |
Perlakuan |
Temuan |
Ref |
|
Jin et al. (2021) |
In vitro |
Plasma yang terinfeksi virus SARS-CoV-2 |
Methylene blue + Sinar biru |
Hasil qPCR menunjukkan pemberian MB dengan konsentrasi 1, 2, and 4 μM dan sinar biru dapat menginaktivasi virus dan menurunkan titer virus dalam 2 menit. |
74 |
|
Svyatcenko et al. (2021) |
In vitro |
Virus SARS- CoV-2 strain RP/2020 di sel Vero E6 |
Methylene blue + Radachlorin + aPDT |
|
75 |
|
Keil et al. (2016) |
In vitro |
Plasma yang terinfeksi MERS-CoV strain EMC |
Riboflavin + sinar UV |
Terjadi penurunan titer virus MERS-CoV dibawah batas deteksi dengan rata-rata penurunan ≥4.07 dan ≥4.42. |
76 |
21
Discussion and feedback