POTENSI KAVAIN DALAM PIPER METHYSTICUM SEBAGAI TATALAKSANA PREVENTIF GENERALIZED ANXIETY DISORDER
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2022), Volume 20, Number 1:27-34
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI KAVAIN DALAM PIPER METHYSTICUM SEBAGAI TATALAKSANA PREVENTIF GENERALIZED ANXIETY DISORDER
Devin Mahendika1
ABSTRAK
Pendahuluan: Generalized Anxiety Disorder (GAD) merupakan gangguan yang ditandai dengan kecemasan, ketegangan motorik, dan overaktivitas otonom. Piper methysticum merupakan tumbuhan yang memiliki khasiat terapi pada GAD karena senyawa kavain sebagai substansi kimiawinya dan memiliki aktivitas ansiolitik poten.
Pembahasan: Kavain memberikan efek pada subunit α1β2γ2L pada reseptor GABA dengan meningkatkan respons yang ditimbulkan GABA dengan bantuan respons kinerja α4β2δ. Kavain dalam perannya juga mampu meningkatkan peran kinerja konektivitas sentral jalur pengaturan cemas. T198N pada kavain dapat meningkatkan produksi kalkon sintase menjadi 2-piron sintase (2PS). Substitusi S133C dapat mengkatalisasi rantai kalkon sintase yang terputus akibat adanya neurodegenerasi oleh enzim RpBASi yang dapat memperpanjang rantai polipeptida tunggal patogenesis GAD. Kavain juga mampu memodulasi saluran kalsium dan mengurangi aktivitas saluran kalsium volted-gated. Kavain juga bertindak pada modulasi saluran natrium volted-gated. Selain itu, efek ansiolitik kavain dapat mengikat reseptor GABA dalam sistem saraf pusat. Kavain berfungsi di jalur serotonergik dan juga di jalur glutamatergik. Efek lainnya, kavain berperan antagonis terhadap saluran Ca2+ dan memiliki efek pada saluran natrium juga kalium. Fenomena ini menunjukkan bahwa kavain dapat bertindak sama seperti inhibitor reuptake norepinefrin dalam memberikan efek ansiolitik.
Simpulan: Pengujian kavain pada piper methysticum secara in-vitro menunjukkan bahwa pada irisan hipokampus marmut tidak ditemukan gerakan streotip dan efek samping minimal pada tikus yang telah diinjeksikan GABA radiolabeled yang diobati kavain. Penggunaan Piper methysticum sebagai upaya preventif GAD terbukti unggul secara pre-klinik. Uji klinik kavain dewasa ini penting untuk dikembangkan agar dapat diimplementasikan secara etis dalam terapi GAD.
Kata kunci: GAD, kavain, Piper methysticum
ABSTRACT
Introduction: Generalized Anxiety Disorder (GAD) is a disorder characterized by anxiety, motor tension, and autonomic overactivity. Piper methysticum is a plant that has therapeutic properties in GAD because of its chemical substance kavaine and has potent anxiolytic activity.
Discussion: Cavaine exerts its effect on the 1β2γ2L subunit of the GABA receptor by enhancing the GABA-induced response with the aid of the 4β2δ performance response. T198N in cavaine can increase the production of chalcone synthase to 2-pyrone synthase (2PS). The substitution of S133C can catalyze the chalcone synthase chain that is broken due to neurodegeneration by the RpBASi enzyme that can extend a single polypeptide chain in the pathogenesis of GAD. Cavaine is also able to modulate calcium channels and reduce the activity of voltage-gated calcium channels. Cavaine also acts on the modulation of volted-gated sodium channels. Cavaine functions in the serotonergic pathway as well as in the glutamatergic pathway. Another effect, cavaine acts as an antagonist to Ca2+ channels. Cavaine may act similarly to norepinephrine reuptake inhibitors in providing anxiolytic effects.
Conclusion: In-vitro testing of cavaine on piper methysticum showed that in guinea pig hippocampus slices no stereotypic movement and minimal side effects were found in rats that had been injected with radiolabeled GABA treated with cavain. The use of Piper methysticum as an effort to prevent GAD has proven to be superior pre-clinically. Current clinical trials of cavaine are important to develop so that it can be implemented ethically in the treatment of GAD.
1 Program Studi Profesi Dokter, Fakultas Kedokteran, Universitas Andalas, Padang, Indonesia
Keywords: GAD, cavaine, Piper methysticum
PENDAHULUAN
Indonesia sebagai negara berkembang memiliki catatan permasalahan kesehatan yang mesti dipikirkan penyelesaiannya.[1,2] Dalam bidang
kesehatan terjadi transisi epidemiologis di masyarakat dari kelompok penyakit menular ke kelompok penyakit tidak menular yang merupakan penyebab utama kematian global dan menyumbang 36 juta kematian di seluruh dunia dengan angka 73% pada tahun 2018 yang insidensinya cukup besar untuk membuat Indonesia bertitel negara dengan endemisitas sedang hingga tinggi untuk penyakit tidak menular,[3,4] termasuk berbagai jenis gangguan jiwa dan gangguan akibat perilaku seperti satunya gangguan cemas menyeluruh/Generalized Anxiety Disorders (GAD).[5,6]
Generalized Anxiety Disorders (GAD) adalah sekelompok kondisi yang memberi gambaran penting tentang kecemasan yang berlebihan yang menunjukkan ansietas sebagai gejala primer yang berlangsung hampir setiap hari untuk beberapa minggu sampai beberapa bulan, yang tidak terbatas atau hanya menonjol pada keadaan situasi khusus yang bersifat free floating atau mengambang yang ditandai dengan kecemasan seperti rasa khawatir akan nasib buruk, merasa seperti di ujung tanduk, dan sulit berkonsentrasi.[7] Ketegangan motorik seperti gelisah, sakit kepala, gemetaran, dan tidak dapat santai dengan gejala overaktivitas otonomik seperti berkeringat, jantung berdebar-debar, sesak napas, keluhan lambung, kepala pusing, dan mulut kering.[7]
Laporan American Psychiatric Association (APA), prevalensi GAD di dunia pada tahun 2013 berkisar pada angka 2,9%.[8] Data ini menjadi komplemen dari Survei Komorbiditas Nasional (SKN) yang menunjukkan prevalensi seumur hidup sebesar 5,1%, dengan 3,6% pada pria dan 6,6% pada wanita.[9] Ironisnya, di Indonesia insiden GAD saat ini sangat memprihatinkan dengan angka kejadian gangguan mental emosional dan kecemasan menunjukkan angka 9,8%.[10] Sehingga, angka ini menunjukkan 4 kali lipat besarnya insiden global sebagai penyumbang gangguan jiwa.
Apabila tidak ditangani dengan tepat, GAD akan menimbulkan angka morbiditas yang tinggi, dapat menurunkan angka kualitas hidup dalam segi psikososial, fungsi peran, produktivitas kinerja, dan menimbulkan disabilitas sehari-hari.[11] Tidak terbatas hanya menurunkan kualitas hidup penderita, GAD menimbulkan beban ekonomi yang tinggi terutama di negara-negara berkembang.[12] Data yang diperoleh dari Facts and Statistics Anxiety and Depression Association of America 42 miliar dolar US per tahunnya.[12]
Sejauh ini banyak tatalaksana komprehensif bersifat holistik yang telah dilakukan seperti tatalaksana farmakoterapi dengan pemberian golongan obat selective serotonine reuptake inhibitor (SSRI) dengan menghambat transporter serotonin dan menyebabkan desensitisasi reseptor serotonin post-sinaptik, sehingga menormalkan aktivitas jalur serotonergik yang penggunaannya lama kelamaan akan menimbulkan efek samping pada saluran cerna, reaksi hipersensitivitas, dan efek samping lain gangguan fungsi seksual, gangguan pergerakan dan penglihatan, hiponatremia, serta perdarahan termasuk ekimosis dan purpura.[13] Perilaku bunuh diri telah dikaitkan dengan penggunaan anti-depresan.[13]
Selain itu, dapat dilakukan psikoterapi.[14] Psikoterapi yang terpilih untuk gangguan ini adalah Cognitive Behavioral Therapy (CBT).[14] Terdapat beberapa metode CBT, di antaranya yakni metode restrukturisasi, terapi relaksasi, terapi bernapas, dan terapi interoceptive.[14] Inti dari terapi CBT adalah membantu pasien dalam memahami kinerja dari pemikiran dan keyakinan yang salah dapat menimbulkan respons emosional yang berlebihan.[14,15] Walaupun demikian, dari seluruh jenis terapi yang diberikan pada pasien diabetes yang mengalami GAD hanya 50% pasien memiliki kepatuhan tinggi terhadap terapi.[15] Apabila kepatuhan pasien yang rendah tersebut dibiarkan, maka mortalitas dan morbiditas pasien akan semakin meningkat.[15]
Lingkungan yang dinamis dan gaya hidup kaum urban yang serba cepat bisa menjadi faktor penyebab munculnya gangguan kecemasan, belum lagi ditambah dengan kondisi spesifik yang berkaitan genetik atau kepribadian seseorang, serta lingkungan tempat tinggal merupakan faktor-faktor utama yang memengaruhi kondisi mental dan kecemasan seseorang.[5,7] Gangguan cemas ini juga berkaitan dengan timbulnya gejala-gejala otonom di dalam tubuh.[7] Biasanya kecemasan berlebihan ditandai dengan dua komponen gejala, yaitu gejala fisik dan psikologis.[7] Berbagai penelitian telah dilakukan untuk mengembangkan metode terapi yang efektif untuk mencegah dan mengatasi GAD, salah satunya ialah memanfaatkan tumbuhan berbahan herbal Piper methysticum.[16]
Piper methysticum (PM) merupakan tanaman yang tergolong famili Piperaceae.[17] Tanaman ini masih tergolong dalam jenis perdu karena batangnya masih kurang dari 4 meter.[17] Batangnya keras, berwarna cokelat tua, beruas, daunnya berbentuk jantung tumbuh berselang seling, ukuran panjang daun 15-20 sentimeter, lebar 10-15 sentimeter.[17] Tidak mempunyai akar penancap, arah tumbuhnya erectus, tidak menjalar, buahnya majemuk bulir berbentuk panjang silindris, serta termasuk dalam buah buni.[17] Piper methysticum merupakan salah satu tanaman herbal dan sudah lama diketahui memiliki khasiat sebagai obat untuk mengatasi batuk, luka akibat gigitan serangga, stres, kejang otot, gangguan menstruasi, dan kecemasan di Asia Tenggara dan Pasifik Selatan.[18] Agustinus Mahize dalam bukunya yaitu Etnobotani: Pengetahuan Lokal Suku Marori di Taman Nasional Wasur Merauke menuliskan bahwa wati memiliki khasiat menghilangkan kecemasan dan sedatif.[18]
Penelitian membuktikan efek terapeutik PM terkait dengan kandungan aktifnya, yaitu kavain.[19] Zat bioaktif ini berperan dalam efek PM terhadap kemampuan aktivitas ansiolitik terkuat melalui enam kavain lipofilik.[19] Selain itu, PM terbukti memiliki efek terapeutik lain terhadap parameter GAD, kavain memberikan efek ansiolitik melalui berbagai aktivitas neurobiologis, terutama dari modulasi GammaAminobutyric Acid (GABA) reseptor melalui blokade saluran ion natrium volted-gated,[20] pengurangan neurotransmiter rangsang melalui blokade saluran ion kalsium,[21] dan peningkatan ikatan ligan dengan reseptor tipe A GABA.[22] Efek neurokimia lainnya mencakup penghambatan reversibel dari monoamine oxidase B21, penghambatan siklo-oksigenase, dan pengurangan pengambilan neuronal dopamin dan noradrenalin di prefrontal korteks.[23] Penelitian yang dilakukan oleh Cochrane menunjukkan PM yang efektif dalam pengurangan kecemasan yang signifikan melalui modulasi transporter GABA polimorfisme.[24]
Berdasarkan pemaparan urgensi permasalahan pada paragraf di atas, PM merupakan tanaman yang berpotensi digunakan sebagai upaya preventif GAD karena kandungan kavain sebagai zat aktif yang dapat mencegah gangguan cemas dan memiliki efek ansiolitik. Dalam tulisan ini akan dibahas mengenai patofisiologi dan patogenesis GAD, efek karakterisasi GAD fungsional kavain pada GABAaRs, diferensial Kavain pada GABAaRs α1β2γ2L dan α4β2δ, efek pada PmSPS1, PmSPS2, S133C, T198N, dan Q213Lm, efek kavain dalam tinjauan farmakoterapi, dan cara penggunaan ekstrak kavain pada pasien GAD.
PEMBAHASAN
Patofisiologi dan Patogenesis GAD
Generalized Anxiety Disorders (GAD) erat dikaitkan dengan konektivitas fungsional yang terganggu dari amigdala dan pemrosesan rasa takut dan kecemasannya.[25] Informasi sensoris memasuki amigdala melalui inti kompleks basolateral (terdiri dari inti basal lateral, basal, dan aksesori).[25] Kompleks basolateral memproses ingatan yang berhubungan dengan sensoris dan mengomunikasikan pentingnya ancaman terhadap ingatan dan pemrosesan sensoris di tempat lain di otak, seperti korteks prefrontal medial dan korteks sensoris.[25]
Area lain, nukleus sentral yang berdekatan dari amigdala, mengendalikan responss ketakutan spesifik spesies dalam hubungannya dengan batang otak, hipotalamus, dan daerah otak kecil.[25] Pada orang-orang dengan gangguan kecemasan umum, koneksi ini tampak kurang berbeda secara fungsional dan terdapat materi abu-abu yang lebih besar di inti pusat.[25] Perbedaan lain adalah bahwa daerah amigdala mengalami penurunan konektivitas dengan insula dan daerah cingulata yang mengendalikan arti penting stimulus umum, konektivitas yang lebih besar dengan korteks parietal dan sirkuit korteks pre-frontal yang mendasari fungsi eksekutif.[25]
Amigdala adalah area otak yang mengatur pusat pengontrolan rasa takut. Input sensoris diterima dari area otak seperti talamus sensoris, korteks sensoris, dan pre-frontal korteks.[25] Koneksi antara amigdala dan korteks pre-frontal mengatur pengalaman ketakutan dan menghasilkan responss psikologis.[25] Respons motorik dikendalikan oleh koneksi daerah periaqueduktal dari otak.[25] Bersama-sama, terbentuklah respons terhadap rasa takut.[25] Ketika sistem ini bekerja secara tidak tepat, sindrom klinis kecemasan dapat terjadi.[25] Dengan cara yang sama seperti rasa khawatir, proses kognitif diatur oleh sirkuit kortiko-striato-talamo-kortikal (CSTC).[25] Sirkuit ini melibatkan neurotransmiter dan reseptor yang mungkin menjadi target untuk farmakoterapi.[25] Beberapa sirkuit neurotransmiter di amigdala dan CSTC terlibat dalam ketakutan, kecemasan, dan kekhawatiran.[25] Sebagai neurotransmiter yang bekerja sebagai antagonis neurotransmiter, GABA berperan penting dalam mengatur rasa takut, cemas dan khawatir.[25] Untuk kecemasan, reseptor Gamma Aminobutyric Acid tipe A (GABA-A) muncul paling relevan.[25] Kompleks reseptor ini melibatkan lima subunit dan elektrolit ion klorida yang melaluinya masuk ke dalam sel ketika agonis GABA mengikatnya seperti subunit α, β, ϒ, dan δ.[26] Masuknya klorida dapat mengurangi aktivitas listrik neuron, sehingga dapat menghambat reseptor GABA.[26]
Serotonin adalah neurotransmiter penting pada amigdala dan korteks pre-frontal.[26] Proyeksi saraf melibatkan serotonin dari nukleus raphe dorsal ke amigdala, korteks frontal diduga terlibat kecemasan, penghindaran antisipatif, dan ketakutan.[26] Overaktivitas sistem serotonin terlibat dalam gangguan kecemasan.[26] Aktivasi reseptor serotonin-1 pre-sinaptik menyebabkan penurunan awal dalam aktivitas serotonin.[26] Jenis reseptor penting lainnya adalah tegangan-sensitif saluran kalsium (VSCC). Reseptor ini mirip dengan GABA.[26] Reseptor VSCC terdiri beberapa subunit yang dapat ditemukan di kedua amigdala dan korteks pre-frontal.[26] Pengaktifan reseptor VSCC di amigdala dapat menghasilkan respons ketakutan, kecemasan, dan kekhawatiran di CSTC.[27]
Efek Karakterisasi Fungsional Kavain pada GABAARS
Struktur kimia enam kavalakton lipoflik utama ditemukan di kava salah satunya adalah kavain. Selain kavain terdapat beberapa struktur kimia lain yaitu metistisin, yangonin, dihidrokavain, dihidrometistisin, dan desmetoksiyangonin, adapun keenam struktur tersebut terlihat pada Gambar 1.[19]
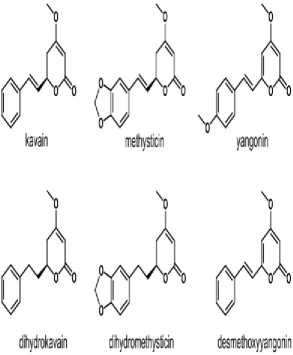
Gambar 1. Struktur Kimia Enam Kavalakton Lipofilik pada Piper methysticum.[19]
Kavain memberikan efek pada subunit α1β2γ2L Gamma Aminobutyric Acid A Receptors (GABAARs) dengan meningkatkan respons yang ditimbulkan GABA.[28] Selain itu, kemampuan kavain untuk mengaktifkan reseptor GABA, dan merangsang aktivitas agonis intrinsik yang dapat memperbaiki gangguan cemas, dengan 300 μM kavain memunculkan arus <1% dari 10 mM untuk memodulasi GABA subtipe reseptor sehingga dapat memengaruhi subunit α1β2, β2γ2L, αxβ2γ2L, α1βxγ2L dan α4β2δ.[28] Kavain dapat memberikan respons pada semua reseptor pada tingkat yang sama, sehingga tidak menunjukkan selektivitas subtipe yang signifikan seperti yang terlihat pada Gambar 2.[28] Penelitian yang dilakukan oleh Jansen et. al. menunjukkan kavain pada PM bersifat pemicu cepat dalam modulasi persinyalan GABA dan mengandung senyawa 2'-hidroksi-4,4',6 trimetoksi kalkon yang berkhasiat sebagai diuretik dan menghalangi terjadinya apoptosis sel.[29]
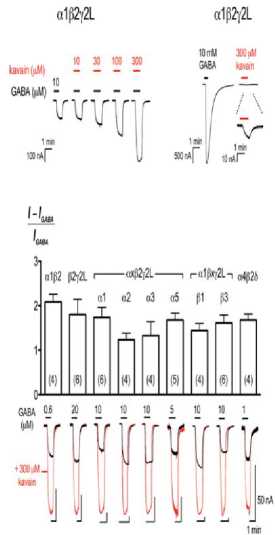
Gambar 2. Kavain MemPotensi GABAARs Tanpa Selektivitas Subtipe.[28]
Efek Diferensial Kavain pada GABAaRs α1β2γ2L dan α4β2δ
Sifat modulasi kavain dalam menanggapi berbagai konsentrasi GABA, dapat dilihat pada pada reseptor α1β2γ2L dan α4β2δ.[29] Reseptor ini mewakili sinaptik utama dan GABAaRs ekstrasinaptik masing-masing, serta ditandai dengan lokalisasi subselular dan sensitivitas yang berbeda.[29] Pada reseptor α1β2γ2L, kavain menunjukkan peningkatan sederhana pada konsentrasi GABA di bawah EC45, tetapi tidak memengaruhi EC50 dan kemanjuran maksimal GABA.[29] Sebaliknya, kavain meningkatkan respons maksimal yang ditimbulkan oleh GABA pada reseptor α4β2δ sebanyak dua kali tanpa memengaruhi potensi GABA secara signifikan seperti yang terlihat pada Gambar 3.[29]
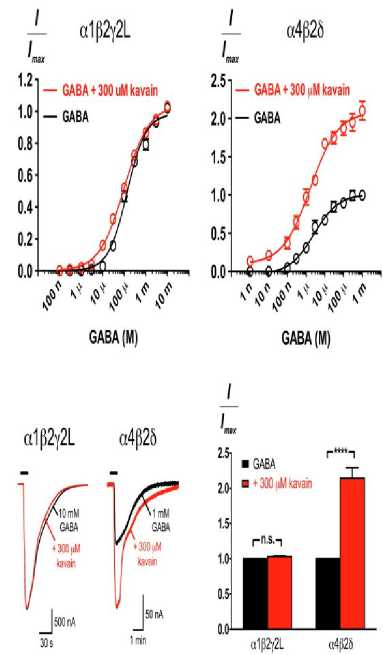
Gambar 3. Efek Kavain pada GABAARs α1β2γ2L dan α4β2δ.[29]
Potensi kavain tidak memerlukan subunit α1 atau L2L karena baik β2γ2L dan α1β2 GABAARs dimodulasi ke tingkat yang sama seperti GABAARs α1β2γ2L.[29] Selain itu, kavain berinteraksi pada subunit α (α1, 2, 3, atau 5) dan isoform subunit β (β1, 2, atau 3) dalam reseptor αβγ2L, atau subunit γ2L dengan δ (α4β2δ).[29] Namun, modulasi kavain pada α1β2γ2L dan α4β2δ GABAARs secara fungsional berbeda.[29] Kavain memodulasi GABAARs α1β2γ2L pada konsentrasi GABA di bawah kinerja EC45.[29] Sebaliknya, konsentrasi GABA merespons kinerja α4β2δ GABAARs secara signifikan sehingga kinerja kavain bekerja secara efektif dan sensitif dalam sistem target.[29]
Preferensi fungsional kavain untuk α4β2δ GABAARs dapat dijelaskan oleh agonis parsial, profil efikasi-intrinsik-lemah GABA pada subtipe reseptor
ini yang menjadikannya lebih sensitif untuk modulasi kavain.[29] Efek peningkatan diferensial serupa pada kavain juga berbeda pada reseptor αβγ sinaptik dan αβδ ekstrasinaptik untuk ligan alosterik lainnya, seperti etomidat, propofol, pentobarbital, dan neurosteroid.[29,30]
Penelitian yang dilakukan oleh Davies et. al. pada tikus menunjukkan bahwa 100 mg/kg kavain menyebabkan lonjakan yang cepat konsentrasi otak (hingga 100 μM) dalam beberapa menit setelah diberikan kavain, hal ini dapat dilihat pada Gambar 4.[31] Disimpulkan bahwa, terdapat korelasi yang signifikan antara konsentrasi kavain dengan efek ansiolisis dan hipnosis pada tikus.[32] Kavain bekerja dengan berinteraksi secara non-spesifik dengan membran lipid neuron untuk mengerahkan efek psikoaktif.[32]
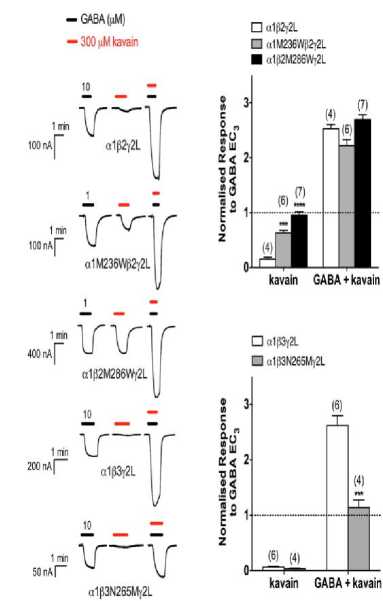
Gambar 4. Efek Kavain pada Tipe GABAARs α1β2γ2L Berupa α1β2M286Wγ2L, α1M236Wβ2γ2L, dan α1β3N265Mγ2L.[29,30]
Efek Kavain pada PmSPS1, PmSPS2, S133C,
T198N, dan Q213L
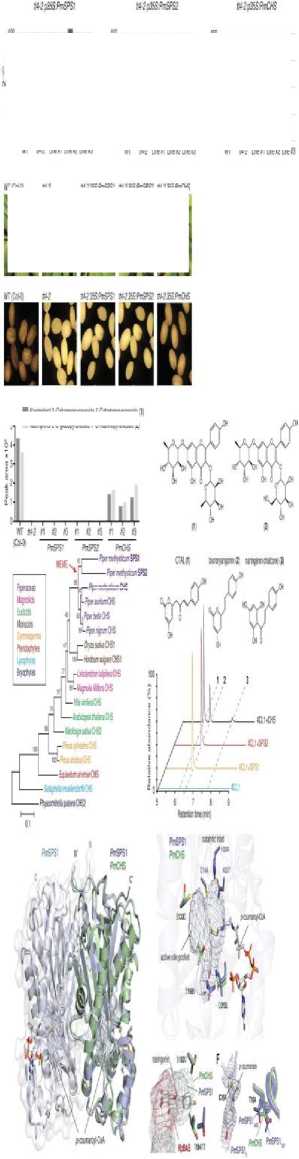
Kavain merupakan enzim eksklusif yang menghasilkan triketid lakton bisnoryangonin dari p-coumaroyl-CoA, yang substansinya berupa protein molekuler PmSPS1 dan PmSPS2.[33] Substansi ini dikode oleh PM kalkon sintase (PmCHS) yang dapat memproduksi p-coumaroyltriacetic acid lactone (CTAL) dan bisnoryangonin sebagai tambahan naringenin sintase yang berperan dalam
meningkatkan peran sentral konektivitas korteks singulata anterior, amigdala, dan pengatur rasa cemas pada korteks pre-frontal medial dan korteks sensoris.[34] Substansi protein molekuler ini
merupakan homodimer dan berbagi lipatan tiolase αβαβα kanonik yang tersusun dari enam residu asam amino dalam substitusi, S133C, T198N, dan Q213L.[33] Khususnya, substitusi T198N dapat meningkatkan produksi kalkon sintase menjadi 2-
piron sintase (2PS).[33] Substitusi S133C dapat mengkatalisasi rantai kalkon sintase yang terputus akibat adanya neurodegenerasi oleh enzim RpBASi yang dapat memperpanjang rantai polipeptida tunggal patogenesis GAD.[33] P-coumaroyl-monocetide intermediet terikat secara kovalen dengan katalitik sistein dari konfigurasi situs aktif pengisian substrat starter siklus katalitik PKS22.[33] Seluruh aktivitas dan mekanisme dapat dilihat pada Gambar 5.[33,34]


■ '⅛ W MCT3⅛f≡10⅛⅛⅛ΠW∣f^^ 111 ⅛τt⅛η '⅛jwyαcκ⅛⅛ftTOCs7
Gambar 5. Efek Kavain pada PmSPS1, PmSPS2, S133C, T198N, dan Q213L.[33,34]
Efek Kavain dalam Tinjauan Farmakoterapi pada GAD
Efek target kavain pada GAD telah dibuktikan pada penelitian yang dilakukan oleh Schirmaccher et. al. melalui pemberian kavain 100 mg/kgBB dalam model neuronal tikus yang menunjukkan bahwa kavain bekerja melalui jalur anti-konvulsan.[35] Mirip dengan gabapentin dan pregabalin, kavain mampu memodulasi saluran kalsium dan mengurangi aktivitas saluran kalsium volted-gated.[35] Selain bertindak pada saluran kalsium, kavain juga bertindak pada modulasi saluran natrium volted-gated.[36] Penelitian ini memperkuat penelitian yang pernah ada dengan model tikus berbasis sel, kavain dapat menghambat saluran natrium volted-gated, yang secara sensitivitas terjaga keamanannya dan efektif memperlambat aktivitas neuron.[36]
Selain itu, efek ansiolitik kavain dapat mengikat reseptor GABA dalam sistem saraf pusat.[36] GABA berfungsi membuka saluran klorida, menyebabkan hiperpolarisasi membran sel, dan meningkatkan ambang batas untuk aktivitas.[36] Peran-peran modulasi GABA dari kavain atau senyawa turunan kavain in-vitro dan ex-vivo ditemukan bahwa sejumlah konstituen kavain menghambat pengikatan benzodiazepin pada tikus forebrains, melalui model in-vitro, tetapi ketika senyawa-senyawa tersebut ditranslasikan menjadi model-model ex-vivo murine, kavain tidak memiliki aktivitas.[37] Untuk mengonfirmasi temuan ini, percobaan perpindahan-reseptor in-vivo yang terkontrol dilakukan dengan radiolabeled [H3] GABA.[37] Tikus diinjeksi dengan GABA radiolabeled dan setelah masa inkubasi, diobati dengan ekstrak kavain dan hasil menujukkan tingkat yang maksimal.[37]
Grunze et. al. membahas tiga percobaan in-vitro yang berbeda untuk mengeksplorasi lebih lanjut mekanisme untuk sifat ansiolitik kavain.[38] Sifat GABAnergik pertama yang dieksplorasi dari kavain dalam irisan hipokampus marmut dan tidak menunjukkan gerakan stereotip positif seperti yang terlihat oleh agonis GABA.[38] Penelitian ini menunjukkan bahwa kavain berfungsi di jalur serotonergik dan juga di jalur glutamatergik.[38] Efek lainnya, kavain berperan antagonis terhadap saluran Ca2+ dan memiliki efek pada saluran natrium juga kalium, mirip dengan terapi mood stabilizer dan terapi anti-epilepsi.[38]
Mekanisme kerja kavain dibandingkan dengan terapi ansiolitik lainnya seperti SSRI dan inhibitor reuptake norepinefrin.[39] Sinaptison serebrokortikal dan hippocampal tikus digunakan untuk menilai kemungkinan efek modulasi-monoamina yang mungkin dimiliki kavain.[39] Setelah memberikan norepinefrin dan serotonin ke sel, ekstrak kavain diberikan dan efek penghambatan reuptake diukur, seperti yang terlihat melalui jumlah neurotransmiter yang tidak diambil oleh sel.[39] Hal ini jauh lebih esensial dibandingkan dengan efek inhibitor reuptake norepinefrin, desimpiramin, dan inhibitor reuptake serotonin seperti fluoxetine.[39] Bila dibandingkan dengan kurva inhibisi yang ditunjukkan oleh inhibitor lainnya, kavain lebih menyerupai inhibitor norepinefrin, tetapi menunjukkan inhibisi reuptake serotonin minimal.[39] Fenomena ini menunjukkan bahwa kavain kemungkinan memiliki aktivitas inhibitor reuptake norepinefrin dalam memberikan efek ansiolitik.[39]
Proses Ekstraksi dan Cara Penggunaan Kavain pada Pasien GAD
World Health Organization (WHO) menyarankan penggunaan ekstrak kavain dari rimpang dan akar yang dikupas lebih dari aseton dan ekstrak etanol karena ekstrak kavain kaya akan glutation hepatoprotektif dan memiliki bukti keamanan dalam penggunaan tradisional.[34] Daun dari batang wati yang sudah tua dikeringkan di bawah sinar matahari selama dua hari, setelah itu dilakukan penggilingan daun tadi secara halus.[34] Seberat 12 gram serbuk kering daun wati diekstraksi secara bertingkat dengan menggunakan pelarut heksana, kloroform, dan metanol berturut-turut.[34] Ekstrak yang diperoleh kemudian diuapkan pelarutnya dengan rotary evaporator sehingga diperoleh ekstrak kasar heksana sekitar 1 gram, ekstrak kloroform 1,45 gram, dan ekstrak metanol 1,5 gram.[34] Selanjutnya, sebagian dari masing-masing ekstrak tersebut dilarutkan kembali untuk dianalisis komponen kimianya dengan menggunakan teknik gabungan kromatografi gas dan spektrometri massa.[34]
Analisis komponen kimia ekstrak kloroform digunakan kolom kapiler shimadzu CBP 5 (p=20 meter, f=0,25 milimeter) dengan suhu awal kolom 100°C yang dibuat konstan selama 5 menit.[34] Kemudian suhu dinaikkan sampai 300°C dengan kecepatan kenaikan 10°C/menit.[34] Pada suhu 300°C ini, suhu dibuat konstan selama 15 menit.[34] Sedangkan untuk analisis ekstrak metanol, digunakan kolom kapiler Shimadzu CBP 20 (p=50 meter, f=0,22 milimeter).[34] Suhu kolom diprogram dari 100°C (5 menit) sampai 250°C (10 menit) dengan kecepatan kenaikan suhu 10°C/menit.[34] Adapun dosis tumbuhan ini yang diberikan pada pasien dengan GAD berkisar antara 120-240 miligram per hari, untuk dosis pemberian ini masih dalam studi double blind, acak, dan terkontrol oleh plasebo.[40]
SIMPULAN
Generalized Anxiety Disorders (GAD) adalah gangguan psikiatri yang mudah mengenai siapa saja tanpa memandang batas usia. Gangguan ini ditandai dengan kecemasan, ketegangan motorik, dan overaktivitas otonom. Prevalensi GAD di seluruh dunia telah menjadi buah bibir yang dapat menimbulkan penurunan kualitas hidup penderita. GAD erat dikaitkan dengan konektivitas fungsional yang terganggu dari amigdala dan pemrosesan rasa takut dan kecemasannya. Tingginya komplikasi sosioekopsikokultural yang dihadapi oleh para penderita GAD menyebabkan pentingnya untuk melakukan tatalaksana pada penyakit GAD.
Piper methysticum atau wati merupakan tumbuhan yang memiliki khasiat sebagai obat sebagaimana telah banyaknya penelitian dan novel terapi yang telah berkembang saat ini. Kavain merupakan kandungan biologis utama dalam Piper methysticum yang memiliki aktivitas ansiolitik poten sehingga dapat menginduksi pelepasan GABA dan pengaturan kadar serotonin. Ekstrak Piper methysticum dapat digunakan sebagai terapi preventif GAD terkait dengan kemampuan Piper methysticum menurunkan kecemasan, mengatur overaktivitas otonom mencegah terjadinya ketegangan motorik yang merupakan faktor risiko utama terjadinya GAD. Pengujian kavain pada piper methysticum secara in-vitro menunjukkan bahwa
pada irisan hipokampus marmut tidak ditemukan gerakan streotip dan efek samping minimal pada tikus yang telah diinjeksikan GABA radiolabeled yang diobati kavain. Penggunaan Piper methysticum sebagai upaya preventif GAD terbukti unggul secara pre-klinik. Uji klinik kavain dewasa ini penting untuk dikembangkan agar dapat diimplementasikan secara etis dalam terapi GAD. Penggunaan Piper methysticum sebagai upaya preventif dan terapi adjuvan GAD terbukti unggul karena murah dan mudah didapatkan, tidak ada efek samping, serta memiliki efektivitas tinggi dalam mencegah terjadinya GAD.
SARAN
Adapun keterbatasan dalam tulisan ini adalah informasi tentang uji klinis mengenai terapi Piper methysticum untuk GAD masih sangat terbatas dan belum banyak dilakukan di Indonesia. Oleh karena itu, penelitian lebih lanjut mengenai uji klinis, toksikologi, daur patogenesis terhadap pengobatan berdasarkan biomolekuler, dan dosis terapeutik Piper methysticum untuk pengobatan GAD perlu dilakukan agar strategi terapi ini dapat diimplementasikan secara etis dan menurunkan angka penyakit tidak menular di Indonesia.
UCAPAN TERIMA KASIH
Terima kasih penulis sampaikan kepada semua instansi yang telah membantu penyelesaian penulisan tinjauan pustaka ini.
DAFTAR PUSTAKA
-
1. Badan Perencanaan Pembangunan Nasional Badan Pusat Statistik Statistik United Nations Population Fund. Proyeksi Penduduk
Indonesia[Internet]. BPS. 2015 [cited 2021 Oct 05]. Available
from:https://www.bappenas.go.id/files/5413/914 8/4109/Proyeksi_Penduduk_Indonesia_2010-2035.pdf.
-
2. World Health Organization. Noncommunicable Disease Country Profil 2018[Internet]. Geneva: World Health Organization; 2018. Available from:
https://www.who.int/nmh/countries/2018/idn_en. pdf?ua=1.
-
3. Kementerian Kesehatan Republik Indonesia. Penyakit tidak menular (PTM) penyebab kematian terbanyak di Indonesia[Internet]. Kemenkes. 2011 [cited 2021 Oct 5]. Available from:
http://www.depkes.go.id/article/print/1637/penya kit-tidak-menular-ptm penyebab-kematian-
terbanyak-di-indonesia.html.
-
4. Ermalena MHS. Indikator sdgs di indonesia. Jakarta: The 4th ICTOH; 2017. ISBN:
9786021154878.
-
5. Cable News Network. Penyakit Kesehatan Jiwa dalam Perlindungan BPJS[Internet]. Available from: https://www.cnnindonesia.com/gaya-
hidup/20181012193101-255-338079/penyakit-kesehatan-jiwa-dalam perlindungan-bpjs.
-
6. Kementerian Kesehatan Republik
Indonesia[Internet].Kemenkes. 2011 [cited 2021 Oct 5]. Available form:
-
7. American Psychiatric Association. Diagnostic and statistical manual of mental disorders
(DSM-5®). Washington, DC: American
Psychiatric Publishing; 2013. ISBN
9780890425558.
-
8. American Psychiatric Association (APA). Diagnostic and statistical manual of mental disorders, 5th ed. Arlington: VA APA; 2013. ISBN 9780890420256.
-
9. Stein MB, Sareen J. Generalized anxiety disorder. N Engl J Med. 2015;373:2059-68. doi: 10.1021/j.med.n.engl.2015.024.008.
-
10. Kementerian Kesehatan Republik Indonesia. Riset kesehatan dasar indonesia tahun 2018. Jakarta: Kemenkes RI; 2018.
-
11. Wetherell J, Petkus A, Nguyen H. Antidepressant medication augmented with cognitive-behavioral therapy for generalized anxiety disorder in older adults. Am J Psychiatry. 2013;170:782-9. doi:
00.1756/j.amp.2013.00.08.
-
12. Revicki D, Travers K, Wyrwich K. Humanistic and economic burden of generalized anxiety disorder in north america and europe. J Affect Disord. 2016;140:103-12. doi:
03.8297/j.ad.2016.17.18.
-
13. Amir N. Buku ajar psikiatri edisi ke-3. Jakarta: FKUI; 2017. ISBN. 9789794967904
-
14. Sadock BJ, Sadock VA, Kaplan HI. Kaplan
sadock's synopsis of psychiatry: behavioral sciences/clinical psychiatry. edisi ke-11. Philladelphia: Lippincott Williams & Wilkins;
2018. ISBN 9781609781095
-
15. Spett M. Cognitive-behaviour therapy for panic attacks; 2016 [diperbarui 2016].[diakses pada tanggal 5 Oktober 2021]. Tersedia dari: http://www.njact. org/panic.html.
-
16. Lebot V, Merlin M, Lindstrom L. Kava: the pacific drug. new haven, connecticut: Yale University Press; 2014. ISBN 9781489935915
-
17. Lebot V, Levesque J. The Origin and distribution and distribution of kava (piper methysticum forst. f, piperaceae) a phytochemical approach, allertonia .national tropical botanical garden. J Lawai Hawaii. 2017;5:23-8. doi:
01.1889/jlh.2017.018.08.
-
18. Singh YN. Kava: an overview. J
Ethnopharmacol. 2014;37:13–45. doi:
07.0789/jeth,2014.014.06.
-
19. Mathews JM, Etheridge AS, Valentine JL. Pharmacokinetics and disposition of the kavalactone kavain: interaction with kava extract and kavalactones in vivo and in vitro. Drug Metab Dispos. 2015;33:1555–63. doi:
02.023/DMD.2015.012.13.
-
20. Gleitz J, Beile A, Peters T. (+/-)-Kavain inhibits veratridine-activated voltedagedependent
Na(+)-channels in synaptosomes prepared from rat cerebral cortex. Neuropharmacol.
2015;34:1133–8. doi: 01.017/Neur.2015.002.17.
-
21. Walden J, von Wegerer J, Winter U. Effects of kavain and dihydromethysticin on field potential changes in the hippocampus. Prog Neuropsychopharmacol Biol Psychiatry.
2017;21:697–706. doi:
02.024/NBP.2017.023.12.
-
22. Uebelhack R, Franke L, Schewe HJ. Inhibition of platelet MAO-B by kavapyrone-enriched extract from Piper methysticum Forster (kava-
kava). Pharmacopsychiatry. 1998;31:187–92. doi: 03.011/Psy.1998.002.11.
-
23. Seitz U, Schule A, Gleitz J. [3H]-monoamine
uptake inhibition properties of kava pyrones. Planta Med. 1997;63:548–9. doi:
01.001/PM.1997.009.05.
-
24. Hunot V, Churchill R, Teixeira V, Silva de Lima
-
M. Psychological therapies for generalised anxiety disorder (Review). Cochrane Database of Systematic Reviews. 2016;24:1848. doi: 00.023/Coch.2016.012.04.
-
25. Etkin, Amit, Prater, Katherine E, Schatzberg, Alan F, et.al. Disrupted amygdalar subregion functional connectivity and evidence of a compensatory network in generalized anxiety disorder. Archives of general psychiatry.
2016;66:1361–72. doi: 02.013/AG.2016.005.02.
-
26. Stahl S. Anxiety disorders and anxiolytics. in: stahl’s essential psychopharmacology, 4th ed. New York: Cambridge University Press, 2013. 9238794277325
-
27. Sheehan D, Svedsater H, Locklear. Effects of extended-release quetiapine fumarate on longterm functioning and sleep quality in patients with generalized anxiety disorder (gad): data from a randomizedwithdrawal, placebo controlled maintenance study. J Affect Dis.2013;151:906-13. doi.10.4103/0973-
1229.58825
-
28. Chua HC, Absalom NL, Hanrahan JR, Viswas R, Chebib M. The direct actions of GABA, 2'-methoxy-6-methylflavone and general
anaesthetics at β3γ2L GABAA receptors: Evidence for receptors with different subunit stoichiometries. PloS one. 2015;10:10-7. doi. 10.1371/journal.pone.0141359
-
29. Janssen PA, Niemegeers CJ, Schellekens KH, Lenaerts FM. Etomidate, R-(+)-ethyl-1-(α-methyl-benzyl) imidazole-5-carboxylate (R 16659), a potent, short-acting and relatively atoxic intravenous hypnotic agent in rats. Arzneimittel-Forschung. 2013;30:1234-43. doi. 11.1998/arzf.203948.
-
30. Feng HJ, Jounaidi Y, Haburcak M, Yang X, Forman SA. Etomidate produces similar allosteric modulation in α1β3δ and α1β3γ2L
GABAA receptors. British Journal of Pharmacology. 2014; 171:789-98.
doi.10.1111/bph.12507
-
31. Keledjian J, Duffield PH, Jamieson DD, Lidgard RO, Duffield AM. Uptake into mouse brain of four compounds present in the psychoactive beverage kava. Journal of Pharmaceutical Sciences. 2018;77:1003-6.
-
32. Mathews JM, Etheridge AS, Valentine JL, Black SR, Coleman DP, Patel P, et. al. Pharmacokinetics and disposition of the kavalactone kawain: interaction with kava
extract and kavalactones in vivo and in vitro. Drug Metabolism and Disposition.
2005;33:1555. doi 10.1124/dmd.105.004317.
-
33. Burbulis IE, Lacobucci M, Shirley BW. A null mutation in the first enzyme of flavonoid
biosynthesis does not affect male fertility in 2015;2:1013-25. doi. 10.1105/tpc.8.6.1013
-
34. Akiyama T, Shibuya M, Liu HM. Ebizuka Y. p-Coumaroyltriacetic acid synthase, a new homologue of chalcone synthase, from
Hydrangea macrophylla var. thunbergii. FEBS J. 2014;263:834-9. doi. 10.1046/j.1432-
1327.2014.00562.x
-
35. Schirrmacher K, Büsselberg D, Langosch JM, Walden J, Winter U. Effects of (+/-)-kavain on voltedage-activated inward currents of dorsal root ganglion cells from neonatal rats. Eur
Neuropsychopharmacol. 2013;9:171-6. doi. 11.1023/jer.14wd-12es7.2013.00322.x
-
36. Strahl S, Ehret V, Dahm HH, Maier KP Necrotizing hepatitis after taking herbal remedies. Dtsch Med Wochenschr. 2012; 123:1410-4. doi.10.1055/s-2012-1024196
-
37. Guro RS, Anand P, Hu Q, Mir R. Dermatomyositis-like illness following kava-kava ingestion. J Clin Rheumatol. 2016;5:342-5. doi 10.1097/00124743-201612000-00008.
-
38. Russmann S, Barguil Y, Cabalion P, Kritsanida M, Duhet D. Hepatic injury due to traditional aqueous extracts of kava root in New Caledonia. Eur J Gastroenterol Hepatol. 2014;15:1033-6. doi: 10.1097/00042737
201409000-00015.
-
39. Richardson WN, Henderson L. The safety of kava—aregulatory perspective. Br J Clin Pharmacol. 2012;64:418-20. Doi.
https://doi.org/10.1111/j.1365-2125.2012.02933.x
-
40. Sarris J, Stough C, Bousman CA, Wahid, Murray ZT, Teschke G, Schweitzer RI. Kava in the Treatment of generalized anxiety disorder. Journal of Clinical Psychopharmacology. 2013;33:643-8.
doi.10.1097/JCP.0b013e318291be67.
34
Discussion and feedback