Potensi Kuersetin Terenkapsulasi PLGA sebagai Terapi dalam Penatalaksanaan Kanker Payudara
on
ARTIKEL TINJAUAN PUSTAKA

Essence of Scientific Medical Journal (2022), Volume 20, Number 1:35-42
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI KUERSETIN TERENKAPSULASI PLGA SEBAGAI TERAPI DALAM PENATALAKSANAAN KANKER PAYUDARA
Putu Risya Sadhu Putra1, Aizar Vesa Prasetyo1, Putu Sinta Elix Wahyuni2
ABSTRAK
Pendahuluan: Kanker payudara merupakan salah satu jenis kanker yang paling umum diderita di seluruh dunia dengan angka kejadian sekitar dua juta kasus setiap tahun serta menjadi penyebab utama kematian pada wanita di dunia. Beberapa literatur telah membahas terapi alternatif untuk pengobatan kanker payudara. Salah satu yang cukup menjanjikan adalah kuersetin. Zati ini merupakan jenis senyawa aktif flavonoid yang dapat menginduksi apoptosis sel dan memengaruhi siklus sel sehingga berpotensi dalam pengobatan kanker payudara. Akan tetapi, efek kuersetin memiliki hambatan, yaitu sifatnya yang larut dalam air, struktur kimia yangtidak stabil, serta sukar diserap pada jalur gastrointestinal sehingga bioavailabilitas buruk. Solusi yang dapat dikembangkan adalah mengformulasikan koersetin dalam bentuk nano dengan memanfaatkan Poly (lactic-co-glycolic acid) PLGA yang dalam literatur dapat meningkatkan efek anti-kanker dari kuersetin.
Pembahasan: Hasil tinjauan pustaka pada berbagai studi literatur menunjukkan bahwa kuersetin terenkapsulasi PLGA menunjukkan peningkatan aktivitas apoptosis (dini, terlambat) secara signifikan sebesar 53,37% dan 6,78% dibandingkan dengan sampel kontrol dan PLGA tanpa kuersetin. Dibandingkan dengan PLGA tanpa kuersetin, kuersetin yang dienkapsulasi PLGA mampu memiliki aktivitas anti-kanker yang sangat baik dengan menurunkan viabilitas sel hingga 40% dalam kisaran konsentrasi 0-2 µg/mL.
Simpulan: Oleh karena itu, terapi kuersetin terenkapsulasi PLGA dalam penatalaksanaan kanker payudara memiliki potensi yang menjanjikan sehingga diperlukan penelitian lebih lanjut.
Kata kunci: Kanker Payudara, Kuersetin, PLGA.
ABSTRACT
Introduction: Breast cancer is one of the most common types of cancer suffered worldwide with an incidence of about two million cases every year and is the leading cause of death in women in the world. Several articles have discussed alternative therapies for the treatment of breast cancer. One that is quite promising is quercetin. This substance is a type of flavonoid active compound that can induce cell cycle and apoptosis so that it is possible in the treatment of breast cancer. However, quercetin has obstacles, namely its air-soluble nature, unstable chemical structure, and difficulty to be absorbed in the gastrointestinal tract so that its bioavailability is poor. The solution that can be developed is to formulate quercetin in nano form by utilizing Poly (lactic-co-glycolic acid) PLGA which in the literature can increase the anti-cancer effect of quercetin.
Discussion: The results of the literature on various literature studies showed that encapsulated PLGA showed a significant increase in apoptotic activity (early, late) by 53.37% and 6.78% compared to the control sample and PLGA without quercetin, respectively. Compared with PLGA without quercetin, quercetin encapsulated PLGA was able to have excellent anti-cancer activity by reducing cell viability by up to 40% in the concentration range of 0-2 g/mL.
Conclusion: Therefore, PLGA-encapsulated quercetin therapy in the management of breast cancer has promising potential, so further research is needed.
-
1 Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Udayana, Bali
-
2 Program Studi Pendidikan Dokter Gigi, Fakultas Kedokteran, Universitas Udayana, Bali
Keywords: Breast Cancer, PLGA, Quercetin.
PENDAHULUAN
Kanker payudara adalah jenis kanker yang menjadi penyebab utama kematian pada wanita. Kanker payudara menjadi salah satu dari tiga kanker yang paling umum diderita di seluruh dunia selain kanker paru-paru dan kanker kolon.[1,2] Pada tahun 2018, insiden kanker payudara dilaporkan mencapai 2.088.849 insiden dan mengakibatkan 626.679 kematian di seluruh dunia.[3] Pada tahun 2020, terhitung terdapat peningkatan kasus menjadi 2.261.419 kasus kanker payudara dan angka mortalitas akibat kanker payudara meningkat hingga 684.996 kematian.[4] Kejadian ini membuat kanker payudara pada 2020 menjadi kanker yang paling sering diderita di seluruh dunia melewati kanker paru-paru dan kanker kolon, serta menjadi kanker kelima dengan angka mortalitas paling tinggi di seluruh dunia.[4]
Insiden kanker payudara diketahui lebih banyak pada negara maju (1.017.459 insiden) dibandingkan dengan negara berkembang (307.658 insiden). Australia dan Selandia Baru melaporkan 95.5 insiden
kanker payudara per 100 ribu penduduk dengan angka mortalitas mencapai 12.1, sedangkan di Asia Tengah-Selatan dilaporkan angka insiden kanker payudara hanya mencapai 26.2 per 100 ribu penduduk dengan angka mortalitas lebih tinggi yaitu 13.1.[4] Perkiraan kelangsungan hidup 5 tahun pada pasien kanker payudara sebesar 80% di negara maju, sedangkan di bawah 40% untuk negara berkembang.[1] Negara berkembang menghadapi kendala sumber daya dan infrastruktur dalam meningkatkan hasil akhir kanker payudara dengan peningkatan diagnosis dan manajemen yang tepat waktu.
Diperlukan modalitas baru yang lebih aman dan efektif sebagai pengobatan alternatif kanker payudara karena prevalensi dan angka mortalitas yang cukup tinggi di seluruh negara. Kuersetin adalah senyawa flavonoid memiliki sifat anti-kanker, antioksidan, pro-oksidan, anti-inflamasi, dan antidiabetes. Kuersetin dapat menginduksi apoptosis pada sel kanker dan melindungi sel non tumor dari efek samping kemoterapi.[5–7] Akan tetapi, karena
sifat zat kuersetin yang larut dalam air, serta penyerapan yang buruk pada gastrointestinal mengakibatkan bioavailabilitasnya yang rendah sehingga pembentukan enkapsulasi nanopartikel kuersetin perlu dipertimbangkan.[8,9] Polimer PLGA memiliki kemampuan untuk mengenkapsulasi berbagai agen hidrofilik dan hidrofobik, serta mengangkut nanopartikel yang spesifik ke organ target yang diinginkan.[10,11] Berdasarkan beberapa penelitian, tidak ditemukan adanya efek samping dari enkapsulasi PLGA ini.[12] Oleh karena itu, penulis tertarik untuk melakukan studi literatur mengenai modalitas nanopartikel kuersetin dienkapsulasi PLGA sebagai tatalaksana kanker payudara.
PEMBAHASAN
Kuersetin
Kuersetin (3,3',4',5,7-pentahydroxyflavone) merupakan senyawa aktif flavonoid dari famili polifenol flavonoid yang sering ditemukan dalam bentuk glikosida pada buah, sayuran, teh, dan anggur.[5] Kuersetin diketahui memiliki sifat yang dapat membantu kesehatan manusia seperti antikanker, anti-oksidan, pro-oksidan, anti-inflamasi, dan anti-diabetes. Zat aktif flavonoid ini bersifat menghambat peroksidasi lipid dan mampu mencegah radikal bebas merusak lipoprotein densitas rendah sehingga berguna dalam pengobatan, serta pencegahan kanker. Penelitian sebelumnya telah menunjukkan bahwa kuersetin pada konsentrasi rendah menginduksi apoptosis yang dimediasi oleh mitokondria dalam sel HeLa dengan mengaktifkan gen p53 dan mengurangi efek samping sitotoksik doxorubicin, obat umum untuk anti-kanker, pada sel non-tumor.[6,7] Kuersetin juga mengatur aktivitas fosfatidilinositol dan fosfatidilinositol fosfat kinase dalam sel karsinoma manusia yang menyebabkan penurunan yang signifikan dalam konsentrasi inositol trifosfat dan kematian sel atau apoptosis yang merupakan tujuan dari terapi anti-kanker. Ini juga digunakan untuk mengobati kanker dengan menurunkan kapasitas transduksi sinyal.[13] Selain itu, efek pro-oksidan kuersetin berkontribusi pada pencegahan pertumbuhan tumor. Metabolisme kuersetin terjadi di usus dan hati. Bentuk utama dari metabolit kuersetin adalah kuersetin 3-O-glukoronida dan kuersetin 3´-O-sulfat yang ditemukan dalam plasma manusia, sedangkan senyawa aglikon induk dikenali dalam sirkulasi sistemik. Oleh karena itu, beberapa sifat kuersetin dan metabolitnya termasuk anti-proliferasi, apoptosis, dan penghentian siklus sel dianggap sebagai senyawa anti-kanker.[12,14–17] Akan tetapi, efek kuersetin terbatas akibat sifatnya yang larut dalam air, ketidakstabilan struktur kimiawi, serta penyerapan kuersetin yang buruk pada gastrointestinal menyebabkan bioavailabilitasnya buruk.[8,9] Oleh karena itu, formulasi nano dari kuersetin sangat dianjurkan untuk meningkatkan bioavailabilitasnya.
PLGA
Poly (lactic-co-glycolic acid) (PLGA) adalah kopolimer sintetis yang terdiri dari monomer asam glikolat dan asam laktat. Asam laktat adalah asam 2-hidroksipropanoat atau asam glikolat tersubstitusi metil yang dapat diproduksi dalam 2 bentuk yaitu D dan L melalui fermentasi jagung dan sumber pertanian lain yang berbeda. Asam glikolat adalah asam 2-hidroksietanoat yang diproduksi baik melalui reaksi enzimatis biokimia atau sintesis kimiawi
menggunakan natrium hidroksida dan asam kloroasetat. Kopolimer PLGA dapat disintesis dengan berbagai metode, diantaranya reaksi polikondensasi dan polimerisasi pembukaan cincin adalah yang utama.[18] Polimer PLGA memiliki kemampuan untuk mengenkapsulasi berbagai agen hidrofilik dan hidrofobik yang berfungsi pada beberapa penyakit.[10] Molecular imprinting (MI) adalah salah satu pendekatan yang digunakan untuk meningkatkan pengenalan molekul PLGA sehingga menghasilkan pengangkutan nanopartikel yang sangat spesifik ini ke organ target yang diinginkan.[11]
Efek toksisitas PLGA NP telah ditentukan pada berbagai macam sel termasuk Caco-2, Colo 205, dan sel MDBK. Studi ini menunjukkan bahwa terdapat sangat sedikit atau tidak ada sama sekali toksisitas secara in vitro.[19,20] Selain toksisitas, struktur nano berbasis PLGA juga telah diuji secara in vivo pada organ viseral (hati, otak, limpa, usus, dan ginjal) setelah paparan oral NP selama kurang dari 7 hari dan tidak ditemukan adanya toksisitas yang berarti. Dalam studi terbaru, toksisitas PLGA dan nanopartikel PLGA kitosan (PLGA/Chi) yang termodifikasi pada permukaannya diuji setelah pemberian oral selama 7, 14, dan 21 hari pada tikus F344. Kitosan termodifikasi PLGA dan PLGA sederhana menunjukkan distribusi bio yang serupa, menggambarkan toksisitas minimal di usus dan hati, tetapi tidak ada toksisitas di ginjal, otak, dan paru-paru.[21] Selain itu, juga pengujian imunotoksisitas dan genotoksisitas dari nanopartikel PLGA-PEO yang menggunakan model sel darah manusia, menunjukkan sifat PLGA yang tidak beracun dalam dosis hingga 3 µg/cm2. Evaluasi genotoksisitas melaporkan bahwa tidak ada peningkatan dalam sel berinti ganda mikro dan sel yang diberi PLGA-PEO bebas dari basa DNA yang teroksidasi.[22]
Beberapa studi terapi kanker dengan struktur nano berbasis PLGA telah dilakukan. Nanopartikel oksida besi yang dienkapsulasi dalam kopolimer PLGA-PEG diisi dengan doxorubicin yang menunjukkan nanopartikel komposit magnet polimer obat ini dapat digunakan sebagai sistem pengiriman yang terkontrol untuk obat anti-kanker ini.[23] Selain itu, masih banyak lagi penelitian anti-kanker yang berbasis PLGA sebagai enkapsulasinya dengan hasil yang cukup baik dimana terdapat peningkatan efek perlambatan laju pertumbuhan tumor, peningkatan ketahanan kelarutan terhadap air sehingga meningkatkan sitotoksisitas obat anti-kanker, peningkatan penyerapan seluler obat pada studi in vivo, dan peningkatan regresi tumor dengan efek samping sistemik yang berkurang pada percobaan kanker payudara. Untuk alasan ini, nanopartikel PLGA telah menjadi sistem kemopreventif dan kemoterapi yang ampuh untuk pasien kanker serta dapat menjadi kandidat yang sesuai untuk pengembangan sistem pengiriman obat.[18]
Mekanisme Konstruksi, Administrasi, dan Distribusi Kuersetin Terenkapsulasi PLGA
Mekanisme Konstruksi Kuersetin Terenkapsulasi PLGA
Terdapat beberapa mekanisme konstruksi dalam pembentukan PLGA yang memuat kuersetin. Terdapat dua penelitian dari Karthick et al dan Halder et al yang masing-masing menggunakan proses emulsi oil-in-water dan teknik difusi pelarut emulsi yang dimodifikasi menggunakan PLF 127. Penelitian dari Karthick et al mendapatkan nilai efikasi
enkapsulasi mencapai 74 ± 1.2 % sedangkan penelitian Halder et al. mendapatkan nilai efikasi 70.52 ± 3.70 %. Masing-masing didapatkan dengan formula yang sama, yaitu % Efikasi Enkapsulasi (EE %) = (Jumlah total kuersetin yang ditambahkan -Jumlah kuersetin bebas dalam supernatan) / Jumlah total kuersetin yang ditambahkan × 100.13,24. Pada penelitian Karthick et.al mikrosfer PLGA-Quercetin (PLGAq) dibuat dengan melarutkan PLGA (50 mg) dan kuersetin (10% berat polimer) dalam etil asetat (500 μL). Lalu campuran dibiarkan larut selama 45 menit sambil diaduk. Proses ini dianggap sebagai fase terdispersi. Selain itu, terdapat fase kontinu yang merupakan larutan polivinil alkohol (PVA) (5%, 2 mL) yang diperoleh dari Sigma Aldrich, Amerika Serikat. Fase terdispersi ditambahkan tetes demi tetes ke fase kontinu dengan pengadukan konstan. Emulsi yang dihasilkan dicampur ke dalam larutan PVA 0,3% (25 mL) dan disimpan dengan tanpa adanya gangguan selama 4 jam. Pada akhir reaksi, mikrosfer PLGAq dikumpulkan dengan sentrifugasi pada 8.000 rpm selama 15 menit dan dicuci tiga kali dengan air suling. Setelah pelarut benar-benar dihilangkan, manik-manik dikeringkan, dibekukan, dan disimpan untuk penggunaan selanjutnya. Prosedur yang disebutkan di atas digunakan untuk menyiapkan mikrosfer PLGA sederhana tanpa kuersetin.[13] Karthick et al melakukan penilaian menggunakan Field Emission Scanning Electron Microscope (FESEM-SUPRA 55) Carl Zeiss, Jerman dalam mengkarakterisasi morfologi dari PLGAq. Mikrosfer selanjutnya dikarakterisasi menggunakan IR Affinity-1s Fourier Transform Infrared Spectroscopy (FTIR) Shimadzu, Japan. Untuk memastikan strukturnya, spektrum 1H dan 13C NMR diukur dengan mencampurkan dengan dimetil sulfoksida (DMSO-d6) dan direkam pada Spektrometer Bruker 800 MHz (Avance III, US2). Pada gambar 1 Puncak pada 1.664 cm-1 menunjukkan serapan ikatan (C = O) dan pita 1618 cm-1 menunjukkan peregangan ikatan (C – C). Puncak pada 1244 cm - 1 dapat dikaitkan dengan peregangan ikatan (-C – O) oksigen di dalam cincin. Demikian juga, getaran deformasi (–C-OH-) terlihat pada 1317 cm-1 dan puncak yang diamati di wilayah 1163 hingga 1002 cm-1 menjelaskan peregangan molekul (C – O).[13]
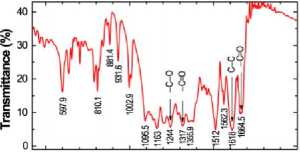
500 1000 1500 2000
Wavenumber (cm1)
Gambar 1. Spektrum FTIR pada PLGAq.[13]
Mekanisme Administrasi dan Distribusi Kuersetin Terenkapsulasi PLGA
Terdapat berbagai cara dalam administrasi obat dengan keunggulan dan kelemahan masing-masing, salah satunya adalah jalur administrasi per oral. Administrasi per oral memiliki keunggulan dalam kenyamanan pemberian, tidak menyakitkan, dan biaya yang diperlukan sangat minimal. Hal ini juga didukung dengan penyerapan kuersetin yang terbatas terjadi di usus besar dan usus halus. Bentuk glikosida dari kuersetin diikuti oleh hidrolisis enzimatik dari gugus glukosa oleh sel-sel usus atau aktivitas bakteri usus besar dan absorpsi oleh transporter
glukosa usus (SGLT1). Kemudian, kuersetin tunduk pada glukoronidasi/sulfasi dan O-metilasi dalam sel epitel dan hati melalui enzim fase II. Akan tetapi, pada administrasi peroral membuat beberapa kelemahan kuersetin menghambat penggunaannya dalam bidang terapeutik dan farmasi, seperti penyerapan buruk di saluran pencernaan, kelarutan air yang rendah, ketidakstabilan kimiawi, dan waktu paruh biologis yang pendek.[25] Oleh karena itu, formulasi nano PLGA sangat dianjurkan untuk meningkatkan bioavailabilitas kuersetin sehingga menutup kekurangan yang dimiliki kuersetin.
Administrasi oral PLGA nanopartikel dilaporkan dapat meningkatkan serapan nanopartikel oleh usus halus oleh patch sel M Peyer jika dibandingkan dengan enterosit normal, serta mencegah metabolisme obat sehingga meningkatkan bioavailabilitas obat.[26] Hal ini juga memungkinkan nanopartikel untuk bersirkulasi dalam durasi yang lama dalam aliran darah, diikuti dengan akumulasi pasif dalam jaringan tumor, memungkinkan nanopartikel keluar dari daerah retikuloendotelial sehingga mengurangi pemrosesannya di situs hati. Sirkulasi nanopartikel yang berkelanjutan ini dapat meningkatkan kemungkinan mencapai jaringan tumor setelah pemberian sistemik.[27]
Mekanisme Kerja Kuersetin Terenkapsulasi PLGA sebagai Terapi Penatalaksanaan Kanker Payudara
Mekanisme Kerja Kuersetin Terenkapsulasi PLGA dalam Meningkatkan Apoptosis Sel Kanker Payudara
Kuersetin diketahui dapat menekan proses apoptosis pada sel kanker dalam beberapa mekanisme (gambar 2). Sel tumor dapat memiliki resistensi terhadap apoptosis sebagai akibat dari ekspresi Bcl-2, protein anti-apoptosis, atau dengan down-regulation dan mutasi Bax, protein proapoptosis. Ekspresi protein Bcl-2 dan mutasi protein Bax diatur oleh gen penekan tumor, yaitu p53. Kuersetin dapat menginduksi apoptosis di jalur ekstrinsik, intrinsik, dan jalur umum dengan meningkatkan aktivator, menekan inhibitor dan regulator, serta meningkatkan mRNA ligan yang terikat pada reseptor apoptosis. Namun, beberapa di antaranya, termasuk sitokrom c, dalam beberapa artikel dan dalam sel kanker yang berbeda, saling bertentangan satu sama lain.[28]
Kuersetin dapat mengurangi ekspresi mitokondria sitokrom c, prokaspase-7, protein antiapoptosis Bcl-2, potensi membran mitokondria, dan meningkatkan ekspresi protein BAX dalam sel MCF-7.[29] Bax lalu melepaskan sitokrom C dari mitokondria ke sitoplasma diikuti oleh kaspase-3, efektor apoptosis, dan aktivasi. Selain aktivitas caspase-3 yang meningkat melalui sitokrom C, kuersetin secara langsung juga memodulasi ekspresi caspase-3. Efek ini menstimulasikan jalur pensinyalan nekroptosis sehingga dapat menginduksi apoptosis pada sel, lalu menekan pertumbuhan sel MCF-7.[30] Selain itu, pada sel BT-474, kuersetin menginduksi apoptosis melalui jalur ekstrinsik melalui peningkatan kaspase-8. Efek ini bahkan dapat berlangsung dengan adanya inhibitor protein pada jalur ekstrinsik karena kuersetin juga dapat menginhibisi C-Flip yang berperan dalam inhibisi protein pada jalur ekstrinsik.[31] Penelitian lain juga telah menunjukkan bahwa kuersetin melalui pensinyalan Fasl, P53, P21, dan GADD45 terlibat dalam penghentian siklus sel dan menginduksi aktivitas Foxo3a yang merupakan anggota keluarga
faktor transkripsi Forkhead boxo (FOXOs) yang terlibat dalam aktivitas penekan tumor dengan penurunan proliferasi sel dan tumorigenesis pada sel kanker payudara ER-positif dalam sel MDAMB-231.[32]
Mekanisme Kerja Kuersetin Terenkapsulasi PLGA dalam Siklus Sel Kanker Payudara
Proliferasi sel dikendalikan oleh mekanisme siklus sel dan checkpoints. Dalam proliferasi sel, cyclin dependent kinases (CDK) diaktifkan dalam kompleks dengan siklin tertentu yang kemudian membantu sel dalam transisi antara fase berurutan dari siklus sel dengan menginduksi fosforilasi. Ekspresi yang menyimpang atau perubahan aktivitas kompleks ini menyebabkan sel keluar dari kontrol siklus sel dan menyebabkan transformasi yang ganas. Oleh karena itu, keefektifan perlakuan pada kanker ditentukan oleh pengaruh faktor-faktor yang
berkontribusi pada regulasi siklus sel. Sejalan dengan gagasan ini, beberapa studi menunjukkan efek kuersetin pada penghentian siklus sel dan ekspresi regulator pada siklus sel. Kuersetin dalam sel MCF-7 menyebabkan apoptosis dan mengurangi viabilitas dan proliferasi sel. Oleh karena itu, perubahan ini menunjukkan adanya gangguan pada proses siklus sel. Kuersetin menginduksi penghentian siklus sel pada fase G1. Kuersetin mempengaruhi signaling protein yang terlibat dalam ekspresi gen dan protein pengatur siklus sel. Dalam hal ini, kuersetin meningkatkan apoptosis dan penangkapan siklus sel dengan meningkatkan aktivitas protein pensinyalan Foxo3a dan protein hulu (JNK) yang terlibat dalam apoptosis dan pengatur siklus sel. Selain efek pada pensinyalan protein, kuersetin meningkatkan aktivitas protein pengatur siklus sel P53, P21, dan GADD45 pada sel kanker payudara BC (gambar 3).[32,33]
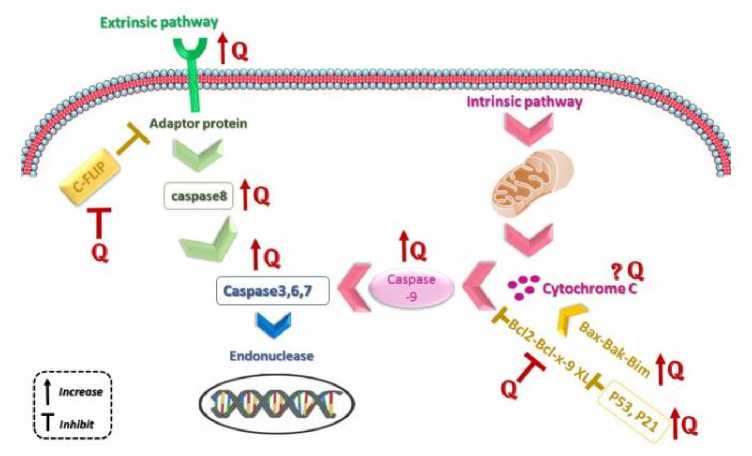
Gambar 2. Mekanisme Kuersetin dalam Menginduksi Apoptosis Sel Kanker.[28]
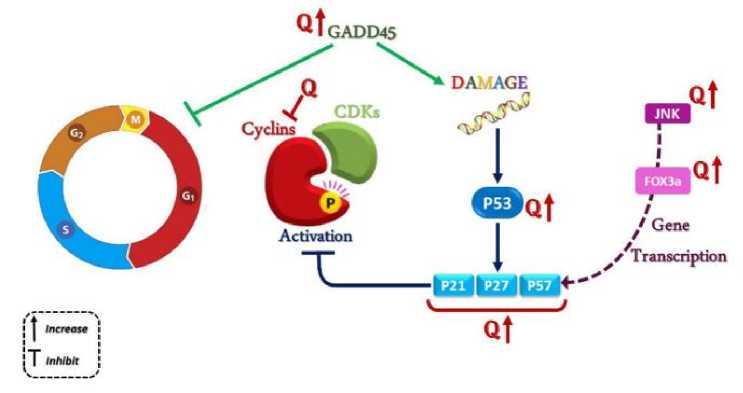
Gambar 3. Pengaruh Kuersetin terhadap Siklus Sel.[28]
Efek Klinis dari Kuersetin Terenkapsulasi PLGA sebagai Terapi Penatalaksanaan Kanker Payudara
Efek kuersetin pada berbagai kondisi in vitro dan in vivo telah ditunjukkan pada Tabel 1. Studi ini dan pekerjaan kami saat ini menunjukkan bahwa peningkatan aksi PLGAq dapat membantu dalam mengembangkan agen baru menggunakan PLGA dalam studi anti-kanker.
Efek Klinis Kuersetin Terenkapsulasi PLGA dalam Meningkatkan Apoptosis Sel Kanker Payudara
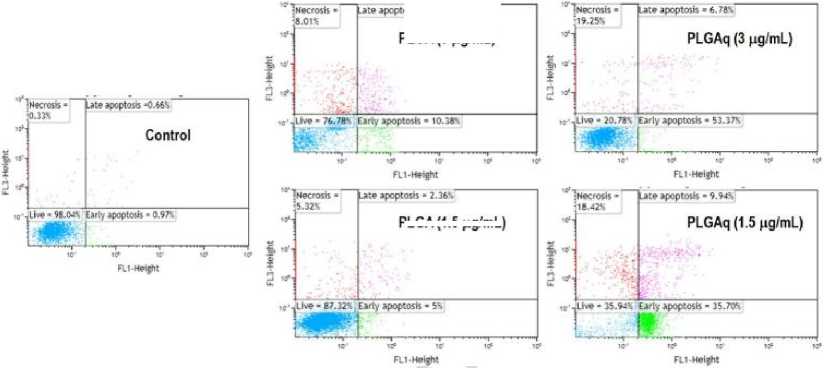
Apoptosis adalah mekanisme kematian sel terprogram yang terjadi pada organisme eukariotik. Proses ini telah meningkatkan penelitian dalam mendeteksi lesi subseluler pada tingkat sel tunggal. Selama apoptosis awal, terjadi peluruhan membran sel dan fosfatidil serin yang keluar dari sisi dalam membran plasma ke selebaran membran luar yang kemudian terpapar pada annexin V terlarut rekombinan berlabel fluorochrome yang merupakan alat untuk mendeteksi dan mengukur sel apoptosis awal dengan flow cytometry.[13]
Pada Gambar 4. menunjukkan pengaruh mikrosfer PLGA dan PLGAq pada tingkat apoptosis dalam sel MCF-7 di mana sel kanker tanpa PLGA dianggap sebagai kontrol. PLGA diuji dalam pengujian dalam dua konsentrasi berbeda (1,5 µg dan 3,0 µg). Jumlah apoptosis awal dan akhir hanya 5% dan 2,36% pada konsentrasi 1,5 µg dan pada konsentrasi 3,0 µg ditemukan 10,38% dan 4,83% pada mikrosfer PLGA. Dalam kasus PLGAq pada
konsentrasi 1,5 µg, 35,70% dan 9,94% sel apoptosis (awal, akhir) diamati. Namun, ketika konsentrasi ditingkatkan menjadi 3,0 µg apoptosisnya (dini, terlambat) ditemukan menjadi 53,37% dan 6,78%. Populasi sel nekrotik juga diamati dengan peningkatan konsentrasi PLGAq dan sel hidup menurun secara signifikan setelah pengobatan. Sehingga disimpulkan bahwa PLGA pada berbagai konsentrasi (1,5 µg dan 3,0 µg) tidak menunjukkan apoptosis yang signifikan tetapi PLGAq menunjukkan peningkatan aktivitas apoptosis dengan meningkatkan konsentrasi obat dari 1,5 µg menjadi 3,0 µg. Aktivitas PLGAq dapat disebabkan oleh penghambatan perkembangan siklus sel sebagai kuersetin sebagai penghambat yang sangat baik dari siklus sel dan dengan demikian menyebabkan kematian sel.[13]
Diketahui bahwa kuersetin menginduksi apoptosis dengan mengaktifkan caspase-3 dan mengatur jalur sel B limfoma-2 (Bcl-2) dan cyclooxygenase-2.[34] Hasil ini menunjukkan bahwa induksi apoptosis oleh PLGAq menegaskan efek antitumor langsungnya pada sel kanker payudara. Studi menunjukkan bahwa viabilitas sel kanker menurun ketika diobati dengan nanopartikel dalam konsentrasi yang berbeda dan berbagai tahap apoptosis juga diamati.[35,36] Demikian pula, konsentrasi rendah formulasi PLGA kurkumin jauh lebih efektif daripada kurkumin asli dan menunjukkan peningkatan aktivitas anti-kanker dengan memulai apoptosis pada jalur kanker usus besar manusia.[37,38
PLGA(3μg∕mL)
4.βn
PLGA 1.5 μg⅛
Gambar 4. Pengaruh PLGAq terhadap Induksi Apoptosis pada Sel MCF-7 menggunakan Metode Pewarnaan
Ganda Annexin V-FITC dan PI.[13]
Efek Klinis Sitotoksisitas Kuersetin Terenkapsulasi PLGA pada Sel Kanker Payudara
Mikrosfer PLGAq diuji sitotoksisitasnya terhadap garis sel THP-1 dan dari hasil tersebut, kami dapat menilai bahwa PLGAq tidak mempengaruhi sel normal (Gambar 5a).[13] Selanjutnya, PLGA dan PLGAq diuji aktivitas anti-kankernya terhadap garis MCF-7 (Gambar 5b).[13] Diketahui bahwa PLGA memiliki aktivitas anti-kanker yang sangat sedikit atau dapat diabaikan dibandingkan dengan PLGAq yang menunjukkan aktivitas anti-kanker sangat baik dengan menurunkan viabilitas sel hingga 40% dalam kisaran konsentrasi 0-2 µg/mL. Nilai konsentrasi
hambat (IC 50) ditemukan pada konsentrasi 3,648 µg. Jadi dengan membandingkan hal-hal di atas, sitotoksisitas PLGA dalam garis sel normal dan sitotoksisitas PLGAq dalam garis sel kanker pada kisaran konsentrasi 1,5 µg dan 3,0 µg ditemukan optimal untuk aktivitas anti-kanker. Studi mengungkapkan bahwa uji viabilitas sel dalam garis sel pankreas diperlakukan dengan berbagai konsentrasi kurkumin bebas dan nanokurkumin.[13] Diketahui dengan baik bahwa kuersetin meningkatkan aktivitas anti-kanker dari protein p53 trichostatin A.[39] Demikian pula, sebuah studi yang dilakukan pada formulasi PLGA kurkumin nano pada
garis sel kanker payudara MCF 7 menunjukkan toksisitas tinggi dari partikel ke sel kanker.[40] Penelitian lain juga menunjukkan bahwa proliferasi
sel telah menurun secara signifikan dalam formulasi PLGA-kurkumin ketika terkena sel kanker usus besar
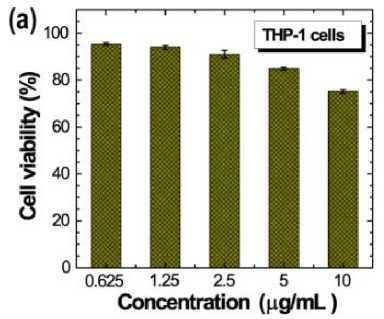
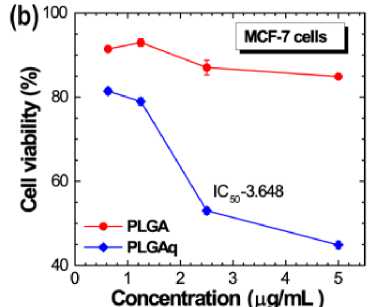
Gambar 5. (a) Uji Sitotoksisitas dengan menggunakan Sel THP-1 dan (b) Uji Sitotoksisitas PLGA dan PLGAq pada Jalur Sel MCF-7.[13]
Tabel 1. Efek Kuersetin pada Sel Kanker Payudara.[13,24,38,41]
|
Peneliti (Tahun) |
Jenis Target Temuan Ref Penelitian |
|
Karthick et al (2019) |
In vitro MCF-7 PLGA kuersetin meningkatkan 13 aktivitas apoptosis (dini, terlambat) secara signifikan sebesar 53,37% dan 6,78%. Viabilitas sel kanker menurun hingga 40% dalam kisaran konsentrasi 0-2 µg/mL |
|
Halder et al (2018) |
In vitro MDA-MB-231 Penurunan viabilitas sel sebesar 24 50% pada dosis terendah 4 μg/ml. Peningkatan sub-G1 dan penurunan G2 / M |
|
Li et al (2018) |
In vivo BALB/c nu-nu Mengurangi potensi metastasis 38 mice dan tumorigenesis dengan mempengaruhi jalur pensinyalan AKT/PI3K/mTOR |
|
Jia et al (2018) |
In vivo Tikus betina Menghambat pertumbuhan tumor 41 BALB/c node Menekan PKM2 dan pAkt Meningkatkan penanda otomatis Beclin-1 |
SIMPULAN
Kanker payudara memiliki prevalensi dan angka mortalitas yang tinggi di seluruh dunia. Oleh karena itu, diperlukan modalitas alternatif yang dapat secara efektif mengobat kanker tersebut. Kuersetin adalah zat flavonoid yang memiliki sifat anti-kanker dengan menginduksi apoptosis, menghambat pertumbuhan kanker, dan mengurangi efek samping dari kemoterapi. Namun, kuersetin memiliki bioavailabilitas yang rendah sehingga harus dibuat dalam bentuk nanopartikel dan dienkapsulasi dengan PLGA. PLGA sendiri sudah terbukti dapat meningkatkan efek perlambatan pertumbuhan tumor, meningkatkan penyerapan seluler obat, dan peningkatan regresi tumor dengan efek samping sistemik yang berkurang. Modalitas nanopartikel kuersetin dienkapsulasi PLGA dikonstruksi dengan proses emulsi oil-in-water dan teknik difusi pelarut emulsi, lalu diadministrasikan secara oral. Berdasarkan penelitian in vitro, modalitas ini dapat menginduksi apoptosis, mengurangi viabilitas sel, dan mengurangi proliferasi sel kanker.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk penyesuaian modalitas kuersetin terenkapsulasi PLGA, seperti pemilihan dosis kombinasi yang tepat, lama terapi, serta efek klinis lebih lanjut sebagai terapi kanker payudara agar menjadi lebih aplikatif. Perlu dilakukan penyempurnaan terkait evaluasi klinis efektivitas kombinasi dan metode konstruksi PLGA kuersetin, sehingga dapat menghasilkan agen terapi yang memenuhi kriteria ideal dengan efek klinis yang lebih bermakna, serta penelitian terkait efek terhadap interaksi obat dengan PLGAq dapat membantu mengurangi efek samping yang tidak diinginkan.
DAFTAR PUSTAKA
-
1. Akram M, Iqbal M, Daniyal M, Khan AU.
Awareness and current knowledge of breast cancer. Vol. 50, Biological Research. BioMed Central Ltd.; 2017. Available from:
https://doi.org/10.1186/s40659-017-0140-9
-
2. Harbeck N, Gnant M. Breast cancer. Vol. 389, The Lancet. Lancet Publishing Group; 2017. p. 1134–50. Available from:
https://doi.org/10.1016/S0140-6736(16)31891-8
-
3. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin [Internet]. 2018 Nov 1 [cited 2020 Dec 31];68(6):394–424. Available from: https://doi.org/10.3322/caac.21492
-
4. International Agency for Research on Cancer. Breast - Global Cancer Observatory [Internet]. World Health Organization. 2020 [cited 2020 Dec 31]. p. 1–2. Available from:
https://gco.iarc.fr/today/data/factsheets/cancers/ 20-Breast-fact-sheet.pdf
-
5. Zheng SY, Li Y, Jiang D, Zhao J, Ge JF. Anticancer effect and apoptosis induction by quercetin in the human lung cancer cell line A-549. Mol Med Rep [Internet]. 2012 Mar [cited 2021 Jan 1];5(3):822–6. Available from: https://pubmed.ncbi.nlm.nih.gov/22200874/
-
6. Vidya Priyadarsini R, Senthil Murugan R, Maitreyi S, Ramalingam K, Karunagaran D, Nagini S. The flavonoid quercetin induces cell cycle arrest and mitochondria-mediated apoptosis in human cervical cancer (HeLa) cells through p53 induction and NF-κB inhibition. Eur J Pharmacol [Internet]. 2010 Dec 15 [cited 2021 Jan 1];649(1–3):84–91. Available from: https://pubmed.ncbi.nlm.nih.gov/20858478/
-
7. Staedler D, Idrizi E, Kenzaoui BH, Juillerat-Jeanneret L. Drug combinations with quercetin: Doxorubicin plus quercetin in human breast cancer cells. Cancer Chemother Pharmacol [Internet]. 2011 Nov [cited 2021 Jan 1];68(5):1161–72. Available from:
https://pubmed.ncbi.nlm.nih.gov/21400027/
-
8. Reinboth M, Wolffram S, Abraham G, Ungemach FR, Cermak R. Oral bioavailability of quercetin from different quercetin glycosides in dogs. Br J Nutr [Internet]. 2010 Jul [cited 2021 Jan
1];104(2):198–203. Available from:
https://pubmed.ncbi.nlm.nih.gov/20230651/
-
9. Almeida AF, Borge GIA, Piskula M, Tudose A, Tudoreanu L, Valentová K, et al. Bioavailability of Quercetin in Humans with a Focus on Interindividual Variation. Compr Rev Food Sci Food Saf [Internet]. 2018 May 1 [cited 2021 Jan 1];17(3):714–31. Available from:
https://onlinelibrary.wiley.com/doi/full/10.1111/1 541-4337.12342
-
10. Matoba T, Egashira K. Nanoparticle-mediated drug delivery system for cardiovascular disease. Vol. 55, International Heart Journal. International Heart Journal Association; 2014. p. 281–6. Available from: https://doi.org/10.1536/ihj.14-150
-
11. Gagliardi M, Bertero A, Bifone A. Molecularly Imprinted Biodegradable Nanoparticles. Sci Rep [Internet]. 2017 Jan 10 [cited 2021 Jan 3];7(1):1– 9. Available from:
www.nature.com/scientificreports
-
12. Roubalová L, Purchartová K, Papoušková B, Vacek J, Kəen V, Ulrichová J, et al. Sulfation modulates the cell uptake, antiradical activity and biological effects of flavonoids in vitro: An examination of quercetin, isoquercitrin and
taxifolin. Bioorganic Med Chem. 2015 Sep
1;23(17):5402–9. Available from:
https://doi.org/10.1016/j.bmc.2015.07.055
-
13. Karthick V, Panda S, Kumar VG, Kumar D, Shrestha LK, Ariga K, et al. Quercetin loaded PLGA microspheres induce apoptosis in breast cancer cells. Appl Surf Sci. 2019 Sep 1;487:211– 7. Available from:
https://doi.org/10.1016/j.apsusc.2019.05.047
-
14. Men K, Duan X, Wei Wei X, Ling Gou M, Juan Huang M, Juan Chen L, et al. Nanoparticle-Delivered Quercetin for Cancer Therapy. Anticancer agents in medicinal chemistry. 2014;14(6):826–832. Available from:
https://doi.org/10.2174/18715206146661405211 22932
-
15. Araújo KCF, Eula EM, Pazini F, Valadares MC, De Oliveira V. Bioconversion of quercetin and rutin and the cytotoxicity activities of the transformed products. Food Chem Toxicol. 2013 Jan 1;51(1):93–6. Available from:
https://doi.org/10.1016/j.fct.2012.09.015
-
16. Kawai Y. β-Glucuronidase activity and mitochondrial dysfunction: the sites where flavonoid glucuronides act as anti-inflammatory agents. J Clin Biochem Nutr [Internet]. 2014 [cited 2021 Jan 1];54(3):145–50. Available from: http://jlc.jst.go.jp/DN/JST.JSTAGE/jcbn/14-9?lang=en&from=CrossRef&type=abstract
-
17. Yeh SL, Lin YC, Lin YL, Li CC, Chuang CH. Comparing the metabolism of quercetin in rats, mice and gerbils. Eur J Nutr [Internet]. 2016 Feb 1 [cited 2021 Jan 1];55(1):413–22. Available from:
https://link.springer.com/article/10.1007/s00394-015-0862-9
-
18. Mir M, Ahmed N, Rehman A ur. Recent applications of PLGA based nanostructures in drug delivery. Vol. 159, Colloids and Surfaces B: Biointerfaces. Elsevier B.V.; 2017. p. 217–31. Available from:
https://doi.org/10.1016/j.colsurfb.2017.07.038
-
19. Alqahtani S, Simon L, Astete CE, Alayoubi A, Sylvester PW, Nazzal S, et al. Cellular uptake, antioxidant and antiproliferative activity of entrapped α-tocopherol and γ-tocotrienol in poly (lactic-co-glycolic) acid (PLGA) and chitosan covered PLGA nanoparticles (PLGA-Chi). J Colloid Interface Sci [Internet]. 2015 May 1 [cited 2021 Jan 3];445:243–51. Available from: https://pubmed.ncbi.nlm.nih.gov/25622049/
-
20. Trif M, Florian PE, Roseanu A, Moisei M, Craciunescu O, Astete CE, et al. Cytotoxicity and intracellular fate of PLGA and chitosan-coated PLGA nanoparticles in Madin-Darby bovine kidney (MDBK) and human colorectal adenocarcinoma (Colo 205) cells. J Biomed Mater Res - Part A [Internet]. 2015 Nov 1 [cited 2021 Jan 3];103(11):3599–611. Available from: https://pubmed.ncbi.nlm.nih.gov/25976509/
-
21. Navarro SM, Morgan TW, Astete CE, Stout RW, Coulon D, Mottram P, et al. Biodistribution and toxicity of orally administered poly (lactic-co-glycolic) acid nanoparticles to F344 rats for 21 days. Nanomedicine [Internet]. 2016 Jul 1 [cited 2021 Jan 3];11(13):1653–69. Available from: https://pubmed.ncbi.nlm.nih.gov/27347781/
-
22. Tulinska J, Kazimirova A, Kuricova M, Barancokova M, Liskova A, Neubauerova E, et al. Immunotoxicity and genotoxicity testing of PLGA-PEO nanoparticles in human blood cell
model. Nanotoxicology [Internet]. 2015 May 1 [cited 2021 Jan 3];9(S1):33–43. Available from: https://www.tandfonline.com/doi/abs/10.3109/17 435390.2013.816798
-
23. Ebrahimi E, Akbarzadeh A, Abbasi E, Khandaghi AA, Abasalizadeh F, Davaran S. Novel drug delivery system based on doxorubicin-encapsulated magnetic nanoparticles modified with PLGA-PEG 1000 copolymer. Artif Cells, Nanomedicine, Biotechnol [Internet]. 2016 Jan 2 [cited 2021 Jan 3];44(1):290–7. Available from: http://www.tandfonline.com/doi/full/10.3109/216 91401.2014.944646
-
24. Halder A, Mukherjee P, Ghosh S, Mandal S, Chatterji U, Mukherjee A. Smart PLGA nanoparticles loaded with Quercetin: Cellular uptake and in-vitro anticancer study. In: Materials Today: Proceedings. Elsevier Ltd; 2018. p.
9698–705. Available from:
https://doi.org/10.1016/j.matpr.2017.10.156
-
25. Ezzati M, Yousefi B, Velaei K, Safa A. A review on anti-cancer properties of Quercetin in breast cancer. Vol. 248, Life Sciences. Elsevier Inc.; 2020. Available from:
https://doi.org/10.1016/j.lfs.2020.117463
-
26. Deepika MS, Thangam R, Sheena TS, Vimala RTV, Sivasubramanian S, Jeganathan K, et al. Dual drug loaded PLGA nanospheres for synergistic efficacy in breast cancer therapy. Mater Sci Eng C. 2019 Oct 1;103. Available from: https://doi.org/10.1016/j.msec.2019.05.001
-
27. Vivek R, Thangam R, Nipunbabu V, Rejeeth C, Sivasubramanian S, Gunasekaran P, et al. Multifunctional HER2-Antibody conjugated polymeric nanocarrier-based drug delivery system for multi-drug-resistant breast cancer therapy. In: ACS Applied Materials and
Interfaces [Internet]. American Chemical Society; 2014 [cited 2021 Jan 3]. p. 6469–80. Available from:
https://pubmed.ncbi.nlm.nih.gov/24780315/
-
28. Kasiri N, Rahmati M, Ahmadi L, Eskandari N, Motedayyen H. Therapeutic potential of quercetin on human breast cancer in different dimensions. Vol. 28, Inflammopharmacology. Springer; 2020. p. 39–62.
-
29. Dhumale SS, Waghela BN, Pathak C. Quercetin protects necrotic insult and promotes apoptosis by attenuating the expression of RAGE and its ligand HMGB1 in human breast adenocarcinoma cells. IUBMB Life [Internet]. 2015 May 1 [cited 2021 Jan 3];67(5):361–73. Available from: https://pubmed.ncbi.nlm.nih.gov/25983116/
-
30. Khorsandi L, Orazizadeh M, Niazvand F,
Abbaspour MR, Mansouri E, Khodadadi A.
Quercetin induces apoptosis and necroptosis in MCF-7 breast cancer cells. Bratislava Med J [Internet]. 2017 [cited 2021 Jan 3];118(2):123–8. Available from:
https://pubmed.ncbi.nlm.nih.gov/28814095/
-
31. Seo HS, Ku JM, Choi HS, Choi YK, Woo JK, Kim M, et al. Quercetin induces caspase-dependent extrinsic apoptosis through inhibition of signal transducer and activator of transcription 3 signaling in HER2-overexpressing BT-474 breast cancer cells. Oncol Rep [Internet]. 2016 Jul 1 [cited 2021 Jan 3];36(1):31–42. Available from:
http://www.spandidos-
publications.com/10.3892/or.2016.4786/abstract
-
32. Nguyen LT, Lee YH, Sharma AR, Park JB, Jagga S, Sharma G, et al. Quercetin induces apoptosis and cell cycle arrest in triple-negative breast cancer cells through modulation of Foxo3a activity. Korean J Physiol Pharmacol [Internet]. 2017 Mar 1 [cited 2021 Jan 3];21(2):205–13. Available from:
https://pubmed.ncbi.nlm.nih.gov/28280414/
-
33. Ranganathan S, Halagowder D,
Sivasithambaram ND. Quercetin Suppresses Twist to Induce Apoptosis in MCF-7 Breast Cancer Cells. Singh PK, editor. PLoS One
[Internet]. 2015 Oct 22 [cited 2021 Jan
3];10(10):e0141370. Available from:
https://dx.plos.org/10.1371/journal.pone.014137 0
-
34. Harada R. Simple, yet Efficient Conformational Sampling Methods for Reproducing/Predicting Biologically Rare Events of Proteins. Bull Chem Soc Jpn [Internet]. 2018 Sep 15 [cited 2021 Jan 3];91(9):1436–50. Available from:
http://www.journal.csj.jp/doi/10.1246/bcsj.20180 170
-
35. Vasanth K, Ilango K, MohanKumar R, Agrawal A, Dubey GP. Anticancer activity of Moringa oleifera mediated silver nanoparticles on human cervical carcinoma cells by apoptosis induction. Colloids Surfaces B Biointerfaces [Internet]. 2014 May 1 [cited 2021 Jan 3];117:354–9. Available from: https://pubmed.ncbi.nlm.nih.gov/24681047/
-
36. He H, Xu B. Instructed-Assembly (iA): A molecular process for controlling cell fate. Bull Chem Soc Jpn [Internet]. 2018 [cited 2021 Jan 3];91(6):900–6. Available from:
https://pubmed.ncbi.nlm.nih.gov/30559507/
-
37. Waghela BN, Sharma A, Dhumale S, Pandey SM, Pathak C. Curcumin Conjugated with PLGA Potentiates Sustainability, Anti-Proliferative Activity and Apoptosis in Human Colon Carcinoma Cells. Anto RJ, editor. PLoS One
[Internet]. 2015 Feb 18 [cited 2021 Jan
3];10(2):e0117526. Available from:
https://dx.plos.org/10.1371/journal.pone.011752 6
-
38. Li S, Yuan S, Zhao Q, Wang B, Wang X, Li K. Quercetin enhances chemotherapeutic effect of doxorubicin against human breast cancer cells while reducing toxic side effects of it. Biomed Pharmacother [Internet]. 2018 Apr 1 [cited 2021 Jan 3];100:441–7. Available from:
https://pubmed.ncbi.nlm.nih.gov/29475141/
-
39. Chan ST, Yang NC, Huang CS, Liao JW, Yeh SL. Quercetin Enhances the Antitumor Activity of Trichostatin A through Upregulation of p53 Protein Expression In Vitro and In Vivo. PLoS One [Internet]. 2013 Jan 16 [cited 2021 Jan 3];8(1). Available from:
https://pubmed.ncbi.nlm.nih.gov/23342112/
-
40. Verderio P, Bonetti P, Colombo M, Pandolfi L, Prosperi D. Intracellular drug release from curcumin-loaded PLGA nanoparticles induces G2/M block in breast cancer cells. Biomacromolecules [Internet]. 2013 Mar 11 [cited 2021 Jan 3];14(3):672–82. Available from: https://pubmed.ncbi.nlm.nih.gov/23350530/
42
Discussion and feedback