POTENSI QUERCETIN DALAM EKSTRAK DAUN PSIDIUM GUAJAVA DAN PAPAIN DALAM EKSTRAK DAUN CARICA PAPAYA LINN TERHADAP TERAPI DEMAM BERDARAH DENGUE
on
ARTIKEL TINJAUAN PUSTAKA

ESSENTIAL:Essence of Scientific Medical Journal (2020), Volume 17, Number 2:22-28
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI QUERCETIN DALAM EKSTRAK DAUN PSIDIUM GUAJAVA DAN PAPAIN DALAM EKSTRAK DAUN CARICA PAPAYA LINN SEBAGAI TERAPI DEMAM BERDARAH DENGUE
Kadek Mercu Narapati Pamungkas,1 Putu Itta Sandi Lesmana Dewi,1 Erick Kusuma Tandiono,1
Abstrak
Latar belakang: Menurut WHO pada tahun 2019, Demam Berdarah Dengue (DBD) mengenai 390 juta jiwa di seluruh dunia per tahun. Penyakit ini disebabkan oleh virus dengue yang ditransmisikan oleh nyamuk Aedes aegypti. Manifestasi klinis yang menjadi perhatian dalam penyakit ini adalah dehidrasi dan trombositopenia. Modalitas terapi yang ada saat ini hanya terapi simtomatik dan substitusi cairan. Oleh karena itulah diperlukan terapi yang dapat mengatasi keterbatasan ini.
Tujuan: Tujuan dibuatnya literature review ini yaitu untuk menemukan modalitas terapi yang dapat mengatasi virus dengue dan trombositopenia.
Metode: Studi ini menggunakan metode tinjauan pustaka dengan mengumpulkan sumber dari literatur ilmiah yang valid seperti PubMed dan Google Scholar.
Hasil: Quercetin memiliki aktivitas antivirus dengan mereduksi persentase foci, pengkopian RNA, dan
menghambat RNA polimerase yang penting dalam replikasi virus dengue. Selain itu, quercetin dapat menghambat enzim NS2B-NS3 protease, domain helikase, dan enzim ATPase. Papain dalam daun Carica papaya L. dapat menginduksi sitokin trombositik seperti IL-6 dan sekresi trombopoietin, sehingga hitung jumlah trombosit meningkat. Papain mampu meningkatkan ekspersi ALOX-12 yang berhubungan dengan peningkatan produksi megakaryosit dan trombosit. Quercetin diekstraksi dan difraksi dari daun Psidium guajava, kemudian hasil campuran diinkubasi. Papain diisolasi dari ekstrak daun Carica papaya L. dengan metode ultrasonication extraction. Kombinasi quercetin dan papain diadministrasikan secara peroral.
Kesimpulan: Kombinasi quercetin dan papain memiliki potensi sebagai antivirus terhadap virus dengue dan memperbaiki kondisi trombositopenia. Penulis menyarankan untuk diadakan penelitan lebih lanjut terkait dosis dan efek samping yang dapat ditimbulkan.
Kata kunci: virus dengue, quercetin, papain, antivirus, trombosit
Abstract
Background: According to WHO in 2019, Dengue Hemorrhagic Fever (DHF) affects 390 million people worldwide annually. This disease is caused by dengue virus transmitted by Aedes aegypti mosquito. Concerning clinical manifestations in this disease are dehydration and thrombocytopenia. Current therapeutic modalities only symptomatic therapy and fluid substitution. Therefore, a therapy that can overcome this limitation is required.
Objective: The purpose of this literature review is to find therapeutic modalities that can overcome the dengue virus and thrombocytopenia.
Methods: This study uses the literature review method by gathering sources from valid scientific literature such as PubMed and Google Scholar.
Results: Quercetin has antiviral activity by reducing the percentage of foci, RNA copying, and inhibiting RNA polymerase which is important in dengue virus replication. Also, quercetin can inhibit NS2B-NS3 protease, helicase domain, and ATPase enzyme. Papain in Carica papaya L. can induce thrombocytic cytokines such as IL-6 and thrombopoietin secretion, so the thrombocyte count increases. Papain can increase the expression of ALOX 12 which is associated with increased production of megakaryocytes and thrombocytes. Quercetin is extracted and diffracted from Psidium guajava, then the mixed product is incubated. Papain is isolated from Carica papaya L. extract by ultrasonication extraction method. The combination of quercetin and papain is administered orally. Conclusion : Combination of quercetin and papain has potential as an antiviral against dengue virus and correct thrombocytopenia. The author recommends further research related to dose and side effects that can be caused.
Keywords : dengue virus, quercetin, papain, antivirus, thrombocyte
PENDAHULUAN
Demam Berdarah Dengue (DBD) merupakan
1Program Studi Sarjana Kedokteran dan Profesi Dokter, Fakultas Kedokteran, Universitas Udayana, Bali
salah satu penyakit yang sering terjadi di Indonesia. World Health Organization (WHO) melaporkan bahwa, belakangan ini kasus dengue ditemukan hampir di seluruh belahan dunia dengan gejala yang parah paling sering ditemukan di wilayah Asia dan Amerika. Penyakit ini diperkirakan menginfeksi sekitar 390 juta jiwa pertahun dan menunjukkan gejala klinis sekitar 96 juta jiwa pertahun di seluruh dunia.[1]
Di Indonesia, insiden dengue cenderung
mengalami peningkatan setiap tahunnya yang mencapai 35-40/100.000 penduduk pada tahun
2013. Pada tahun 2015, 1.229 penduduk Indonesia meninggal akibat dengue dan pada tahun 2016 jumlah penderita dengue mengalami peningkatan dengan Case Fatality Rate (CFR) tertinggi berada di daerah Maluku (6,0%), Gorontalo (6,1%) dan Papua Barat (4,6%).[2] Di Bali, wabah dengue yang cukup parah pernah terjadi pada tahun 2010 sebanyak 12.574 kasus dengan 35 kematian dan pada tahun 2015 sebanyak 10.704 kasus dengan 28 kematian. [3,4]
Demam berdarah dengue disebabkan oleh virus dengue yang merupakan RNA virus, genus Flavivirus famili Flaviviridae yang ditransmisikan melalui gigitan nyamuk Aedes.[2,5] Di antara spesies
Aedes yang ada, Aedes aegypti merupakan spesies yang paling banyak berperan dalam penyebaran dengue. Virus dengue memiliki empat serotype (DENV-1, DENV-2, DENV-3 dan DENV-4), adanya variasi serotype pada virus dengue memungkinkan terjadinya cross reaction oleh antibodi yang telah terbentuk setelah infeksi primer sehingga semakin parah pada infeksi sekunder.[5] Dalam perjalanan penyakit ini, berbagai manifestasi klinis yang berisiko pada tingkat mortalitas pasien menjadi perhatian yang serius, seperti dehidrasi dan trombositopenia yang mengakibatkan pasien dapat jatuh pada kondisi syok.
Berdasarkan Handbook for Clinical Management of Dengue oleh WHO, algoritma penatalaksanaan dengue sampai saat ini masih menangani gejala secara simtomatik, dengan pemberian substitusi cairan sebagai hal utama dalam mencegah dehidrasi dan pemberian antipiretik untuk menurunkan demam.[6] Sehingga modalitas terapi untuk menangani virus dengue dan trombositopenia sampai saat ini belum tersedia. Berkaitan dengan hal itu, maka telah banyak penelitian dilakukan untuk menemukan herbal sebagai alternatif terapi dengue untuk mengatasi virus dengue dan trombositopenia. Dari beberapa penelitian yang telah dilakukan sebelumnya, papain dalam daun Carica papaya L. dan quercetin dalam daun Psidium guajava diketahui memiliki potensi dalam terapi dengue.[7,8]
Berbagai penelitian sebelumnya juga menyatakan bahwa, quercetin dalam ekstrak daun Psidium guajava memiliki efek antivirus yang mampu menekan replikasi dari virus dengue di dalam sel inang.[9] Disamping itu, berkaitan dengan infeksi dengue virus yang mengakibatkan trombositopenia, papain yang terkandung dalam ekstrak daun Carica papaya L. memiliki efek yang mampu meningkatkan jumlah trombosit pada pasien demam berdarah dengue.[10] Keseluruhan mekanisme ini akan membantu proses penyembuhan pasien demam berdarah dengue dan menghambat progresivitas virus dengue di dalam tubuh pasien.
Melihat potensi quercetin dan papain sebagai terobosan mutakhir dalam penanganan demam berdarah dengue, maka penulis terdorong untuk mengkaji lebih dalam mengenai “Potensi Quercetin dalam Ekstrak Daun Psidium guajava dan Papain dalam Ekstrak Daun Carica papaya Linn terhadap Terapi Demam Berdarah Dengue”.
PEMBAHASAN
Patogenesis Demam Berdarah Dengue
Demam berdarah dengue disebabkan oleh adanya infeksi Dengue Virus (DENV) yang memiliki 4 serotype yaitu (DENV-1, DENV-2, DENV-3, DENV-4) yang ditransmisikan melalui nyamuk Aedes sp. Diantara keempat serotype DENV, DENV-2 dan DENV-3 merupakan yang paling sering menyebabkan severe dengue sedangkan DENV-1 dan DENV-4 memiliki gejala yang lebih ringan.[11] Adanya respon imun adaptif tubuh memegang peranan dalam imunopatogenesis dari dengue. Respon tersebut menyebabkan second infection dengan heterotype DENV cenderung menjadi severe dengue dibandingkan primary infection.[12,13]
Primary infection atau infeksi pertama pada dengue terjadi melalui ikatan yang terjadi antara
serotype DENV menuju cross binding non neutralising antibody yang kemudian memfasilitasi masuknya virus ke sel mononuklear. Hal ini memicu aktivasi sel T memori menghasilkan DENV spesifik memori CD4+CD8- dan CD4-CD8+.[14] Aktivasi dari sel T menyebabkan peningkatan level limfokin dalam serum pasien DHF/DF seperti IL-2, IL-6, TNF-α IFN-γ, IL-8, IL-10, IL-12. Sitokin dan mediator kimia tersebut menyebabkan kerusakan pembuluh darah kapiler yang berlanjut pada malfungsi sel endotel vaskular, kerusakan ini diperparah dengan rendahnya kadar protein C, S dan anti-trombin pada sirkulasi sehingga menyebabkan plasma leakage.[14,15] Kerusakan pada trombosit akibat antibodi cross-reactive, anti-NS1, prM dan protein E virus yang menyerang trombosit, aktivasi faktor koagulasi oleh sitokin inflammatory, kerusakan sel endotel, dan aktivasi makrofag melalui Tissue Factor (TF) pathway,[16] merupakan beberapa mekanisme yang menjelaskan terjadinya trombositopenia pada dengue. Hal ini dapat meningkatkan risiko perdarahan dan memperparah plasma leakage pada demam berdarah dengue.[15]
Potensi Quercetin dalam Ekstrak Daun Psidium guajava
Ekstrak daun Psidium guajava mengandung senyawa flavonoid seperti quinic acid, caffeoyl glucose, quercetin, gallic acid, dan myricetin.[17] Menurut Anderson et al., menyatakan dalam 100 mg ekstrak daun Psidium guajava mengandung senyawa fenol seperti catechin, epigallocatechin, syringic acid, o-coumaric acid, dan resveratrol. Flavonoid quercetin dalam Psidium guajava hanya ditemukan pada daun dan kulitnya. Jumlah quercetin pada daunnya yaitu 56,17 ± 0,0058 μg/mg dan pada kulitnya yaitu 10,09 ± 0,012 μg/mg.[18]
Menurut penelitian Saptawati et al., ekstrak Psidium guajava memiliki efek viabilitas sel mencapai 88,7%, aktivitas antivirus terhadap DENV pada dosis 20 μg/mL mencapai 92,6% dan indek selektivitas >3. Konsentrasi sitotoksik median (CC50) Psidium guajava yang diukur pada Huh7it-1 yang tidak terinfeksi yaitu sebesar 153,18 μg/mL. Menurut penelitian Zandi et al., CC50 quercetin terhadap sel vero lebih tinggi daripada flavonoid lain seperti daidzein, naringin dan hesperetin yaitu mencapai 252,6 ± 0,17 μg/mL. Dengan tingginya konsentrasi sitotoksik median, quercetin akan memiliki aktivitas virus yang baik tanpa menyebabkan kerusakan sel [7].
Quercetin dapat menekan replikasi intraseluler dari virus dengue tipe 2 (DENV-2) mencapai 75,7% ± 1,57 pada konsentrasi 50 μg/mL.[19] Selain itu, quercetin juga dapat menghambat ATPase pada DENV-4.[9] Maka dari itu, quercetin berpotensi sebagai antivirus melalui berbagai mekanisme dalam menghambat virus dengue, terutama DENV-2 dan DENV-4.
Potensi Papain dalam Ekstrak Daun Pepaya (Carica papaya L.)
Daun Carica papaya L. telah terbukti mengandung banyak komponen aktif seperti papain, chymopapain, cystatin, tocopherol, ascorbic acid, flavonoids, cyanogenic-glucosides, dan glucosinolates serta diketahui juga mengandung cardiac glycosides, anthraquinones, carpaine, pseudocarpaine, dan komponen phenolic.[8] Ekstrak daun ini kaya akan papain, yang mampu
memperbaiki jumlah trombosit pada pasien demam berdarah dengue.[10]
Menurut Yogiraj et al., konsentrat high-dose dari ekstrak daun Carica papaya L. yang diberikan pada tikus trombositopenia secara signifikan meningkatkan trombosit sebanyak 76,5%, WBC 30,51%, dan RBC 9,08% bila dibandingkan dengan control.[20] Papain dapat menginduksi sintesis IL-6 yang menstimulasi ekspresi trombopoietin di hati, sehingga megakaryopoiesis atau trombopoiesis terjadi menyebabkan meningkatnya trombosit.[10] Penelitian lain menunjukkan adanya peningkatan ekspresi gen yang membantu produksi dan agregasi trombosit, yakni ALOX12 dan PTAFR.[21] Berdasarkan hal di atas, papain telah banyak dibuktikan potensinya dalam perbaikan jumlah trombosit sehingga menjadi modalitas yang menjanjikan dalam penanganan pasien demam berdarah dengue.
Mekanisme Kerja
Mekanisme Kerja Quercetin
Mekanisme kerja dari quercetin secara umum ada dua yaitu sebagai antivirus dengan menghambat replikasi virus dengue dan meningkatkan viabilitas dari sel yang terinfeksi.
Menurut Zandi et al., dalam penelitiannya secara in vitro pada sel yang tidak terinfeksi, quercetin mereduksi persentase foci (kluster virus terlokalisir) dan pengkopian RNA. Viral foci divisualsasi dengan menggunakan pengecatan berbahan peroksidase 4 hari pasca infeksi. [19] Quercetin dapatmenghambat enzim RNA polimerase yang penting dalam replikasi DENV. Sehingga, replikasi dari DENV-2 dapat dihambat melalui mekanisme tersebut. Penghambatan pada RNA polimerase dapat dibuktikan oleh Anusuya et al., dengan ditemukannya residu Trp795, Arg792, dan Glu351 yang penting dalam menjaga stabilitas kompleks polimerase tersebut.[22]
Quercetin juga dapat menghambat enzim NS2B-NS3 protease. NS2B-NS3 merupakan protein non-struktural yang berperan penting dalam replikasi DENV-2. Dengan terhambatnya NS2B-NS3 protease maka akan mengganggu proses pasca translasi yaitu pemotongan polipeptida dalam menghasilkan protein tunggal yang terpisah-pisah.[23,24] Dalam penelitian Anusuya et al., derivat quercetin dapat mengganggu turunan nukleotida dan template RNA dalam mengikat enzim polimerase. Hal tersebut terbukti dengan ditemukannya residu Thr413 yang terletak pada loop3 yang berperan penting dalam mengatur template ssRNA. [22]
Selain itu, quercetin memiliki efek inhibisi terhadap enzim ATPase. Inhibisi dari enzim ATPase mencapai 40-52%. Mekanisme dari inhibisi tersebut yaitu melalui peningkatan aktivitas hidrolisis ATP pada rekombinan NS2B18NS3 dan NS3 domain helikase dari DENV-2 dan DENV-4. Quercetin menghambat secara menyeluruh pada rekombinan NS2B18NS3 lebih kuat daripada NS3 domain helikase.[9] Menurut Ismail et al., flavonoid quercetin
menginhibisi protein E dari DENV. Protein E dari DENV berperan dalam sintesis protein yang membentuk kapsul virus. Sehingga dengan hal tersebut, quercetin memiliki aktivitas antivirus dengan menginhibisi fusi membran virus.[25]
Quercetin memiliki aktivitas dalam pembentukkan interaksi coulumb dengan residu Asn405, ikatan hidrogen dengan Trp795 dan interaksi kation-π dengan Lys401. Ikatan yang terbentuk berperan terutama dalam pembentukkan kompleks polymerase-lead yang stabil.[22] Inhibisi quercetin yaitu melalui inhibisi non-kompetitif, sehingga hal tersebut dapat menjelaskan penurunan afinitas dengan menghambat protease DENV-3 dan DENV-2 NS2B-NS3.[26] Menurut Anusuya et al., quercetin juga memiliki aktivitas antivirus terhadap protein target dengan menghambat enzim DENV RNA-dependent RNA-polymerase (RdRp) sehingga terganggunya katalis dari replikasi template RNA.[22]
Mekanisme kedua quercetin menurut Carrasco et al., yaitu dengan mereduksi stres oksidatif, disfungsi mitokondria dan kematian sel. Sehingga, dengan reduksi tersebut mampu meningkatkan viabilitas dari sel yang terinfeksi DENV.[27]
Mekanisme Kerja Papain
Mekanisme yang dimiliki papain dalam penyakit demam berdarah dengue adalah potensinya untuk menginduksi tersekresinya sitokin trombositik seperti IL-6. Menurut Aziz et al., sekresi ini dilakukan oleh haematopoietic stem cells dan mesenchymal stem cells seperti SHED dan akan secara langsung meningkatkan proliferasi, maturasi, dan diferensiasi HSC ataupun menstimulasi produksi trombosit dengan meningkatkan sekresi dari trombopoietin di hati sehingga hitung trombosit meningkat.[10] Selain itu, papain sebagai enzim proteolitik dapat melakukan degradasi pada enzim-enzim dari sel mast seperti protease, triptase, dan chymase yang dapat mengakibatkan plasma leakage.[28]
Pada pasien yang ikut serta dalam penelitian Subenthiran et al., ekstraksi RNA menunjukkan ekspresi gen Arachidonate 12-lipoxygenase atau ALOX12 dan Platelet-Activating Factor Receptor atau PTAFR. Dalam penelitian ini, pada akhir hari ketiga, terjadi peningkatan gen ALOX12 sebanyak 15 kali lipat dan diketahui gen ini berhubungan dengan peningkatan produksi megakaryosit yang diikuti pula dengan trombosit melalui jalur 12-Hydroxyeicosatetraenoic acid atau 12-HETE. ALOX12 diketahui adalah target dari faktor transkripsi RUNX1 yang mengatur ekspresi dari gen-gen haemopoietic-specific pada megakaryosit dan trombosit.[21,29] Namun, beberapa sumber tersebut tidak menyebutkan adanya hubungan langsung antara DENV dengan gen ALOX12 dan PTAFR. Mekanisme kerja papain dan quercetin pada proses patofisiologi demam berdarah dengue dapat dilihat pada (Gambar 1).
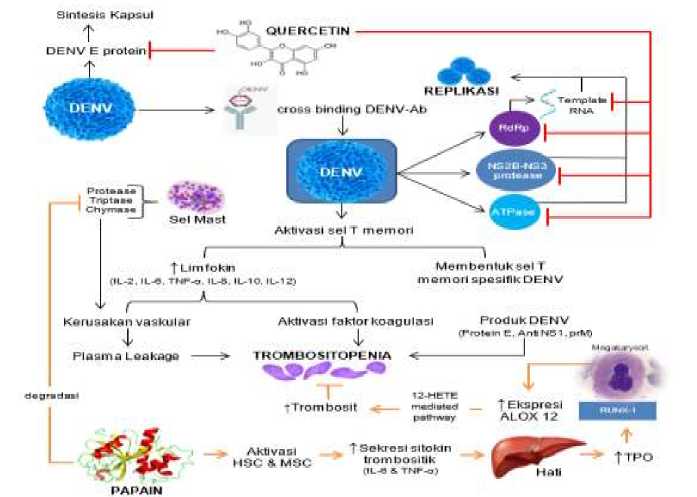
Gambar 1. Mekanisme Kerja Quercetin dan Papain [9,10, 21-29]
Efek in vivo dan in vitro
Efek Klinis Quercetin
Quercetin memiliki efek antivirus terhadap DENV. Quercetin dapat bekerja sebagai antivirus melalui beberapa cara yaitu dengan menghambat replikasi intraseluler, mereduksi ukuran foci terhadap sel yang terinfeksi DENV, menghambat aktivitas ATPase, dan menghambat domain helikase NS3.[7,9,19] Dalam penelitian Saptawati et al., ekstrak daun Psidium guajava dapat
menghambat replikasi DENV-2 dengan IC50 yaitu 7,2 ug/mL,[7] Pemberian 50 μg/mL quercetin menunjukkan reduksi foci mencapai 67% ± 1 jauh melebihi flavonoid lain (Gambar 2). Berdasarkan pemeriksaan Foci Forming Unit Reduction Assay (FFURA) quercetin dapat mereduksi foci. Hal tersebut dibuktikan dengan memudarnya foci dan lebih kecil setelah pemberian quercetin 50 μg/mL (Gambar 3).[19]
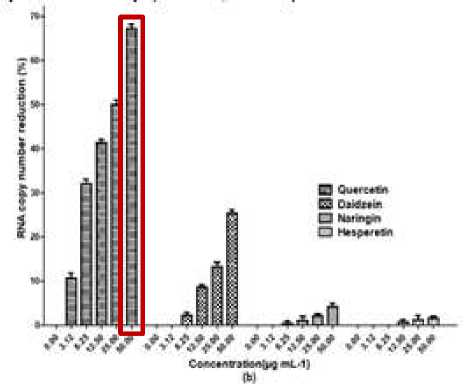
Gambar 2. Efek Antivirus Flavonoid Terhadap
Replikasi Intraseluler DENV-2.
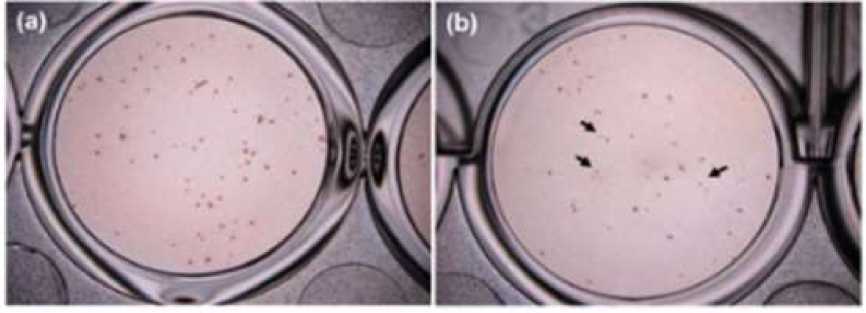
Gambar 3. Foci pada Sel yang Tidak Dipengaruhi Quercetin (a) foci pada sel setelah diberikan quercetin 50 μg/mL. (b) Tanda panah menunjukkan foci yang memudar dan mengecil.[19]
Berdasarkan penelitian Pan (2017), quercetin
dapat mengurangi aktifitas ATPase DENV-2
NS2B18NS3 lebih kuat daripada DENV-2 NS3 domain helikase. Penurunan aktifitas ATPase mencapai ~52% (Gambar 4). Hal tersebut juga terjadi pada serotype DENV-4.[9]
Efek Klinis Papain
Aktivitas papain terdeteksi pada Carica papaya L., terutama pada bagian daun. Dengan menggunakan metode colorimetric untuk mendeteksi aktivitas papain, didapatkan rentang dari 205,86 sampai 401,27 unit enzim.[30] Berdasarkan penelitian Tahir et al., pada hewan coba yang mengalami trombositopenia, ekstrak daun dapat mencegah terjadinya penurunan drastis pada trombosit dan efek maksimumnya diobservasi pada hari ketujuh, kemudian pemulihan spontan pun terjadi (Gambar 5).[31]
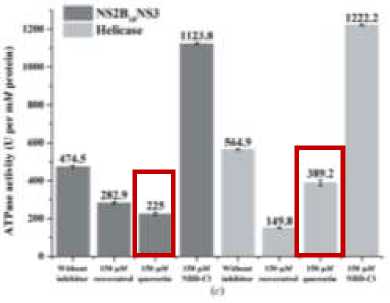
Gambar 4. Diagram Aktifitas ATP-hidrolisis DENV-2 NS2B18NS3 dan Domain Helikase.
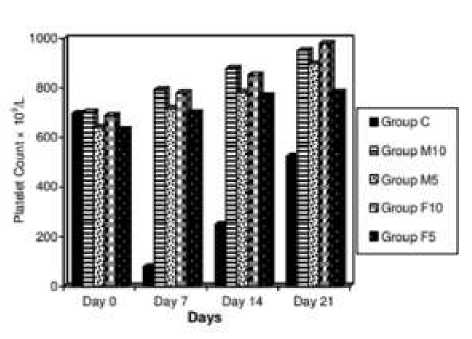
Gambar 5. Diagram Hitung Trombosit (Rata-Rata ± SD) pada Hewan Coba Trombositopenia pada Hari 0, 7, 14, Dan 21.
Keterangan:
C : Kontrol positif
M10 : Male, jus daun pepaya 10 ml/kg
M5 : Male, jus daun pepaya 5 ml/kg
F10 : Female, jus daun pepaya 10 ml/kg
F5 : Female, jus daun pepaya 5 ml/kg
Mekanisme Konstruksi Quercetin-Papain
Papain yang terkandung dalam daun Carica papaya L. memerlukan beberapa proses untuk dipisahkan dari zat lainnya. Dalam penelitian eksperimen yang dilakukan oleh Tigist et al., papain yang terdapat dalam ekstrak Carica papaya L. diisolasi dengan menggunakan metode ultrasonication extraction atau ultrasound assisted extraction.[32] Metode ultrasonication dilakukan dengan tahapan sebagai berikut: daun Carica papaya L. segar dipotong berukuran 3 cm x 3 cm dengan menggunakan pisau, sampel kemudian
dimasukkan kedalam mesin ultrasonication. Hasil yang paling optimal didapatkan dengan memasukkan sampel pada mesin ultrasonication selama 60 menit dengan suhu 60oC.
Ekstrak daun Carica papaya L. mentah akan diproses dengan dua tahap presipitasi garam. Tahap pertama, ekstrak dicampur dengan 40 mM sistein dengan ratio 3:1 dan dibuat suspensi dengan pH 5,6 dengan menambahkan 6 M HCl, kemudian diaduk selama 15 menit pada suhu 4◦oC. Suspensi ini kemudian disaring dan filtrat kemudian dipertahankan pada pH 9,0 dengan 6 M NaOH. Material yang tidak larut dipisahkan dengan sentrifugasi 9.000xg selama 30 menit dengan suhu 4 oC. Hasil dari sentrifugasi berupa supernatan kemudian dipresipitasi dengan (NH4)2SO4 pada saturasi 45%. Larutan yang mengandung enzim papain kemudian diinkubasi selama 30 menit dalam suhu 4◦C lalu dicampur dengan 200 μl casein 50 mM, 20 mM EDTA, pH 8,0, 700 μl 50 Mm Tris-HCl dan 1.000 μl larutan enzim. Enzim papain kemudian diekstraksi setelah campuran diinkubasi pada suhu 37◦C, yang berdasarkan penelitian oleh Tigist et al., didapatkan konsentrasi ekstrak papain sekitar 0,054-0,002 mg/ml.[32]
Seperti dalam penelitian eksperimen oleh Sobral et al., kandungan quercetin dalam daun Psidium guajava diekstraksi melalui beberapa tahapan seperti halnya papain.[33] Daun Psidium guajava terlebih dahulu di ekstraksi dan fraksi sampai membentuk larutan, kemudian ditambahkan aluminium klorida (AlCl3) dan sodium asetat (CH3COONa) masing-masing 40 μg/mL. Kemudian untuk mendapatkan flavonoid siapkan tabung reaksi yang ditambahkan dengan 100 μL air, 10 μL asetat, 20 μL sampel, 10 μL klorida, dan 60 μL etanol. Campuran yang telah dibuat diinkubasi pada suhu ruangan selama 30 menit lalu diproses dengan 415 nm pada ELISA Termoplate Reader. Total flavonoid yang didapatkan pada proses ini mengandung miligram quercetin yang setara pada setiap gram dari ekstrak daun Psidium guajava.[17]
Kombinasi quercetin dan papain diadministrasikan secara peroral, dengan bantuan bakteri dalam usus dengan aktivitas glikosidase dan hidrolisis rantai glukosa, menghasilkan bentuk aktif quercetin yaitu aglycone yang akan diserap usus.[33,34] Dalam penelitian oleh Lavanya et al., papain murni diserap melalui usus dan masuk ke plasma dan menginduksi thrombopoiesis.[35]
SIMPULAN
Kombinasi quercetin yang terkandung dalam ekstrak daun Psidium guajava dan papain yang terkandung dalam ekstrak daun Carica papaya L. merupakan salah satu potensi terapi demam berdarah dengue. Konstruksinya diawali dengan ekstraksi dari masing-masing zat yang kemudian dikombinasikan dan diadministrasikan secara peroral. Berkaitan dengan efek klinis, quercetin memiliki efek antivirus terhadap DENV sedangkan papain berefek dengan memacu trombopoesis melalui sekresi sitokin trombositik seperti IL-6 yang membantu memperbaiki kondisi trombositopenia.
SARAN
Berkaitan dengan potensi quercetin dan papain dalam terapi demam berdarah dengue, penulis menyarankan untuk diadakan penelitian lanjutan agar mengetahui adverse effect pada
hewan coba maupun manusia dan mengetahui pemilihan dosis yang efektif, kombinasi yang tepat, lama terapi yang disarankan serta efek klinis yang mungkin ditimbulkan.
DAFTAR PUSTAKA
-
1. WHO. Dengue and severe dengue. World Health Organization, Geneva, Switzerland. 2019;
https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue.
-
2. Haryanto B. Indonesia dengue fever: Status, vulnerability, and challenges. Current Topics in Tropical Emerging Diseases and Travel Medicine. 2018;5;81-92.
http://dx.doi.org/10.5772/intechopen.82290
-
3. Yoshikawa MJ & Kusriastuti R. Surge of dengue virus infection and chikungunya Fever in bali in 2010: the burden of mosquito-borne infectious diseases in a tourist destination. Trop Med Health. 2013;41:67–78.
-
4. Megawati D, Masyeni S, Yohan B, Lestarini A, Hayati RF, Meutiawati F, Suryana K, Widarsa T, Budiyasa DG, Budiyasa N, Myint KSA, Sasmono RT. Dengue in Bali: Clinical characteristics and genetic diversity of circulating dengue viruses. PLOS Neglected Tropical Diseases. 2017;1-15.
-
5. Rodriguez-Roche R & Gould EA. Understanding the dengue virus and progress towards their control. BioMed Research International. 2013;1-20; http://dx.doi.org/10.1155/2013/690835
-
6. WHO. Handbook for clinical management of dengue. World Health Organization, Geneva, Switzerland. 2012;
http://whqlibdoc.who.int/publications/2009/97892 41547871_eng.pdf.
-
7. Saptawati L, Febrinasari RP, Yudhani RD, Hudiyono, Faza AG, Luthfiani S, Ummiyati HS, Sudiro TM, & Dewi BE. In vitro study of eight Indonesian plants extracts as anti Dengue virus. Health Science Journal of Indonesia. 2017;8(1): 12-18.
-
8. Yunita F, Hanani E, & Kristianto J. The effect of Carica papaya L. leaves extract capsules on platelets count and hematocrit level in dengue fever patient. Int. J. Med. Arom. Plants. 2012;2(4):573-578.
-
9. Pan A, Saw WG, Manimekalai MSS, Gruber A, Joon S, Matsui T, Weiss TM, & Gruber G. Structural features of NS3 of Dengue virus serotype 2 and 4 in solution and insight into RNA binding and the inhibitory role of quercetin. Structural Biology. 2017;D73:1-12.
-
10. Aziz J, Kassim NLA, Kasim NHA, Haque N, & Rahman MT. Carica papaya induces in vitro thrombopoietic cytokines secretion by
mesenchymal stem cells and haematopoietic cells. BMC Complementary and Alternative Medicine. 2015;15:215.
-
11. WHO. Dengue: Guidelines for Diagnosis , Treatment, Prevention and Control. World Health Organization, Geneva, Switzerland. 2009; http://whqlibdoc.who.int/publications/2009/97892 41547871eng.pdf.
-
12. Yacoub S, Mongkolsapaya J, & Screaton G. The pathogenesis of dengue. Current Opinion in Infectious Diseases. 2013;26(3):284-289.
-
13. Adikari TN, Gomes L, Wickramasinghe N, Wijesiriwardana N, Kamaladasa A, Shyamali NLA, Ogg GS, & Malavide GN. Dengue NS1 antigen contributes to disease severity by
inducing interleukin (IL)-10 by monocytes. The Journal of Translational Immunology.
2016;184:90-100.
-
14. Kurane I, Matsutani T, Suzuki R, Takasaki T, Kalayanarooj S, Green S, Rothman AL, & Ennis FA. T-cell responses to dengue virus in humans. The Japanese Society of Tropical Medicine. 2011;39(4):45-51.
-
15. Azeredo EL, Monteiro RQ & Pinto LMO. Thrombocytopenia in dengue: Interrelationship between virus and the imbalance between
coagulation and fibrinolysis and inflamatory mediators. Hindawi Publishing Corporation.
2015:1-16.
-
16. Honda S, Saito M, Dimaano EM, Morales PA, Alonzo MT, Suarez LA, Koike N, Inoue S,
Kumatori A, Natividad FF, Oishi K. Increased phagocytosis of platelets from patients with secondary dengue virus infection by human macrophages. The American Journal of Tropical Medicine and Hygiene. 2009;80(5):841-845.
-
17. Sobral CE, Silva ARP, Leite NF, Rocha JE, Menezes AK, Cuncha FABA, Rolim LA, & Coutinho HDM. Psidium guajava bioactive
product chemical analysis and heavy metal
toxicity reduction. Chemospere. 2018;213:1-17.
-
18. Zhang W, Wang J, Chen Y, Zheng H, Xie B, & Sun Z. Flavonoid compounds and antibacterial mechanisms of different parts of white guava (Psidium guajava L. cv. Pearl). Natural Product Research. 2018:2-3.
-
19. Zandi K, Teoh BT, Sam SS, Wong PF, Mustafa MR, & AbuBakar S. Antiviral activity of four types of bioflavonoid against dengue virus type-2. Virology Journal. 2011;8:560.
-
20. Yogiraj V, Goyal PK, Chauhan CS, Goyal A, & Vyas B. Carica papaya Linn: An Overview. International Journal of Herbal Medicine. 2014;2(5):1-8.
-
21. Subenthiran S, Choon TC, Cheong KC, Thayan R, Teck MB, Muniandy PK, Afzan A, Abdullah NR, & Ismail Z. Carica papaya leaves juice significantly accelerates the rate of increase in platelet count among patients with dengue fever and dengue haemorrhagic fever. EvidenceBased Complementary and Alternative Medicine. 2013:1-7.
-
22. Anusuya S & Gromiha MM. Quercetin derivatives as non-nucleoside inhibitors for dengue polymerase: molecular docking,
molecular dynamics simulation and binding free energy calculation. Journal of Biomolecular Structure and Dynamics. 201:1-24
-
23. Chandramouli S, Joseph JS, Daudenarde S, Gatchalian J, Cornillez-Ty C, & Kuhn P.
Serotype-specific structural differences in the protease-cofactor complexes of the
dengue virus family. Journal of Virology.
2010;84(6):3059-3067.
-
24. Senthilvel, Padmanabhan, Lavanya P, Kumar KM & Swetha R. Flavonoid from Carica papaya inhibits NS2B-NS3 protease and prevents Dengue 2 viral Assembly. Available from http://www.
bioinformation.net/009/97320630009889.pdf. 2013.
-
25. Ismail NA & Jusoh SA. Molecular docking and molecular dynamics simulation studies to predict flavonoid binding on the surface of DENV2 E
protein. Interdiscip Sci Comput Life Sci. 2016:111
-
26. Sousa LRF, Wu H, Nebo L, Fernandes JB, Silva MFGF, Kiefer W, Kanitz M, Bodem J, Diederich WE, Schirmeister T, & Vieira PC. Flavonoid as noncompetitive inhibitors of Dengue virus NS2B-NS3 protease: Inhibition kinetics and docking studies. ELSEVIER. 2015:1-5
-
27. Carrasco‐Pozo, C., Gotteland, M., & Speisky, H. Protection by apple peel polyphenols against indometacin‐induced oxidative stress,
mitochondrial damage and cytotoxicity in Caco‐2 cells. J. Pharm. Pharmacol. 2010;62: 943-950.
-
28. Rahman MT, Haque N, Abdurrazaq NB, & Aziz J. Current knowledge of dengue pathogenesis and potential role of Carica papaya and vitamins in dengue fever. Tropical Biomedicine. 2016;33(3):512-518
-
29. Kaur G, Jalagadugula G, Mao G, & Rao AK. RUNX1/core binding factor A2 regulates platelet 12-lipoxygenase gene (ALOX12): studies in human RUNX1 haplodeficiency. Blood.
2010;115(15):3128-3135
-
30. Nwofia GE, Ojimelukwe P, & Eji C. Chemical composition of leaves, fruit pulp and seeds in some Carica papaya (L) morphotypes. Int. J. Med. Arom. Plants. 2012;2(1):200-206.
-
31. Tahir N, Zaheer Z, Kausar S, & Chiragh S. Prevention of fall in platelet count by Carica papaya leaf juice in carboplatin induced thrombocytopaenia in mice. Biomedics. 2014;30(1):21-25.
-
32. Tigist M, Getnet B, Beza K, Endalamaw M, Lulit M, Tamirat D, & Tinsae M. Extraction and purification of papain enzyme from papaya leaf and the phytochemical components of the leaf. Biotechnology International. 2016;9(8):176-184.
-
33. Anderson AS, Tamara RM, Silvana M, & Angelita DC. Aqueous extract of Psidium guajava leaves: phenolic compounds and
inhibitory potential on digestive enzymes. Anais da Academia Brasileira de Ciências. 2017;89 (3):2155-2165.
-
34. Nam J, Sharma AR, Nguyen LT, Chakraborty C, Sharma G, & Lee S. Application of bioactive quercetin in oncotherapy: From nutrition to nanomedicine. MDPI. 2016;21(108):1-23.
-
35. Lavanya B, Maheswaran A, Vimal N, Vignesh K, Yuvarani K, & Varsha R. Extraction and effects of papain obtained from leaves of carica papaya: A remedy to dengue fever. International Journal of Pharmaceutical Science and Research. 2018;3(1):44-46.
28
Discussion and feedback