Potensi Antibodi Anti-PfRH5 Terkonjugasi Nanopartikel Poly(lactide-co-glycolide) acid (PLGA) sebagai Inovasi Vaksin Malaria Falciparum
on
ARTIKEL TINJAUAN PUSTAKA

ESSENTIAL:Essence of Scientific Medical Journal (2019), Volume 17, Number 1:9-15
P-ISSN.1979-0147, E-ISSN. 2655-6472
TINJAUAN PUSTAKA
POTENSI ANTIBODI ANTI-PfRH5 TERKONJUGASI NANOPARTIKEL POLY (lactide-co-glycolide) ACID (PLGA) SEBAGAI INOVASI VAKSIN Malaria falciparum
Gde Aditya Putra Deva1, Agung Bagus Sista Satyarsa1, Sang Ayu Arta Suryantari1, I Made Susila Utama2
ABSTRAK
Malaria Falciparum adalah salah satu penyakit infeksi disebabkan oleh parasit protozoa Plasmodium falciparum yang memiliki morbiditas dan mortalitas terbesar kasus malaria pada manusia. Upaya pencegahan dan penanganan malaria falciparum saat ini masih mendapat hambatan dari resistensi terhadap insektisida dan obat anti-malaria. Untuk itu, perlu adanya metode pencegahan parasit yang bersifat lebih spesifik yakni berupa vaksin dengan target protein parasit. Tinjauan pustaka dilakukan berdasarkan literatur seperti jurnal dan website. Dari 60 jurnal yang ditelaah, 46 jurnal ditemukan sesuai dengan topik bahasan dan digunakan sebagai referensi karya ini. Dalam siklus hidup P.falciparum terjadi fase invasi terhadap eritrosit. Plasmodium falciparum Reticulocyte-binding Protein Homologue 5 (PfRH5) dan basigin (BSG) dari eritrosit adalah pasangan ligan-reseptor esensial dalam invasi eritrosit. Tambahan nanopartikel poly(lactide-co-glycolide) acid (PLGA) sangat penting untuk melindungi komponen vaksin antibodi anti-PfRH5 agar tidak mudah mengalami degradasi yang membantu untuk meningkatkan efikasi kerja vaksin dalam menginhibisi proses invasi oleh merozoit. Karena berperan sebagai target yang penting dalam menginhibisi invasi merozoit, potensi PfRH5 sebagai vaksin malaria sangat signifikan dan spesifik. Potensi PfRH5 juga didukung dengan munculnya respon imun alami yang dapat menghambat pertumbuhan parasit. Respon imun tersebut melibatkan IgG spesifik terhadap PfRH5 yang dapat memberikan efek protektif dengan menghambat terjadinya ikatan antara PfRH5-BSG sehingga proses invasi tidak terjadi. Vaksin malaria (antibody anti-PfRH5 terkonjugasi nanopartikel PLGA) yang spesifik pada merozoit merupakan modalitas pencegahan potensial dalam perkembangan vaksin malaria falciparum. Penelitian lebih lanjut diperlukan untuk mengetahui efikasi dan induksi antibodi pada tubuh oleh anti-PfRH5 masih diperlukan untuk menambah bukti ilmiah.
Kata kunci: malaria falciparum, plasmodium falciparum, vaksin PfRH5, nanopartikel PLGA
ABSTRACT
Malaria falciparum is an infectious disease caused by protozoan Plasmodium falciparum which has the highest morbidity and mortality rate of all the types of malaria in human. The prevention and treatment in malaria falciparum is challenged by the resistance to insecticides and anti-malarial drugs. So, the more specific prevention method is necessary such as vaccine with the specific parasite protein target. This literature review is composed by many literatures like scientific journals and websites. From 60 journals have been reviewed, 46 journals were found according to the topic and used as references for this literature review. Invasion phase to erythrocyte takes place in the life cycle of P. falciparum. Plasmodium falciparum Reticulocyte-binding Protein Homologue 5 (PfRH5) and basigin (BSG) on erythrocyte is ligand-receptor couple which is essential in erythrocyte invasion. In addition, poly(lactide-co-glycolide) acid (PLGA) nanoparticles is very important to protect the components of the antibody anti-PfRH5 vaccine, so that become not easily degradable which help to improve the efficacy of the vaccine in inhibiting invasion process of merozoite. It serves as an important target for inhibition of invasion of merozoites, PfRH5 has potential to be a very significant and specific vaccine against malaria. The potential of PfRH5 is also supported by the emergence of natural immune response which can inhibit the parasite growth. The immune response involves specific IgG to PfRH5 to provide protective effect by inhibiting the bond between PfRH5-BSG, so that the invasion process will not occur. PLGA-encapsulated PfRH5 vaccine is specific for merozoite which is potential as prevention modality in malaria vaccine development. Further research is necessary to determine the efficacy and induction of antibody in the body by anti-PfRH5 vaccine to enrich the scientific evidences.
Keywords: malaria falciparum, PfRH5 vaccine, plasmodium falciparum, PLGA nanoparticles
1Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Udayana, Bali 2Divisi Penyakit Tropik dan Infeksi, Bagian/SMF Penyakit Dalam FK Unud/RSUP Sanglah Denpasar, Bali
PENDAHULUAN
Malaria falciparum disebabkan oleh protozoa Plasmodium falciparum dengan diperantarai oleh nyamuk Anopheles betina.[1] Malaria falciparum merupakan jenis malaria dengan prevalensi dan mortalitas tertinggi di dunia.[2] Hampir separuh dari populasi penduduk dunia saat ini yaitu sekitar 3,2 miliar penduduk, sedang dalam risiko terinfeksi malaria. Setiap tahunnya diperkirakan terjadi sekitar 1-3 juta kematian akibat malaria secara global terutama pada anak berusia <5 tahun dan ibu hamil.[3] Pada tahun 2015, diperkirakan terdapat 214 juta kasus malaria dengan angka mortalitas sebanyak 438 ribu jiwa di seluruh dunia.[2] Penyakit malaria masih dapat dijumpai di seluruh
provinsi di Indonesia, terutama di wilayah timur Indonesia yang merupakan wilayah wilayah endemik malaria. Menurut Riskesdas tahun 2010, malaria falciparum mempunyai prevalensi sebesar 86,4% dan merupakan prevalensi tertinggi di antara semua jenis malaria.[4]
Selain memiliki tingkat mortalitas dan prevalensi yang cukup tinggi, malaria falciparum juga memiliki tingkat morbiditas dan progresivitas yang tinggi. Gejala-gejala awal dari malaria falciparum bersifat non-spesifik dan menyerupai gejala penyakit viral sistemik minor seperti sakit kepala, keletihan, rasa sakit pada regio abdomen, nyeri sendi dan otot, juga bisa disertai oleh demam, menggigil, berkeringat, kehilangan nafsu makan, serta batuk.
Pada saat gejala-gejala awal ini muncul, tidak ditemukan tanda-tanda kegagalan fungsi organ tubuh dan dapat sembuh apabila diberikan pengobatan yang tepat. Namun apabila pengobatan yang diberikan tidak sesuai atau bahkan tidak mendapatkan pengobatan apapun, maka jumlah P.falciparum dalam tubuh akan terus meningkat dan berpotensi memperparah penyakit malaria hingga bersifat fatal bahkan letal. Progresivitas dari gejala awal menuju gejala malaria yang lebih berat hanya membutuhkan durasi beberapa hari atau bahkan dalam hitungan jam. Penyakit malaria berat menunjukkan salah satu atau lebih dari manifestasi klinis berikut ini yaitu koma (cerebral malaria), asidosis metabolik, anemia parah, hipoglikemia, gagal ginjal akut, atau edema paru akut. Efek patologis dan manifestasi klinis yang muncul berpotensi lebih parah pada ibu hamil, bayi, dan balita dengan malaria.[1,5]
Upaya preventif terhadap transmisi malaria direkomendasikan oleh World Health Organization (WHO) dalam dua bentuk metode kontrol vektor yaitu insecticide-treated mosquito nets (ITNs) dan indoor residual spraying (IRS).[2] Kedua metode kontrol vektor tersebut juga dilakukan di Indonesia sesuai program elimininasi malaria.[6] Tetapi dalam beberapa tahun terakhir, resistensi vektor terhadap insektisida yang digunakan dalam kedua metode tersebut muncul di beberapa negara.[2] Selain itu, tindakan kuratif pada malaria bertujuan untuk menghilangkan parasit P. falciparum dalam darah agar penyakit tidak menyebabkan komplikasi maupun infeksi kronis seperti anemia terkait malaria.
Kebijakan monoterapi yaitu dengan penggunaan obat golongan aminoquinolin dan antifolat.[1,7] Adanya mutasi di salah satu asam amino, K76T, pada gen pfcrt (P. falciparum chloroquine resistance transporter) diketahui menjadi penyebab dari resistensi obat anti-malaria sebelumnya.[7,8] Saat ini, Artemisinin-based combination therapy (ACT) adalah lini pertama pengobatan malaria di dunia termasuk di Indonesia.[9,10] Namun resistensi terhadap obat antimalaria masih menjadi penghadang utama dalam penanganan malaria.[11] Pada tahun 2008, dilaporkan adanya P.falciparum resisten terhadap derivat artemisinin.[1,9] Resistensi tersebut menimbulkan kesulitan dalam pengobatan malaria falciparum.[1] Hal ini tentunya dapat menghambat baik pencegahan dan penanganan malaria sehingga membutuhkan suatu modalitas pencegahan lain yang lebih efektif seperti vaksin.
Sebuah vaksin P.falciparum pre-eritrosit dengan target sporozoit, ‘RTS,S’ baru-baru ini menjalani fase ketiga dari clinical rial terhadap anak-anak di Afrika. Hasilnya adalah vaksin tersebut memiliki efikasi parsial hanya sebesar 29%-36%. Vaksin dengan target merozoit memiliki potensi yang cukup menjanjikan.[12,13,16] Merozoit P.falciparum diketahui memiliki beberapa jenis protein yang berperan penting dalam proses invasi eritrosit, salah satunya adalah reticulocyte-binding protein homologue (RH).[14] Salah satu jenis dari RH protein P.falciparum adalah PfRH5. Plasmodium falciparum reticulocyte-binding protein homolog 5 (PfRH5) adalah protein esensial dalam invasi eritrosit pada semua strain P.falciparum.[14,15] Anti-PfRH5 juga diketahui bersifat spesifik terhadap reaksi imun karena memiliki polimorfisme yang terbatas. Antibodi yang ditargetkan pada PfRH5 dapat secara efektif menghalangi invasi P.falciparum in vitro.[16-18] PfRH5
juga dapat merangsang antibodi penetral melebihi potensi strain.[17,19]
Polylactic polyglycolic acid (PLGA) merupakan salah satu nanopartikel yang paling sering digunakan sebagai carrier untuk membawa obat termasuk untuk membawa vaksin.[20,21] PLGA memiliki banyak kelebihan, salah satunya adalah dapat melindungi obat dari degradasi dan dapat dimodifikasi untuk menargetkan organ spesifik tertentu. Akhir–akhir ini, banyak penelitian menggunakan PLGA dapat menjaga ketahanan vaksin sampai target kerja, sehingga vaksin dapat bekerja lebih efektif dan efisien. Penelitian Kalluru, et al,[22] memperjelas bahwa satu dosis obat yang terkonjugasi di dalam PLGA dapat bertahan selama 12 hari dan dapat meningkatkan efektivitas vaksin. Hal ini menunjukkan bahwa PLGA merupakan nanopartikel yang memiliki potensi besar sebagai carrier anti-PfRH5.
Berdasarkan penelitian-penelitian di atas, penulis mengajukan gagasan untuk menggunakan antibodi anti-PfRH5 yang dienkapsulasikan ke dalam nanopartikel PLGA untuk mencegah infeksi P.falciparum secara efektif. Diharapkan dengan dienkapsulasikan ke dalam nanopartikel PLGA dapat meningkatkan efisiensi antibodi anti-PfRH5. Inovasi vaksin ini diharapkan dapat menjadi solusi baru yang mampu mencegah perkembangan penyakitMalaria Falciparum.
PEMBAHASAN
Peranan PfRH5 dalam Patogenesis Malaria Falciparum
Plasmodium memiliki dua siklus hidup yaitu fase seksual pada nyamuk betina dan fase aseksual pada hospes vertebrata.[23,24] Malaria ditransmisikan ke tubuh manusia melalui gigitan vektor nyamuk Anopheles betina.[1] Penyakit malaria dapat menginfeksi manusia baik secara alami melalui gigitan nyamuk Anopheles maupun melalui induksi seperti jalur transfusi darah, injeksi, dan bisa juga karena faktor kongenital.[25,26] Infeksi bermula ketika nyamuk Anopheles betina yang mengandung Plasmodium di dalam tubuhnya menusuk hospes, sporozoit Plasmodium akan masuk ke dalam sirkulasi darah hospes. Dalam jangka waktu setengah jam hingga satu jam, sporozoit akan masuk ke dalam sel hati. Inti dari parasit tersebut akan membelah secara kontinu dan berkembang membentuk ribuan merozoit berinti satu.[24,25,27] Tahap ini merupakan tahap skizogoni pra eritrosit. Panjang tidaknya tahap ini bergantung pada jenis Plasmodium yang menginfeksi hospes. Setelah tahap pra eritrosit berakhir, skizon akan pecah dan merozoit akan keluar, kemudian memasuki tahapan siklus blood-stage. Pada tahap ini, merozoit dilepaskan ke aliran darah akan segera menginvasi eritrosit.[23,24,25] Di dalam eritrosit, merozoit dari P. falciparum akan berkembang ke tahapan membentuk tropozoit, skizon, dan selanjutnya skizon tersebut pecah mengeluarkan merozoit-merozoit baru yang akan menginfeksi sel eritrosit baru. Proses ini terus berlanjut dalam fase aseksual di dalam tubuh manusia. Replikasi dari tahapan blood-stage ini membutuhkan waktu sekitar 48 jam tiap siklusnya.[15,23,24,28]
Ditinjau dari segi molekuler, tahap invasi eritrosit oleh merozoit dibagi menjadi tiga fase yang berbeda yaitu pra invasi, invasi aktif, dan
echinocytosis. Pada fase pra invasi, merozoit mulai berinteraksi dengan eritrosit dalam afinitas rendah yang diiringi oleh deformasi bentuk membran pada eritrosit target.[29,30] Terdapat dua jenis protein ligan esensial yang memengaruhi tahap pra invasi menuju tahap invasi dengan cara menyediakan jalur untuk invasi. Dua ligan tersebut adalah P. falciparum reticulocyte-binding protein homolog (PfRhs) dan erythrocyte-binding like protein (EBLs).[30,31,32,33] Fase pra invasi ini terjadi selama sekitar 10 detik.[30] Setelah itu, merozoit akan mengeluarkan ligan dari organel apikalnya (microneme dan rhoptry) untuk menginvasi eritrosit (Gambar 1).[29,30] Fase invasi merozoit P. falciparum pada eritrosit dilakukan dalam bentuk tight junction yang didahului oleh terbentuknya antigen membran apikal (PfAMA1) pada merozoit dan kompleks RON pada eritrosit.[15] Setelah terbentuk tight junction pada permulaan invasi, isi dari organel rhoptry akan dikeluarkan untuk menyusun membran vakuola parasitophorous saat merozoit didorong masuk ke dalam eritrosit oleh gerakan motorik aktomiosin.[31] Pada P. falciparum, proses invasi ini memerlukan waktu sekitar 30 detik.[29] Setelah terjadi fase invasi aktif, fase berikutnya adalah echinocytosis. Fase ini ditandai oleh menyusutnya eritrosit hingga berwujud menyerupai bintang yang dikarenakan masuknya ion Ca2+ ke dalam eritrosit.[29,30] Fase ini berlangsung selama 5-10 menit dan diakhiri oleh kembalinya eritrosit ke bentuk normal (bikonkaf).[30]
Plasmodium falciparum reticulocyte bindinglike homologous protein 5 (PfRH5) merupakan ligan terpendek dari semua ligan PfRHs (63 kDa pada PfRH5 dan 200-375 kDa pada PfRH yang lain) dan tidak memiliki transmembran.[19,35]
A.

B.

Gambar 1. Peranan PfRH5 dalam Patogenesis Malaria Falciparum.[15,16]
-
(A) Microneme dan Rhoptry Beserta Ligannya Pada Merozoit.[16]
-
(B) Pengikatan Ligan PfRH5 pada Merozoit Terhadap Reseptor Basigin pada Eritrosit dalam Proses Invasi.[15]
Pada microneme dan bagian-bagian rhoptry terdapat sejumlah ligan yang digunakan untuk menginvasi serta memfasilitasi diversifikasi jalur bagi merozoit dalam menginvasi eritrosit untuk menghindari sistem imun hospes.[32,34] Ligan ini berikatan dengan protein permukaan eritrosit yaitu basigin (CD147, EMMPRIN).[36,37] PfRH5 juga membentuk kompleks dengan P. falciparum PfRH5-interacting protein (PfRipr) dan dengan cystein-rich protective antigen (CyRPA) untuk membentuk tight junction pada saat invasi (Gambar 2). Namun peranan kompleks PfRH5/PfRipr/CyRPA ini masih belum diketahui secara pasti.[15,19,35,38] Dalam berbagai percobaan, PfRH5 merupakan satu-satunya ligan yang tidak dapat dihilangkan di semua strain P. falciparum dan diduga protein PfRH5 diperlukan dalam viabilitas P. falciparum.[5,34,37] Secara umum, PfRH5 diketahui hanya memiliki lima non-synonymous single nucleotide polymorphisms (SNPs). Hal ini menjadi bukti bahwa protein PfRH5 mempunyai sekuensi polimorfisme yang terbatas.[17,39,40] Polimorfisme dari PfRH5 menentukan virulensi patogen dan spesifisitas reaksi imun dari host P.falciparum.[18]
Pengikatan PfRH5 terhadap basigin berperan penting dalam proses invasi merozoit. Plasmodium falciparum menggunakan ligan PfRH5 dan membentuk kompleks dengan PfRipr dan CyRPA untuk memediasi invasi eritrosit dengan menempel pada reseptor basigin pada eritrosit.[19,35,36,38]
Mekanisme Konstruksi Vaksin Malaria Falciparum: anti-PfRH5 terkonjugasi Nanopartikel PLGA
Pembuatan sediaan nanopartikel PLGA dengan anti-PfRH5 berdasarkan formula Paul et al., [41] menggunakan metode nanopresipitasi dan untuk 26 hari terapi. Proses ini diawali dengan melarutkan antibodi anti-pfrh5 dan polimer PLGA ke dalam pelarut organik PC menggunakan stirer 500 rpm selama 30 menit. Campuran antigen PfRH5 ini ditambahkan ke dalam campuran larutan stabilizer menggunakan mikropipet dengan laju 0,5 mL/menit. Larutan stabilizer dibuat dengan cara melarutkan pluronik F68 ke dalam aquabidestilata menggunakan magnetik stirer 1250 rpm selama 30 menit. Campuran sediaan disentrifugasi dengan kecepatan 10000 g T = 4°C selama 30 menit.
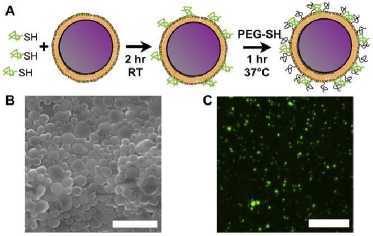
Gambar 2. Sintesis Nanopartikel PLGA terkonjugasi permukaannya oleh anti-PfRH5 (Inovasi Vaksin Malaria Falciparum).[15]
Potensi Inovasi Vaksin Malaria Falciparum dalam Meningkatkan Imunitas terhadap Merozoit Malaria Falciparum
Vaksin sebagai upaya pencegahan penyakit merupakan salah satu penelitian intensif dalam penanganan malaria khususnya P. falciparum. Vaksin PfRH5 untuk malaria faciparum ditargetkan pada fase eritrositik berdasarkan perjalanan penyakitnya.[18] Inovasi vaksin ini diinjeksi secara intravena. Reaksi imun dalam bentuk aktivitas antigen-antibodi yang kompleks pada fase eritrositik menimbulkan berbagai macam antigen bermunculan sebagai kandidat vaksin. Vaksin PfRH5 tersebut dinilai berdasarkan seberapa pentingnya peranan antigen dalam menimbulkan respon antibodi sehingga dapat menghasilkan respon imun protektif yang adekuat.[20] Antigen dengan profil polimorfisme yang tinggi menyebabkan parasit malaria dapat menghindar dari sistem imun host. Polimorfisme tersebut menyebabkan perubahan sifat antigenik sewaktu-waktu yang dapat berakibat pada resistensi.[24]
Meskipun PfMSP dan PfAMA telah ditemukan dapat menginduksi pembentukan antibodi penghambat pertumbuhan parasite P. falciparum, tetapi masih belum ada penelitian yang menjelaskan secara spesifik terkait mekanisme inhibisinya. Sementara itu, antigen kelas PfRH telah ditemukan berperan penting dalam proses invasi merozoit P. falciparum pada sel eritrosit, hal ini membuat antigen PfRH memiliki mekanisme kerja yang lebih spesifik dan dasar dalam patogenitas P.falciparum yang perlu dicegah.[9,11] Terlebihnya lagi, PfRH5 memiliki sekuens polimerfisme yang terbatas dan kemampuan untuk menginduksi aktivitas antibodi inhibitor yang luas setelah dilakukan vaksinasi pada hewan.[13, 23]
Dengan profil polimerfisme antigen yang rendah maka kemungkinan resistensi terhadap vaksin akan semakin kecil. Anti-PfRH5 dengan pelapisan oleh nanopartikel PLGA menyebabkan bahwa terjadi pertahanan signifikan terhadap vaksin agar dapat menginduksi antibodi secara maksimal, hal ini dibuktikan dalam penelitian Douglas et al. di mana imunisasi dengan virus rekombinan yang mengekspresikan PfRH5 menghasilkan antibodi terhadap beberapa strain P.falciparum.[45] Hasil ini juga didukung dengan penelitian mengenai potensi full-length recombinant PfRH5 yang menunjukkan mekanisme induksi antibodi dengan daya inhibisi invasi yang kuat dan dapat menghambat pertumbuhan sembilan jenis strain P.falciparum.[17]
P. falciparum FVO strain challenge
Gambar 3. Mekanisme Kerja Vaksin Malaria Falciparum dari Antibodi Anti-PfRH5 terhadap Infeksi
Malaria Falciparum.[44]
Potensi PfRH5 sebagai kandidat vaksin juga diperkuat dengan adanya respon antibodi alami yang dapat mencegah pertumbuhan parasit dan menunda terjadinya episode malaria. Hal ini dibuktikan melalui perbandingan antara IgG terinduksi PfRH5 dan IgG dari donor sehat dengan uji growth inhibition assays (GIAs). Hasil uji menunjukkan adanya konsentrasi minimal dibutuhkan untuk aktivitas inhibisi parasit (Ab50 = 55 μg/mL) pada IgG terinduksi PfRH5, sementara tidak terdapat aktivitas inhibisi sama sekali dari IgG donor sehat (Gambar 4)[46] Selebihnya, PfRH5 ditemukan dapat menginduksi respon antibodi IgG spesifik secara alami pada pasien malaria falciparum sejak awal fase eritrositik hingga timbulnya gejala malaria dalam durasi 71 hari.[46] Hal ini menunjukkan bahwa dengan adanya antibodi spesifik dalam tubuh maka dapat meningkatkan sistem kekebalan tubuh terhadap malaria falciparum pada musim transmisi malaria atau bahkan menurunkan risiko terjangkit penyakit.
Meningkatnya sistem imun protektif terhadap P. falciparum melalui antigen PfRH5 juga didukung oleh penelitian dari Douglas et al. yang telah membuat vaksin yang mengeskpresikan beberapa antigen siklus eritrositik yaitu PfMSP (PfMSP1, PfMSP 9), PfAMA (PfAMA1), PfRAP (PfRAP3), dan PfRH (PfRH2 dan PfRH5).[45] Hasil uji ELISA menunjukkan antibodi titer melebihi 10.000 khususnya untuk PfRH2 dan PfRH5. Dari hasil penelitian tersebut maka dapat diartikan bahwa pembentukan antibodi IgG spesifik akan meningkat secara signifikan dengan adanya paparan terhadap antigen yang dilemahkan sebelumnya dan efek inhibisi akan lebih baik lagi.[45]
Mekanisme Proteksi Antibodi anti-PfRH5 terhadap P.falciparum (in vitro)
Studi mengenai mekanisme proteksi vaksin antibodi-anti PfRH5 saat ini baru sebatas secara in vitro. Beberapa studi menyatakan bahwa antibodi anti-PfRH5 memberikan proteksi terhadap sel host melalui ikatan antigen-antibodi yaitu mekanisme inhibisi terhadap interaksi PfRH5 dengan BSG dan melalui mekanisme netralisasi parasit oleh antibodi IgG spesifik. Pada patogenesis malaria falciparum, antigen PfRH5 berada pada permukaan merozoit, badan rhotropy skizon dan pada tahap awal invasi eritrosit sebelum terbentuknya tight junction antara parasit dengan eritrosit.[46] Pada tahap awal invasi, adanya PfRH5 merupakan target potensial vaksin. Inhibisi antibodi PfRH5 terhadap penempelan PfRH5 pada BSG menyebabkan penurunan interaksi merozoit dengan eritrosit.[46]
Vaksin antibodi anti-PfRH5 juga dapat menetralisir merozoit. Mekanisme netralisasi dapat diukur secara in vitro dari kemampuan inhibisi antibodi terhadap antigen yang berperan dalam pertumbuhan parasit. Dalam uji dengan GI Assay tiga jenis antibodi monoklonal terhadap PfRH5 (QA1, QA5 dan 6BF10) yang terbentuk ditemukan dapat menghambat pertumbuhan parasit secara in vitro pada konsentrasi 500μg/mL secara berturut-turut sebesar 38%, 63% dan 30% (Gambar 5).[46] Selain
itu, antibodi lainnya seperti 9AD4 dan 2AC7 memiliki afinitas rendah terhadap PfRH5, tetapi dapat menginduksi mekanisme netralisasi dengan potensi yang cukup tinggi dengan nilai EC50 (setengah dari konsentrasi efektif maksimal) masing-masing 62 μg/mL dan <15μg/mL.[46] Hal ini menunjukkan meskipun tanpa adanya ikatan yang baik, antibodi anti-PfRH5 masih memungkinkan untuk menetralisir merozoit sehingga menghambat pertumbuhan parasit pada uji in vitro. Hasil ini juga memungkinkan adanya mekanisme neutralisasi lain yang terjadi selain melalui inhibisi terhadap interaksi PfRH5 dengan BSG. Sesuai dengan pernyataan bahwa antibodi-anti BSG dapat menginduksi neutralisasi parasit tanpa menghambat interaksi antigen-antibodi sehingga membuat peranan PfRH5 dalam menginduksi aktivitas imun protektif semakin luas.[46]
Keunggulan Inovasi Vaksin Malaria Falciparum sebagai Upaya Pencegahan Malaria falciparum
Vaksin merupakan penelitian yang sangat berkembang pesat karena potensinya yang besar dalam eradikasi morbiditas dan mortalitas penyakit. Apabila dibandingkan dengan upaya pencegahan transmisi malaria saat ini yang berkonsentrasi pada upaya pemberantasan vektor secara massal melalui tindakan sederhana,[7] vaksin menawarkan terapi pencegahan dengan memberikan perlindungan yang dimulai dari dalam tubuh manusia itu sendiri. Sistem imunitas yang diinduksi juga dapat bertahan selama bertahun-tahun bahkan seumur hidup.[31] Mengingat prinsip dari herd community yang di mana semakin besar proporsi individu dalam masyarakat yang kebal terhadap penyakit infeksi, maka semakin kecil risiko bagi mereka yang tidak kebal di dalam populasi tersebut untuk terkena penyakit.[31] Dengan kata lain, proteksi secara tidak langsung diberikan oleh mereka yang sudah kebal terhadap mereka yang belum. Sesuai dengan pernyataan ini maka dengan bantuan vaksin malaria, sistem kekebalan tubuh manusia akan meningkatdan semakin kecil pula risiko akan terjangkitnya penyakit.
Vaksin malaria yang ideal merupakan vaksin dengan antigen yang memiliki spektrum yang luas terhadap strain P.falciparum dan memiliki peran penting untuk kelangsungan hidup parasit dan reproduksi sehingga resistensi tidak dapat dengan mudah diperoleh dengan mutasi, atau dengan hanya mematikan ekspresi.[15] PfRH5 merupakan antigen esensial dalam patogenesis malaria falciparum, hal ini membuat PfRH5 menjadi target terapi mutakhir terhadap penatalaksanaan malaria falciparum.
Terapi vaksin yang sangat menjanjikan. Berdasarkan penelitian Douglas, et al didapatkan bahwa PfRH5FL memiliki potensi induksi antibodi yang lebih tinggi dibandingkan dengan antigen PfAMA1 dan PfMSP1. Selain itu, diketahui bahwa densitas dari polimorfisme pada PfRH5 lebih rendah 3,3 kali jika dibandingkan dengan 19kDa C-terminus PfMSP1, sehingga PfRH5 memiliki kecenderungan mutasi yang lebih kecil.[46]
Kesuksesan suatu vaksin antigen dipengaruhi oleh berbagai faktor yang terkait dengan antigen yang terkandung di dalamnya seperti, imunogenisitas, spesifisitas, stabilitas, ketersediaan dan keamanan.[42] Terkait dengan imunogenisitas telah dibahas sebelumnya bahwa antibodi anti-PfRH5 mampu meningkatkan pembentukan antibodi. Berdasarkan penelitian Saurabh et al, menunjukan bahwa antibodi anti-PfRH5 mampu
dihasilkan secara stabil oleh bakteri E. coli dan memperlihatkan adanya reaksi imun terhadap serum pasien.[3] Hal tersebut menunjukan ketersediaan dan stabilitas dari antibodi anti-PfRH5. Protein PfRH5 pada merozoit memenuhi kriteria dalam spesifisitas, salah satunya dikarenakan pada beberapa penelitian yang menguji untuk menghapus gen PfRH5 telah gagal, sehingga menunjukkan bahwa PfRH5 memiliki adanya peran penting untuk viabilitas parasit.[15] Selain itu, adanya spesifitas PfRH5 pada merozoit, memungkinkan vaksin berbasis PfRH5 tidak akan mempengaruhi eritrosit atau bagian lain dari tubuh, sehingga kemungkinan besar tidak menginisiasi suatu respon auto- imun. Hal tersebutjuga menunjukan bahwa adanya peluang terbaik karena kekhususan yang dimiliki PfRH5 sehingga membuatnya menjadi "aman" dan menjadi strategi efektif vaksin target.[15,25,27]
Selain itu, tingkat ekspresi dari PfRH5 tidak berubah pada strain P.falciparum dengan rute invasi yang berbeda dan itu dibuktikan dalam serum dari pasien yang menderita infeksi malaria alami,[34] yang menunjukkan bahwa PfRH5 adalah calon yang sangat baik untuk dimasukkan sebagai komponen dalam vaksin antimalaria yang sepenuhnya efektif.[34] Butuhnya merozoit untuk masuk dan bereplikasi dalam eritrosit, memperlihatkan bahwa pengembangan vaksin merupakan hal yang paling masuk akal. Selain itu, dikarenakan manusia adalah pembawa maupun penyebar kepada nyamuk, sehingga sangat penting untuk menemukan vaksin bagi manusia. Adapun dengan vaksin dapat menghentikan penyebaran gametosit kepada nyamuk sehingga mampu mencegah pembentukan sporozoit dan re-infeksi manusia lainnya.[35]
Keunggulan vaksin Antibodi Anti-PfRH5 Terkonjugasi Nanopartikel PLGA ini secara mekanisme kerja farmakokinetik dan farmakodinamik akan lebih efisien dibandingkan dengan pengembangan vaksin malaria tanpa menggunakan bantuan nanopartikel. Selain itu, menutupi keterbatasan dari PfRH5 yang rentan rusak maka diperlukan perlindungan dari dalam tubuh dengan mengkombinasikan nanopartikel PLGA. Hal tersebut dapat meningkatkan efektivitas dari vaksin malaria ini.
Keterbatasan Inovasi Vaksin Malaria Falciparum sebagai Upaya Pencegahan Malaria falciparum
Masih belum terdapat penelitian mengenai kombinasi Antibodi Anti-PfRH5 Terkonjugasi Nanopartikel PLGA. Penelitian lanjutan perlu dilaksanakan untuk membuktikan efektivitas, aplikabilitas dan safety dari pemberian vaksin antibody anti-PfRH5 pada tubuh manusia.
SIMPULAN
Berbagai penelitian baik in vitro maupun in vivo yang telah dilakukan sampai saat ini menunjukan bahwa antibody anti-PfRH5 memiliki potensi besar sebagai vaksin malaria falciparum. Dengan digunakan sebagai vaksin spesifik pada merozoit tidak akan mempengaruhi eritrosit dan bagian tubuh lainnya. Rendahnya densitas polimorfisme pada PfRH5 menunjukan rendahnya kecenderungan untuk mengalami mutasi yang berakibat pada resistensi. Selain itu, penggunaan nanopartikel PLGA dalam distribusi dan peningkatan bioavabilitas anti-PfRH5. Dengan demikian, vaksin dari antibodi anti-PfRH5 terkonjugasi nanopartikel
PLGA dapat menjadi salah satu kandidat vaksin untuk penyakit malaria falciparum di masa depan. Perlu diingat bahwa penggunaan vaksin tidak menggantikan upaya pencegahan konvensional, karena mengingat prinsip keseimbangan antara host, lingkungan dan agen, sehingga upaya pencegahan harus holistik.
SARAN
Diperlukan penelitian lanjutan mengenai efektivitas dan keamanan vaksin antibodi anti-PfRH5 pada tubuh manusia.
DAFTAR PUSTAKA
-
1. WHO. Guidelines for the treatment of malaria. 3rd ed. World Health Organization: Geneva,
Switzerland. 2014.
-
2. WHO | Malaria. World Health Organization; [cited 2016 Sept 8]; Available from:
http://www.who.int/mediacentre/factsheets/fs094 /en/
-
3. Patel SD, Ahouidi AD, Bei AK, Dieye TN, Mboup S, Harrison SC, et al. Plasmodium falciparum Merozoite Surface Antigen , PfRH5 , Elicits Detectable Levels of Invasion-Inhibiting Antibodies in Humans. 2013;208:1679–87.
-
4. Kemkes RI. Epidemiologi Malaria di Indonesia. Buletin Jendela Data dan Informasi Kesehatan, Jakarta: Bakti Husada. 2011.
-
5. Hayton K, Gaur D, Liu A, Takahashi J, Henschen B, Singh S, et al. Erythrocyte binding protein PfRH5 polymorphisms determine speciesspecific pathways of Plasmodium falciparum invasion. Cell Host & Microbe. 2008 Jul 17;4(1):40-51.
-
6. Ppbb D, Pp D, Pl DAN, Ri KK. Buku saku menuju eliminasi malaria.
-
7. Srinivas. Malaria Site; [cited 2016 Sept 9]; Available from: http://www.malariasite.com/drug-resistance/
-
8. Petersen I, Eastman R, Lanzer M. Drug‐resistant malaria: Molecular mechanisms and implications for public health. FEBS letters. 2011 Jun 6;585(11):1551-62.
-
9. WHO. WHO’s emergency response to artemisinin resistance. World Health
Organization. 2016.
-
10. Treatment FORTHE, Malaria OF. For the treatment of malaria.
-
11. Zenonos ZA, Dummler SK, Müller-sienerth N, Chen J, Preiser PR, Rayner JC, et al. Basigin is a druggable target for host- oriented antimalarial interventions.
-
12. Draper SJ, Angov E, Horii T, Miller LH, Srinivasan P, Theisen M, et al. Recent advances in recombinant protein-based malaria vaccines. Vaccine. 2015 Dec 22;33(52):7433-43.
-
13. Agnandji ST, Lell B, Fernandes JF, Abossolo BP, Methogo BG, Kabwende AL, et al. A phase 3 trial of RTS, S/AS01 malaria vaccine in African infants. The New England journal of medicine. 2012 Dec;367(24):2284-95.
-
14. Wright KE, Hjerrild KA, Bartlett J, Douglas AD, Jin J, Brown RE, et al. Structure of malaria invasion protein RH5 with erythrocyte basigin and blocking antibodies. Nature. 2014 Nov 20;515(7527):427-30.
-
15. Volz JC, Yap A, Sisquella X, Thompson JK, Lim NT, Whitehead LW, et al. Essential role of the
PfRh5/PfRipr/CyRPA Complex during
Plasmodium falciparum Invasion of Erythrocytes. Cell Host & Microbe. 2016 Jul 13;20(1):60-71.
-
16. Douglas AD, Williams AR, Illingworth JJ, Kamuyu G, Biswas S, Goodman AL, et al. The blood-stage malaria antigen PfRH5 is susceptible to vaccineinducible cross-strain neutralizing antibody. Nature Communications. 2011 Dec 20;2:601.
-
17. Bustamante LY, Bartholdson SJ, Crosnier C, Campos MG, Wanaguru M, Nguon C, et al. A fulllength recombinant Plasmodium falciparum PfRH5 protein induces inhibitory antibodies that are effective across common PfRH5 genetic variants. Vaccine. 2013; 31:373–9.
-
18. Ord RL, Caldeira JC, Rodriguez M, Noe A, Chackerian B, Peabody DS, et al. A malaria vaccine candidate based on an epitope of the Plasmodium falciparum RH5 protein. Malaria
Journal. 2014 Aug 18;13(1):1.
-
19. Reddy KS, Amlabu E, Pandey AK, Mitra P,
Chauhan VS, Gaur D. Multiprotein complex between the GPI-anchored CyRPA with PfRH5 and PfRipr is crucial for Plasmodium falciparum erythrocyte invasion. 2015;112(4).
-
20. Powles L, Xiang SD, Selomulya C, Plebanski M. The use of synthetic carriers in malaria vaccine design. Vaccines. 2015 Oct 29;3:894-929.
-
21. Hajizade A, Ebrahimi F, Salmanian AH, Arpanaei A, Amani J. Nanoparticles in vaccine development. J Applied Biotechnology Reports. 2014;1(4):125-134.
-
22. Kalluru R, Fenaroli F, Westmoreland D, Ulanova L, Maleki A, Roos N, et al. Poly(lactide-co-
glycolide)-rifampicin nanoparticles efficiently clear Mycobacterium bovis BCG infection in macrophages and remain membrane-bound in phago-lysosomes. J Cell Sci.
2013;126(14):3043–54.
-
23. Sinka ME, Bangs MJ, Manguin S, Rubio-Palis Y, Chareonviriyaphap T, Coetzee M, et al. A global map of dominant malaria vectors. Parasites & vectors. 2012 Apr 4;5(1):1.
-
24. Fauci AS. Harrison's principles of internal medicine. McGraw-Hill, Medical Publishing Division; 2008
-
25. Weekley C, Smith DS. Malaria: the clinical basics. Global Health Education Consortium (GHEC). 2013 Feb.
-
26. Sutanto I, Sumariah I, Pudji K, Saleha S. Buku ajar parasitologi. Fakultas Kedokteran
Universitas Indonesia. Balai Penerbit FKUI: 2009:189-207.
-
27. Kasper DL, Fauci AS. Harrison’s infectious diseases. 2nd ed. New York: McGraw Hill Professional, 2013.
-
28. Beeson JG, Drew DR, Boyle MJ, Feng G, Fowkes FJ, Richards JS. Merozoite surface proteins in red blood cell invasion, immunity and vaccines against malaria. FEMS microbiology reviews. 2016 May 1;40(3):343-72.
-
29. Gilson PR, Crabb BS. Morphology and kinetics of the three distinct phases of red blood cell invasion by Plasmodium falciparum merozoites. Weiss GE, Gilson PR, Taechalertpaisarn T, Tham WH, de Jong NW, Harvey KL, Fowkes FJ, Barlow PN, Rayner JC, Wright GJ, Cowman AF. Revealing the sequence and resulting cellular morphology of receptor-ligand interactions during
Plasmodium falciparum invasion of erythrocytes. PLoS Pathog. 2015 Feb 27;11(2):e1004670.
International journal for parasitology. 2009 Jan 31;39(1):91-6.
-
30. Weiss GE, Gilson PR, Taechalertpaisarn T, Tham WH, de Jong NW, Harvey KL, Fowkes FJ, Barlow PN, Rayner JC, Wright GJ, Cowman AF. Revealing the sequence and resulting cellular morphology of receptor-ligand interactions during Plasmodium falciparum invasion of erythrocytes. PLoS Pathog. 2015 Feb 27;11(2):e1004670.
-
31. Riglar DT, Richard D, Wilson DW, Boyle MJ, Dekiwadia C, Turnbull L, et al. Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte. Cell host & microbe. 2011 Jan 20;9(1):9-20.
-
32. Tham WH, Healer J, Cowman AF. Erythrocyte and reticulocyte binding-like proteins of Plasmodium falciparum. Trends in parasitology. 2012 Jan 31;28(1):23-30.
-
33. Singh S, Alam MM, Pal-Bhowmick I, Brzostowski JA, Chitnis CE. Distinct external signals trigger sequential release of apical organelles during erythrocyte invasion by malaria parasites. PLoS Pathog. 2010 Feb 5;6(2):e1000746.
-
34. Cowman AF, Crabb BS. Invasion of red blood cells by malaria parasites. Cell. 2006 Feb
24;124(4):755-66.
-
35. Chen L, Lopaticki S, Riglar DT, Dekiwadia C, Uboldi AD, Tham WH, et al. An EGF-like protein forms a complex with PfRh5 and is required for invasion of human erythrocytes by Plasmodium falciparum. PLoS Pathog. 2011; 7:e1002199.
-
36. Crosnier C, Bustamante LY, Bartholdson SJ, Bei AK, Theron M, Uchikawa M, et al. Basigin is a receptor essential for erythrocyte invasion Bay Plasmodium falciparum. Nature. 2011;480:534– 37.
-
37. Baum J, Chen L, Healer J, Lopaticki S, Boyle M, Triglia T, et al. Reticulocyte-binding protein
homologue 5–an essential adhesin involved in invasion of human erythrocytes by Plasmodium falciparum. International journal for parasitology. 2009 Feb 28;39(3):371-80.
-
38. Dreyer AM, Matile H, Papastogiannidis P, Kamber J, Favuzza P, Voss TS, Wittlin S, Pluschke G. Passive immunoprotection of Plasmodium falciparum-infected mice designates the CyRPA as candidate malaria vaccine antigen .J Immonol. 2012 Jun 15;188(12):6225-37.
-
39. Manske M, et al. Analysis of Plasmodium falciparum diversity in natural infections by deep sequencing. Nature. 2012; 487:375–379.
[PubMed: 22722859].
-
40. Williams AR, et al. Enhancing blockade of Plasmodium falciparum erythrocyte invasion: assessing combinations of antibodies against PfRH5 and other merozoite antigens. PLoS Pathog. 2012; 8:e1002991. [PubMed: 23144611].
-
41. Paul S, Bhattacharyya SS, Boujedaini N, Khuda-Bukhsh AR. Anticancer potentials of root extract of polygala senega and its PLGA nanoparticles-encapsulated form. Evid Based Complement Alternat Med. 2011: 13.
-
42. Slingerland M. Exploring novel formulations and new classes of anticancer drugs in solid tumors (Doctoral dissertation, Department of Clinical Oncology and Clincal Pharmacy and Toxicology, Faculty of medicine/Leiden University Medical Center (LUMC), Leiden University), 2014.
-
43. Douglas AD, Williams AR, Illingworth JJ, et al. Europe PMC Funders Group The Blood-Stage Malaria Antigen PfRH5 is Susceptible to VaccineInducible Cross-Strain Neutralizing Antibody. 2012.
-
44. Douglas AD, Williams AR, Knuepfer E, et al. Europe PMC Funders Group Neutralization of Plasmodium falciparum merozoites by antibodies against PfRH5. 2014;192(1):1-33.
doi:10.4049/jimmunol.1302045.Neutralization.
-
45. Mishra RP, Orta OE, Prachie P, Rappuoli R, Bagnoli F. Vaccines and antibiotic resistance. Curr Opin Microbiol; 2012; 15(5):596-602.
-
46. Zenonos ZA, Dummler SK, Müller-sienerth N, Chen J, Preiser PR, Rayner JC, et al. Basigin is a druggable target for host- oriented antimalarial interventions. 2015;212(8):1145–51.
15
Discussion and feedback