POTENSI MICRORNA10-B DAN MICRORNA-155 SEBAGAI MODALITAS MUTAKHIR DALAM DETEKSI MIKROMETASTASIS/ISOLATED TUMOR CELLS (ITC) PADA KANKER PAYUDARA STADIUM DINI
on

ESSENCE OF SCIENTIFIC MEDICAL JOURNAL
TINJAUAN PUSTAKA
POTENSI MICRORNA10-B DAN MICRORNA-155 SEBAGAI MODALITAS MUTAKHIR DALAM DETEKSI MIKROMETASTASIS/ISOLATED TUMOR CELLS (ITC) PADA KANKER PAYUDARA STADIUM DINI
Feliani Sanjaya,1 Ivana Beatrice Paulus,1 Felicia Puspita Sari1 1Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas Udayana, Bali
ABSTRAK
Pendahuluan: Metastasis merupakan penyebab kematian utama pada kasus kanker payudara. Metastasis diawali dengan mikrometastasis/isolated tumor cells (ITC) yang dapat terekspresi pada sirkulasi darah tepi (Circulating Tumor Cells/CTC) atau sumsum tulang (Disseminated Tumor Cells/DTC). Identifikasi mikrometastasis penting dilakukan sebagai upaya mendeteksi distant metastasis pada masa mendatang. Sampai saat ini belum ada pemeriksaan mikrometastasis yang efektif. Untuk itu, perlu adanya modalitas screening metastasis kanker payudara dengan biomarker miR-10b dan miR-155.
Metode: Tinjauan pustaka disusun berdasarkan literatur seperti jurnal dan website. Kata kunci yang digunakan yaitu “EMT”, “kanker payudara”, “mikrometastasis”, “miR-10b” dan “miR-155” pada search engine scholar.google.com ,www.nature.com dan Pubmed. Dari 80 jurnal yang ditelaah, 70 jurnal ditemukan sesuai dengan topik bahasan dan digunakan sebagai referensi karya ini.
Pembahasan: Proses metastasis kanker payudara didahului oleh mikrometastasis yang berkaitan dengan epithelial-mesenchymal transition (EMT). Proses EMT mengekspresikan beberapa faktor yakni SNAI1 , SNAI2 dan Twist yang berkorelasi dengan peningkatan ekspresi miR-10b secara signifikan. MiR-155 sebagai biomarker yang memilliki peran penting dalam regulasi transforming growth factor β (TGF-β). TGF-β merupakan regulator dari EMT, sehingga miR-155 berkorelasi dengan proses EMT. MiR-155 dan miR-10b memiliki keunggulan baik sensitivitas maupun spesifisitas serta dengan prosedur invasif minimal sehingga jika dikombinasikan dapat menjadi agen potensial biomarker metastasis kanker payudara. Simpulan: MiR-10b dan miR-155 merupakan agen potensial dalam deteksi metastasis kanker payudara. Penelitian lebih lanjut diperlukan untuk mengetahui efektivitas kombinasi miR-10b dan miR-155 dalam mendeteksi metastasis kanker payudara untuk menambah bukti ilmiah.
Kata Kunci: EMT, kanker payudara, mikrometastasis, miR-10b, miR-155
ABSTRACT
Introduction: Metastasis is the leading cause of mortality in breast cancer. Metastasis is from micrometastasis/isolated tumor cells (ITC) which expressed in peripheral blood circulation (Circulating Tumor Cells/CTC) or in bone marrow (Disseminated Tumor Cells/DTC). Identification of micrometastasis is important to perform as the effort of detecting distant metastasis in future. There is still unknown effective examination for micrometastasis recently. Therefore, screening modality for metastasis breast cancer is necessary with biomarkers such as miR-10b and miR-155.
Method: This literature review was arranged according to some literatures from journals and website. The keywords that were used are “breast cancer”, “EMT”, “micrometastasis”, “miR-10b” and “miR-155” in search engine scholar.google.com, www.nature.com and Pubmed. From 80 journals that have been reviewed, 70 journals were found to be suitable as references for this paper.
Discussion: Metastatic breast cancer process is started by micrometastasis which is related with epithelial-mesenchymal transition (EMT). The EMT process expresses some factors like SNAI1 , SNAI2 and Twist that are correlated with elevation of expression of miR-10 significantly. MiR-155 as biomarker has the important role in regulating transforming growth factor β (TGF-β). TGF-β is a regulator from EMT, so that miR-155 correlated to the EMT process. MiR-155 and miR-10b has some benefits in sensitivity, specificity, and minimally invasive procedure so that the combination of both can become the potential agent in metastatic breast cancer detection. Further studies need to be conducted to understand the effectivity of combination between miR-10b and miR-155 in detecting metastatic breast cancer to enrich scientific evidence.
Keywords: breast cancer, EMT, micrometastasis, miR-10b, miR-155
PENDAHULUAN
Metastasis merupakan faktor utama penyebab kematian pada penderita kanker, khususnya kanker payudara. Banyaknya kasus kanker berhubungan dengan pola hidup tidak sehat seperti kurangnya aktivitas fisik, kurang mengonsumsi sayur dan buah, merokok, serta konsumsi alkohol berlebihan.[1] Kanker payudara termasuk jenis kanker dengan prevalensi
terbanyak di dunia dan paling banyak ditemukan pada perempuan. Diperkirakan terdapat 1,7 juta kasus kanker payudara dan angka mortalitas sebesar 522.000 kematian di seluruh dunia pada tahun 2012.[2,3] Di Indonesia, kanker payudara, bersama dengan kanker serviks, masih menjadi jenis kanker dengan prevalensi dan mortalitas tertinggi. Pada tahun
2013, diperkirakan terdapat lebih dari 61 ribu penderita kanker payudara di seluruh Indonesia.[1]
Metastasis berkontribusi sebanyak lebih dari 90% terhadap kematian yang disebabkan oleh kanker.[4,5] Metastasis pada kanker payudara menyebar melalui sistem limfatik dan sistem sirkulasi darah.[6] Meskipun teknik screening pada kanker payudara seperti mammography telah diaplikasikan secara luas, namun teknik ini tidak dapat digunakan untuk mendeteksi adanya metastasis.[7] Selain itu, proses metastasis juga seringkali tidak tertangani karena bersifat sistemik dan sekitar 5% dari penderita kanker payudara telah mengalami distant metastasis pada saat diagnosis awal.[8,9] Metastasis juga terjadi pada hampir 50% penderita kanker payudara yang telah menjalani kemoterapi atau terapi hormonal dan menurunkan angka 5-year survival rate menjadi hanya ~20%.[10,11]
Pada tahun 1977, The American Joint Committee on Cancer (AJCC) menambahkan subkategori mikrometastasis ke dalam Manual for Staging Cancer yang mendefinisikan mikrometastasis (pN1mi) pada kanker payudara secara histopatologi sebagai deposit tumor berukuran >0,2 mm hingga ≤2 mm dan Isolated Tumor Cells (ITC/pN0[i+]) sebagai deposit tumor dengan ukuran ≤0,2 mm/200 sel. ITC juga merupakan istilah yang khusus dalam subkategori mikrometastasis dan umum digunakan dalam sistem staging kanker payudara.[12] Dalam beberapa studi, ITC dan mikrometastasis jarang dibedakan karena adanya relevansi prognosis di antara keduanya.[13] Mikrometastasis/ITC bersifat stem-like/tumorigenik dan berada dalam sirkulasi darah tepi (Circulating Tumor Cells/CTC) atau sumsum tulang (Disseminated Tumor Cells/DTC) penderita kanker payudara yang telah mengalami metastasis sehingga terdapat kecenderungan mengalami resistensi terhadap agen kemoterapi serta berkaitan dengan prognosis buruk.[14–16]
Mikrometastasis/ITC seringkali tidak dapat dideteksi oleh pemeriksaan klinis, laboratorium, maupun dengan menggunakan teknik imaging konvensional seperti CT scan.[17–19] Diketahui 20% dari jumlah penderita kanker payudara node-negative mengalami mikrometastasis. Sementara itu, mikrometastasis juga terjadi secara hematogen, yaitu melalui sirkulasi darah.[17,18] Oleh karena itu, identifikasi mikrometastasis/ITC menjadi penting karena berkorelasi dengan meningkatnya risiko kematian pada penderita kanker payudara stadium dini.[20] CTC menjadi sel tumor yang berperan dalam identifikasi sejumlah karakter sel baik secara subseluler maupun secara epigenetik.[21,22]
Metode pemeriksaan axillary lymph node untuk mendeteksi mikrometastasis/ITC menjadi kurang efektif karena diketahui 1 dari 3 penderita kanker payudara stadium dini yang mengalami distant metastasis merupakan node-negative.[20] Saat ini, Sentinel Lymph Node Biopsy (SLNB) diterima sebagai prosedur standar dalam mendeteksi adanya metastasis pada penderita kanker payudara stadium dini yang tidak ditemukan keterlibatan lymph node (node-negative).[19,23] Namun prosedur ini juga masih memiliki beberapa kekurangan yakni kurang sesuai digunakan untuk mendeteksi terjadinya distant metastasis. Sebanyak 15-20% sel-sel kanker mengalami distant metastasis secara langsung melalui
sirkulasi darah tanpa melalui sentinel lymph node.[17] Selain itu, prosedur SLNB mempunyai beberapa risiko seperti terjadinya lymphedema dan sensory loss, serta peluang terjadinya negatif palsu cukup tinggi.[23] Oleh karena itu, diperlukan pengembangan metode lain yang lebih akurat untuk mendiagnosis dan memprediksi adanya mikrometastasis/ ITC yaitu dengan penggunaan bio-marker seperti circulating miRNA. Selain mempunyai prosedur invasif yang minimal, circulating miRNA memiliki konsentrasi yang cenderung stabil dalam darah karena diproteksi oleh protein atau vesikel.[24]
MicroRNA (miRNA/miR) merupakan jenis RNA non-coding rantai pendek (hanya tersusun dari 19-24 nukleotida). MiRNA berperan dalam regulasi ekspresi gen dan gene-silencing dengan cara menyatukan beberapa komponen pada regio 3’ dari mRNA yang tidak tertranslasi (3’ Untranslated Region/3’UTR).[25–27] Oleh karena fungsinya ini, miRNA yang beredar dalam sirkulasi darah (circulating miRNA) berpotensi sebagai biomarker untuk keperluan diagnostik, deteksi atau prognostik dari kanker serta metastasis.[28,29]
MiR-10b dan miR-155 berkaitan dengan regulasi dari proses EMT yang berkaitan dengan migrasi sel dan proses mikrometastasis.[30–32] Tingkat ekspresi berbeda-beda berdasarkan pada tubuh orang sehat, penderita kanker payudara noninvasif, maupun pada kanker payudara invasif (metastasis). Selanjutnya, konsentrasi/kadar dari miRNA dianalisis dengan menggunakan RT-PCR kuantitatif.[33]
METODE
Penulisan tinjauan pustaka ini menggunakan metode studi kepustakaan yang didasarkan dari hasil studi terhadap berbagai literatur yang telah teruji validitas dan kredibilitasnya, kemudian dianalisis serta dihubungkan gagasannya satu dengan yang lain. Adapun sumber literatur yang digunakan adalah dari Google Scholar dan PubMed.
PEMBAHASAN
Jenis dan Patogenesis Kanker Payudara
Kanker payudara merupakan proliferasi sel yang tidak terkendali pada jaringan payudara.[34] Kanker payudara dapat dibagi menjadi dua secara umum yaitu invasive dan in situ. In situ dapat diklasifikasikan menjadi dua jenis yaitu ductal carcinoma in situ (DCIS) dan lobular carcinoma in situ (LCIS) sedangakan invasive dapat dibagi menjadi infiltrate duktus, invasif lobular, duktal/lobular, mucinous (colloid), tubular, medullary dan papillary carcinoma.[35]
Reseptor yang dapat menjadi marker pada kanker payudara terbagi menjadi estrogen reseptor (ER+), progesteron reseptor (PR+), human epidermal growth factor receptor (HER2+), dan triple negative breast cancers (TNBC/ basal like). [36,37]
Luminal subtipe A (ER+/PR+) dan B (ER+/PR+;HER2+) merupakan kanker payudara yang dimodulasi oleh regulasi naik insulin growth factor (IGF). IGF akan mengaktifkan kaskade jalur Ras and phosphatidylinositol 3-kinase (PI3K). PI3K meningkat akan mengakibatkan beberapa molekul teraktivasi PIK3CA, Akt/phosphatase and tensin homolog (PTEN). Rangkaian aktivasi kaskade tersebut
menyebabkan proliferasi sel yang mengarah pada keganasan.
Kanker payudara tipe HER2+ disebabkan aktivasi sinyal PI3K/Akt, FGF, IGF, and PI3K/Akt.[37,38] TNBC adalah jenis kanker payudara yang defisiensi ekspresi ER+, PR+ dan HER2+.[36,39]TNBC mengalami mutasi pada p53 sehingga menginhibisi gen CCNA1 dan RB sehinga menginduksi fase G1 ke fase S dan mengaktivasi gen ATM yang memicu mutasi BRCA1 dan BRCA2 sehingga memasuki ke fase G1/S/M dan akhirnya terjadi proliferasi sel.[39]
Sel kanker memiilki kemampuan metastasis sebagai penyebaran dari target organ primer ke sekitarnya maupun memungkinkan ke jaringan yang lebih jauh. Metastasis dapat melalui sistem limfatik dan peredaran darah.[40] Sel yang berproliferasi memilki mekanisme angiogenesis yaitu pembentukan pembuluh darah untuk mendapatkan asupan nutrisi layaknya sel fisiologis dan memudahkan sel kanker untuk mengalami metastasis maupun recurrence dari kanker payudara setelah masa terapi. Angiogenesis ditandai dengan ekspresi dari vascular endothelial growth factor (VEGF), basic fibroblast growth factor dan hypoxia-inductable factor-1 (HIF-1). Hipoksia pada sel tersebut dapat mengekspesikan HIF-1 yang mampu mengendalikan transkripsi gen VEGF.[40–42]
Intravasasi sistem peredaran darah maupun kelenjar getah bening mengawali proses metastasis kemudian migrasi ke pembuluh darah melalui mekanisme ekstravasasi dan metastasis. Mekanisme intravasasi melibatkan adhesi antar sel oleh cadherin dan extracellular matrix (ECM). Invasi sel kanker diawali melalui mekanisme adhesi dengan ECM dan integrin yang terekspresi oleh upregulate N-cadherin, lalu dilanjutkan dengan downregulate E-cadherin sehinga adhesi antar sel target melemah. E-Cadherin berperan dalam ikatan antar sel sedangkan ekspresi N-cadherin berperan dalam mesenchymal cells dan epithelial to-mesenchymal transition (EMT). Proses adhesi sel kanker dan ECM dibantu oleh metalloproteinases (MMPs) , EMT melalui enzim protease dan urokinase plasminogen activator (uPA) yang melisiskan ECM sehingga memudahkan sel kanker untuk metastasis. [43–45]
EMT sebagai mekanisme yang mendasari terjadinya metastasis dieskpresikan beberapa faktor SNAI1, SNAI2 (Slug), Twist and Zeb1/Zeb2 yang teraktivasi oleh TGF-β, Notch ,Wnt maupun hypoxia.[46–48] Twist merupakan faktor transkripsi EMT yang berfungsi dalam tahap invasi dan metastasis, dapat mengganti tumor sel menjadi keganasan dengan mekanisme cancer stem cell (CSC) dan meningkatkan resistensi terhadap terapi.[47] Snail memiliki kemampuan migrasi dan invasi sel tumor maupun kanker melalui proses EMT dan aktivasi MAPK (ERK1/2). [49–51]
Mekanisme MiRNA pada Kanker
MicroRNAs (miR), berfungsi dengan mengikat (3'UTR) dari molekul messenger RNA (mRNA), memicu pembentukan kompleks, yang pada mamalia, represi post-transcriptional terikat mRNA, baik dengan mekanisme degradasi mRNA maupun penghambatan translasi protein mRNA.[52] mRNA, baik dengan degradasi mRNA atau penghambatan translasi protein mRNA. MiR-10b mengekpresikan twist berfungsi menghambat translasi homeobox D10
(HOD10). HOD10 befungsi untuk supresi metastasis kanker.[30,53,54]
MicroRNA (miR) adalah kelompok RNA yang tidak mengkode protein (non-coding RNA) dan tersusun atas 19-24 nukleotida yang terlibat dalam mengatur stabilitas dan translasi mRNA. MiRNA memiliki ciri khas yaitu mengatur ekspresi gen dengan mengikatkan diri (hybridize) pada region 3’ dari mRNA yang tidak tertranslasi dan menyebabkan degradasi pasca transkripsi mRNA bersangkutan dalam sel yang berproliferasi.[26] Gen-gen miRNA tersebar di dalam genom dan diperkirakan berjumlah 2-5% dari gen-gen manusia.[55] Sebagian besar miRNA diekspresikan sebagai transkrip polisistronik.[56] Satu miRNA dapat mempunyai banyak mRNA target sehingga dapat diperkirakan bahwa lebih dari 1/3 gen-gen manusia diatur oleh miRNA. MiRNA berperan sebagai molekul pengatur utama yang mengontrol berbagai macam proses dasar yang ada di dalam sel, seperti proliferasi, apoptosis, diferensiasi, sifat invasif, dan respon stres.[57,58]
Gen-gen miRNA ditranskripsikan menjadi miRNA primer (pri-miRNA) oleh RNA polimerase II. Transkrip pri-miRNA adalah non coding RNA (ncRNA) dengan struktur sekunder stem loop yang mengandung prekursor miRNA (pre-miRNA). Transkrip pri-miRNA dipotong oleh enzim Drosha (RNA polimerase III) menjadi pre-miRNA yang akan dikeluarkan menuju sitoplasma oleh exportin 5, untuk selanjutnya diproses menjadi miRNA yang matang oleh Dicer (RNA polimerase III yang kedua).[59] Pada sel normal, perbandingan antara pri-miRNA terhadap miRNA yang matang mendekati satu, sedangkan pada sel-sel kanker terdapat banyak gen miRNA yang ditranskripsikan namun tidak diproses menjadi miRNA yang matang.[60]
Ekspresi abnormal miRNA dapat ditemukan pada spesimen tumor dan lini sel kanker ketika dibandingkan dengan kontrol jaringan normal. MiRNA berikatan secara spesifik dengan targetnya, sehingga polimorfisme nukleotida tunggal (single nucleotide polymorphism/ SNP) pada urutan mRNA target dapat mengarah kepada ekspresi gen yang menimbulkan sebuah penyakit, salah satunya adalah kanker.[57] Sebagian besar miRNA yang terdapat dalam sirkulasi darah dapat ditemukan di dalam exosomes dan beberapa penelitian mengemukakan bahwa miRNA mungkin dihasilkan dari sel yang telah mati atau sel yang rusak dan sedang menuju kematian sel tersebut.[61] Selama ini, pengembangan molekul sebagai biomarker yang dapat diuji dari spesimen manusia mempunyai kendala berupa ketidakstabilan dan tidak resisten terhadap penyimpanan. RNAse yang terdapat pada cairan tubuh dapat mendegradasi molekul RNA (termasuk miRNA). Sedangkan, penelitian menunjukkan bahwa serum miRNA dapat tetap stabil pada lingkungan ekstraseluler, pemanasan, tingkat pH yang sangat rendah atau tinggi, waktu penyimpanan yang lama, dan pembekuan-pencairan berulangkali. Keunikan miRNA ini menjanjikan penemuan biomarker-biomarker baru yang dapat digunakan sebagai penegak diagnosis dan prognosis pada penyakit kanker[62]
Peranan MiRNA dalam Formasi Mikrometastasis
MiRNA berpotensi untuk digunakan sebagai biomarker pada penentuan diagnostik atau prognostik
penyakit kanker, karena profil ekspresi mRNA merefleksikan asal tumor, stadium, dan variabel patologis lainnya. MiRNA memiliki peran dalam mekanisme invasi dan migrasi sel kanker (epithelial-messenchymal transdition / EMT), yang merupakan langkah awal bagi kanker untuk bermetastasis.[29] EMT menginduksi perubahan bentuk dan motilitas dari sel-sel epitel. Jika sel epitel sudah berubah menjadi fenotip mesenkimal, sel-sel kanker dapat kehilangan kemampuan untuk mengatur aktivitas normal kontak antar sel (cell-cell contact) dan menjadi mobile serta invasif sehingga dapat menyebar ke jaringan disekitarnya. [63] Dalam proses invasi dan metastasis (Gambar 1), sel kanker sebelumnya sudah terdesak oleh sel tumor primer, sehingga (1) sel melakukan invasi secara lokal melewati matriks ekstraseluler disekitarnya, (2) memasuki lumina dari pembuluh darah yang prosesnya disebut intravasation, (3) menyebar secara sistemik melalui sistem peredaran darah, (4) tertangkap pada suatu organ, (5) keluar dari lumina pembuluh darah dan memasuki jaringan parenkim dari organ tersebut (extravasation), (6) beradaptasi di lingkungan yang baru dan bersiap untuk membentuk mikrometastasis, (7) menyelesaikan proses metastasis sehingga akhirnya dapat ditemukan nodul-nodul metastasis[55] Penekanan ekspresi dari E-cadherin pada sel kanker epitel merupakan tanda dari proses EMT. Beberapa molekul yang diketahui dapat berfungsi sebagai penekan ekspresi dari E-cadherin adalah ZEB, Twist, Snail, Slug, dan TGF-β.[64]
Penelitian menunjukkan bahwa kelompok miR-200 (miR2001/200b/200c/141/429) dapat menghambat migrasi dan invasi sel dengan menargetkan ZEB dalam beberapa tipe kanker seperti kanker ovarium dan kanker kandung kemih. Selain itu, pada kanker payudara ditemukan beberapa jenis miRNA yang ekspresinya meningkat dengan spesifik diantaranya miR-155 dan miR-10b.[30]
Peranan miR-10b dalam Mikrometastasis dan Regulasinya
Sebuah penelitian menunjukkan bahwa sel tumor kontrol apabila dibandingkan dengan sel tumor pada kultur SUM149 yang memiliki ekspresi berlebihan dari
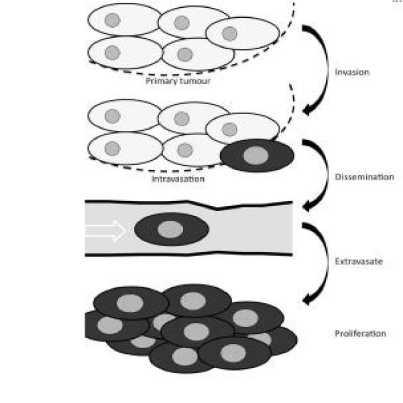
Gambar 1. Tahapan Metastasis Kanker Payudara.[6]
miR-10b tidak memiliki perbedaan ukuran yang signifikan, hal ini menunjukkan bahwa ekspresi berlebihan dari miR-10b tidak berpengaruh secara signifikan pada tahap awal pembentukan tumor.[30] Akan tetapi, MiR-10b akan diekspresi dengan kadar yang tinggi hanya pada sel kanker yang mengalami metastasis. Sebagai contoh, ekspresi miR-10b akan mencapai 50-fold lebih tinggi pada sel kultur MDA-MB-231, yaitu kultur sel yang berpotensi bermetastasis, apabila dibandingkan dengan sel kultur MCF-7, sel yang tidak berpotensi untuk bermetastasis (Gambar 2a). Ekspresi miR-10b juga meningkat pada sel yang mengalami motilitas dan bersifat invasif (Gambar 2b, c).[30] MiR-10b hanya diekspresikan secara berlebihan pada kanker payudara yang mengalami metastasis mengindikasi bahwa gen yang tidak mengode protein dari miRNA ini mungkin merupakan target dari suatu faktor transkripsi yang dapat mengaktivasi sel untuk bermetastasis secara spesifik. Ekspresi dari miR-10b berkorelasi dengan ekspresi dari salah satu faktor transkripsi yaitu Twist.[65] Korelasi antara Twist dan miR-10b berhubungan dengan penghambatan sintesis protein HOXD10 yang menyebabkan terbentuknya produk dari gen pro-metastasis yaitu RHOC, produk tersebut akan menyebabkan terjadinya migrasi dan invasi sel.[30]
Diagnosis metastasis kanker payudara menggunakan miR-10b memiliki sensitivitas sebesar 71% dan spesifisitas sebesar 72% jika digunakan untuk mendiagnosis proses metastasis pada sel kanker payudara (Gambar 3). [66] Tampak perbedaan konsentrasi miR-10b pada tiap garis sel ketika dianalisis dengan menggunakan real-time RT-PCR dan migration serta invasion assay pada masing-masing sel kultur HMEC dan SUM149.
Peranan miR-155 dalam Mikrometastasis dan Regulasinya
MicroRNA-155 (miR-155) merupakan salah satu biomarker paling umum yang diekspresikan pada keganasan.[67] Oleh karena itu, miR-155 termasuk biomarker yang menjanjikan dalam upaya deteksi kanker, khususnya kanker payudara beserta metastasisnya (migrasi sel). MiR-155 merupakan miRNA yang bersirkulasi dan dapat dideteksi di
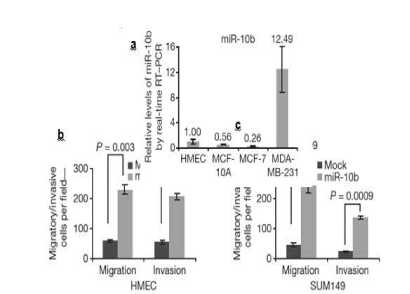
Gambar 2. Ekspresi miR-10b. (a) Hasil Real-time RT-PCR miR-10b. (b) Transwell migration assay dan matrigel invasion assay dari sel kultur HMEC dan SUM149.[30]
seluruh bagian darah, serum, dan plasma dari penderita kanker payudara.[68] Kenaikan konsentrasi miR-155 dalam darah terjadi pada jaringan kanker payudara dibandingkan dengan jaringan payudara normal hingga sebanyak 1,6 kali (P = 0,008) dan 2,7 kali (P = 0,0001) pada M0 dan M1.[25,28,68,69]
MiR-155 ditemukan dari proses gen B-Cell Integration Cluster (BIC) pada kromosom 21 manusia yang merupakan transkripsi non-coding.[67] Struktur genomik pada gen BIC manusia terdiri dari 3 ekson dimana ekson 3 mengode miR-155. Konstruksi dari ekspresi miR-155 stabil: 5’-
TGCTGTTAATGCTAATTGTGATAGGG
GGTTTTGGCCACTGACTGACCCCCTATCAATTAGC ATTA-3’ dan 5’-CCT
GTAATGCTAATTGATAGGGGGTCAGTCAGTGGCC AAAACCCCCTATCACAATTAGCATTAAC-3’. [31]
Biomarker ini berperan penting dalam regulasi transforming growth factor β (TGF-β) dan TGF-β merupakan regulator dari epithelial-mesenchymal transition (EMT). Jika sel-sel kanker mengalami proses EMT, maka sel-sel tersebut akan mengekspresikan fenotip menyerupai komponen mesenkimal (stem-like) yang ditandai oleh kehilangan kemampuan adhesi pada sel-sel epitelnya serta pada komponen sitoskeletalnya. Jika tahap ini telah terjadi, maka invasi dan metastasis akan terjadi.[14,31,32]
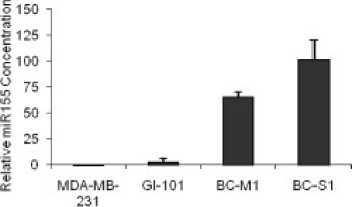
Transforming growth factor β (TGF-β) menginduksi ekspresi miR-155 dan aktivitas promotornya melalui jalur Smad4. Peredaman dari miR-155 dapat menekan (TGF-β)-induced epithelial-mesenchymal transition (EMT) dan menyebabkan disolusi tight junction sehingga miR-155 memengaruhi terjadinya metastasis. MiR-155 mempunyai peranan penting pada TGF-β-induced EMT dan migrasi sel serta invasi dengan menarget RhoA.[31] Hal ini terbukti dari penelitian yang dilakukan oleh Roth et al, 2010 yang menyatakan hasil bahwa terdapat kenaikan konsentrasi dari miR-155 secara signifikan terhadap garis sel mikrometastasis pada kanker payudara, yaitu BC-M1 dan BC-S1 dari DTC yang mengekspresikan fenotip EMT (Gambar 4). [28,70]
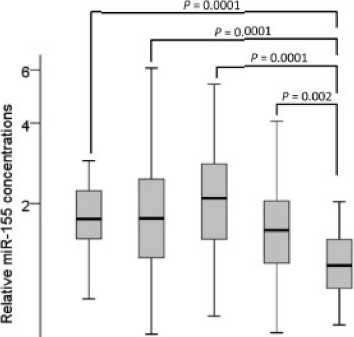
Namun menurut studi yang dilakukan Eichelser et al, dalam konsentrasi serum, miR-155 memiliki spesifisitas rendah jika digunakan untuk membedakan orang sehat dengan penderita kanker payudara primer (M0) (Tabel 1). Pemeriksaan miR-155 hanya efektif
CflIILkitt
Gambar 4. Konsentrasi miR-155 terhadap Garis Sel Mikrometastasis BC-M1 dan BC-S1[28] Konsentrasi miR-155 menunjukkan kenaikan signifikan pada garis sel mikrometastasis dibandingan dengan garis sel kanker payudara primer (MDA-MB-231).
oj r τ r r r
Healthy Tripfe HER2+ ER+JPR+ M1
MQ
Gambar 5. Kuantifikasi Konsentrasi Serum pada Penderitas Kanker Payudara Primer dan Metastasis.[33] Perbandingan nilai relative miR-155 dalam darah orang sehat, penderita kanker payudara M0 (Triple Negative Breast Cancer/TNBC;
HER2+; ER+/PR+), dan M1. Nilai P dihitung dengan Mann-Whitney U-test.
diaplikasikan pada penderita kanker payudara yang telah mengalami distant metastasis. Konsentrasi miR-155 dalam darah dianalisis dengan RT-PCR kuantitatif (Gambar 5).[33] Terdapat perbedaan nilai relatif sensitivitas dan spesifisitas pada miR-155 di tiap kondisi penderita.
Teknik dan Analisis MiRNA dengan RT-qPCR
MiRNA yang berada dalam plasma diisolasi dari 200 uL menggunakan miRNeasy Mini Kit dan dielusi dalam 50 mL larutan elusi. Kemudian, RNA dimurnikan menggunakan RNeasy MinElute. Pembersihan kit (Qiagen) untuk menghilangkan kotoran dan akhirnya dielusi dalam 21 uL larutan elusi sesuai dengan protokol pabrik. Jumlah miRNAs (mir-10b) dikuantifikasi dengan reverse transkripsi kuantitatif real-time PCR (RT-qPCR) menggunakan human TaqMan MicroRNA Assay kit (Applied Biosystems). Lima mikroliter RNA dielusi itu terbalik ditranskripsikan dengan spesifik dilingkarkan RT primer untuk dengan menggunakan TaqMan MicroRNA reverse transkripsi kit (Applied Biosystems). Selanjutnya, 1.33 uL produk transkripsi terbalik digunakan sebagai template di RT-qPCR menggunakan TaqMan MicroRNA Tes (Applied Biosystems). Semua reaksi dijalankan pada ABI PRISM 7000 Detection System (Applied Biosystems). Siklus kuantifikasi (Cq) nilai-nilai dihitung dengan SDS 1.2 software (Applied Biosystems). Ekspresi miR dari plasma dinormalisasi menggunakan metode 2-dCq relatif. dCq kemudian dihitung dengan mengurangkan nilai Cq dari nilai-nilai Cq dari miRNAs. DdCq
Tabel 1. Perbandingan nilai relatif miR-155 pada setiap kondisi pasien (Sehat, M0, M1)[33]
|
M0 vs Sehat |
M1 vs Sehat |
M0 vs M1 | ||||
|
miR-155 |
Sensitivitas |
Spesifitas |
Sensitivitas |
Spesifitas |
Sensitivitas |
Spesifitas |
|
70,6 |
42,7 |
85,3 |
70 |
79,5 |
64,3 | |
kemudian dihitung dengan mengurangkan dCq plasma pasien non-metastasis dengan dCq pasien metastatik. Folding change gen dihitung dengan persamaan 2-ddCq. RT-qPCR menunjukkan median dCq values (range) miR-10b adalah 8.06 (5.1–10.89) pada pasien sehat, 7.47 (4.74–9.12) pada pasien M0, and 4.61 (2.15–5.52) pada pasien M1.[66]
SIMULAN
Telah dilakukannya berbagai penelitian baik in vitro maupun in vivo menunjukan ekspresi yang signifikan miR-10b dan miR-155 sebagai screening metastasis kanker payudara. Metode screening miR-10b dan miR-155 minimal invasif yakni dengan pengambilan darah. Dengan demikian, miR-10b dan miR-155 dapat menjadi screening mikrometastasis kanker payudara di masa depan.
SARAN
Diperlukan penelitian lebih lanjut mengenai efektivitas kombinasi miR-10b dan miR-155 dalam mendeteksi metastasis kanker payudara. MiR-10b dan miR-155 dapat digunakan screening metastasis kanker payudara dengan bukti ilmiah yang kuat.
DAFTAR PUSTAKA
-
1. Kementrian Kesehatan RI Pusat Data dan Informasi Kesehatan. Stop Kanker. infodatin-Kanker. 2015;hal 3.
-
2. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin [Internet]. Jan [cited 2016 Aug 20];66(1):7–30. Available from:
http://www.ncbi.nlm.nih.gov/pubmed/26742998
-
3. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):e359–86.
-
4. Monteiro J, Fodde R. Cancer stemness and metastasis: Therapeutic consequences and perspectives. Eur J Cancer [Internet]. 2010;46(7):1198–203. Available from: http://dx.doi.org/10.1016/j.ejca.2010.02.030
-
5. Alečković M, Kang Y. Regulation of cancer metastasis by cell-free miRNAs. Biochim Biophys Acta -Rev Cancer. 2015;1855(1):24–42.
-
6. McGuire A, Brown JAL, Kerin MJ. Metastatic breast cancer: the potential of miRNA for diagnosis and treatment monitoring. Cancer Metastasis Rev. 2015;34(1):145–55
-
7. Kang P, Liao M, Wester MR, Leeder JS, Pearce RE. NIH Public Access. Ratio. 2010;36(3):490–9.
-
8. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin [Internet]. 2011;61(2):69–90. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21296855
-
9. Coughlin SS, Ekwueme DU. Breast cancer as a global health concern. Cancer Epidemiol. 2009;33(5):315–8.
-
10. Nicolini A, Giardino R, Carpi A, Ferrari P, Anselmi L, Colosimo S, et al. Metastatic breast cancer: an updating. Biomed Pharmacother [Internet]. 2006;60(9):548–56. Available from:
http://linkinghub.elsevier.com/retrieve/pii/S075333 2206002496%0Ahttp://www.ncbi.nlm.nih.gov/pub med/16950593
-
11. Yardley DA. Visceral Disease in Patients With Metastatic Breast Cancer: Efficacy and Safety of Treatment With Ixabepilone and Other Chemotherapeutic Agents. Clin Breast Cancer [Internet]. 2017 Jan 6;10(1):64–73. Available from: http://dx.doi.org/10.3816/CBC.2010.n.009
-
12. Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol [Internet]. 2010;17(6):1471–4. Available from:
http://www.ncbi.nlm.nih.gov/pubmed/20180029
-
13. Boer M De, Deurzen CHM Van, Borm GF, Diest PJ Van, Adang EMM, Nortier JWR, et al. new england journal. 2009;653–63.
-
14. Theodoropoulos PA, Polioudaki H, Agelaki S, Kallergi G, Saridaki Z, Mavroudis D, et al. Circulating tumor cells with a putative stem cell phenotype in peripheral blood of patients with breast cancer. Cancer Lett [Internet]. 2010;288(1):99–106. Available from:
http://dx.doi.org/10.1016/j.canlet.2009.06.027
-
15. Gorges TM, Pantel K. Circulating tumor cells as therapy-related biomarkers in cancer patients. 2013;931–9.
-
16. Trumpp A, Wiestler OD. Mechanisms of Disease: cancer stem cells--targeting the evil twin. Nat Clin Pract Oncol. 2008;5(6):337–47.
-
17. Tseng SPLLWW. Micrometastatic Cancer Cells in Lymph Nodes, Bone Marrow, and Blood. CA Cancer J Clin. 2014;64(3):195–206
-
18. Pantel K, Alix-Panabières C, Riethdorf S. Cancer micrometastases. Nat Rev Clin Oncol [Internet]. 2009;6(6):339–51. Available from:
http://dx.doi.org/10.1038/nrclinonc.2009.44
-
19. Cheng G, Kurita S, Torigian DA, Alavi A. Current status of sentinel lymph-node biopsy in patients with breast cancer. Eur J Nucl Med Mol Imaging. 2011;38(3):562–75.
-
20. Iqbal J, Ginsburg O, Giannakeas V, Rochon PA, Semple JL, Narod SA. The impact of nodal micrometastasis on mortality among women with
early-stage breast cancer. Breast Cancer Res Treat. 2016;1–13.
-
21. Lin H, Balic M, Zheng S, Datar R, Cote RJ. Disseminated and circulating tumor cells: Role in effective cancer management. Crit Rev Oncol Hematol [Internet]. 2011;77(1):1–11. Available from:
http://dx.doi.org/10.1016/j.critrevonc.2010.04.008
-
22. Pantel K, Alix-Panabières C. Circulating tumour cells in cancer patients: Challenges and perspectives. Trends Mol Med. 2010;16(9):398– 406.
-
23. Wiatrek R, Kruper L. Sentinel lymph node biopsy indications and controversies in breast cancer. Maturitas [Internet]. 2011;69(1):7–10. Available from:
http://dx.doi.org/10.1016/j.maturitas.2011.02.006
-
24. Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA [Internet]. 2008;105(30):10513–8. Available from:
http://www.ncbi.nlm.nih.gov/pubmed/18663219
-
25. Paranjape T, Slack FJ, Weidhaas JB. MicroRNAs: tools for cancer diagnostics. Gut [Internet]. 2009;58(11):1546–54. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19834118%5 Cnhttp://www.pubmedcentral.nih.gov/articlerender .fcgi?artid=PMC2802653
-
26. Wuchty S, Arjona D, Bozdag S, Bauer PO. Involvement of microRNA families in cancer. Nucleic Acids Res. 2012;40(17):8219–26.
-
27. Bhagavathi S, Czader M. MicroRNAs in benign and malignant hematopoiesis. Arch Pathol Lab Med. 2010;134(9):1276–81.
-
28. Roth C, Rack B, Müller V, Janni W, Pantel K, Schwarzenbach H. Circulating microRNAs as blood-based markers for patients with primary and metastatic breast cancer. 2010;6–13.
-
29. Meng F, Wu G. The rejuvenated scenario of epithelial-mesenchymal transition (EMT) and cancer metastasis. Cancer Metastasis Rev. 2012;31(3–4):455–67.
-
30. Ma L, Teruya-Feldstein J, Weinberg R a. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature.
2007;449(7163):682–8.
-
31. Kong W, Yang H, He L, Zhao J, Coppola D, Dalton WS, et al. MicroRNA-155 Is Regulated by the Transforming Growth Factor beta/Smad Pathway and Contributes to Epithelial Cell Plasticity by Targeting RhoA. Mol Cell Biol. 2008;28(22):6773–84.
-
32. Zavadil J, Narasimhan M, Blumenberg M, Schneider RJ. Transforming Growth Factor-β and microRNA:mRNA Regulatory Networks in Epithelial Plasticity. Cells Tissues Organs [Internet]. 2007;185(1–3):157–61. Available from: http://www.karger.com/DOI/10.1159/000101316
-
33. Eichelser C, Flesch-Janys D, Chang-Claude J, Pantel K, Schwarzenbach H. Deregulated serum concentrations of circulating cell-free microRNAs miR-17, miR-34a, miR-155, and miR-373 in human breast cancer development and progression. Clin Chem. 2013;59(10):1489–96.
-
34. Centers for Disease Control. What Is Breast
Cancer? Control, Division of Cancer Prevention and Prevention, Centers for Disease Control and. 2016.
-
35. Malhotra GK, Zhao X, Band H, Band V. Histological, molecular and functional subtypes of breast cancers. Cancer Biol Ther. 2010;10(10):955–60
-
36. Foulkes W, Smith I, Reis-Filho J. Triple-Negative Breast Cancer. N Engl J Med.
2010;363(20):1938–48.
-
37. Saijo CJH, G. van de VD, Haller; David J. Kerr; Michael Baumann; Nagahiro. Oxford Textbook of Oncology. Oxford Textb Oncol. 2016;3–10.
-
38. Kabel aM, Baali FH. Breast Cancer: Insights into Risk Factors , Pathogenesis , Diagnosis and Management. 2015;3(2):28–33.
-
39. Koboldt DC, Fulton RS, McLellan MD, Schmidt H, Kalicki-Veizer J, McMichael JF, et al. Comprehensive molecular portraits of human breast tumours. Nature. 2012;490(7418):61–70.
-
40. Kumar V, Abbas AK, Aster JC. Robbins Basic Pathology. 9th ed. Klatt E c, Kumar R, Mitchell RN, editors. basic pathology. Philadelphia, Pennsylvania: Elsevier Inc; 2013. 716-762 p.
-
41. Banerjee S, Dowsett M, Ashworth A, Martin L-A. Mechanisms of disease: angiogenesis and the management of breast cancer. Nat Clin Pract Oncol. 2007;4(9):536–50.
-
42. Schneider BP, Miller KD. Angiogenesis of breast cancer. J Clin Oncol. 2005;23(8):1782–90.
-
43. Scully OJ, Bay B-H, Yip G, Yu Y. Breast cancer metastasis. Cancer Genomics Proteomics [Internet]. 2012;9(5):311–20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22990110
-
44. Weigelt B, Peterse JL, van ’t Veer LJ. Breast cancer metastasis: markers and models. Nat Rev Cancer. 2005;5(August):591–602.
-
45. Thiery JP, Morgan M. Breast cancer progression with a Twist. Nat Med. 2004;10(8):777–8.
-
46. Felipe Lima J, Nofech-Mozes S, Bayani J, Bartlett J. EMT in Breast Carcinoma—A Review. J Clin Med. 2016;5(7):65.
-
47. Wang Y, Liu J, Ying X, Lin PC, Zhou BP. Twist-mediated Epithelial-mesenchymal Transition Promotes Breast Tumor Cell Invasion via Inhibition of Hippo Pathway. Sci Rep.
2016;6(April):24606.
-
48. Lander R, Nasr T, Ochoa SD, Nordin K, Prasad MS, Labonne C. Interactions between Twist and other core epithelial-mesenchymal transition factors are controlled by GSK3-mediated phosphorylation. Nat Commun. 2013;4:1542.
-
49. Smith BN, Burton LJ, Henderson V, Randle DD, Morton DJ, Smith BA, et al. Snail promotes epithelial mesenchymal transition in breast cancer cells in part via activation of nuclear ERK2. PLoS One. 2014;9(8).
-
50. Wu Y, Zhou BP. Snail More than EMT. 2010;(June):199–203.
-
51. Wang Y, Shi J, Chai K, Ying X, Zhou BP. The Role of Snail in EMT and Tumorigenesis. 2014;2(4):2733–52.
-
52. Abba ML, Patil N, Leupold JH, Allgayer H. MicroRNA Regulation of Epithelial to Mesenchymal Transition. 2016;
-
53. Lu Y, Cheng A. Cancer Science & Research: Open Access Pathological Function and Clinical
Significance of Microrna- 10b in Cancer. 2014;
-
54. Bourguignon LYW, Wong G, Earle C, Krueger K, Spevak CC. Hyaluronan-CD44 interaction promotes c-Src-mediated twist signaling, microRNA-10b expression, and RhoA/RhoC upregulation, leading to Rho-kinase-associated cytoskeleton activation and breast tumor cell invasion. J Biol Chem. 2010;285(47):36721–35.
-
55. Paranjape T, Slack FJ, Weidhaas JB. MicroRNAs: tools for cancer diagnostics. Gut.
2009;58(11):1546–54.
-
56. Farazi TA, Spitzer JI, Morozov P, Tuschl T. NIH Public Access. Brain [Internet]. 2012;32(2):1–8. Available from:
http://www.pubmedcentral.nih.gov/articlerender.fc gi?artid=3170756&tool=pmcentrez&rendertype=a bstract
-
57. Li M, Ding X, He M, Cheng S. microRNA and cancer. AAPS J. 2010;12(3):309–17.
-
58. Wang J, Zhang K-Y, Liu S-M, Sen S. Tumor-Associated Circulating MicroRNAs as Biomarkers of Cancer. Vol. 19, Molecules . 2014.
-
59. Kala R, Peek GW, Hardy TM, Tollefsbol TO. MicroRNAs: an emerging science in cancer epigenetics. J Clin Bioinforma. 2013;3(1):6.
-
60. Hulf T, Sibbritt T, Wiklund ED, Bert S, Strbenac D, Statham AL, et al. Discovery pipeline for epigenetically deregulated miRNAs in cancer: integration of primary miRNA transcription. BMC Genomics [Internet]. 2011;12(1):54. Available from: http://dx.doi.org/10.1186/1471-2164-12-54
-
61. Turchinovich A, Weiz L, Langheinz A, Burwinkel B. Characterization of extracellular circulating microRNA. Nucleic Acids Res. 2011;39(16):7223– 33.
-
62. Hunter MP, Ismail N, Zhang X, Aguda BD, Lee EJ, Yu L, et al. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One. 2008;3(11).
-
63. Kalluri R, Weinberg R a. Review series The basics of epithelial-mesenchymal transition. J Clin
Invest. 2009;119(6):1420–8.
-
64. Chua HL, Bhat-Nakshatri P, Clare SE, Morimiya A, Badve S, Nakshatri H. NF-kappaB represses E-cadherin expression and enhances epithelial to mesenchymal transition of mammary epithelial cells: potential involvement of ZEB-1 and ZEB-2. Oncogene. 2007;26(5):711–24.
-
65. Yang J, Mani SA, Donaher JL, Ramaswamy S, Itzykson RA, Come C, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis. Cell. 2004;117(7):927– 39.
-
66. Chen W, Cai F, Zhang B, Barekati Z, Zhong XY. The level of circulating miRNA-10b and miRNA-373 in detecting lymph node metastasis of breast cancer: potential biomarkers. Tumour Biol [Internet]. 2013;34(1):455–62. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23238818
-
67. Higgs G, Slack F. The multiple roles of microRNA-155 in oncogenesis. J Clin Bioinforma [Internet]. 2013;3(1):17. Available from:
http://jclinbioinformatics.biomedcentral.com/article s/10.1186/2043-9113-3-17
-
68. Heneghan HM, Miller N, Lowery AJ, Sweeney KJ, Newell J, Kerin MJ. Circulating microRNAs as novel minimally invasive biomarkers for breast cancer. Ann Surg. 2010;251(3):499–505.
-
69. Iorio M V., Casalini P, Tagliabue E, Ménard S, Croce CM. MicroRNA profiling as a tool to understand prognosis, therapy response and resistance in breast cancer. Eur J Cancer. 2008;44(18):2753–9.
-
70. Bartkowiak K, Wieczorek M, Buck F, Harder S, Moldenhauer J, Effenberger KE, et al. TwoDimensional Differential Gel Electrophoresis of a Cell Line Derived from a Breast Cancer Micrometastasis Revealed a Stem/Progenitor Cell Protein Profile. J Proteome Res [Internet]. 2009 Apr 3;8(4):2004–14. Available from:
http://dx.doi.org/10.1021/pr8009758
20
Discussion and feedback