SELF-NANOEMULSIFYING DRUG DELIVERY SYSTEM (SNEDDS) UNTUK MENINGKATKAN BIOAVAILABILITAS ROSUVASTATIN SEBAGAI UPAYA PENGOBATAN PADA PENYAKIT HIPERLIPIDEMIA
on
ARTIKEL TINJAUAN PUSTAKA
Essence of Scientific Medical Journal (2023), Volume 21, Number 1:29-37
P-ISSN.1979-0147, E-ISSN. 2655-6472

TINJAUAN PUSTAKA
SELF-NANOEMULSIFYING DRUG DELIVERY SYSTEM (SNEDDS) UNTUK MENINGKATKAN BIOAVAILABILITAS ROSUVASTATIN SEBAGAI UPAYA PENGOBATAN PADA PENYAKIT HIPERLIPIDEMIA
Tracey Odella Jiraldi Akemah,1 Natasya Pramatya Putri,1 Ni Nyoman Tri Eka Buanasari,2 Agung Wiwiek Indrayani 3
ABSTRAK
Pendahuluan: Hiperlipidemia merupakan keadaan dimana kadar kolesterol atau low-density lipoprotein cholesterol (LDL-C) dalam darah di atas kadar normal. Rosuastatin merupakan obat jenis statin yang memiliki efektivitas paling tinggi dalam menurunkan LDL-C sehingga dapat mengobati hiperlipidemia dengan baik. Pemberian rosuvastatin dalam dosis yang kecil memiliki kemampuan untuk mengurangi kadar LDL-C dengan lebih baik dibandingkan dengan obat statin lainnya yang membutuhkan dosis dalam jumlah lebih banyak. Penggunaan rosuvastatin dengan pemberian secara oral belum maksimal dalam pengobatan hiperlipidemia karena bioavailabilitas dari rosuvastatin sangat rendah yaitu sekitar 20%. Oleh karena itu, dibutuhkan suatu sistem penghantaran obat yang dapat meningkatkan penyerapan rosuvastatin.
Pembahasan: SNEDDS merupakan modifikasi baru pada sistem penghantaran obat yang dikategorikan sebagai lipid based drug delivery system (LBDDS) berupa campuran isotropik yang terdiri dari komponen minyak, surfaktan dan kosolven (kosurfaktan). SNEDDS akan meningkatkan kelarutan obat dalam saluran pencernaan dengan membentuk partikel-partikel yang sangat kecil yaitu <200 nm melalui nanoemulsi dan meningkatkan luas permukaan antara fase air dan minyak. Rosuvastatin dalam bentuk SNEDDS dapat meningkatkan kelarutan dan bioavailabilitas obat dengan memperbaiki profil farmakokinetika obat.
Simpulan: Rosuvastatin dalam bentuk SNEDDS layak untuk ditinjau lebih lanjut karena efektif dalam menyebabkan perubahan yang sangat signifikan terhadap bioavailabilitas rosuvastatin yang rendah, yaitu dari bioavailabilitas 20% dapat ditingkatkan hingga >80% dengan pemberian SNEDDS.
Kata Kunci: Bioavailabilitas, hiperlipidemia, rosuvastatin, SNEDDS
ABSTRACT
1Program Studi Sarjana Kedokteran dan Profesi Dokter, Fakultas Kedokteran, Universitas Udayana, Bali 2Program Studi Sarjana Kesehatan Masyarakat, Fakultas Kedokteran, Universitas Udayana, Bali 3Departemen Farmakologi dan Terapi, Fakultas Kedokteran, Universitas Udayana, Bali
Introduction: Hyperlipidemia is a disease with a high prevalence throughout the world. This disease is a condition where the cholesterol level or low-density lipoprotein cholesterol (LDL-C) in the blood is above normal levels. Rosuvastatin is classified as a statin drug with the highest effectivity to decrease the LDL-C levels so that hyperlipidemia can be treated well. The administration of rosuvastatin in small doses has the ability to reduce LDL-C levels better than other statin drugs that requires larger doses. The use of rosuvastatin orally is not maximal in the treatment of hyperlipidemia because the bioavailability of rosuvastatin is very low at around 20%. Therefore, a drug delivery system is needed to enhance rosuvastatin absorption.
Discussion: SNEDDS is a newly modified drug classified as a lipid based drug delivery system (LBDDS) in the form of isotropic mixture consisting of oil, surfactants, and cosolvents or cosurfactants components. SNEDDS can increase drug solubility in the gastrointestinal tract by forming very small particles around <200 nm through nanoemulsions and increase the surface area between water and oil phases. Rosuvastatin in the form of SNEDDS can enhance its drug solubility and bioavailability by improving the pharmacokinetic profile of the drug.
Conclusion: Rosuvastatin in the form of SNEDDS deserves further review because of its effectivity in causing significant changes to rosuvastatin’s low bioavailability, which is from 20% bioavailability enhanced to >80% through SNEDDS.
Keywords: Bioavailability, hyperlipidemia, rosuvastatin, SNEDD.
PENDAHULUAN
Hiperlipidemia adalah suatu keadaan yang ditandai dengan tingginya kadar kolesterol atau lipid pada darah. Keadaan ini dipengaruhi oleh kadar low-density lipoprotein cholesterol (LDL-C) dan high-density lipoprotein cholesterol (HDL-C). Kadar LDL-C yang tinggi dapat menyebabkan
plak-plak pada arteri sehingga meningkatkan risiko penyakit artherosclerotic cardiovascular disease (ASCVD). Sebaliknya, kadar HDL-C yang tinggi akan mengurangi kadar kolesterol pada tubuh.[1]
Lipid merupakan lemak yang diabsorpsi dari makanan atau disintesis oleh hati.
Metabolisme lipid dalam tubuh terbagi menjadi metabolisme eksogen dan metabolisme endogen.[2] Metabolisme eksogen adalah peristiwa ketika kolesterol yang berasal dari makanan akan dibawa ke hati untuk dihidrolisis. Hasil dari hidrolisis ini akan disimpan dalam bentuk jaringan adiposa atau disekresikan ke dalam tubuh. Metabolisme endogen dimulai ketika hasil sintesis kolesterol akan disekresi kembali ke dalam sistem sirkulasi dalam bentuk lipoprotein very low density lipid (VLDL). Selanjutnya, pada sistem sirkulasi akan terjadi hidrolisis trigliserida dalam VLDL oleh enzim lipoprotein lipase. Hidrolisis ini akan mengubah VLDL menjadi intermediate density lipid (IDL). Setelah itu, IDL akan mengalami hidrolisis dan kembali menjadi low density lipid (LDL). Kolesterol paling banyak terkandung dalam LDL. Kolesterol pada LDL akan dibawa kembali ke hati dan jaringan lainnya yang mempunyai reseptor untuk LDLC. LDL-C akan dioksidasi dan diterima oleh reseptor scavenger A (SR-A) pada makrofag. Sel makrofag akan memakan kolesterol pada LDL dan menghasilkan sel busa (foam cell).[3]
Prevalensi keberadaan penyakit hiperlipidemia sangat mengkhawatirkan. Menurut WHO, prevalensi penyakit tersebut mencapai angka kematian sebesar 2,6 juta setiap tahunnya. Hiperlipidemia sering terjadi baik pada negara maju ataupun negara berkembang. Berdasarkan data WHO, disebutkan bahwa Eropa memiliki prevalensi kasus yang paling tinggi, dilanjutkan dengan benua lainnya seperti Amerika, Afrika, dan disusul Asia Tenggara.[4,5] Di Asia Tenggara, tidak terkecuali wilayah Indonesia, menunjukkan tingkat prevalensi kasus hiperlipidemia yang cukup tinggi. Berdasarkan data Riskesdas 2018, sebanyak 21,2 % penduduk Indonesia memiliki kadar kolesterol borderline (perbatasan) dan 7,6 % penduduk memiliki kadar kolesterol tinggi.[6] Dilatarbelakangi dengan hal itu, diperlukan penanganan yang kompleks agar penyakit hiperlipidemia ini dapat ditangani dengan maksimal dan lebih baik lagi.
Rosuvastatin merupakan agen antihiperlipidemia yang diklasifikasikan sebagai obat statin paling efektif untuk menurunkan kadar LDL-C dan trigliserida (TG) sehingga memiliki kemampuan untuk meningkatkan kadar HDL-C.[7] Akan tetapi, rosuvastatin memiliki kelarutan yang rendah sehingga bioavailabilitasnya kurang efektif yaitu sekitar 20% karena memiliki sifat yang lipofilik dan sukar larut dalam air.[8]
Rosuvastatin dapat dimodifikasi melalui perbaikan sistem penghantaran dalam formulasi Self-nanoemulsifying Drug Delivery System (SNEDDS). SNEDDS diklasifikasikan sebagai self-dispersing carriers tipe lllA yang merupakan campuran bersifat isotropik stabil
yang memiliki komponen minyak, surfaktan dan kosolven atau kosurfaktan.[9,10] SNEDDS memiliki kemampuan untuk mengatasi beberapa keterbatasan pemberian obat secara oral seperti kelarutan yang buruk dan bioavailabilitas rendah.[10] Komponen surfaktan dan lipid dalam SNEDDS dapat meningkatkan kemampuan absorpsi saluran pencernaan.
SNEDDS dapat membentuk nanoemulsi secara spontan dalam cairan gastrointestinal (GIT) yang menghasilkan pencampuran minyak dalam air melalui proses emulsi yang dilakukan oleh surfaktan dan kosurfaktan.[11] Globul yang terbentuk memiliki ukuran <200 nm.[8] Lapisan antara fase air dan minyak terbentuk pada proses pengenceran dengan air karena zat aktif akan larut pada fase minyak atau surfaktan. Meningkatnya luas permukaan yang dibentuk di antara fase air dan minyak meningkatkan laju kelarutan pada zat yang sukar larut dalam air.[10] Oleh karena itu, proses ini akan meningkatkan kemampuan kelarutan, difusi, dan kelarutan obat di dalam sistem pencernaan. Globul yang teremulsi juga meningkatkan keefektifan distribusi obat yang lebih cepat dan merata, dan juga meminimalisir iritasi mukosa akibat kontak antara obat dan dinding usus. SNEDDS menunjukkan potensi yang lebih menjanjikan untuk meningkatkan solubilitas dan bioavailabilitas.[7,9] . Oleh karena itu, SNEDDS merupakan modifikasi sistem penghantaran obat yang tepat digunakan untuk meningkatkan kemampuan kelarutan rosuvastatin agar memiliki pengaruh yang lebih efektif sebagai pengobatan terhadap hiperlipidemia.[8]
METODE
Penulisan literature review ini menggunakan metode kajian pustaka dan studi literatur yang menggunakan panduan PICO yaitu Problem/Patient, Intervention, Comparison, dan Outcome. Penerapan PICO pada penulisan bertujuan untuk memfokuskan penulisan terhadap permasalahan dan hasil yang paling penting, sehingga penulis dapat mengidentifikasi permasalahan, langkah intervensi dan hasil dengan jelas, serta membantu penulis dalam proses pencarian kajian pustaka dengan menggunakan dan memilih kata kunci yang tepat.[12] Pencarian kajian pustaka menggunakan kata kunci SNEDDS,Self-nanoemulsifying drug delivery system rosuvastatin, hyperlipidemia, dan antihyperlipidemic.
Kata kunci diterapkan dengan metode phrase searching dengan menggunakan tanda petik pada kata kunci untuk mendapatkan hasil pencarian yang spesifik
seperti “SNEDDS bioavailability” dan “SNEDDS for hyperlipidemia” serta Boolean operators “AND” untuk menggabungkan dua kata kunci seperti SNEDDS “AND” hyperlipidemia dan rosuvastatin “AND” hyperlipidemia. Database yang digunakan dalam pencarian yaitu PubMed, NCBI, ScienceDirect, Taylor & Francis, dan google scholar. Kajian pustaka dan literatur yang diperoleh akan diseleksi validitasnya dengan melakukan inklusi dan eksklusi berdasarkan kriteria penulis. Kriteria inklusi adalah literatur yang membahas topik berkaitan dengan SNEDDS, rosuvastatin, dan hiperlipidemia. Kriteria eksklusi adalah literatur yang tidak jelas sumbernya dan pembahasan topik tidak sesuai informasi yang dibutuhkan yakni hubungan antara SNEDDS, hiperlipidemia, dan rosuvastatin, serta literatur yang dipublikasikan lebih dari 10 tahun yang lalu (2012-2022).
PEMBAHASAN
Hiperlipidemia
Hiperlipidemia adalah suatu kondisi patologi yang disebabkan karena adanya kelainan metabolisme pada lipid. Hiperlipidemia disebut sebagai kumpulan penyakit heterogen yang ditandai oleh peningkatan kadar lipid dalam darah.[13] Lipid yang dimaksud seperti kolesterol, trigliserida, kolesterol ester, fosfolipid, atau lipoprotein seperti LDL dan HCL.[14,15] Kelainan pada lipid ini dapat menyebabkan predisposisi penyakit jantung koroner, serebrovaskular, dan penyakit arteri perifer.[14,16] Meskipun pada umumnya hiperlipidemia tidak menunjukkan gejala klinis yang spesifik, tetapi hiperlipidemia berat akan ditandai dengan adanya benjolan kekuningan pada kulit (xanthoma) dan arcus kornea.[17]
Hiperlipidemia merupakan penyakit degeneratif, yang dapat memburuk apabila tidak segera ditangani.[18] Hiperlipidemia sering terjadi di masyarakat dan terjadi pada semua kalangan usia.[19] Hiperlipidemia merupakan salah satu faktor risiko utama terjadinya penyakit kardiovaskular, dimana penyakit ini menyebabkan 1/3 dari jumlah kematian di seluruh dunia.[16]
Gejala hiperlipidemia jarang ditemukan dan tidak spesifik. Oleh karena itu, harus dilakukan pemeriksaan dan skrining terlebih dahulu untuk mendeteksi penyakit hiperlipidemia. Sebelum menjalani pengobatan, harus diidentifikasi jika terdapat penyebab sekunder dari hiperlipidemia tersebut. Oleh karena itu, dibtutuhkan pemeriksaan mengenai riwayat penyakit, riwayat keluarga, kadar glukosa, tes TSH (thyroid stimulating hormone), kreatinin, dan urinalisis.[20] Durasi pengobatan hiperlipidemia membutuhkan waktu cukup
lama. Pengobatan yang tersedia yaitu obat antilipidemia yang dapat menurunkan kadar lipid dalam darah sehingga menjadi normal. Obat antihiperlipidemia yang banyak digunakan untuk menghambat enzim hidroksi metil-glutaril koenzim A reduktase yaitu obat golongan statin dan golongan fibrat dengan mekanisme kerjanya berbeda.[21,22] Obat statin aman digunakan dan dapat menurunkan kadar LDL-C secara signifikan. Oleh karena itu, obat golongan statin merupakan pengobatan yang paling direkomendasi untuk mengatasi hiperlipidemia dan penyakit kardiovaskular. [20]
Patogenesis Hiperlipidemia
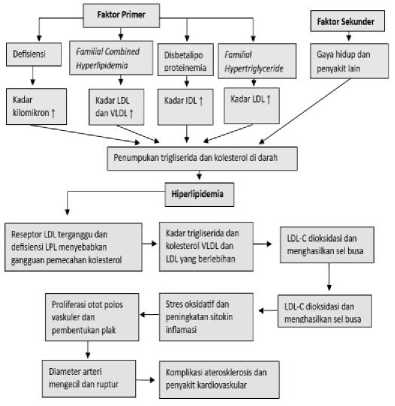
Gambar 1. Patogenesis
Hiperlipidemia.[15,17,23]
Pada dasarnya, penyakit hiperlipidemia dapat terjadi karena adanya peningkatan kadar lipid yang dapat disebabkan oleh kelainan genetik atau penyakit lain.[24] Hiperlipidemia yang disebabkan oleh peningkatan LDL dalam darah dapat menyebabkan peningkatan risiko penyakit aterosklerosis dan berbagai macam penyakit dalam sirkulasi pembuluh darah.[25] Terjadi gangguan metabolisme lipid pada hiperlipidemia. Lipid digunakan sebagai sumber energi ketika lemak pada makanan dikonsumsi, lalu dipecah oleh asam empedu dan diserap di usus. Pada sel usus, asam lemak bebas bergabung dengan gliserol untuk membentuk trigliserida. Lalu, enzyme acyl-coenzyme A (CoA): cholesterol acyltransferase (ACATs) mengubah kolesterol menjadi kolesterol ester. Trigliserida dan kolesterol ester bergabung dengan apolipoprotein (Apo) B-48 untuk membentuk kilomikron. Kilomikron ini memasuki sirkulasi sistemik dan memperoleh apoC-ll dan apoE dari HDL.[24] Hati mengambil sisa-sisa kilomikron dan memulai
proses sintesis VLDL.[13] Setelah itu, kilomikron berikatan dengan reseptor LPL untuk menghidrolisis trigliserida dan menyimpan asam lemak di jaringan perifer sebagai sumber energi. [24]
Trigliserida dan kolesterol ester disintesis secara endogen untuk membentuk VLDL lalu berikatan dengan reseptor LDL melalui apoB-100 dan apoE. VLDL kemudian berubah menjadi IDL oleh LPL dan enzim lipase di hati, lalu fosfolipid dan apolipoprotein dikembalikan ke HDL. Setelah dihidrolisis oleh enzim lipase, IDL berubah menjadi LDL.[15] LDL mengangkut kolesterol dari hati menuju sel-sel melalui reseptor apoB/E untuk memperkuat integritas sel membran atau mensintesis hormon. LDL-C dapat dioksidasi dan menghasilkan sel busa sehingga berperan dalam pembuatan plak aterosklerosis.[24] Kondisi hiperlipidemia menyebabkan fungsi reseptor LDL terganggu sehingga LDL berlebih tetap berada pada peredaran darah. Hal ini menyebabkan terjadinya kenaikan kadar LDL dalam darah.[26] Pada hiperlipidemia, terjadi defisiensi lipoprotein lipase (LPL) dan kelebihan produksi trigliserida pada VLDL karena gangguan pemecahan kolesterol pada VLDL oleh lipoprotein lipase. Hal ini menyebabkan tingginya kadar trigliserida dan kolesterol pada VLDL di peredaran darah.[23]
Faktor-faktor yang menyebabkan hiperlipidemia dapat diklasifikasikan menjadi 2 bagian yaitu faktor primer dan sekunder. Faktor primer disebabkan oleh kelainan genetik seperti defisiensi LPL, familial combined hyperlipidemia (FCHL), disbetalipoproteinemia, dan familial hypertriglyceridemia.[24,27] Faktor sekunder disebabkan oleh penyakit lain seperti diabetes, obesitas, hipotiroidisme, gangguan ginjal, dan juga penggunaan obat seperti kortikosteroid, diuretic dan beta blocker.[15,27]
Rosuvastatin
Rosuvastatin merupakan inhibitor dari β-hydroxy β-methylglutaryl-CoA (HMG-CoA) reductase yang berfungsi sebagai agen penurun lipid sintetik dan tersedia secara pemberian oral dalam dosis tablet 5 mg, 10 mg, dan 40 mg yang digunakan untuk mengobati hiperlipidemia.[28,29] Mekanisme kerja rosuvastatin sebagai inhibitor dari HMG-CoA reduktase dimana enzim tersebut akan mengubah HMG-CoA menjadi asam mevalonik pada jalur biosintesis kolesterol yang merupakan langkah pembatas laju sintesis kolesterol. Rosuvastatin bekerja pada hati dan mengurangi konsentrasi kolesterol hepatoseluler. Respon hepatosit terhadap penurunan kolesterol intraseluler ini adalah dengan meningkatkan sintesis reseptor LDL sehingga proses reuptake LDL hepatik dari
sirkulasi juga meningkat. Fenomena ini akan menyebabkan peningkatan katabolisme LDL sehingga kadar LDL-C dan kolesterol berkurang.[30]
Rosuvastatin merupakan BCS kelas ll yang memiliki efektivitas yang lebih tinggi dibandingkan jenis statin lain dalam mengurangi kadar LDL-C.[31] Pemberian dosis 10 mg rosuvastatin dapat mengurangi kadar LDL-C dan trigliserida dengan lebih efektif dibandingkan dengan pravastatin dan atorvastatin yang diberikan pada dosis yang lebih tinggi (hingga 40 mg). Rosuvastatin juga dapat meningkatkan kadar HDL-C secara lebih konsisten dan efektif dibandingkan dengan simvastatin dan pravastatin. Kekurangan dari rosuvastatin yaitu hanya memiliki bioavailabilitas sebesar 20% jika diberikan secara oral. Hal ini disebabkan karena rosuvastatin bersifat hidrofilik dan kurang lipofilik jika dibandingkan dengan statin lain seperti atorvastatin dan simvastatin.[30] Kekurangan lainnya yaitu karena bersifat sukar larut dalam air dan memiliki sifat kristal serta dicerna secara ekstensif oleh hati melalui glukuronidasi, laktonisasi, dan oksidasi.[32]
Self-Nanoemulsifying Drug Delivery System (SNEDDS)
Nanoemulsi merupakan suatu liquid biphasic system (LBS) yang digunakan untuk pemisahan atau pemurnian biomolekul.[33] Biphasic system tersebut merupakan proses yang terjadi antara dua cairan yang tidak dapat bercampur dimana satu fase terdispersi dalam fase lain dalam bentuk tetesan submikron yaitu tetesan air dalam minyak atau minyak dalam air, serta distabilisasikan oleh surfaktan dan kosurfaktan yang memiliki sifat amfifilik.[34,35] Proses tersebut menghasilkan dispersi sangat halus yang berbentuk bulat dan memiliki ukuran kurang dari 200 nm, serta memiliki kemampuan untuk meningkatkan kelarutan dalam fase internal sehingga dapat berfungsi dalam penghantaran obat.[34,36]
Nanoemulsi tidak dipengaruhi oleh perubahan-perubahan disekitarnya (variasi fisik atau kimia) seperti perubahan suhu atau pH, serta membutuhkan rasio surfaktan yang lebih sedikit terhadap minyak dalam persiapannya dibandingkan dengan jenis emulsi lainya seperti mikroemulsi dan emulsi kasar yaitu sekitar 3-10% surfaktan.[35,37] Persiapan nanoemulsi ini membutuhkan urutan pencampuran spesifik, dimana fase minyak harus tercampur dengan surfaktan terlebih dahulu. Nanoemulsi bersifat stabil secara kinetik, seperti proses destabilisasinya yang sangat lambat karena memiliki hambatan energi yang tinggi dan massa transport yang lambat.[38]
Nanoemulsi dapat dibuat melalui berbagai macam metode yang diklasifikasikan menjadi dua metode yaitu pendekatan yaitu emulsifikasi energi tinggi, energi rendah, atau kombinasi dari kedua pendekatan tersebut. Pendekatan melalui energi tinggi menggunakan perangkat mekanis menghasilkan kekuatan yang sangat kuat sehingga dapat memecahkan fase air dan minyak untuk menghasilkan tetesan minyak. Pada pendekatan melalui energi rendah, energi kimia internal dari sistem digunakan untuk melakukan emulsifikasi dengan cara mengalihkan sifat fisikokimia intrinsik dari surfaktan dan kosurfaktan dalam formulasi.[37]
Nanoemulsi ini masih memiliki beberapa kekurangan yaitu dapat mengalami kerusakan melalui “Ostwald ripening” yang merupakan fenomena larutnya kristal kecil dan pengendapan ulang spesies terlarut pada permukaan partikel yang lebih besar. Proses tersebut terjadi karena partikel lebih besar lebih disukai secara energetik sehingga kelarutan partikel kecil menjadi lebih tinggi.[38,39] Faktor lain yang menjadi kekurangan dari nanoemulsi yaitu tidak cocok untuk pengiriman melalui kapsul gelatin karena adanya kandungan lipid.[38]
Oleh karena itu, diciptakan suatu modifikasi untuk memperbaiki kekurangan nanoemulsi yang disebut self-nanoemulsifying drug delivery system (SNEDDS). SNEDDS merupakan sistem penghantaran obat yang diklasifikasikan sebagai lipid based drug delivery system (LBDDS) dan memiliki sifat anhidrat sehingga mudah dikemas dalam kapsul gelatin.[40]
SNEDDS merupakan modifikasi sistem penghantaran obat terbaru yang lebih efektif dibandingkan dengan sistem penghantaran awalnya yaitu self-emulsifying drug delivery system (SEDDS). Kekurangan dari SEDDS yaitu dapat terjadi presipitasi obat di saluran pencernaan pada SEDDS tipe I dan ll, serta iritasi mukosa dan toleransi yang buruk di saluran pencernaan pada tipe lV.[10]
SNEDDS berupa campuran homogen isotropik yang terdiri dari suatu zat aktif dalam kombinasi lipid, surfaktan, dan kosurfaktan. SNEDDS juga biasanya disebut sebagai formulasi pre-concentrate.[41] Ketika dilakukan pemberian obat menggunakan SNEDDS secara oral, ukuran droplet sangat kecil yang dihasilkan oleh nanoemulsi memiliki kemampuan melarutkan obat yang sangat hidrofobik, sehingga dapat meningkatkan bioavailabilitas obat. [42]
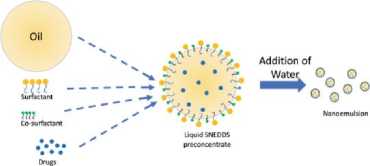
Gambar 2. Skema Formulasi
SNEDDS.[42]
SNEDDS berfungsi untuk meningkatkan laju kelarutan dan penyerapan obat, terutama untuk obat yang memiliki kelarutan buruk dalam air.[35] Biopharmaceutics Classification System (BCS) mengkategorikan obat-obat tersebut menjadi dua kelas yaitu kelas ll dan lV. Kelas ll merupakan obat yang sukar larut dalam air dan kelas IV merupakan obat yang sukar larut dalam air dan memiliki permeabilitas yang buruk untuk menembus membran biologis.[43]
Mekanisme Dan Peran Dari SNEDDS
Pada tahap formasi pada SNEDDS, surfaktan sejajar dengan antarmuka pada minyak dan air untuk mengurangi tegangan antarmuka dan kestabilan SNEDDS terjaga. Ketika partikel nanoemulsi berukuran lebih kecil, maka tegangan antarmuka permukaan meningkat. Molekul-molekul kecil pada kosurfaktan akan meningkatkan fungsi emulsifikasi dari surfaktan dengan menembus lapisan surfaktan pada antarmuka air dan minyak. Agar SNEDDS dapat stabil, maka energi bebas harus negatif. Semakin meningkatnya jumlah surfaktan dalam SNEDDS, maka kestabilan pembentukan nanoemulsi akan meningkat juga karena dapat mengurangi energi bebas. Akan tetapi, jumlah surfaktan tidak boleh berlebihan karena jika rasio surfaktan melebihi 60%, maka energi bebas akan meningkat dan sistem self-emulsification menjadi gagal.[44] SNEDDS memberikan permukaan antarmuka yang luas untuk mempartisi obat lipofilik antara minyak dan saluran pencernaan ketika terjadi pencampuran minyak dan surfaktan atau kosurfaktan dengan air pada agitasi ringan.[44]
LBDDS seperti SNEDDS dapat meningkatkan kelarutan obat dengan menghantarkan seluruh dosis obat tersebut sehingga menghindari kelarutan lambat pada fase kristal. SNEDDS dapat menghantarkan dosis secara keseluruhan karena air yang menembus melalui antarmuka dan sampai ke fase minyak sehingga menyebabkan terbentuknya dispersi fase kristal cair.[43,44]
Pencernaan formulasi SNEDDS menyebabkan adanya perubahan pada komposisi lipid dalam saluran pencernaan, sehingga fase terlarutnya obat tidak diperoleh secara langsung dari formulasi SNEDDS
sendiri, tetapi karena adanya pemrosesan intraluminal terhadap lipid sebelum diabsorpsi. Adanya zat lipid pada duodenum akan merangsang sekresi komponen pelarut yang berasal dari empedu seperti garam empedu dan lemak empedu. Cairan empedu meningkatkan kelarutan produk lipid dalam lumen usus berair oleh penggabungan misel dan misel campuran. Sepanjang proses penyerapan tersebut, obat tetap dalam keadaan terlarut.[42] Pembentukan fase misel campuran berair tersebut memperluas kapasitas kelarutan dari usus halus. Oleh karena itu, ketika obat yang sukar larut dalam air diberikan dengan formulasi lipid, maka obat tersebut dapat terdistribusi diantara zat koloid tersebut. Proses tersebut menghambat presipitasi obat sehingga meningkatkan kelarutan.[43]
Efektivitas SNEDDS Terhadap Bioavailabilitas Rosuvastatin
Pemberian SNEDDS kepada rosuvastatin dapat meningkatkan kelarutannya dan bioavailabilitasnya.[32] SNEDDS juga dapat menghindari efek lintas pertama, memfasilitasi penyerapan limfatik, dan meningkatkan kelarutan dan permeabilitas membran saluran pencernaan.[31]
SNEDDS dapat meningkatkan disolusi dan kelarutan rosuvastatin secara signifikan dibandingkan dengan bentuk zat murni/suspensinya. Rosuvastatin yang memiliki sifat sukar larut dalam air dapat terdisolusi dan >80%.[8] Pada data penelitian ditemukan zat murni/suspensi ditemukan persentase disolusinya <30% dan meningkat menjadi >85 %,[7] serta terdapat juga yang persentase disolusinya meningkat dari 38% menjadi 98% menggunakan SNEDDS pada rosuvastatin tersebut.[45]
Dalam penelitian mengenai bioavailabilitas rosuvastatin, formulasi SNEDDS yang diberikan pada rosuvastatin menunjukkan nilai Cmax dan AUC (Area Under Curve) yang lebih tinggi sehingga menunjukkan adanya peningkatan signifikan terhadap bioavailabilitas di suspensi.[46] Cmax merupakan konsentrasi maksimal dalam darah.[47] Hal ini disebabkan oleh dispersi partikel sangat kecil (berukuran nano) sehingga terdapat peningkatan kelarutan, difusi obat dan permeabilitas mukosal. Formulasi SNEDDS yang digunakan yaitu CN7, dimana Cmax pada obat murni/suspensi 7,83 μg/mL dan meningkat menjadi 15,92 μg/mL pada formulasi SNEDDS. Bioavailabilitas relatif (%) dari CN7 SNEDDS adalah 245,15 jika dibandingkan dengan obat murni/suspensi.[46]
Tabel 1. Parameter Farmakokinetik Setelah Pemberian Oral Pada Obat Murni dan CN7 SNEDDS.[46]
|
Parameter Farmakokin etik |
Obat murni/ suspensi |
CN7 SNEDDS |
|
Cmax (μg/mL) |
7,83 ± 2,61 |
15,92 ± 3,28 |
|
AUC(μ g.jam/mL) |
39,05 |
95,74 |
Pada profil farmakokinetik, konsentrasi rosuvastatin plasma dalam darah diukur setiap 2 jam pada selang waktu 0 sampai 24 jam pada 3 tikus wistar jantan dan kurva plasma konsentrasi terhadap waktu dibandingkan antara pemberian rosuvastatin dengan CN7 SNEDDS dan obat murni/suspensi. Plasma konsentrasi rosuvastatin pada SNEDDS menunjukkan hasil yang lebih tinggi pada setiap periode waktu jika dibandingkan dengan hasil pada obat murni/suspensi. Bioavailabilitas rosuvastatin dalam bentuk CN7 SNEDDS meningkat 2,45 kali lebih besar dibandingkan obat murni/suspensi.[46]
Efek Klinis Formulasi SNEDDS Pada Rosuvastatin Terhadap Hiperlipidemia
Rosuvastatin merupakan agen antihiperlipidemia yang menghambat sintesis kolesterol. Rosuvastatin dapat diterima dengan baik pada semua kalangan usia untuk menurunkan total kolesterol, LDL, apolipoprotein B dan trigliserida.[48] Rosuvastatin dapat mengurangi kadar LDL-C sebanyak 63% dalam dosis 40 mg. [49] Rosuvastatin meningkatkan HDL-C pada pengobatan hiperlipidemia.[48] Bioavailabilitas rosuvastatin yang rendah dapat ditingkatkan secara signifikan menggunakan SNEDDS.[50]
SNEDDS telah diakui sebagai teknologi yang sangat menjanjikan karena memiliki efek samping rendah. Akan tetapi, salah satu efek samping yang dapat ditemukan adalah konsentrasi surfaktan yang tinggi dalam SNEDDS dapat menyebabkan gangguan pencernaan.[9] Selain itu, SNEDDS dapat menargetkan situs tertentu dalam tubuh, mengurangi toksisitas, dan mengurangi jumlah pemberian dosis. Oleh karena itu, SNEDDS berfungsi dalam meningkatkan keamanan obaat, efikasi, dan umur simpan obat. [32] Melalui penerapan SNEDDS pada rosuvastatin, kelarutan obat yang sukar larut dalam air menjadi lebih baik melalui pembentukan nanoemulsi minyak dalam air sehingga bioavailabilitas rosuvastatin meningkat dan obat. Dengan meningkatnya obat yang terabsorbsi dalam sirkulasi darah, maka efek klinis dari rosuvastatin dapat
memberikan pengaruh yang lebih optimal dan pengobatan terhadap hiperlipidemia menjadi lebih efektif.[8,48]
SIMPULAN
Hiperlipidemia merupakan gangguan pada kadar kolesterol dan lipid yang melebihi batas normal. Prevalensi penyakit ini sering ditemukan di seluruh dunia, sehingga diperlukan pengobatan yang efektif untuk menangani kasus penyakit hiperlipidemia dengan baik. Rosuvastatin merupakan obat yang sangat efektif untuk mengobati hiperlipidemia. Akan tetapi, bioavailabilitas rosuvastatin masih sangat rendah. Melihat kondisi hiperlipidemia yang jarang
menimbulkan gejala dan mengakibatkan risiko yang fatal, adanya modalitas modifikasi nanoemulsi dengan SNEDDS dan pemberian SNEDDS pada rosuvastatin layak untuk ditinjau lebih lanjut karena efektif dalam meningkatkan dan menyebabkan perubahan yang sangat signifikan terhadap
bioavailabilitas rosuvastatin yang rendah.
SARAN
Penelitian lebih lanjut masih diperlukan karena SNEDDS termasuk modifikasi baru yang diciptakan. Penulisan yang telah dibuat memiliki tujuan untuk membantu penelitian selanjutnya dalam meningkatkan efektifitas dan inovasi terkait SNEDDS. Selain itu, SNEDDS dapat menjadi alternatif untuk memperbaiki profil farmakokinetika dari rosuvastatin. Diperlukan juga adanya studi lebih lanjut pada manusia agar SNEDDS dapat digunakan dengan baik dan aman. Kedepannya, diharapkan rosuvastatin dapat digunakan dengan lebih efektif dan dilakukan pengkajianlebih lanjut untuk obat-obatan lainnya dalam menangani penyakit hiperlipidemia. Diharapkan dengan adanya penelitian lebih lanjut, dapat mengurangi jumlah penderita hiperlipidemia sehingga tidak meningkatkan potensi terjadinya penyakit-penyakit lain yang dapat mengikuti penyakit hiperlipidemia.
DAFTAR PUSTAKA
-
1. Karr S. Epidemiology and
Management of Hyperlipidemia. Am J Manag Care.2017;23(9):139–48.
-
2. Badimon L, Chiva-blanch G. Lipid
Metabolism in Dyslipidemia and Familial Hypercholesterolemia.
Elsevier Inc.2019;307-322.
-
3. Akbar A. PENGARUH PEMBERIAN
EKSTRAK DAUN KERSEN (Mutingia calabura l.) TERHADAP KADAR MALONDIALDEHID DARAH PADA MENCIT PUTIH (Mus musculus)
JANTAN YANG DIINDUKSI DIET TINGGI LEMAK [Internet]. UMM Institutional Repos.2017;Available from:
https://eprints.umm.ac.id/41601/
-
4. Santosa AP, Trimurtini I, Hasan K.
Efek Anti Hiperlipidemik Ekstrak Etanol Daging Buah Semangka Merah (Citrullus Lanatus) Terhadap Kadar Low Density Lipoprotein Pada Tikus Jantan Galur Wistar (Rattus Norvegicus). JIMKI Jurnal Ilmu Mahasiswa Kedokteran Indonesia. 2018;6(2):41–8.
-
5. WHO. Raised cholesterol [Internet].
World Health Organization .2023 [cited 2023 Aug 12];Available from: https://www.who.int/data/gho/indicat or-metadata-registry/imr-details/3236
-
6. Kemenkes RI. Laporan Nasional
RISKESDAS 2018. Kementerian Kesehatan RI [Internet] 2018;150. Available from:
https://dinkes.babelprov.go.id/sites/d efault/files/dokumen/bank_data/2018 1228 - Laporan Riskesdas 2018
Nasional-1.pdf
-
7. Abo Enin HA. Self-nanoemulsifying
drug-delivery system for improved oral bioavailability of rosuvastatin
using natural oil antihyperlipdemic. Drug Development Industrial
Pharmacy .2015;41(7):1047–56.
-
8. Priani SE. Pengaruh Pengembangan
Self-Nanoemulsifying Drug Delivery System Terhadap Disolusi,
Bioavailabilitas, Dan Aktivitas Agen Antihiperlipidemia. Jurnal Ilmu
Farmasi Farmasyifa.2022;5(1):101– 11.
-
9. Buya AB, Beloqui A, Memvanga PB,
Préat V. Self-Nano-Emulsifying DrugDelivery Systems: From the
Development to the Current Applications and Challenges in Oral Drug Delivery. Pharmaceutics. 2020;12(12):1194.
-
10. Krstić M, Medarević Ð, Đuriš J, Ibrić
-
S. Self-nanoemulsifying drug delivery systems (SNEDDS) and selfmicroemulsifying 12 drug delivery systems (SMEDDS) as lipid nanocarriers for improving dissolution rate and bioavailability of poorly soluble drugs. Lipid Nanocarriers Drug Target.2018;473–508.
-
11. Jaiswal M, Dudhe R, Sharma P.
Nanoemulsion : an advanced mode of drug delivery system. 3 Biotech. 2015;5(2):123–7.
-
12. Eriksen MB, Frandsen TF. The
impact of PICO as a search strategy tool on literature search quality: A systematic review. J Med Libr Assoc.
2018;106(4):420–31.
-
13. Nouh F, Omar M, Younis M. Risk
Factors and Management of
Hyperlipidemia ( Review ) Risk Factors and Management of
Hyperlipidemia ( Review ). Asian J Cardiol Res. 2019;2(1):1–10.
-
14. Heryani R. Pengaruh Ekstrak Buah
Naga Merah Terhadap Profil Lipid Darah Tikus Putih Hiperlipidemia. J Ipteks Terapan. 2016;10(1):8–17.
-
15. Shattat GF. A Review Article on
Hyperlipidemia: Types , Treatments and New Drug Targets. Biomed Pharmacol J. 2014;7(2):399–409.
-
16. Mumthaj P, Natarajan P, Janani AM,
Vijay J, Gokul V. A Global Review Article on Hyperlipidemia. Int J Pharm Sci Rev Res. 2021;68(1):104–10.
-
17. Su L, Mittal R, Ramgobin D, Jain R,
Jain R. Review Article Current Management Guidelines on
Hyperlipidemia: The Silent Killer. J Lipids.2021;2021:9883352.
-
18. Santoso P, Udayani NNW, Putra
IMAS, Dewi NKLA. INFORMASI OBAT PENYAKIT DEGENERATIF DAN ALTERNATIF TERAPINYA. COMSERVA. Jurnal Pengabdian Masyarakat. 2021;1(4):140–5.
-
19. Gustomi MP, Larasati R. Ekstrak
Rimpang Kunyit Menurunkan Kadar Lemak Darah Pasien Hiperlipidemia. Journals Ners Community
2015;6(1):1–7.
-
20. Bethelli S, Oroszi T. Role of LDL and
Triglycerides in Hyperlipidemia in Diabetes Mellitus. J Fam Med Dis Prev. 2023;10(1):1–9.
-
21. Alfiani F, Subarnas A. ANALISIS
PERBANDINGAN HASIL TERAPI
PASIEN HIPERLIPIDEMIA YANG MENGGUNAKAN TERAPI STATIN
ANTARA DUA KELOMPOK UJI DENGAN MODIFIKASI METODE KONSELING DI BEBERAPA
APOTEK DI BANDUNG. Jurnal Ilmu Kesehatan. 2021;9(2).
-
22. Gitawati R, Widowati L, Suharyanto
-
F. Penggunaan Jamu pada Pasien Hiperlipidemia Berdasarkan Data Rekam Medik, di Beberapa Fasilitas Pelayanan Kesehatan di Indonesia. Jurnal Kefarmasian Indonesia. 2015;5(1):41–8.
-
23. Goobie G. Primary
hypertriglyceridemia: Pathogenesis
and clinical findings: Calgary guide. The Calgary Guide to Understanding Disease [Internet]. Calgary Guide .2015 [cited 2023 Dec 10];Available from:
https://calgaryguide.ucalgary.ca/prim ary-hypertriglyceridemia-
pathogenesis-and-clinical-findings/
-
24. Stewart J, Mccallin T, Martinez J,
Chacko S, Yusuf S. Hyperlipidemia. Pediatric Rev.2020;41(8):393–402.
-
25. Hill MF, Bordoni B. Hyperlipidemia
[Internet]. StatPearls Publ. 2022 [cited 2022 Dec 10];Available from: https://www.ncbi.nlm.nih.gov/books/ NBK559182/
-
26. Putri RK. Pengaruh Kombinasi
Minyak Zaitun Ekstrak Virgin Dan Madu Kelengkeng Terhadap Kadar Trigliserida Tikus Putih Jantan Strain Wistar Hiperlipidemia. UMM
Institutional Repos.2017;
-
27. Naser IH, Alkareem ZA, Mosa AU.
Hyperlipidemia: pathophysiology ,
causes , complications , and treatment . A review. Kerbala J Pharmacy Pharmaceutical Sci. 2021;1(19):118–32.
-
28. Cortese F, Gesualdo M, Cortese A,
Carbonara S, Devito F, Zito A, et al. Rosuvastatin: Beyond the
cholesterol-lowering effect.
Pharmacol Res . 2016;107:1–18.
-
29. Bowman CM, Ma F, Mao J, Chen Y.
Examination of Physiologically-Based Pharmacokinetic Models of
Rosuvastatin. CPT Pharmacometrics Syst Pharmacol. 2021;10(1):5–17.
-
30. Luvai A, Mbagaya W, Hall AS, Barth
JH. Rosuvastatin: A review of the pharmacology and clinical
effectiveness in cardiovascular disease. Clin Med Insights Cardiol. 2012;6:17–33.
-
31. Desavathu M, Rani P. SNEDDS in
Shell: A Novel Approach to Enhance the Solubility of Rosuvastatin Calcium. Asian J Pharm.
2020;14(4):499–506.
-
32. Verma R, Kaushik A, Almeer R,
Habibur Rahman M, Abdel-Daim MM, Kaushik D. Improved
Pharmacodynamic Potential of Rosuvastatin by Self-
Nanoemulsifying Drug Delivery
System: An in vitro and in vivo
Evaluation. Int J Nanomedicine. 2021;16:905–24.
-
33. Khoo KS, Leong HY, Chew KW, Lim
JW, Ling TC, Show PL, et al. Liquid biphasic system: A recent
bioseparation technology. Processes. 2020;8(2):149.
-
34. Shah M, Imran R, Ullah S.
Nanoemulsions. In: Lipid-Based
Nanocarriers for Drug Delivery and Diagnosis. 2017. page 111–37.
-
35. Singh Y, Meher JG, Raval K, Khan
FA, Chaurasia M, Jain NK, et al. Nanoemulsion: Concepts,
development and applications in drug
delivery. J Control Release. 2017;252:28–49.
-
36. Aswathanarayan JB, Vittal RR.
Nanoemulsions and Their Potential Applications in Food Industry. Front Sustain Food Syst. 2019;3:95.
-
37. Marzuki NHC, Wahab RA, Hamid
MA. An overview of nanoemulsion: Concepts of development and cosmeceutical applications.
Biotechnol Biotechnol Equip.
2019;33(1):779–97.
-
38. Rehman FU, Shah KU, Shah SU,
Khan IU, Khan GM. From nanoemulsions to self
nanoemulsions, with recent advances in self-nanoemulsifying drug delivery systems (SNEDDS). Expert Opin Drug Deliv. 2017;14(11):1325–40.
-
39. Liu B, Hu X. Hollow Micro- and
Nanomaterials: Synthesis and
Applications. Elsevier Inc.; 2020.
-
40. Kazi M, Al-Swairi M, Ahmad A, Raish
-
M, Alanazi FK, Badran MM, et al. Evaluation of Self-Nanoemulsifying Drug Delivery Systems (SNEDDS) for Poorly Water-Soluble Talinolol: Preparation, in vitro and in vivo
Assessment. Front Pharmacol. 2019;10(459):1–13.
-
41. Kazi M. Lipid‐Based Nano‐Delivery
for Oral Administration of Poorly Water Soluble Drugs (PWSDs):
Design, Optimization and in vitro Assessment. In: Advanced
Technology for Delivering
Therapeutics. 2017. page 31–51.
-
42. Sailor GU. Self-Nanoemulsifying
Drug Delivery Systems (SNEDDS): An Innovative Approach to Improve Oral Bioavailability. Nanocarriers Drug Deliv Syst An Evid Based Approach . 2021;255–80.
-
43. Cherniakov I, Domb AJ, Hoffman A.
Self-nano-emulsifying drug delivery systems: An update of the
biopharmaceutical aspects. Expert Opin Drug Deliv. 2015;12(7):1121– 33.
-
44. Li L, Hui Zhou C, Ping Xu Z. Self-
Nanoemulsifying Drug-Delivery
System and Solidified Self-Nanoemulsifying Drug-Delivery
System. In: Nanocarriers for Drug Delivery: Nanoscience and
Nanotechnology in Drug Delivery..
2019. page 421–49.
-
45. Tripathi CB, Gupta N, Kumar P, Singh
AK, Raj V, Parashar P, et al. ω-3 Fatty Acid Synergized Novel Nanoemulsifying System for
Rosuvastatin Delivery: In Vitro and In Vivo Evaluation. AAPS
PharmSciTech. 2017;19(3):1205–18.
-
46. Balakumar K, Raghavan CV, Selvan
NT, Prasad RH, Abdu S. Self nanoemulsifying drug delivery system (SNEDDS) of Rosuvastatin calcium: Design, formulation, bioavailability
and pharmacokinetic evaluation. Colloids Surfaces B Biointerfaces.
2013;112:337–43.
-
47. Han YR, Lee PI, Pang KS. Finding
Tmax and Cmax in
Multicompartmental Models. Drug Metab Dispos.2018;46(11):1796–
804.
-
48. Vu GTT, Phan NT, Nguyen HT,
Nguyen HC, Hai Tran YT, Pham TB, et al. Application of the artificial neural network to optimize the formulation of self-nanoemulsifying drug delivery system containing rosuvastatin. J Appl Pharm Sci. 2020;10(9):1–11.
-
49. Alshora DH, Ibrahim MA, Elzayat E,
Almeanazel OT. Rosuvastatin
calcium nanoparticles: Improving
bioavailability by formulation and stabilization codesign. PLoS One. 2018;13(7):1–17.
-
50. Beg S, Katare OP, Singh B.
Formulation by design approach for development of ultrafine self-nanoemulsifying systems of
rosuvastatin calcium containing long-chain lipophiles for hyperlipidemia management. Colloids Surfaces B Biointerfaces. 2017;159:869–79.
37
Discussion and feedback