SERBUK BIJI BUAH SEMANGKA DAN PEPAYA SEBAGAI KOAGULAN ALAMI DALAM PENJERNIHAN AIR
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 9 Nomor 1, Mei 2021

SERBUK BIJI BUAH SEMANGKA DAN PEPAYA SEBAGAI KOAGULAN ALAMI DALAM PENJERNIHAN AIR
Adriana Anteng Anggorowati
Jurusan Teknik Kimia Universitas Katolik Widya Mandala Surabaya, Jl. Kalijudan 37 Surabaya (60114) Indonesia
ABSTRAK: Proses koagulasi dalam pengolahan air limbah merupakan proses yang penting. Tujuan koagulasi yaitu untuk menghilangkan kotoran koloid sehingga turbiditas air limbah dapat berkurang. Selama ini koagulan yang dipergunakan dalam proses penjernihan adalah koagulan kimia, yang memiliki kekurangan karena dapat mengganggu kesehatan manusia. Dalam penelitian ini menggunakan bahan alami yang berasal dari tumbuh-tumbuhan sebagai koagulan yaitu biji semangka dan biji pepaya. Serbuk biji semangka dapat menurunkan turbiditas hingga 53,85 % sedangkan biji pepaya 72,31 %. Kemampuan biji pepaya untuk penurunan turbiditas lebih besar dari pada biji semangka karena kadar protein dalam biji pepaya juga lebih besar dari pada kadar protein dalam biji semangka.
Kata kunci: koagulan alami, biji semangka, biji pepaya.
ABSTRACT: The coagulation process in wastewater treatment is an important process. The purpose of coagulation is to remove colloidal impurities so that the turbidity of wastewater can be reduced. So far, the coagulants used in the purification process are chemical coagulants, which have disadvantages because they can interfere with human health. In this study, using natural ingredients derived from plants as coagulants, namely watermelon and papaya seeds. Watermelon seed powder can reduce turbidity by up to 53.85% while papaya seeds can reduce the turbidity by 72.31%. The ability of papaya seeds to reduce turbidity is greater than that of watermelon seeds because the protein content in papaya seeds is also greater than the protein content in watermelon seeds.
Keywords: natural coagulants, watermelon seeds, papaya seeds
-
1. PENDAHULUAN
Dalam pengolahan air limbah, proses koagulasi merupakan proses yang penting dengan tujuan untuk menghilangkan kotoran koloid sehingga kekeruhan air limbah dapat berkurang. Air yang keruh dapat ditengarai mengandung komponen penyebab berbagai penyakit. Oleh sebab kekeruhan dalam air limbah harus dikurangi hingga mencapai batas tertentu yang diijinkan. Pada proses koagulasi dibutuhkan koagulan, yaitu suatu zat yang prinsip kerjanya mendestabilisasi partikel tersuspensi (koloid) dan memperbesar laju pembentukkan flok sehingga terjadi
koagulasi [1]. Koagulan pada umumnya
berasal dari bahan disebut sebagai
misalnya, alum garam besi
(FeCl3.6H2O),
kimia, yang sering koagulan kimiawi
(Al2(SO4)3.14H2O), ferric chloride
ferric sulfate
ferrous sulfate
Chloride Sodium Setelah
(Fe2(SO4)3.9H2O), (FeSO4.7H2O), poly aluminum (PAC) (Aln(OH)mCl3n-m),
Aluminate (NaAlO2) [2].
koagulan dimasukkan ke dalam air, koloid dalam air berkumpul dan tumbuh lebih besar membentuk flok yang bersama dengan kotoran dalam air dapat mengendap di bagian bawah sehingga dapat dipisahkan dari suspensi air. Namun demikian terdapat kelemahan
dalam penggunaan koagulan kimiawi ini karena ion aluminium dalam koagulan kimiawi jika masuk ke dalam tubuh manusia melebihi nilai ambang batas (NAB) dapat menyebabkan beberapa efek samping khususnya kesehatan manusia antara lain sembelit usus, kehilangan ingatan, kejang, kolik perut, kehilangan energi dan kesulitan konsentrasi [3]. Oleh sebab itu saat ini dikembangkan koagulan yang bersifat alami. Koagulan alami dapat diperoleh dari ekstrak hewan, mikroorganisme, dan tumbuhan.
Penggunaan koagulan alami untuk penjernihan air dapat dilakukan dengan beberapa cara. Cara yang paling sederhana adalah langsung menggunakan serbuk dari biji tanaman yang sudah dikeringkan [4]. Cara ini kurang efektif karena bahan akftif koagulan masih tercampur dengan berbagai pengotor. Untuk memperoleh bahan aktif dari koagulan alami dapat dilakukan ekstraksi menggunakan air atau larutan garam NaCl. Air atau larutan NaCl yang mengandung ekstrak koagulan dapat langsung digunakan untuk proses penjernihan air. Meskipun ekstrak yang diperoleh belum murni, penggunaan larutan ekstrak ini lebih efektif dari pada penggunaan dalam bentuk serbuk. Dari penelitian yang sudah dilakukan diketahui bahwa kebanyakan bahan aktif dari koagulan alami adalah protein yang terdapat pada biji tanaman. Secara umum, terdapat empat jenis mekanisme koagulasi yaitu charge neutralization, sweep coagulation, polymer bridging, dan patch flocculation seperti dalam Gambar 1.
Proses koagulasi yang terjadi pada koagulan alami, adalah mekanisme koagulasi polymer bridging, dan charge neutralization [6]. Pada Gambar 1 terlihat bahwa mekanisme polymer bridging diawali dengan adsorpsi polimer yang merupakan proses dimana polimer rantai panjang menempel pada
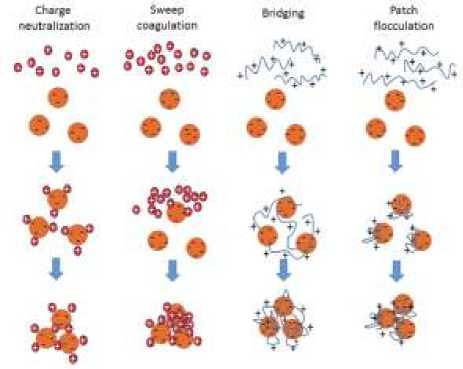
Gambar 1. Mekanisme koagulasi dan flokulasi [5]
permukaan partikel koloid karena adanya hubungan afinitas diantara keduanya. Loop dan ekor ini adalah struktur utama jembatan polimer karena memungkinkan perlekatan ke partikel koloid lain dan dengan demikian membentuk flok yang lebih besar. Sedangkan dasar dari charge neutralization adalah adsorpsi poli-elektrolit dengan kerapatan muatan tinggi oleh partikel koloid. Mekanisme pada charge neutralization, menggunakan polimer terionisasi (poli-elektrolit) sebagai koagulan untuk menstabilkan partikel koloid. Partikel koloid yang bermuatan negatif satu sama lain akan saling tolak menolak. Oleh karena itu polycation digunakan untuk menstabilkan partikel supaya mendapatkan potensial zeta mendekati nol. Densitas muatan dari polielektrolit akan menentukan dosis optimal dari polielektrolit yang dibutuhkan karena densitas muatan yang lebih tinggi sesuai dengan dosis koagulan yang lebih rendah [7].
Tumbuhan yang berpotensi menjadi sumber koagulan alami adalah tanaman yang banyak mengandung protein. Setiap jenis protein memiliki titik isolektrik pada pH yang berbeda-beda. Pada titik isoelektriknya, protein akan bermuatan
netral. Hal ini akan mempengaruhi interaksinya dengan senyawa-senyawa yang ada di air. Adanya kation bivalance dalam air juga mempengaruhi efektifitas proses koagulasi. Jenis koagulan alami yang banyak dipelajari dan digunakan adalah dari ektrak biji tanaman kelor (M. Oleifera). Pada penggunaan ekstrak larutan NaCl dari M. Oleifera aktifitas koagulasinya meningkat dengan adanya kation Mg2+, Ca2+ atau Ba2+ [8]. Koagulasi akan lebih efektif jika bahan aktif koagulan diekstrak terlebih dahulu. Koagulan alami yang dipergunakan dalam penelitian ini adalah biji buah semangka dan buah pepaya. Dalam penelitian ini NaCl (garam dapur) digunakan sebagai bahan pengestrak.
Biji semangka dan pepaya mengandung polimer alami yang dapat dimanfaatkan sebagai koagulan alami. Protein dan karbohidrat termasuk dalam polimer alami yang dapat berfungsi sebagai koagulan alami. Selama ini biji pepaya hanya dipergunakan untuk bibit pepaya saja sehingga masih dapat dikembangkan pemanfaatannya. Biji semangka selama ini dijadikan makanan ringan kwaci dan sebagai bibit semangka. Maka dengan dikembangkannya biji-bijian ini sebagai koagulan alami, akan memberikan nilai tambah semangka dan pepaya selain sebagai buah-buahan. Komposisi proksimat biji semangka dan pepaya ditunjukkan dalam Tabel 1 dan Tabel 2. Protein dan karbohidrat dalam biji-bijian ini merupakan polimer alami yang dapat bermanfaat sebagai koagulan alami.
Tabel 1. Komposisi Proksimat Serbuk Biji Semangka [9]
|
Parameter |
Besaran |
|
Protein |
17,75 % |
|
Lemak |
26,83 % |
|
Abu |
3,00 % |
|
Serat |
0,63 % |
|
Karbohidrat |
40,75 % |
|
Energi (kkal/100 gr) |
359,15 |
Tabel 2. Komposisi Proksimat Serbuk Biji Pepaya [10]
|
Parameter |
Besaran |
|
Kelembaban |
7,3 % |
|
Minyak |
30,1 % |
|
Protein |
28,1 % |
|
Abu |
8,2 % |
|
Serat |
19,1 % |
|
Karbohidrat |
25,6 % |
Bahan-bahan yang dipergunakan dalam penelitian ini adalah biji semangka, biji pepaya, aquades, NaCl p.a, kaolin, H2SO4 96-98%, NaOH p.a – Merck, HCl 37 % -Merck, serbuk metal merah, kristal asam oksalat p.a dan natrium borax, tablet Kjeldhal – Merck. Adapun alat yang dipakai adalah blender, moisture balance merk Ohause MB35, motor pengaduk (Janke & Kunkel RE 16), tachometer, jet pump (Gast DOA-P504-BN), corong buchner, oven (Memmert UM 400), desikator, peralatan Kjedahlterm (Gerhardt KB 12), Turbidimeter (Hanna: HI88703).
Dalam penelitian ini digunakan koagulan alami adalah biji buah semangka dan biji buah pepaya. Sebagai pengekstrak koagulan alami adalah larutan NaCl. Variabel bebas yang dipergunakan adalah konsentrasi larutan pengekstrak NaCl dan dosis larutan NaCl yang sudah mengandung zat aktif koagulan. Sedangkan sampel yang akan diuji penurunan turbiditasnya akibat penambahan koagulan alami dibuat selalu konstan nilai turbiditas awalnya. Sampel air keruh dibuat dari kaolin yang dilarutkan dalam air sehingga terbentuk suspensi kaolin 500 mg/L. Suspensi kaolin dihomogenkan diaduk menggunakan Tachometer dengan
kecepatan 100 rpm selama 30 menit untuk menyeragamkan dispersi kaolin. Setelah suspensi didiamkan 1 jam, cairan bagian atas dari suspensi diukur turbiditasnya. Nilai turbiditas ini merupakan nilai
turbiditas awal sebelum sampel dijernihkan menggunakan koagulan alami.
Ekstrak koagulan alami dibuat dengan cara mengekstrak serbuk kering biji semangka dan biji pepaya masing-masing setiap 0,5 gram menggunakan 100 mL larutan NaCl dengan konsentrasi bervariasi dari 0,05 M sampai dengan 1,2 M. Masing-masing campuran antara serbuk biji buah dan larutan NaCl diaduk dengan kecepatan 100 rpm selama 30 menit untuk mendapatkan ekstrak zat aktif koagulan alami. Setelah pengadukan, padatan serbuk biji buah dipisahkan dari filtratnya. Di dalam filtrat ini terdapat ekstrak zat aktif koagulan alami. Ekstrak koagulan ini yang akan dicampurkan ke dalam sampel yang keruh, dengan harapan dapat menjernihkan sampel yang semula keruh. Turbiditas diukur menggunakan alat Turbidimeter. Proses penjernihan dilakukan dengan cara menambahkan ekstrak koagulan yang telah dibuat ke dalam larutan sampel yang keruh. Setelah diaduk dengan kecepatan 40 rpm selama 30 menit, pengadukan dihentikan dan campuran ini didiamkan selama 30 menit. Selanjutnya larutan bagian atas diukur turbiditasnya. Berdasarkan metode ini maka akan dihitung berapa persentase penurunan turbiditas sampel air sebelum dan sesudah ditambahkan dengan koagulan alami yang berasal dari ekstrak serbuk biji semangka dan biji pepaya.
Penentuan Turbiditas Air Keruh menggunakan Koagulan Alami Serbuk Biji semangka dan pepaya ditunjukkan pada Gambar 2. Turbiditas semakin turun dengan adanya penambahan koagulan alami. Serbuk biji semangka dan biji pepaya sebagai koagulan alami mampu menurunkan turbiditas sampel air. Dalam penelelitian ini, kekeruhan air mula-mula 65 NTU (NEPHELOMETRIC TURBIDITY UNIT). Kekeruhan ini dapat diturunkan dengan penambahan koagulan alami yang komponen aktifnya diekstrak menggunakan larutan NaCl
dengan variasi konsentrasi 0,05 sampai dengan 1,2 M.
Berdasarkan hasil penelitian, turbiditas terendah pada penambahan ekstrak komponen aktif koagulan dalam NaCl dengan konsentrasi 1 M. Serbuk biji semangka dapat menurunkan turbiditas hingga 30 NTU atau 53,85 % sedangkan biji pepaya dapat menurunkan turbiditas lebih rendah lagi, yaitu 18 NTU atau 72,31 %. Zat bioaktif yang berperan dalam poses penurunan turbiditas dalam koagulan alami adalah polimer alami protein [11]. Berdasarkan Tabel 1 dan Tabel 2, biji semangka mengandung protein sebesar 17,75 % sedangkan biji pepaya memiliki komponen protein lebih besar yaitu 28,1 %. Perbedaan ini menyebabkan besarnya protein yang terekstrak dalam NaCl berbeda yaitu lebih besar protein dari biji pepaya sehingga kemampuan untuk menurunkan turbiditas air juga lebih besar biji pepaya dari pada biji semangka.
^^ Turbiditas (biji semangka)
80,00
5» CS ⅛^
’O
A
S H
70,00
60,00
50,00
40,00
30,00
20,00
10,00
0,00

Penurunan Turbiditas (%)-biji semangka
Turbiditas (biji pepaya)
Penurunan Turbiditas (%)-biji pepaya
<? ζp ^ ^ & ⅛? <? ^ ⅛' O- O' O' O' O' ∖' v
Konsentrasi NaCl yang mengandung ekstrak koagulan (M)
Gambar-2. Penurunan turbiditas sampel menggunakan koagulan alami
Proses terekstraknya protein dalam NaCl akan terus meningkat sejalan dengan peningkatan konsentrasi garam namun apabila konsentrasi garam ditingkatkan terus menerus maka kelarutan protein akan turun pada konsentrasi tertentu sehingga protein justru akan mengendap [12]. Jika
protein sudah mulai mengendap maka proses penjernihan air tidak terjadi lagi dan akibatnya turbiditas air tidak dapat turun lagi. Dalam penelitian ini terjadi pada konsentrasi NaCl 1 M. Peristiwa terekstraknya protein dalam larutan NaCl ini sering disebut juga proses salting-in. Dalam proses salting-in ini adanya zat terlarut tertentu yaitu garam NaCl menyebabkan kelarutan zat utama (bioaktif) dalam koagulan alami dalam solven menjadi lebih besar. Oleh sebab itu untuk mendapatkan turbiditas yang terus menurun, konsentrasi garam harus tetap dijaga agar tidak menurun dalam larutan sehingga tidak terjadi pengendapan protein. Dengan demikian aktivitas koagulasi zat aktif koagulan protein yang diekstrak dengan larutan NaCl ini dapat menampakkan hasil yang efektif untuk proses penurunan turbiditas atau untuk penjernihan air.
Koagulan alami yang terdapat dalam serbuk biji semangka dan biji pepaya dapat menurunkan turbiditas air atau dapat menjernihkan air. Penurunan turbiditas ini dapat mencapai 53,85 % untuk koagulan alami dalam biji semangka dan 72,31 % untuk koagulan alami yang terdapat dalam biji pepaya dengan konsentrasi pengekstrak NaCl sebesar 1 M.
Penulis mengucapkan terima kasih kepada Jurusan Teknik Kimia dan Program Studi Program Profesi Insinyur Universitas Katolik Widya Mandala Surabaya yang telah memberi kesempatan pendanaan untuk menyelesaikan penelitian ini.
-
[1] S.E. Elpani, M.J., Gunawan, E. Aviventi, R.A. Sabila. Utilization of Natural Coagulant Substance
(Tamarind and Winged Bean Seed) on the Quality of Tofu Wastewater in Muntilan, Magelang, Indonesia.
Journal of Chemistry and
Environment. 2019, 2(1), 25 – 32.
-
[2] V. Yargeau. Water and wastewater treatment: chemical processes.
Woodhead Publishing, 2012.
-
[3] Saravanan J, Priyadharshini D,
Soundammal A, Sudha G, Suriyakala K. Wastewater
Treatment using Natural
Coagulants. SSRG International Journal of Civil Engineering. 2017, 4(30), 37-39.
-
[4] Mirjana G. Antov, Marina B. Šiban, Slavica R. Adamovi and Mile T. Klašnja. Investigation Of Isolation Conditions And Ion-Exchange Purification Of Protein Coagulation Components From Common Bean Seed. Acta Periodica Technologica. 2007 38(38), 3-8.
-
[5] Terhi Suopajärvi. Functionalized nanocelluloses in wastewater treatment
applications. Finlandia: University of Oulu Juvenes Print, 2015.
-
[6] Kristianto, H. The Potency of Indonesia Native Plants as Natural Coagulant: a Mini Review. Water Conservation Science and
Engineering. 2017, 2(2), 51–60.
-
[7] Bolto, B., & Gregory, J. Organic
polyelectrolytes in water treatment. Water Research. 2007, 41(11), 2301– 2324.
-
[8] Liew A.G., Noor M.J.M and Ng Y.M. Turbid Water Clarification Using Extraction of Cowpea Seed. KKU Engineering Journal, 2004, 31(2), 73 – 82.
-
[9] Betty Tabiri, Jacob K. Agbenorhevi, Faustina D. Wireko-Manu, Elsa I. Ompouma. Seeds as Food: Nutrient Composition, Phytochemicals and Antioxidant Activity. International Journal of Nutrition and Food Sciences. 2016, 5(2), 139-144.
-
[10] Syed, H.M., Kunte S.P., Jadhav B.A. and Salve, R.V. Extraction and characterization of papaya seed oil. International Journal of Applied,
Physical and Bio-chemistry Research. 2012, 2(1), 33-43.
-
[11] Samia El-Safy, F., Salem, Rabab H., Abd El-Ghany M.E. Chemical and Nutritional Evaluation of Differen Seed Flours as Novel Sources of Protein. World Journal of Dairy and Food Science. 2012, 7(1), 59-65.
-
[12] N. A Deak, P. A. Murphy, L. A. Johnson. Effect of NaCl Concentration on Salting-in and Dilution During Salting-out Soy Protein Fractination. Journal of Food Science. 2006, 71(4), C247-C254.
23
Discussion and feedback