FRAKSINASI SELULASE MIKROBA SELULOLITIK DENGAN AMONIUM SULFAT DAN AMOBILISASI PADA AGAR-AGAR KOMERSIAL
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 9 Nomor 1, Mei 2021
FRAKSINASI SELULASE MIKROBA SELULOLITIK DENGAN AMONIUM SULFAT DAN AMOBILISASI PADA AGAR-AGAR KOMERSIAL
*
Oka Ratnayani, Putu Elvira Yulianthi, I Nengah Wirajana
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Jimbaran, Bali, Indonesia
*e-mail : nengah_wirajana@unud.ac.id
ABSTRAK: Penggunaan selulase yang semakin meningkat telah mendorong berbagai studi tentang eksplorasi, pemurnian, dan amobilisasi selulase. Penelitian ini bertujuan untuk fraksinasi ekstrak kasar selulase yang diperoleh dari mikroba selulolitik serta amobilisasinya pada agar-agar komersial. Produksi selulase dari mikroba selulolitik U3.1 dilakukan pada media yang mengandung substrat spesifik yaitu Carboxymethyl cellulose (CMC). Ekstrak kasar selulase dimurnikan dengan metode fraksinasi amonium sulfat dan dialisis. Ekstrak kasar selulase dan selulase murni diamobilisasi pada matrik agar-agar. Aktivitas selulase ditentukan berdasarkan analisis gula pereduksi yang dihasilkan dari reaksi enzimatis dengan reagen DNS. Kadar protein total diukur dengan metode Biuret. Aktivitas spesifik ekstrak kasar selulase dan selulase murni diperoleh berdasarkan rasio antara aktivitas selulase dengan kadar protein total tiap fraksi selulase. Fraksi 2 (selulase yang dimurnikan dengan garam amonium sulfat dengan tingkat kejenuhan 20-40%) memiliki aktivitas spesifik selulase tertinggi sebesar 3,3977 x 10-3 U/µg, dengan tingkat kemurnian 21,0317 kali dibandingkan ekstrak kasar selulase. Konsentrasi agar-agar optimum untuk amobilisasi ekstrak kasar selulase dan selulase murni adalah masing- masing 2% (b/v) dan 3% (b/v) dengan efisiensi amobil sebesar 13,99% dan 51,26%.
Kata kunci: selulase, fraksinasi, amobilisasi, agar-agar komersial.
ABSTRACT: The increasing use of cellulase has encouraged various studies on exploration, purification and immobilization of the enzyme. This study aimed to fractionate the crude extract of cellulase obtained from cellulolytic microbe as well as immobilize it into commercial agar. The cellulase production from cellulolytic microbe U3.1 was carried out on the media containing a specific substrate of Carboxymethyl cellulose (CMC). The crude extract of cellulase was purified by fractionation of ammonium sulfate and dialysis. The crude extract and the pure cellulase were immobilized into the agar matrix. Cellulase activity was determined based on the analysis of reducing sugars produced by enzymatic reaction with DNS reagent. The total protein content was measured by using the Biuret method. The specific activity of the crude extract and the pure cellulase was obtained from the ratio of the cellulase activity to the total protein of each fraction. Fraction 2 (cellulase purified with 2040% saturation of ammonium sulfate) had the highest specific activity of 3.3977 x 10-3 U/µg with the purity level increased by 21.0317 times compared to the crude extract of cellulase. The optimum agar concentration for immobilization of the crude extract and the pure cellulase was 2% (b/v) and 3% (b/v) with the immobilization efficiency of 13.99% and 51.26%, respectively.
Keywords: cellulase, fractionation, immobilization, commercial agar.
Mikroba selulolitik mampu mensintesis beberapa enzim yang dapat menghidrolisis selulosa, dimana enzim tersebut dinamakan selulase [1]. Selulase disebut juga enzim multikomponen karena terdiri dari tiga enzim yang berbeda, yaitu endoselulase, selobiohidrolase dan β-glukosidase dimana ketiga komponen enzim tersebut akan bekerjasama sehingga dapat menghidrolisis selulosa menjadi glukosa. Selulase banyak dimanfaatkan dalam bidang industri tekstil, kertas, bahan bakar alternatif, detergen, makanan serta pakan ternak [2].
Selulase dapat diproduksi melalui mikroorganisme seperti bakteri dan fungi, namun bakteri lebih banyak digunakan untuk produksi selulase karena bakteri dapat mendegradasi selulosa serta memiliki kelimpahan tertinggi dibandingkan mikroorganisme lain [3]. Selain itu, bakteri juga memiliki tingkat pertumbuhan yang cepat karena memiliki ukuran molekul yang kecil sehingga mempersingkat waktu produksi selulase [4]. Produksi selulase telah banyak dilakukan, diantaranya produksi selulase dari bakteri yang diisolasi dari limbah rumput laut [5], serta selulase yang diperoleh dari bakteri OS-16 yang berasal dari padang pasir Tengger-Bromo [6].
Di alam, selulosa selalu berasosiasi dengan polisakarida lain seperti pektin, xilan, hemiselulosa serta lignin, tidak ditemukan dalam keadaan murni [7]. Aktivitas selulase sulit ditentukan jika filtrat yang akan diukur terdiri dari campuran dari bermacam jenis enzim selulase [8]. Oleh sebab itu pemurnian selulase penting dilakukan karena meningkatkan aktivitas spesifik enzim tersebut. Selulase murni setelah dialisis memiliki aktivitas spesifik sebesar 14,075 U/mg dengan tingkat kemurnian sebesar
-
5,7 kali dibandingkan ekstrak kasar selulase [9].
Presipitasi protein dan enzim merupakan pemurnian enzim tahap awal yang dapat dilakukan dengan beberapa metode, yaitu penambahan pelarut organik dan penambahan garam serta perubahan pH, [10]. Metode yang sering dilakukan dalam proses pemekatan enzim adalah dengan menambahkan garam ke dalam larutan enzim, seperti garam natrium klorida, garam natrium sulfat maupun garam amonium sulfat. Garam yang biasa digunakan adalah garam amonium sulfat karena memiliki beberapa kelebihan, yaitu memiliki efek penstabil terhadap kebanyakn enzim, tidak akan mempengaruhi aktivitas enzim, memiliki daya pengendapan yang efektif, kelarutan tinggi, serta dapat digunakan pada berbagai pH [11]. Penggunaan garam amonium sulfat pada tahap awal pemurnian menunjukkan bahwa selulase yang dihasilkan dari isolat khamir jenis Candida utilis memiliki aktivitas selulase tertinggi sebesar 0,2163 U/mL menggunakan fraksi dengan tingkat kejenuhan 80% [12].
Dialisis merupakan metode yang dapat diaplikasikan untuk meningkatkan kemurnian selulase setelah dilakukan fraksinasi dengan garam. Pada proses dialysis, membran semipermeable digunakan untuk memisahan molekul-molekul besar dan molekul-molekul kecil. Meningkatnya kemurnian selulase setelah proses dialisis presipitasi garam amonium sulfat pada tingkat kejenuhan 70% memiliki tingkat kemurnian sebesar 4,70 kali dibandingkan dengan supernatan selulase, kemudian di dialisis sehingga kemurniannya meningkat menjadi 21,25 kali dibandingkan dengan supernatannya [13].
Syarat tertentu harus dipenuhi untuk penggunakaan enzim dalam proses industri, dimana enzim disarankan bersifat termostabil serta memiliki ketahanan yang
kuat terhadap kondisi ekstrim. Sementara itu, enzim hanya dapat bekerja pada kondisi fisiolgis serta tidak tahan terhadap kondisi ekstrim. Kelemahan ini dapat diatasi dengan teknik amobilisasi. Amobilisasi enzim dilakukan untuk meingkatkan daya tahan enzim terhadap perubahan lingkungan serta enzim amobil dapat digunakan kembali secara berulang-ulang [14,15]. Salah satu jenis selulase yaitu endo 1,4 β-D-glukanase pernah diamobil pada matrik agar-agar dengan stabilitas termal antara 50-80 oC pada konsentrasi agar-agar optimum 2% dan dapat digunakan sebanyak 8 siklus [16].
Pada penelitian sebelumnya, isolasi beberapa mikroba selulolitik telah dilakukan dari fermentasi ubi jalar ungu dalam tanah. Selanjutnya, isolasi selulase secara ekstraseluler serta pemurniannya menggunakan metode fraksinasi dengan penambahan garam amonium sulfat dilakukan pada penelitian ini. Selulase ekstrak kasar dan hasil pemurniannya diamobilisasi pada matrik agar-agar komersial untuk ditentukan efisiensi enzim amobilnya.
Bahan yang digunakan dalam penelitian ini yaitu agar-agar plain komersial (Merek Swallow). Selulase yang digunakan berasal dari inokulum mikroba selulolitik dengan kode U3.1 (hasil isolasi dari fermentasi ubi jalar ungu dalam tanah). Bahan kimia yang digunakan memiliki kualitas pro analysis (p.a) yaitu garam amonium sulfat, garam natrium kalium tartarat (Merck), glukosa anhidrat, Carboxymethyl cellulose, natrium klorida, asam 3,5-dinitrosalisilat, tembaga sulfat penta hidrat, natrium hidroksida (Merck), Bovine Serum Albumin, natrium dihidrogen fosfat, dinatrium fosfat, barium diklorida, pepton, yeast extract, membran selofan (Carolina Dialysis Tubing), bacto agar, aquades, aluminium foil, kertas saring, dan jarum ose steril.
Alat gelas yang digunakan dalam adalah pipet tetes, gelas Beker, gelas ukur, labu ukur, Erlenmeyer, botol kaca, corong, dan batang pengaduk. Alat non-gelas yang digunakan adalah cawan petri, tabung Eppendorf, tabung sentrifugasi, pipet mikro, tip mikro, neraca analitik, stopwatch, penangas air, pH meter, dan termometer. Instrumen yang digunakan adalah lemari pendingin, Laminar flow, autoklaf, sentrifugasi (KUBOTA S700TR), spektrofotmeter UV-Vis (Single Beam Genesys), Biokit ELISA reader (ELx808TM Absorbance Microplates Reader), shaker incubator (BioSan Orbital ShakerIncubator ES-20), dan pengaduk magnetic (JLab TechR Daihan Labtech Co. Ltd.).
Mikroba selulolitik ditumbuhkan dalam media padat CMC. Media padat CMC mengandung CMC 1% (b/v), pepton 2% (b/v), yeast extract 1% (b/v), NaCl 0,5% (b/v), serta bacto agar 2% (b/v). Selanjutnya disuspensi dalam 100 mL akuades. Kemudian disterilisasi dengan autoklaf selama 15 menit pada suhu 121 oC. Hasil sterilisasi media ini dipindahkan kedalam masing-masing petri sebanyak 5 buah yang dilakukan dalam Laminar flow. Media dibiarkan memadat, setelah dingin disimpan didalam kulkas sebelum digunakan. Penanaman mikroba dilakukan dengan mengambil satu koloni tunggal dengan jarum ose steril. Mikroba yang sudah ditanam dalam media, lalu diinkubasi pada suhu 37oC selama 1 hari.
Produksi dan Isolasi Selulase
Koloni tunggal mikroba selulolitik diambil dengan jarum ose steril lalu dimasukkan ke dalam 20 mL media stater dalam Erlenmeyer 100 mL. Media starter diinkubasi selama 1 hari pada suhu 37 oC dalam shaker inkubator. Inokulum mikroba yang sudah tumbuh diambil sebanyak 1 mL lalu dimasukkan ke dalam 100 mL media fermentasi dalam Erlenmeyer 500 mL.
Media produksi ini kemudian diinkubasi pada suhu 37 oC selama 3 hari dalam shaker inkubator. Isolasi selulase dilakukan dengan menggunakan metode sentrifugasi. Media produksi yang berisi mikroba selulolitik diinkubasi dalam shaker incubator pada suhu 37 oC selama 3 hari, lalu dipisahkan selulase dari komponen sel lainnya dengan cara sentrifugasi pada kecepatan 5000 x g selama 20 menit pada suhu 4o C.
Pemurnian Selulase dengan Metode Fraksinasi Amonium Sulfat
Ekstrak kasar selulase diendapkan dengan menambahkan amonium sulfat secara perlahan-lahan dan diaduk dengan menggunakan pengaduk magnetik dalam keadaan dingin hingga larut, lalu disimpan didalam lemari pendingin. Amonium sulfat ditambahkan dengan variasi derajat kejenuhan 0 - 20%; 20 - 40%; 40 - 60%; 60 - 80%; 80 - 100%. Endapan yang dihasilkan tiap fraksi disentrifugasi pada kecepatan 5000 x g selama 20 menit pada suhu 4 oC. Selanjutnya, endapan yang diperoleh dilarutkan dengan buffer fosfat 0,2 M pH 6,0 hingga volumenya mencapai 10 mL.
Pemurnian Selulase dengan Metode Dialisis
Endapan protein tiap fraksi dapat dimurnikan dengan metode dialisis menggunakan membran semipermeabel (Carolina Dialysis Tubing). Endapan protein didialisis pada pH 6 dengan buffer fosfat 0,02 M pada suhu dingin menggunakan kantong selofan hingga garam yang terkandung didalam setiap fraksi hilang. Pergantian buffer setiap 3 jam selama dialisis dilakukan agar mengurangi konsentrasi ion-ion garam di dalam kantong selofan.
Amobilisasi Selulase pada Agar-Agar Komersial
Proses amobilisasi diawali dengan mempersiapkan matriks agar-agar dengan konsentrasi yang berbeda-beda yaitu 1%,
2%, dan 3% (b/v) dalam akuades sambil dipanaskan pada suhu 50 oC. Campuran didinginkan pada suhu kamar. Sebanyak 1 mL selulase dicampur dengan 9 mL larutan agar-agar dan segera dipindahkan ke cawan petri dan dibiarkan mengeras pada suhu kamar. Setelah itu, gel agar-agar dipotong dengan ukuran 0,5 x 0,5 cm2 dan dicuci sebanyak 3 kali menggunakan akuades, untuk menghilangkan selulase yang tidak teramobil. Selanjutnya gel agar-agar yang telah dipotong disimpan pada suhu 4 oC, untuk kemudian dilakukan pengujian aktivitas selulase amobil.
Pembuatan Kurva Standar Glukosa
Glukosa sebanyak 0,1 gram dimasukkan dalam labu ukur 100 mL lalu ditambahkan akuades sampai batas ukur untuk membuat larutan stok 1000 ppm. Larutan stok glukosa diencerkan dengan konsentrasi 80; 100; 120; 140; 160; 180 dan 200 ppm. Diambil masing-masing 250 µL buffer fosfat 0,2 M pH 6, 250 µL substrat CMC 1%, 100 µL larutan standar glukosa yang telah diencerkan lalu dimasukkan ke dalam tabung Eppendorf. Kemudian ditambahkan 150 µL reagen DNS ke dalam masing-masing tabung reaksi dan dihomogenkan. Tabung Eppendorf dimasukkan dalam air mendidih selama 5 menit hingga larutan berwarna merah-cokelat. Setelah itu larutan ditambahkan 200 µL KNa-Tartrat dan 150 µL akuades, lalu didinginkan pada suhu ruang. Absorbansi larutan diukur dengan alat ELISA reader pada panjang gelombang 490 nm. Dari kurva standar dan persamaan garis yang dihasilkan, dapat ditentukan konsentrasi glukosa dari masing-masing sampel yang telah diukur absorbansinya.
Penentuan Aktivitas Selulase dengan Metode DNS
Sebanyak 250 µL substrat CMC 1% (b/v) dan 250 µL buffer fosfat 0,2 M pH 6 dimasukkan ke dalam tabung Eppendorf lalu ditambahkan dengan 100 µL selulase (ekstrak kasar, hasil fraksinasi, dan hasil
dialisis). Campuran diinkubasi pada suhu 37 oC selama 60 menit. Untuk menghentikan reaksi, sebanyak 100 µL reagen DNS ditambahkan dan didihkan dalam waterbath pada suhu 100 oC selama 15 menit. Setelah itu ditambahkan sebanyak 100 µL KNa-Tartarat dan didinginkan. Jumlah gula reduksi yang dilepaskan diukur dengan menggunakan ELISA reader pada panjang gelombang 490 nm.
Penentuan Aktivitas Selulase Amobil
Pengukuran aktivitas selulase amobil dilakukan dengan metode yang sama seperti selulase bebas dengan sedikit modifikasi. Sebanyak satu gram selulase amobil direaksikan dengan 250 µL substrat CMC 1% (b/v) dan 250 µL buffer fosfat 0,2 M pH 6, lalu diinkubasi selama 60 menit pada suhu 37 oC yang digoyang dengan pelan (10 rpm) dengan shaker inkubator. Bagian cairan atau larutannya yang mengandung hasil hidrolisis substrat secara enzimatis diambil 250 µL dan ditambahkan 150 µL reagen DNS, untuk menghentikan reaksi serta didihkan dalam waterbath pada suhu 100 oC selama 15 menit. Setelah itu ditambahkan dengan 200 µL KNa-Tartarat dan didinginkan. Larutan tersebut diukur absorbansinya pada panjang gelombang 490 nm menggunakan ELISA reader. Absorbansi yang diperoleh diplotkan terhadap kurva standar glukosa untuk menentukan konsentrasi glukosa hasil hidrolisis substrat CMC 1% dengan selulase.
Pembuatan Kurva Standar BSA
Dibuat larutan protein BSA (Bovine Serum Albumin) dengan konsentrasi 5000 ppm, selanjutnya disiapkan 6 buah tabung reaksi dengan masing-masing tabung reaksi diisi larutan protein standar sebanyak 0 (blanko), 0,5; 1; 1,5; 2; dan 2,5 mL. Kemudian masing-masing tabung reaksi ditambahkan akuades hingga volumenya mencapai 4 mL. Lalu masing-masing tabung reaksi ditambahkan pereaksi Biuret
sebanyak 6 mL dan dihomogenkan. Tabung reaksi diinkubasi pada suhu 37 oC selama 60 menit hingga terbentuk warna ungu sempurna. Larutan standar diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 550 nm
Penentuan Kadar Protein Selulase dengan Metode Biuret
Sebanyak 1 mL ekstrak selulase ditambahkan dengan 4 mL akuades. Kemudian ditambahkan reagen Biuret hingga volumenya mencapai 10 mL dan dihomogenkan. Selanjutnya larutan disimpan pada suhu 37 oC selama 60 menit sampai larutan berwarna ungu sempurna. Diukur absorbansinya pada panjang gelombang 550 nm dengan menggunakan spektrofotometer UV-Vis.
Pemurnian selulase tahap awal dilakukan dengan penambahan garam amonium sulfat jenuh. Ekstrak kasar selulase diendapkan dengan ammonium sulfat dengan derajat kejenuhan berbeda tiap fraksi 0 - 20%; 20 - 40%; 40 - 60%; 60 - 80% dan 80 - 100% pada suhu dingin, untuk menghindari terjadinya denaturasi enzim. Endapan tiap fraksi hasil fraksinasi dengan amonium sulfat selanjutnya dimurnikan kembali melalui proses dialisis. Membran selofan yang digunakan untuk dialisis memiliki cutoff antara 12-14 kDa sehingga baik digunakan untuk proses dialisis selulase, sebab selulase memiliki berat molekul berkisar antara 26-200 kDa sehingga selulase tertahan oleh pori-pori membran selofan, sedangkan amonium sulfat dalam bentuk ion dengan mudah keluar melalui membran. Untuk mengetahui kemurnian selulase, dilakukan penentuan kadar protein dengan metode Biuret untuk menghitung aktivitas spesifik selulase hasil pemurnian.
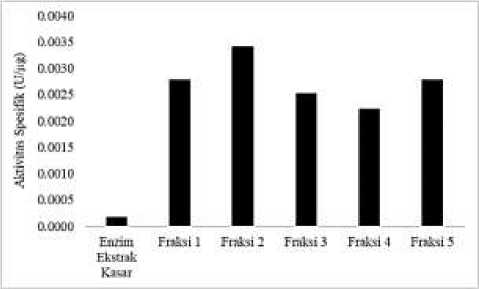
Gambar 1. Aktivitas Spesifik Selulase Setiap Fraksi setelah Dialisis
Gambar 1 menunjukkan bahwa ekstrak kasar selulase setelah melalui proses dialisis pada tingkat kejenuhan amonium sulfat 20 - 40% mengandung protein selulase paling murni dibandingkan dengan fraksi lainnya. Hal ini dapat dilihat dari aktivitas spesifik tertinggi berada pada fraksi 2 dengan aktivitas spesifik sebesar 3,3977 x 10-3 U/µg. Pada tingkat kejenuhan ini, garam amonium sulfat lebih banyak dapat mengendapkan protein yang memiliki aktivitas selulase dibandingkan protein ekstraseluler lainnya.
Tabel 1 menunjukkan bahwa adanya peningkatan kemurnian pada masing-masing fraksi dibandingkan dengan ekstrak kasar selulase, hal ini dikarenakan protein lain selain selulase sudah terpisah sehingga menyebabkan terjadinya peningkatan aktivitas enzim, karena enzim dapat bekerja dengan efektif tanpa gangguan dari zat pengotor lainnya [17]. Berdasarkan hasil yang diperoleh maka pemurnian selulase dengan metode fraksinasi dan dialisis efektif untuk meningkatkan kemurnian selulase ekstrak kasar.
Amobilisasi selulase diawali dengan mempersiapkan matrik agar-agar komersial konsentrasi 1%, 2% dan 3% (b/v). Pada
penelitian ini, ekstrak kasar selulase dan selulase hasil fraksinasi setelah dialisis (fraksi 2) yang memiliki aktivitas spesifik tertinggi digunakan untuk amobilisasi. Aktivitas selulase amobil ditunjukkan pada Tabel 2.
Tabel 1. Tingkat Kemurnian Selulase Hasil Pemurnian
|
Nama Sampel |
Aktivitas Spesifik Selulase (U/µg) |
Tingkat Kemurnian (kali) |
|
Ekstrak kasar |
1,6155 x 10-4 |
1,0000 |
|
Selulase | ||
|
Fraksi 1 (D) |
2,7741 x 10-3 |
17,1715 |
|
Fraksi 2 (D) |
3,3977 x 10-3 |
21,0317 |
|
Fraksi 3 (D) |
2,5142 x 10-3 |
15,5625 |
|
Fraksi 4 (D) |
2,2098 x 10-3 |
13,6784 |
|
Fraksi 5 (D) |
2,7694 x 10-3 |
17,1423 |
Tabel 2. Aktivitas Selulase Amobil pada Matrik Agar-Agar
|
Nama Sampel dan Konsentrasi Agar-agar (b/v) |
Aktivitas Selulase (U/mL) |
|
Ekstrak kasar selulase |
0,0180 |
|
amobil 1% | |
|
Ekstrak kasar selulase |
0,0191 |
|
amobil 2% | |
|
Ekstrak kasar selulase |
0,0223 |
|
amobil 3% | |
|
Selulase hasil fraksinasi dan |
0,0207 |
|
dialisis amobil 1% | |
|
Selulase hasil fraksinasi dan |
0,0173 |
|
dialisis amobil 2% | |
|
Selulase hasil fraksinasi dan |
0,0198 |
|
dialisis amobil 3% |
Tabel 2 menunjukkan bahwa aktivitas ekstrak kasar selulase amobil pada konsentrasi matriks agar-agar 1%, 2%, dan 3% (b/v), berturut-turut sebesar 0,0180; 0,0191; 0,0223 U/mL; cenderung lebih tinggi daripada aktivitas ekstrak kasar selulase bebas yaitu sebesar 1,9026 x 10-2 U/mL. Namun hal yang berbeda terjadi
untuk aktivitas selulase hasil fraksinasi dan dialisis teramobilisasi pada konsentrasi matriks agar-agar 1%, 2%, dan 3% (b/v), berturut-turut sebesar 0,0207; 0,0173; 0,0198 U/mL; lebih rendah dari pada aktivitas selulase bebas hasil fraksinasi dan dialisis yaitu sebesar 3,5450 x 10-2 U/mL. Hal ini dapat disebabkan karena adanya perubahan kondisi optimum antara selulase bebas dan selulase amobil [18].
Salah satu keuntungan enzim amobil adalah dapat digunakan lebih dari satu kali dan penggunaan secara kontinyu, tetapi dapat menurunkan aktivitas enzim amobil tersebut setelah digunakan lebih dari satu kali pemakaian. Hal ini disebabkan adanya kebocoran pada enzim amobil yang digunakan berulang kali. Semakin tinggi tingkat kebocoran enzim, maka semakin buruk matriks tersebut dalam mengamobilisasi enzim. Adanya kebocoran pada enzim amobil dapat dilihat pada Tabel 3.
|
Tabel 3. |
Aktivitas |
Selulase |
Tidak |
|
Teramobilisasi |
pada | ||
|
Pencucian Berulang | |||
|
Aktivitas Selulase (U/mL) | |||
|
Nama |
Hasil Pencucian ke- | ||
|
Sampel | |||
|
1 |
2 |
3 | |
|
Ekstrak kasar amobil 1% |
0,0171 |
0,0170 |
0,0159 |
|
Ekstrak kasar amobil 2% |
0,0164 |
0,0134 |
0,0133 |
|
Ekstrak kasar amobil 3% |
0,0171 |
0,0165 |
0,0160 |
|
Enzim murni amobil 1% |
0,0183 |
0,0177 |
0,0168 |
|
Enzim murni amobil 2% |
0,0177 |
0,0176 |
0,0166 |
|
Enzim murni amobil 3% |
0,0174 |
0,0160 |
0,0159 |
Tabel 3 menunjukkan bahwa selulase amobil dicuci sebanyak 3 kali dengan sisa aktivitas selulase amobil pada
pencucian ketiga ekstrak kasar 1%, ekstrak kasar 2%, ekstrak kasar 3%, enzim murni 1%, enzim murni 2%, enzim murni 3% secara berturut-turut yaitu 0,0159; 0,0133; 0,0160; 0,0168; 0,0166 dan 0,0159 U/mL. Hal ini menunjukkan adanya kebocoran pada enzim amobil karena pada air cucian ditemukan aktivitas selulase.
Efisiensi amobilisasi selulase pada matrik agar-agar ditentukan untuk mengetahui kemampuan agar-agar komersial sebagai matrik pendukung amobilisasi suatu enzim. Efisiensi amobilisasi selulase pada agar-agar ditunjukkan pada Gambar 2.
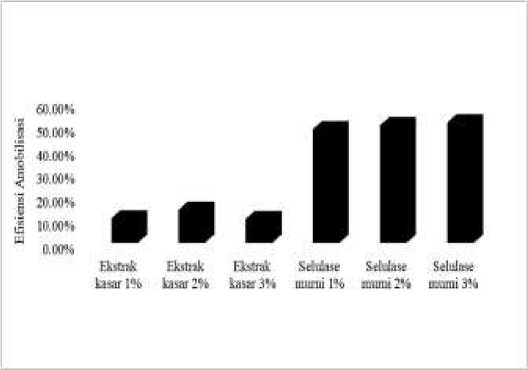
Gambar 2. Efisiensi Amobilisasi Selulase pada Agar-Agar Komersial
Gambar 2 menunjukkan bahwa agar-agar 2% merupakan konsentrasi optimum untuk amobilisasi selulase ekstrak kasar karena efisiensi amobilnya sebesar 13,99%. Sementara agar-agar 3% merupakan konsentrasi optimum untuk amobilisasi selulase murni dengan efisiensi amobil sebesar 51,26%. Efisiensi amobil yang rendah dapat disebabkan oleh hambatan yang semakin besar dari substrat maupun produk yang keluar masuk melalui pori-pori agar-agar. Konsentrasi molekul enzim yang tinggi menyebabkan penghalang sterik dengan membentuk kompleks multilayer protein pada permukaan partikel yang bermuatan dalam polimer agar-agar. Selain itu, pada metode
ini tidak terjadi pengikatan secara kimia antara enzim dengan matriks agar-agar sehingga enzim mudah lepas selama proses pencucian dan pada akhirnya menghasilkan efisiensi amobil yang rendah.
Aktivitas ekstrak kasar selulase dan selulase murni amobil memiliki perbandingan yang tidak terlalu signifikan. Hal ini menunjukkan bahwa selulase ekstrak kasar dapat diamobilisasi langsung tanpa harus melalui proses pemurnian. Namun selulase murni yang diamobilisasi juga menguntungkan, karena efisiensi amobilisasi cenderung lebih tinggi dibandingkan dengan selulase ekstrak kasar.
Selulase paling murni diperoleh pada fraksi 2 (yang dimurnikan menggunakan ammonium sulfat dengan tingkat kejenuhan 20 - 40%) dengan aktivitas spesifik sebesar 3,3977 x 10-3 U/µg dan tingkat kemurnian 21,0317 kali lebih tinggi dibandingkan ekstrak kasar selulase. Konsentrasi agaragar optimum untuk amobilisasi ekstrak kasar selulase dan selulase murni adalah masing-masing 2% (b/v) dan 3% (b/v), dengan efisiensi amobil sebesar 13,99% dan 51,26%.
Penelitian ini merupakan bagian dari Penelitian Inovasi Udayana 2019 yang didanai dari DIPA BLU Universitas Udayana. Ucapan terima kasih disampaikan kepada Kepala UPT Laboratorium Forensik, Ketua LPPM dan Rektor Universitas Udayana atas dukungan dan fasilitas dalam penelitian.
-
[1] Ibrahim, A. S. S., dan El-diwany, A. I.
2007. Isolation and Identification of
New Cellulaces Producing
Thermophilic Bacteria from an Egyptian Hot Spring and Some Properties of the Crude Enzyme. Journal Science. 1: 473-478.
-
[2] Andhikawati, A., Oktavia, Y., Ibrahim, B., dan Kustiariyah. 2014. Isolasi dan Penapisan Kapang Laut Endofit Penghasil Selulase. Jurnal Ilmu dan Teknologi Kelautan Tropis. 6(1): 219227.
-
[3] Hasibuan, B. E. 2009. Pupuk dan Pemupukan. Universitas Sumatra Utara Press.
-
[4] Alam, M. Z., Manchur, M.A., and Anwar, M.N. 2004. Isolation, Purification, Characterization of Cellulolytic Enzymes Produced by The Isolate Streptomyces amiyaensis. Pakistan Journal of Biological Science. 7: 1647-1653.
-
[5] Dini, I., Rahma, dan Munifah, I. 2014. Produksi dan Karakterisasi Enzim Selulase Ekstrak Kasar dari Bakteri yang Diisolasi dari Rumput Laut. Skripsi. Universitas Riau.
-
[6] Sonia, N. M. O., dan Joni, K. 2015. Isolasi dan Karakterisasi Parsial Enzim Selulase dari Isolat Bakteri OS-16 Asal Padang Pasir Tengger-Bromo. Jurnal Pangan dan Agroindustri. 3(4): 11-19.
-
[7] Fitriani, E. 2003. Aktivitas Enzim Karboksimetil Selulase Bacillus pumilus Galur 55 pada Berbagai Suhu Inkubasi. Skripsi. Institut Pertanian Bogor.
-
[8] Enari, T. M. Microbial Cellulases In: Fogarty W.M. 1983. Microbial
Enzymes and Biotechnology. New
York: Appl. Sci. Publisher.
-
[9] Aulia, F. A. 2017. Amobilisasi Enzim Selulase dari Bacillus subsitilis ITBCCB148 Menggunakan Bentonit. Skripsi. Universitas Lampung.
-
[10] Chaplin, M. F., and Bucke. 1990. Enzyme Technology. Cambridge University Press.
-
[11] Scopes, R. K. 1982. Protein Purification: Principles and Practice. Springer-Verlag.
-
[12] Azizah, N. 2017. Pemurnian Enzim Selulase dari Isolat Khamir Jenis Candida utilis menggunakan
Fraksinasi Amonium Sulfat. Skripsi. UIN Alauddin.
-
[13] Sonia, N. M. O., dan Joni, K. 2015. Isolasi dan Karakterisasi Parsial Enzim Selulase dari Isolat Bakteri OS-16 Asal Padang Pasir Tengger-Bromo. Jurnal Pangan dan Agroindustri. 3(4): 11-19.
-
[14] Goddatte, D. W., Terri. C., Beth, F.L., Maria, L., Jonathan, R.M., Christian, P., Robert, B.R., Shiow S.Y., and Wilson, C.R. 1993. Strategy and Implementation of a System for Protein Engineering. Journal
Biothecnology. 28: 41-54.
-
[15] Krajewska, B. 2004. Aplication of Chitin and Chitosan-based Material for Enzyme Immobilizations: A
Review. Enzyme and Microbial Technology. Journal Article of Enzyme and Microbial Technology. 35: 126-139.
-
[16] Karim, A., Qader, S.H.U., Nazwaz, A., and Aman, A. 2014. Immobilization of Endo (1,4) β-D-Glucanase from Bacillus
Licheniformis KIBGE-IB2 Using Agar-Agar as Support for Continuous Use. Journal of Chemical Engineering. 38: 409-414.
-
[17] Sumardi, A., Suwanto, M., Thenawidjaja, T., and Purwadaria. 2005. Isolation and Characterization of Mannanolytic Thermophilic Bacteria from Palm Oil Shell and Their Mananase Enzyme Production Properties. Journal of Biotropia. 25: 1-10.
-
[18] Zusfahir, dan Fatoni, A. 2011. Amobilisasi Protease dari Bacillus sp. BT 1 menggunakan Poliakrilamida. Jurnal Kimia FMIPA Universitas Jenderal Soedirman. 6(2): 84-92.
9

Discussion and feedback