PERBANDINGAN EFEKTIFITAS DISINFEKTAN KAPORIT, HIDROGEN PEROKSIDA, DAN PEREAKSI FENTON (H2O2/Fe2+)
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 1, Nomor 2, November 2013
I Ca⅛ra ∣ ■ cKimia ∣
PERBANDINGAN EFEKTIFITAS DISINFEKTAN KAPORIT, HIDROGEN PEROKSIDA, dan PEREAKSI FENTON (H2O2/Fe2+)
Didik Setiawan1, James Sibarani1*, Iryanti E. Suprihatin1 1Magister Kimia Terapan, Fakultas Pascasarjana, Universitas Udayana Denpasar, Bali-Indonesia *
Email: sibaranijames@gmail.com
ABSTRAK: Tujuan dari penelitian ini adalah untuk menentukan konsentrasi optimum dan efektifitas hidrogen peroksida dan pereaksi Fenton sebagai disinfektan dibandingkan dengan kaporit. Efektivitas disinfeksi ditentukan berdasarkan beberapa parameter yaitu: koefisien fenol disinfektan dan kualitas air yang dihasilkan yang diukur melalui pH, oksigen terlarut (DO, dissolved oxygen), dan suhunya serta harga disinfektan itu sendiri. Analisis statistik ANOVA dua arah tanpa interaksi pada tingkat kesalahan 0.01 dilakukan guna menentukan disinfektan paling efektif dan konsentrasi optimumnya. Uji koefisien fenol dilakukan dengan mencampurkan disinfektan dengan konsentrasi tertentu dengan bakteri Salmonella typhosa dan Staphyllococcus aureus kemudian membandingkan hasilnya dengan fenol. Hasil pengamatan menunjukkan bahwa koefisien fenol dari kaporit, hidrogen peroksida, dan reagen Fenton berturut-turut adalah 4, 6, dan 6. Air yang dihasilkan oleh kaporit mempunyai pH, DO dan suhu berturut-turut adalah 10.07 - 9.2, 6.63-8.07 mgL-1, dan 28.5-28.13oC. Air yang didisinfeksi dengan hidrogen peroksida mempunyai pH, DO, dan suhu berturut-turut adalah 9.03-7.33, 6.93-9.40 mgL-1 , dan 28.5-28.03oC. Sedangkan air hasil didisinfeksi dengan reagen Fenton mempunyai pH, DO, dan suhu berturut-turut adalah 5.97-4.57, 7.40-8.57 mgL-1 , dan 28.47-28.07oC. Meskipun kaporit paling murah, namun dari segi kesehatan hidrogen peroksida merupakan reagen yang paling aman dan paling efektif karena dengan daya disinfeksi enam kali dibandingkan fenol, tidak meninggalkan residu yang membahayakan. Fenton, dilain pihak, meskipun mempunyai daya disinfeksi setara dengan hidrogen peroksida, namun menghasilkan ion Besi (III) dalam air sehingga memerlukan pengolahan lebih jauh. Dengan demikian, secara keseluruhan hidrogen peroksida merupakan disinfektan paling efektif dari ketiganya.
Kata kunci: Koefisien fenol, Kaporit, Pereaksi Fenton, Hidrogen Peroksida
ABSTRACT: The purpose of this study is to determine the optimum concentration and the effectiveness of hydrogen peroxide and Fenton reagent as disinfectants compared to chlorine. The most effective disinfectant is that having the highest phenol coefficient, and resulting good water quality with pH of 6.5-8.5, high dissolved oxygen (DO), and temperature close to ambient, and cheap. The three materials were tested on Salmonella typhosa and Staphyllococcus aureus and their minimum concentrations that kill the bacteria were compared to that of phenol to determine the phenol coefficients. The results show the phenol coefficients of chlorine, hydrogen peroxide, and Fenton are 4, 6, and 6 respectively. The pH of the water treated by the three disinfectants 10.07-9.2, 9.03-7.33, and 5.97-4.57 respectively. The disinfected waters have DO of 6.63-8.07 mgL-1, 6.93-9.40 mgL-1, and 7.40-8.57 mgL-1 respectively. The temperatures of the water are 28.5-28.3, 28.5-28.03, and 28.47-8.07 oC respectively. Chlorine is the cheapest in price, however, its residue may lead to the formation of the carcinogenic halomethanes in the drinking water, and its phenol coefficient is lower than both hydrogen peroxide and Fenton
reagents. The last two disinfectants have the highest phenol coefficient, however, hydrogen peroxide is saver because it does not produce harmful chemicals whereas Fenton reagent results in the formation of residual Iron(III) in the water that needs to be treated further.
Keywords: Phenol Coefficient, Fenton Reagent, Hydrogen Peroxide, Chlorine
Air merupakan kebutuhan pokok makhluk hidup untuk dapat menjalankan segala aktivitasnya. Pengaruh air sangat luas bagi kehidupan, khususnya untuk makan dan minum. Orang akan mengalami dehidrasi atau terserang penyakit bila kekurangan cairan dalam tubuhnya [1]. Sekitar 70 % tubuh manusia terdiri dari air. Manusia memerlukan air sekitar 1,5 L per hari untuk minum. Angka tersebut tentunya akan bervariasi dari satu daerah dengan yang lain, tergantung pada situasi, iklim dan suhu setempat. Konsumsi air pada daerah beriklim panas lebih banyak daripada daerah beriklim dingin [2].
Air dibutuhkan oleh organ tubuh manusia untuk melangsungkan metabolisme, sistem asimilasi, menjaga keseimbangan cairan tubuh, memperlancar proses pencernaan, melarutkan dan membuang racun dari ginjal. Air yang cukup dan layak masuk ke dalam tubuh akan membantu berlangsungnya fungsi tersebut dengan sempurna. Jumlah air yang cukup mutlak diperlukan, lebih dari itu air yang mengandung polutan dapat menyebabkan gangguan kesehatan [3].
Beberapa persyaratan yang perlu diketahui mengenai kualitas air tersebut baik secara fisik, kimia dan juga mikrobiologi. Syarat fisik, antara lain: air harus bersih dan tidak keruh, tidak berwarna, tidak berasa, tidak berbau, suhu tidak berbeda lebih dari 3oC dari suhu udara dan tidak meninggalkan endapan. Syarat kimiawi, antara lain: tidak mengandung bahan kimiawi yang mengandung racun, tidak mengandung zat-zat kimiawi yang berlebihan, cukup yodium,
pH air antara 6,5 – 8,5. Syarat mikrobiologi, antara lain: tidak mengandung kuman-kuman penyakit seperti disentri, tipus, kolera, dan bakteri patogen penyebab penyakit [4].
Pemerintah dalam hal ini perusahaan daerah air minum berusaha mencukupi kebutuhan masyarakat akan air bersih melalui pengolahan air minum yang bahan bakunya berupa air permukaan. Proses yang dilakukan dalam mengolah air minum meliputi, presedimentasi, koagulasi-flokulasi, klarifikasi, filtrasi, sedimentasi, dan disinfeksi [5]. Proses disinfeksi yang banyak digunakan adalah klorinasi, karena klor efektif sebagai disinfektan dan harganya terjangkau . Tujuan klorinasi adalah mengurangi dan membunuh mikroorganisme yang ada di dalam air baku. Kaporit umumnya digunakan sebagai sumber klor. Salah satu kelemahan desinfeksi menggunakan kaporit adalah terbentuknya senyawa trihalometan yang merupakan senyawa yang bersifat karsinogenik dan mutagenik. Ada korelasi positif antara konsentrasi kaporit dengan terbentuknya trihalometan. Semakin tinggi konsentrasi kaporit yang digunakan, semakin tinggi pula konsentrasi trihalometan yang terbentuk [6].
Beberapa laporan penelitian mengenai pengaruh negatif klorin terhadap kesehatan manusia telah dilaporkan di antaranya dapat menyebabkan efek toksik [7], asma [8], penyakit kulit [9,10], menaikkan kadar serum kolesterol dan low-density lipoprotein (LDL) [11], dan memicu kanker kandung kemih [12]. Salah satu cara untuk menghindari terbentuknya senyawa yang membahayakan kesehatan tersebut adalah mencari bahan
kimia disinfektan alternatif yang tidak menghasilkan senyawa trihalometan [13]. Diantara alternatifnya adalah hidrogen peroksida (H2O2) dan pereaksi Fenton (H2O2/Fe2+).
Hidrogen peroksida sering digunakan dalam dunia kesehatan sebagai disinfektan karena tidak meninggalkan residu yang berbahaya. Bahan inipun digunakan sebagai antiseptik pada akuarium. Hidrogen peroksida merupakan antiseptik yang efektif dan nontoksik. Adanya ion-ion logam yang umumnya terdapat di dalam sitoplasma sel menyebabkan terbentuknya radikal superoksida (.O2-) selama pembentukan oksigen yang akan bereaksi dengan gugus bermuatan negatif dalam protein dan selanjutnya akan me-nonaktif-kan sistem enzim yang penting [14].
Tujuan dari penelitian ini adalah untuk membandingkan efektifitas ketiga jenis disinfektan yaitu kaporit, H2O2 dan reagen Fenton dan mengetahui konsentrasi optimum dalam membunuh bakteri dalam air.
Bahan penelitian yang digunakan dalam penelitian ini, antara lain : akuades yang telah disterilkan, bakteri Salmonella thyphosa dalam agar nutrisi (sebagai gram negatif) dan bakteri Staphylococcus aureus dalam agar nutrisi (sebagai gram positif) yang diperoleh dari laboratorium mikrobiologi RSU Sanglah, besi (II) sulfat heptahidrat Merck p.a., fenol kristal Merck p.a., hidrogen peroksida 30% Merck p.a., kaldu nutrisi (Nutrient Broth), kalsium hipoklorit kristal Merck p.a., larutan NaCl fisiologis 0,9%, Mc Farland III (109 kuman/mL), dan spiritus.
-
2.2 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini antara lain : autoclave, Digital Oxygen Meter DO-5510 Lutron, pHmeter pHep HI 96107 Pocket-Sized Hanna Instruments, inkubator, kawat ose, labu ukur, pencatat waktu (stopwatch), tabung reaksi, pipet volume, mikro pipet, dan timbangan Digital Ohaus Carat Series.
-
2.3 Penentuan Konsentrasi Optimum Disinfektan
Media adalah tempat untuk pertumbuhan mikroorganisme, yang berupa kaldu nutrisi (Nutrient Broth). Komposisi kaldu nutrisi adalah 10 g pepton, 5 g ekstrak daging, 5 g garam dapur (NaCl), 1,25 mL buffer fosfat pH 6,8 dan akuades sampai volume akhir 1 L. Inokulum berupa biakan bakteri Salmonella thyphosa dan inokulum berupa biakan bakteri Staphylococcus aureus diencerkan dengan larutan NaCl fisiologis 0,9% hingga diperoleh kekeruhan 0,5 Mc Farland III. Selanjutnya inokulum biakan Salmonella thyphosa yang telah diencerkan diisikan ke dalam tabung reaksi sebanyak 0,5 mL/tabung. Perlakuan yang sama dikenakan juga terhadap inokulum berupa biakan bakteri Staphylococcus aureus.
Larutan fenol dengan konsentrasi 0.02 – 0.2% (b/v) disiapkan dari larutan baku fenol 5% (b/v). Masing-masing larutan kaporit, H2O2, dan larutan FeSO4 dengan konsentrasi 0,00625 – 0,2% (b/v) juga disiapkan. Larutan uji H2O2 ini dibagi menjadi 2 bagian. Satu bagian digunakan untuk membuat reagen Fenton dengan menambahkan larutan FeSO4 yang konsentrasinya sama tetapi dengan perbandingan volume 5 : 1.
Uji koefisien fenol dilakukan dengan menambahkan larutan hasil pengenceran sebanyak 4,5 mL ke dalam tabung reaksi yang telah diisi 0,5 mL biakan bakteri dan masing-masing dibiarkan dalam waktu 5, 10, dan 15 menit dan selanjutnya diinkubasi pada
suhu 37 oC selama 48 jam. Pengamatan dilakukan dengan
-
2.4 Penentuan Efektifitas Disinfektan
Efektifitas masing-masing disinfektan ditentukan dengan cara membandingkan daya bunuh bahan disinfektan pada pengenceran tertinggi yang mematikan bakteri pada waktu 10 menit tetapi tidak mematikan bakteri pada waktu 5 menit. Selanjutnya dilakukan penentuan pH dengan alat pHmeter, jumlah oksigen terlarut (DO) dan suhu. Data yang diperoleh dianalisis dengan metode analisis varians (ANOVA) dua arah tanpa interaksi pada tingkat kesalahan 0,01 untuk mengetahui kadar optimal dan efektivitas masing-masing bahan disinfektan.
Perbandingan efektifitas daya bunuh ketiga disinfektan disinfektan kaporit, H2O2, dan pereasksi Fenton terhadap bakteri dibandingkan dengan daya bunuh fenol terhadap dua jenis bakteri pada berbagai konsentrasi. Berdasarkan data hasil penelitian daya bunuh disinfektan terhadap bakteri Salmonella thyphosa dan Staphylococcus aureus yang dibandingkan dengan daya bunuh larutan fenol seperti tertera pada Tabel. 1 dan Tabel. 2 maka diperoleh bahwa daya bunuh kaporit 4 kali lebih kuat daripada daya bunuh fenol, sementara daya bunuh hidrogen peroksida dan pereaksi fenton 6 kali lebih kuat daripada daya bunuh fenol terhadap kedua jenis bakteri tersebut. Hal ini diduga karena daya oksidasi kaporit lebih rendah daripada kedua disinfektan yang lain, sesuai dengan data potensial elektroda standar (Eo) untuk kaporit sebesar +1,51 volt, sementara untuk hidrogen peroksida sebesar 1,78 volt [15]. Sedangkan hidrogen peroksida dan pereaksi Fenton memiliki nilai yang sama karena ion Fe2+ hanya berfungsi mempercepat penguraian hidrogen peroksida
(sebagai katalis) tanpa mempengaruhi daya oksidasi hidrogen peroksida.
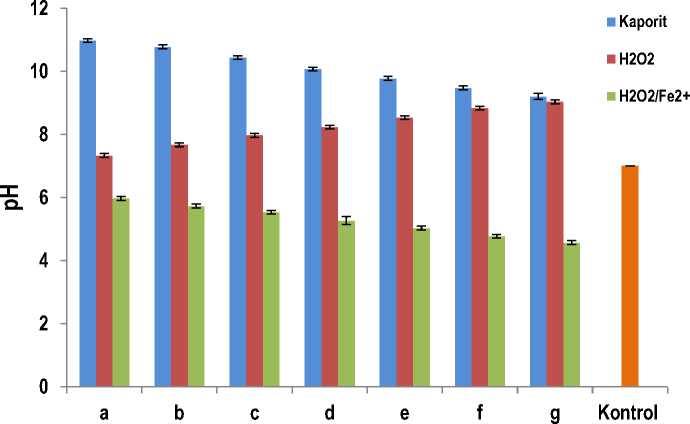
Berdasarkan data hasil penelitian dan analisis varians (ANOVA) dua arah tanpa interaksi untuk pengaruh jenis dan konsentrasi disinfektan terhadap pH menunjukkan harga F hitung (= 0,2138) lebih kecil daripada F tabel (= 4,82) antar kolom (konsentrasi disinfektan), sedangkan antar baris (jenis disinfektan) F hitung (=85,11398) lebih besar daripada F tabel (= 6,93). Hal ini menunjukkan bahwa pengaruh konsentrasi terhadap pH larutan tidak memberikan beda yang bermakna, sedangkan jenis disinfektan memberikan beda yang bermakna.
Larutan kaporit memiliki pH paling besar ( pH: 9,2 - 10,07), larutan hidrogen peroksida memiliki pH paling dekat pH netral (pH: 7,33 - 9,03), dan pereaksi Fenton memiliki pH paling kecil (pH: 4,57 - 5,97). Dalam air kaporit [Ca(OCl)2] mengalami hidrolisis membentuk senyawa Ca(OH)2 yang merupakan basa kuat dan HOCl yang merupakan asam lemah. Ca(OH)2 segera terurai membentuk ion Ca2+ dan ion OH-, sehingga perbandingan ion OH- lebih besar daripada ion H+ yang menyebabkan larutan bersifat basa. Hidrogen peroksida dalam larutan diduga terurai menjadi HO2. dan H+, sehingga larutan bersifat asam karena perbandingan ion H+ lebih besar daripada ion OH-.
Tabel 1. Daya Bunuh Larutan Fenol, Kaporit, Hidrogen Peroksida (H2O2), dan Pereaksi Fenton (H2O2/Fe2+) Dalam Beberapa Konsentrasi Terhadap Bakteri Salmonella thyphosa
|
Sampel |
Waktu |
Kode |
Tabung |
Koef. | ||||||
|
(menit) |
a |
b |
c |
d |
e |
f |
g |
Kontrol |
fenol | |
|
5 |
- |
- |
- |
+ |
+ |
+ |
+ |
+ | ||
|
Fenol |
10 |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
15 |
- |
- |
- |
- |
- |
+ |
+ |
+ | ||
|
5 |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
400/100 | |
|
Kaporit |
10 |
- |
- |
- |
- |
- |
+ |
+ |
+ |
= 4 |
|
15 |
- |
- |
- |
- |
- |
- |
+ |
+ | ||
|
5 |
- |
- |
- |
- |
- |
+ |
+ |
+ |
600/100 | |
|
H2O2 |
10 |
- |
- |
- |
- |
- |
- |
+ |
+ |
= 6 |
|
15 |
- |
- |
- |
- |
- |
- |
- |
+ | ||
|
5 |
- |
- |
- |
- |
- |
+ |
+ |
+ |
600/100 | |
|
H2O2/Fe2+ |
10 |
- |
- |
- |
- |
- |
- |
+ |
+ |
= 6 |
|
15 |
- |
- |
- |
- |
- |
- |
- |
+ |
Tabel 2. Daya Bunuh Larutan Fenol, Kaporit, Hidrogen Peroksida (H2O2), dan Pereaksi Fenton (H2O2/Fe2+) Dalam Beberapa Konsentrasi Terhadap Bakteri Staphylococcus
aureus
|
Sampel Waktu |
Kode |
Tabun |
g Koef |
|
(menit) a b c |
d |
e |
f g Kontrol Fenol |
|
5 - - - |
+ |
+ |
+ + + |
|
Fenol 10 - - - |
- |
+ |
+ + + - |
|
15 - - - |
- |
- |
+ + + |
|
5 - - - |
- |
+ |
+ + + 400/100 |
|
Kaporit 10 - - - |
- |
- |
+ + + = 4 |
|
15 - - - |
- |
- |
- + + |
|
5 - - - |
- |
- |
+ + + 600/100 |
|
H2O2 10 - - - |
- |
- |
- + + = 6 |
|
15 - - - |
- |
- |
- - + |
|
5 - - - |
- |
- |
+ + + 600/100 |
|
H2O2/Fe2+ 10 - - - |
- |
- |
- + + = 6 |
|
15 - - - |
- |
- |
- - + |
|
Keterangan : |
c |
: konsentrasi 0,05%, khusus untuk fenol 0,067% | |
|
Masing-masing uji dilakukan sebanyak 3 kali. |
d |
: konsentrasi 0,025%, khusus untuk fenol 0,05% | |
|
Volume sampel dan kontrol yang ditambahkan masing- |
e |
: konsentrasi 0,0125%, khusus untuk fenol 0,033% | |
|
masing 4,5 mL. |
f |
: konsentrasi 0,00833%, khusus untuk fenol 0,025% | |
|
Inkubasi masing-masing dilakukan selama 48 jam pada suhu |
g |
: konsentrasi 0,00625%, khusus untuk fenol 0,020% | |
|
37 oC. + : keruh (ada kehidupan bakteri)
|
kontrol |
: hanya berisi akuades steril |
Konsentrasi desinfektan (sesuai dengan keterangan pada Table.2)
Gambar 1. Pengaruh konsentrasi disinfektan kaporit, H2O2, dan Reagen Fenton (H2O2/Fe2+) terhadap pH dari larutan. (Data merupakan nilai rata-rata ± SD dengan n = 3)
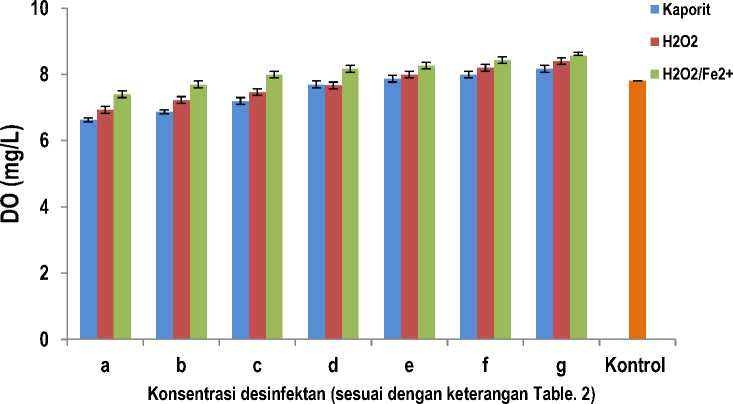
Gambar 2. Pengaruh konsentrasi disinfektan kaporit, H2O2, dan Reagen Fenton (H2O2/Fe2+) terhadap oksigen terlarut (Dissolved Oxygen, DO) dalam larutan. (Data merupakan nilai rata-rata ± SD dengan n = 3)
Salah satu faktor yang dapat mempengaruhi pertumbuhan bakteri adalah pH. Bakteri uji Salmonella thyphosa tumbuh dengan baik pada pH 4,5 – 8,0 sedangkan Staphylococcus aureus tumbuh dengan baik
pada pH 4,2 – 9,3 [16]. Jika dilihat dari data hasil penelitian seharusnya kaporit mempunyai daya bunuh lebih kuat daripada hidrogen peroksida dan pereaksi Fenton karena pH kaporit di atas pH pertumbuhan
bakteri uji, sedangkan pH hidrogen peroksida dan pereaksi Fenton di sekitar pH pertumbuhan bakteri uji. Hal ini diduga karena pengaruh daya oksidasi yang lebih kuat daripada pengaruh pH. Meskipun begitu persyaratan air minum tentang pH air harus menjadi pertimbangan, yaitu 6,5 – 8,5 [4] maka hidrogen peroksida merupakan disinfektan paling efektif.
Berdasarkan data hasil penelitian dan analisis varians (ANOVA) dua arah tanpa interaksi untuk pengaruh jenis dan konsentrasi disinfektan terhadap jumlah oksigen terlarut (DO) diperoleh harga F hitung lebih besar daripada F tabel baik antar kolom (konsentrasi disinfektan) maupun antar baris (jenis disinfektan). Harga F hitung adalah 15,2124 untuk antar kolom dan 206,9779 untuk antar baris. Sedangkan harga F tabel 4,82 untuk antar kolom dan 6,93 untuk antar baris. Hal ini menunjukkan bahwa pengaruh konsentrasi dan jenis desinfektan memberikan beda yang bermakna terhadap DO. Hal ini diduga karena daya oksidasi kaporit lebih rendah dibandingkan hidrogen peroksida dan pereaksi Fenton. Dalam reaksi oksidasi ini terjadi pelepasan oksigen, sehingga makin kuat daya oksidasi makin banyak pula oksigen yang terserap oleh air. Sebagai akibatnya jumlah oksigen yang terlarut juga makin tinggi.
Reaksi pengurain kaporit [17]:
Ca(OCl)2 + H2O —► Ca(OH)2 + HOCl
HOCl + H2O ----► H3O+ + OCl-
OCl- -----► Cl- + O
Reaksi peruraian hidrogen peroksida [18]:
H2O2 ----► 2 OH.
H2O2 + OH. —► OOH. + H2O
OOH. + OH. —► H2O + 2 On
Reaksi penguraian perekasi Fenton [19-21]:
H2O2 + Fe2+ ----► Fe3+ + ·OH + OH-
H2O2 + Fe3+ _____► Fe2+ + ·O2- + 2 H+
-
· O2- + Fe3+ -----► Fe2+ + O2(g) + 2 H+
-
· OH + kontaminan ----► hasil samping
-
· OH + H2O2 ----► ·HO2 + H2O
Berdasarkan data hasil penelitian dan analisis varians (ANOVA) dua arah tanpa interaksi untuk pengaruh jenis dan konsentrasi disinfektan terhadap suhu menghasilkan harga F hitung (=231,5556) lebih besar daripada F tabel (= 6,93) untuk antar baris (jenis disinfektan), sedangkan F hitung (= 0,6667) lebih kecil daripada F tabel (= 4,82) untuk antar kolom (konsentrasi disinfektan). Hal ini menunjukkan bahwa pengaruh jenis disinfektan memberikan beda yang bermakna terhadap suhu larutan, sedangkan konsentrasi disinfektan tidak memberikan beda yang bermakna.
Suhu larutan kaporit 28,13 – 28,50 oC, larutan hidrogen peroksida 28,03 – 28,50 oC, dan larutan pereaksi Fenton 28,07 – 28,47 oC, sedangkan larutan kontrol 28,10 oC. Larutan kaporit memberikan pengaruh suhu paling tinggi. Larutan hidrogen peroksida memberikan pengaruh paling rendah. Jika dibandingkan dengan larutan kontrol, pengaruh ketiga disinfektan uji terhadap suhu tidak lebih dari 3 oC, maka masih memenuhi syarat.
Berdasarkan reaksi penguraiannya kaporit menghasilkan ion Ca2+ dan pereaksi Fenton menghasilkan ion Fe3+, dimana ion Ca2+ dan ion Fe3+ merupakan ion-ion yang seharusnya dihilangkan dalam air minum, sedangkan hidrogen peroksida tidak menghasilkan ion atau senyawa yang tidak
dikehendaki, maka hidrogen peroksida merupakan desinfektan yang paling efektif
dari antara ketiga desinfektan tersebut.
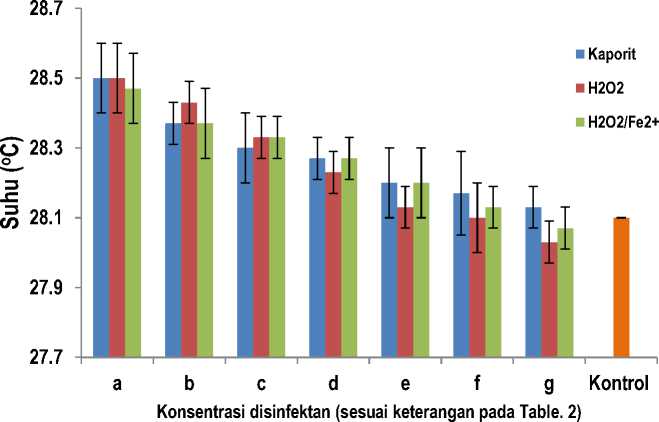
Gambar 3. Pengaruh konsentrasi disinfektan kaporit, H2O2, dan Reagen Fenton (H2O2/Fe2+) terhadap temperature larutan. (Data merupakan nilai rata-rata ± SD dengan n = 3)
Dari penelitian ini dapat disimpulkan bahwa hidrogen peroksida dan reagen Fenton merupakan desinfektan yang lebih efektif dibandingkan kaporit dan hidrogen
-
[1] Suriawiria, U. Pengantar Mikrobiologi Umum. Penerbit Angkasa, Bandung, 1995.
-
[2] Hiskia, A., Pencemaran Lingkungan. Penerbit Erlangga, Jakarta, 1997
-
[3] Pitojo, S., dan Purwantoyo, E. Deteksi Pencemar Air Minum, Penerbit CV Aneka Ilmu, Demak, 2003.
-
[4] Departemen Kesehatan Republik Indonesia. Peraturan Menteri Kesehatan Nomor: 1205/Menkes/Per/X/2004,
Persyaratan Air Bersih Sesuai Peraturan Menteri Kesehatan Nomor:
peroksida merupakan desinfektan yang paling efektif.
416/MENKES/PER/IX/1990, Depkes RI, Jakarta, 2004.
-
[5] Departemen Kesehatan Republik Indonesia. Petunjuk Pemeriksaan Bakteriologi Air. Departemen Kesehatan RI Pusat Laboratorium Kesehatan, Jakarta, 1991
-
[6] Sururi, R. M., Rachmawati, S.D., dan Sholichah, M., Perbandingan Efektifitas Klor dan Ozon sebagai Desinfektan pada Sampel Air dari Unit Filtrasi Instalasi PDAM Kota Bandung. Prosiding Seminar Nasional Sains dan Teknologi-
-
II. Lampung : Universitas Lampung, 2008.
-
[7] Lubbers J.,R, Chauan S, Bianchine J.R., Controlled clinical evaluations of chlorine dioxide, chlorite and chlorate in man. Environmental health perspectives, 46:57-62, 1982.
-
[8] Watson SH, Kibler CS. Drinking water as a cause of asthma. Journal of allergies, 5:197-199, 1933.
-
[9] Environmental Criteria and Assessment Office. Ambient water quality criterion for theprotection of human health: chlorine. Washington, DC, Office of Water Regulations andStandards, US Environmental Protection Agency, 1981.
-
[10] Eun HC, Lee AY, Lee YS. Sodium hypochlorite dermatitis. Contact dermatitis, 11:45, 1984.
-
[11] Zeighami EA, Watson AP, Craun GF. Serum lipid levels in neighboring communities with chlorinated and nonchlorinated drinking water. Fundamental and applied toxicology, 6:421-432, 1990.
-
[12] Dunnick, J. K., and Melnick, R. L., Assessment of the Carcinogenic Potential of Chlorinated Water: Experimental Studies of Chlorine, Chloramine, and Trihalomethanes, Journal of the National Cancer Institute, 85(10): 817 – 822, 1993.
-
[13] Chandra,B.. Pengantar Kesehatan Lingkungan. Penerbit Buku Kedokteran EGC, Jakarta, 2007.
-
[14] Pelczar, M.J., dan Chan, E.C.S., Dasar-dasar Mikrobiologi 2. Jakarta : Penerbit Universitas Indonesia (UI-Press), 2009.
-
[15] Dickson, G., Participatory action research: Theory and practice. In M. Stewart (Ed.), Community Nursing: Promoting Canadians’ Health (2nd ed.), Toronto: W.B. Saunders, 2000.
-
[16] Brooks, G.F., Jawetz, Melnick,& Adelberg’s Medical Microbiology. 22th Ed. New York: Lange Medical Books, 2001.
-
[17] Lestari, D.E., Utomo, S.B., Sunarko, Virkyanov, Pengaruh Penambahan Biosida Pengoksidasi Terhadap Kandungan Klorin untuk Pengendalian Pertumbuhan Mikroorganisme pada Air Pendingin Sekunder RSG-GAS. Pusat Reaktor Serba Guna-BATAN. Kawasan Puspitek Serpong. Tangerang. Banten, 2008.
-
[18] Kirk and Othmer, Encyclopedia of Chemicals Technology. 4th ed. New York : John Wiley and Sons, 1992.
-
[19] Huling, S.G, Arnold, R.G, Sierka, R.A, Miller, M.A., Measurement of hydroxyl radical activity in a soil slurry using the spin trap α-(4-pyridyl-1-oxide)-N-tert-butyl-nitrone. Environmental Science & Technology. 32(21):3436-3441, 1998.
-
[20] Huling, S.G, Arnold, R.G, Jones, P.K, and Sierka, R.A., Predicting the rate of Fenton-driven 2-chlorophenol transformation using a contaminant analog. Journal of Environmental Engineering. 126(4):348-353, 2000.
-
[21] Huling, S.G, Arnold, R.G, Sierka, R.A, and Miller, M.A., Influence of peat on Fenton oxidation. Water Research. 35(7):1687-1694, 2001.
24
Discussion and feedback