Reaksi Antara Gliserol dan o-Metoksi Fenol Dalam Suasana Basa dan Asam Sebagai Upaya Pendahuluan Pemanfaatan Gliserol dari Produk Samping Produksi Biodiesel Untuk Pembuatan Obat Batuk Gliseril Guaiakolat
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry) I Cakra I
Volume 1, Nomor 2, November 2013
IQimta i
Reaksi Antara Gliserol dan o-Metoksi Fenol Dalam Suasana Basa dan Asam Sebagai Upaya Pendahuluan Pemanfaatan Gliserol dari Produk Samping Produksi Biodiesel Untuk Pembuatan Obat Batuk Gliseril Guaiakolat
Ritmaleni
Fakultas Farmasi, Universitas Gadjah Mada, Bulaksumur, Yogyakarta, Indonesia 55281 Email: ritmaleni@ymail.com
ABSTRAK: Berbagai kondisi reaksi basa dan asam termasuk penggunaan asam Lewis telah diaplikasikan pada reaksi antara gliserol dan o-metoksi fenol sebagai upaya dalam pemanfaatan gliserol dari hasil samping produksi biodiesel berbahan dasar minyak jelantah. Reaksi ini nantinya akan digunakan pada pembuatan obat batuk gliseril guaiakolat. Kondisi reaksi yang dilakukan belum menghasilkan suatu reaksi yang berjalan secara optimal sehingga masih diperlukan penelitian berikutnya.
Kata kunci: gliserol, o-metoksi fenol, minyak jelantah, basa, asam, asam Lewis.
ABSTRACT: Some reaction conditions in basic and acid including Lewis acid have been applied on the reaction between glycerol and o-methoxy phenol. This study is an attempt to use glycerol as by-product of waste cooking oil-based biodiesel production. This reaction will be applied for synthesizing of cough medicine named glyceryl guaiacolate. Based on the results obtained, the reaction conditions applied were still not fit yet for optimum reaction and need to be found in the further study.
Keywords: glycerol, o-methoxy phenol, waste cooking oil, basic, acid, Lewis acid
Gliserol tidak lagi menjadi barang mahal dan bahkan bisa dikatakan melimpah ketersediannya karena merupakan produk samping dari produksi biodiesel, oleo-chemical dan industri bioetanol. [1,2] Dalam setiap pembuatan biodiesel selain dihasilkan biodiesel untuk bahan bakar dihasilkan paling sedikit 10 % gliserol. Dengan asumsi ini, dapat diperkirakan besarnya potensi gliserol yang dihasilkan sebagai bahan baku berbagai produk farmasi di Indonesia seperti pada pembuatan obat dan kosmetik. Gliserol telah
diketahui berperan pada pembuatan berbagai produk kimia dan produk kimia terkait seperti pada proses protein rekombinan, produksi 1,3-propanadiol dan 3-hidroksipropionaldehid [3,4], prekursor senyawa aktif [5] seperti pada sintesis asam laktat [6]. Gliserol juga telah dikonversi menjadi berbagai senyawa kimia yang mempunyai nilai ekonomi lebih seperti 1,2-propanadiol. [7].
Pada industri farmasi salah satu cara pemanfaatan gliserol ini adalah pada
pembuatan obat batuk gliseril guaiakolat. Obat gram NaOH (50 mmol) pada suhu 0°C.
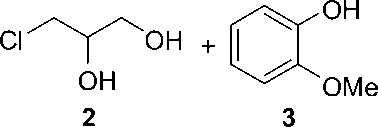
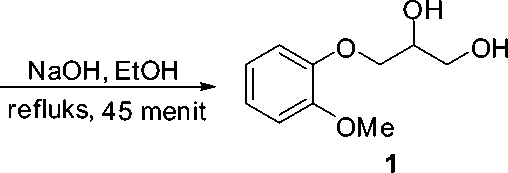
Skema 1. Sintesis gliseril guaiakolat (guaifenesin) melalui reaksi Eter Williamson
batuk gliseril guaiakolat 1 dapat dibuat melalui reaksi pembentukan eter Williamson melalui reaksi antara 3-kloro-1,2-propanadiol 2 dan guaiakolat (o-metoksi fenol) 3 dengan suasana basa dari natrium hidroksida dalam etanol (Skema 1) [8].
Pada penelitian ini, gliserol yang strukturnya mirip dengan 3-kloro-1,2-diol hanya berbeda pada gugus OH (hidroksi) dan Cl (kloro) yang terikat pada karbon ketiga dari gliserol akan digunakan sebagai bahan baku pada pembuatan obat batuk gliseril guaiakolat.
Bahan : Gliserol, o-metoksifenol, berbagai asam mineral (HCl, H2SO4, HNO3), berbagai basa mineral (NaOH, NaH), berbagai pelarut organik, kertas saring. Alat : Berbagai alat gelas, pengaduk magnet, magnetic bar, corong pisah, TLC chamber
-
A. Suasana Basa
Sebanyak 3,06 gram (50 mmol) gliserol dimasukkan ke dalam labu alas bulat kemudian ditambahkan 5,06 gram (50 mmol) o-metoksi fenol dan 4 mL methanol serta 1,08
Campuran reaksi diaduk hingga mencapai suhu kamar. Kemudian ditambahkan 5 mL methanol dan di refluks selama 6,5 jam pada suhu 80 °C. Hasilnya dicek dengan KLT dengan fase gerak : etil asetat : n-hexane : etanol = 1:1:1. Sebagian hasil reaksi yang belum ditambahkan apa-apa, ditambahkan sedikit etanol. Kemudian didiamkan selama 1 malam hingga terbentuk endapan dan disaring hingga filtratnya jernih. Hasilnya dicek lagi dengan KLT dengan fase gerak : etil asetat : n-hexane : etanol = 1:1:1. Perlakuan terhadap filtrat : 20 mL filtrat diambil kemudian H2SO4 1 M kemudian disaring dan dicek dengan menggunakan KLT dengan fase gerak : etil asetat : n-hexane : etanol = 1:1:1. Sebagian lagi di ekstraksi dengan menggunakan kloroform, dan hasilnya pun di KLT dengan menggunakan fase gerak : etil asetat : n-hexane : etanol = 1:1:1. Selain itu juga di KLT dengan dibandingkan dengan GG yang ada di pasaran dengan menggunakan fase gerak : etil asetat : n-hexane : etanol = 1:1:1.
-
B. Suasana Asam
0.71 mL (10 mmol) gliserol murni dimasukkan kedalam labu alas bulat, lalu ditambahkan 1.96 mL H2SO4 (10 mmol) dan diaduk dengan magnetic stirrer (kuning ÷ coklat), lalu ditambahkan 1,12 mL (10 mmol) o-metoksi fenol (merah) dan dimasukkan 2
mL metanol. Hasil reaksi dicek dengan menggunakan KLT dengan fase gerak n-hexane:etil asetat:etanol = 1:1:1 dan dengan menggunakan fase gerak n-hexane:etil asetat:etanol = 3:1:1.
Hal pertama yang dilakukan adalah menemukan cara yang cepat untuk mensintesis gliseril Guaiakolat (GG). Jika dilihat dari analisis diskoneksinya maka akan diperoleh hasil sebagai berikut:
Ketika ikatan C-O pada GG diputus maka
OH

O OH
OCH3
C-O
=^
O
Gliseril Guaiakolat (GG)
OCH sinton 1
sinton 2
OH
OCH3
OH

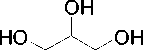
gliserol
atau
o-metoksi fenol
OH
Cl OH
gliseril klorida
Skema 2 . Analisis diskoneksi sintesis GG
-
C. Penambahan Asam Lewis
Gliserol 0,71 mL (10 mmol) dimasukkan ke dalam labu dan diaduk, ditambahkan AlCl3 sebanyak 0,4 gram (10 mmol) sedikit demi sedikit. Ditambahkan 1,1 mL (10 mmol) o-metoksi fenol (merah muda menjadi kuning kehijauan) lalu ditambahkan 2 mL etanol, hasilnya dicek dengan menggunakan fase gerak n-heksane : etil asetat : etanol : = 1:1:1.
-
3. HASIL dan PEMBAHASAN
-
3.1 Reaksi antara Gliserol dan o-metoksi fenol (guaiakol)
-
akan menghasilkan sinton 1 dan sinton 2 dan selanjutnya menghasilkan sintestik ekuivalennya berupa o-metoksi fenol dan gliserol atau gliseril klorida. o-metoksi fenol tersedia secara komersial dan gliserol atau gliseril klorida juga tersedia secara komersial. Karena penelitian ini lebih mengupas bagaimana menggunakan gliserol dari hasil samping pengolahan biodiesel maka gliserol inilah yang akan digunakan sebagai starting material pada pembuatan obat batuk gliseril guaiakolat (GG). Adapun gliserol yang diperoleh berasal dari pengolahan biodiesel yang berbahan dasar minyak jelantah. Reaksi yang dilakukan mengikuti persamaan reaksi berikut (Skema 3):
HO η OH + rj OH
OH
OCH3
OH
Kondisi reaksi
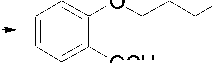
OCH3
Skema 3. Reaksi antara gliserol dan o-metoksi fenol
Berbagai kondisi reaksi telah dilakukan agar gliserol dari minyak jelantah ini dapat digunakan langsung pada pembuatan obat batuk GG. Adapun reaksi pembandingnya adalah menggunakan gliserol murni yang tersedia secara komersial.
A.1. Kondisi reaksi dalam suasana basa
Pertama-tama, untuk menentukan kondisi reaksi apakah berlangsung dalam suasana reaksi tertentu maka dilakukan analisa sebagai berikut (Skema 4):
OH) tidak mampu untuk mungikat hidrogen yang ada pada fenol dari o-metoksi fenol.
ikatan kuat
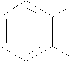
OH
OCH3
Gambar 1. Kekuatan ikatan O-H pada o-metoksi fenol
Menurut Williams pKa dari fenol dan o-

OH
OCH
-OH
3

OH
Skema 4. Mekanisme reaksi dalam suasana basa antara o-metoksi fenol dan gliserol
Jika mekanisme reaksi berlangsung seperti mekanisme reaksi diatas maka sintesis GG dapat dilakukan dengan cara mereaksikan o-metoksi fenol dan gliserol dalam suasana basa dan sejumlah reaksi sudah dilakukan seperti yang terlihat pada Tabel 1.
Dari berbagai kondisi diatas secara umum reaksi tidak terjadi. Hal ini mungkin disebabkan oleh ikatan O-H pada o-metoksi fenol yang kuat sehingga gugus hidroksi (–
metoksi fenol bernilai sebesar 9,95 dan 9,93 dan besar pH bernilai sekitar 10. Jika dilihat dari kedua nilai pKa ini maka perilaku dari fenol dan o-metoksi fenol akan tidak jauh berbeda. Ion fenoksida dari o-metoksi fenol (o-metoksi fenoksida) merupakan basa yang lebih lemah dari OH, oleh karena ion fenoksida dari o-metoksi fenol dapat dibuat dengan cara mengolah o-metoksi fenol dengan basa berair seperti NaOH berair, seperti pada reaksi berikut (Skema 5):
Jika ion o-metoksi fenoksida benar-benar terbentuk, maka ion ini akan menyerang
gliserol melalui reaksi substitusi nukleofilik-2 (SN2) sehingga akan terbentuk senyawa GG
OH
OCH
+
3
NaOH

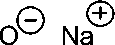
+
OCH3
H2O
Skema 5. Ionisasi dari o-metoksi fenol dalam suasana basa
Table 1. Kondisi Reaksi Antara o-Metoksi Fenol dan Gliserol Dalam Suasana Basa
|
No |
Reagen |
Suhu |
Waktu |
Hasil |
|
1 |
NaOH, MeOH |
0 - 30 °C, 70°C |
6,5 jam |
NR |
|
3 |
NaOH, EtOH |
85 - 90 °C |
7 jam |
NR |
|
4 |
NaOH, DCM |
r.t. |
6 jam |
NR |
|
5 |
NaOH, EtOH |
85 - 90 °C |
45 menit |
NR |
|
6 |
NaH, MeOH, NaOH |
0 - 30 °C |
7 jam 15 menit |
NR |
|
7 |
NaH, EtOH |
r.t. |
7 jam |
NR |
|
8 |
NaH, EtOH |
r.t. |
6 jam |
NR |
|
9 |
NaH, MeOH |
r.t. |
2 jam |
NR |
|
10 |
NaH, MeOH, NaOH |
r.t. |
3 jam |
NR |
|
11 |
NaH, MeOH |
r.t. |
4 jam |
NR |
|
12 |
NaOH, EtOAc |
r.t. |
6,5 jam |
Gliseril asetat |
|
13 |
NaOH, EtOAc |
r.t. |
1 jam |
Gliseril asetat |
|
14 |
NaOH, EtOAc |
80 °C, refluks |
6 jam |
Gliseril asetat |
|
15 |
NaOH, EtOH |
85 °C |
4 jam |
NR |
|
16 |
KOH, EtOH |
r.t. |
7 jam 15 menit |
NR |
|
17 |
KOH, EtOH |
78 °C |
5 jam |
NR |
|
18 |
NaOH, EtOAc |
78 °C |
6 jam |
Gliseril asetat |
|
19 |
NaOH, aseton |
r.t. |
5 jam 40 menit |
NR |
Catatan : NR = no reaction
mungkin dapat menjelaskan kenapa reaksi sesuai mekanisme reaksi diatas. Tapi
tidak menghasilkan GG adalah karena faktor kenyataannya adalah tidak terjadi reaksi apa
sterik dari gliserol dan o-metoksi fenol dari
pun. Jadi kemungkinan pertama yang
keduanya. Jika dilihat dari strukturnya maka mengatakan ikatan antara O-H pada o-metoksi
dapat dilihat bahwa ion fenoksida yang fenol sangat kuat dapat dibatalkan karena
terbentuk masih dihalangi oleh adanya gugus sesuai teori yang ada akan mudah terbentuk
metoksi pada posisi arto, sehingga kesempatan dengan adanya NaOH berair. Hal kedua yang
untuk menyerang gugus OH pada gliserol
menjadi sedikit. Disamping itu faktor elektronik dari gliserol juga berpengaruh. Diketahui bahwa atom oksigen adalah atom yang elektronegatif maka pada ikatan C-O elektronnya akan terpolarisasi di O. Dan juga diketahui bahwa OH adalah gugus penyumbang elektron dimana akan membentuk suatu bentuk resonansi positif seperti gambar berikut pada gliserol. Ini menyebabkan akan sulit sekali untuk membentuk suatu produk substitusi SN2 karena kemungkinan resonansi posistif (efek mesomerik, R = M+) pada gliserol lebih kuat dibanding efek induksi atom oksigen pada ikatan C-O dari gliserol. Jika dilihat dari kedua gambar berikut maka faktor yang paling berpengaruh yang menyebabkan reaksi tidak dapat berlangsung adalah karena faktor sterik.
mengikuti Skema 6.
HO

OH
OH

OH -H2O
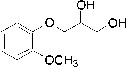
Skema 6. Mekanisme reaksi antara gliserol dan o-metoksi fenol pada suasana asam
Dengan protonasi pada gugus OH maka terbentuk gugus OH2+ dan diketahui dengan adanya penyerangan oleh nukleofil maka gugus OH2+ akan mudah lepas menjadi H2O. Tetapi hal ini ini tidak terjadi dikarenakan oleh faktor sterik disekitar OH dari o-metoksi fenol yang cukup besar sehingga reaksi SN2 juga tidak mungkin dapat berlangsung.
OH
O3 HO ×∕∖
H
OH
© OH
HO ∕ OH
O H
Gambar 2 . Faktor sterik, elektronik (faktor induksi) dan mesomerik pada reaksi antara gliserol dan o-metoksi fenol
Usaha selanjutnya yang dilakukan adalah mereaksikan antara gliserol dan o-metoksi fenol dalam suasana asam. Jika reaksi berjalan dengan baik maka mekanismenya akan
Kondisi reaksi lain yang juga dicoba adalah dengan menambahkan asam Lewis yaitu dengan harapan atom oksigen pada gliserol dapat menjadi lebih positif sehingga memudahkan penyerangan secara SN2 oleh OH dari o-metoksi fenol. Kemungkinan reaksi dapat berlangsung sesuai mekanisme Skema 7. Pada kondisi reaksi yang ketiga inipun reaksi tidak berjalan sesuai yang diharapkan. Hal ini mungkin kembali disebabkan oleh faktor sterik seperti yang terjadi pada reaksi sebelum ini.
HO
HO OH AlCl3 HO O H3CO
OH ZnCl2 OH ZnCl2
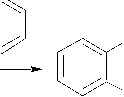
O OH OH
OCH3
Skema 7. Mekanisme reaksi antara gliserol dan o-metoksi fenol pada penambahan asam Lewis (AlCl3 dan ZnCl2)
Penggunaan basa, asam mineral dan asam Lewis belum menghasilkan gliseril guaikolat sehingga masih membutuhkan penelitian lebih lanjut.
[4]
Terimakasih kepada L’Oreal-Unesco For Women In Science dan Direktorat Pendidikan Tinggi Indonesia atas dana penelitian tahun anggaran 2010.
[5]
-
[1] Khanal, S. K., Rasmussen, M., Shrestha, P., Van Leeuwen, H., Visvanathan, C., Liu, H. 2008, Bioenergi and biofuel production from waste/residues of emerging biofuel industries, Water Environ. Res., 2008, 80, 1625 – 1647
-
[2] Rausch, K. D. and Belyea, R. L. 2006, The future of co-products from corn processing, Appl. Biochem. Bioetechnol., 128, 47 – 86
-
[3] Vizoso M. G., Pinto, S. E. Pasteris, A. M. Strasser de Saad 2004 Glycerol catabolism by Pediococcus pentosaceus
[6]
[7]
[8]
isolated from beer, Food Microbiology, 21, 111–118
Sauvageo,t N., Gouffi, K., Laplace, J. M., Auffray, Y. 2000 Glycerol metabolism in Lactobacillus collinoides: production of 3-hydroxypropionaldehyde, a precursor of acrolein. International Journal of Food Microbiology, 55 167–170
Molinari F., Cavenago, K. S., Romano, A., Romano, D. and Gandolfi, R. 2004 Enantioselective hydrolysis of (RS)-isopropylideneglycerol acetate with Kluyveromyces marxianus. Tetrahedron: Asymmetry, 15, 1945– 1947
Mazumdar, S., Blankschien, M. D., Clomburg, J. M., Gonzales, R. 2013, Efficient synthesis of L-lactic acid from glycerol by metabolically engineered Escherichia coli, Microbial Cell Factories, 12,
Marinoiu, A., Carcades, E., Cobzaru, C., Capris, A., Tanislav, V., Raceanu, M., Iordache, I. 2013, The Efficient catalytic conversion of glycerol into valuable chemicals, Progress of Cryogenics and Isotopes Separation, 16, 43 – 50
Dicks, A. P. and Stabile, R. G., 2007, Semi-microscale Williamson ether synthesis and simultaneous isolation of an expectorant from cough tablets, J. of Chem. Ed., 80, 3.
39
Discussion and feedback