SELULASE DAN AMILASE DARI DAUN LONTAR (Borassus flabelliformis) YANG TELAH LAPUK SERTA UJI INHIBISI DENGAN MINYAK SEREH DAN CENGKEH
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 7 Nomor 2, Oktober 2019
I Ca%ra I ; Kjmia j
SELULASE DAN AMILASE DARI DAUN LONTAR (Borassus flabelliformis) YANG TELAH LAPUK SERTA UJI INHIBISI DENGAN MINYAK SEREH DAN CENGKEH
Ida Bagus Putu Eristya Putra, I Nengah Wirajana *, Anak Agung Istri Agung Mayun Laksmiwati
Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran, Bali-Indonesia
ABSTRAK: Pelapukan naskah lontar salah satunya disebabkan oleh mikroba yang menghasilkan enzim pendegradasi selulosa dan amilum yang terkandung dalam daun siwalan (lontar). Tujuan penelitian ini adalah untuk menentukan aktivitas selulase dan amilase dari mikroba selulolitik dan amilolitik yang diisolasi dari lontar yang telah lapuk, serta mengetahui kemampuan minyak sereh dan cengkeh menginhibisi aktivitas selulase dan amilase dari kedua jenis mikroba tersebut. Isolasi mikroba selulolitik dan amilolitik dari lontar yang telah lapuk dilakukan dengan metode pengenceran dan dikultivasi dalam media yang mengandung substrat spesifik. Substrat carboxymethyl cellulose (CMC) digunakan untuk mikroba selulolitik, sedangkan substrat amilum untuk mikroba amilolitik. Mikroba selulolitik dideteksi dengan adanya zona bening di sekitar koloni mikroba setelah ditambahkan larutan congo red 0,1% (b/v), sedangkan untuk mikroba amilolitik ditambahkan dengan larutan iodin 0,1% (b/v). Aktivitas selulase dan amilase ditentukan berdasarkan gula pereduksi yang dihasilkan dari reaksi enzim-substrat setelah direaksikan reagen dinitro salisilat (DNS) dan ditentukan dengan spektrofotometri UV-Vis. Hasil penelitian diperoleh mikroba selulolitik (C3B) dengan aktivitas selulase sebesar 0,068 U/mL; dan mikroba amilolitik (A5A) dengan aktivitas amilase sebesar 0,827 U/mL. Uji inhibisi menggunakan minyak sereh menunjukkan penurunan aktivitas selulase 4,41% dan penurunan aktivitas amilase 30,96%. Uji inhibisi menggunakan minyak cengkeh menunjukkan penurunan aktivitas amilase 92,50%. Hasil ini mengindikasikan adanya potensi minyak sereh dan cengkeh sebagai bahan untuk konservasi lontar.
Kata kunci: inhibitor; aktivitas enzim; selulase; dan amilase
ABSTRACT: Weathering of the manuscript was caused by one of the microbes that produced cellulose and starch degrading enzymes contained in the palm-leaf (lontar). The purpose of this study was to determine the activity of cellulase and amylase from cellulolytic and amylolytic microbes isolated from weathered palm, also know the ability of lemongrass and clove oil to inhibit cellulase and amylase activity from both types of microbes. Isolation of cellulolytic and amylolytic microbes from decaying palms was carried out by a dilution method and cultivated in media containing specific substrates. Carboxymethyl cellulose (CMC) substrate is used for cellulolytic microbes, while starch substrates for amylolytic microbes. Cellulolytic microbes were detected by the presence of clear zones around the microbial colonies after adding 0.1%
(w/v) congo red solution, while for amylolytic microbes added with 0.1% (w/v) iodine solution. Cellulase and amylase activity was determined based on reducing sugars produced from enzymesubstrate reactions after reacting dinitro salicylate (DNS) reagents and determined by UV-Vis spectrophotometry. The results obtained by cellulolytic microbes (C3B) with cellulase activity of 0.068 U/mL; and amylolytic microbes (A5A) with amylase activity of 0.827 U / mL. Inhibition test using lemongrass oil showed a decrease in cellulase activity 4.41% and decreased amylase activity 30.96%. Inhibition testing using clove oil showed a 92.50% decrease in amylase activity. These results indicate the potential for lemongrass and clove oil as ingredients for palm-leaf conservation.
Keywords: inhibitors; enzyme activity; cellulase; and amylase.
Naskah lontar adalah benda pustaka yang bernilai sejarah. Penyimpanan naskah lontar oleh masyarakat bali dalam kurun waktu tertentu tetap membuat lontar lapuk. Pelapukan bahan organik seperti lontar salah satu penyebabnya adalah mikroba. Menurut penelitian yang dilakukan sebelumnya, bahwa pada naskah lontar ditemukan jenis Aspergillus sp., Penicillium sp. dan Fusarium sp. [1]. Mikroba dalam lontar menghasilkan enzim untuk menghidrolisis makanannya atau substrat. Bahan-bahan organik mampu diurai oleh mikroba dengan bantuan enzim yang dihasilkannya, enzim akan mengkatalis media tempat mikroba berkembang [2].
Untuk menghambat aktivitas enzim tertentu, maka diperlukan inhibitor. Inhibitor akan menghambat secara kompetitif atau nonkompetitif. Inhibitor dapat berupa benda organik seperti minyak sereh dan cengkeh. Komponen utama pada minyak sereh adalah sitronellal (34,60%), geraniol (23,17%), serta sitronellol (12,09%) [3]. Minyak cengkeh mengandung eugenol (87,00%), eugenil asetat (8,01%), dan β-caryophyllene (3,56%) [4]. Komponen tersebut pernah diteliti dapat menghambat aktivitas enzim atau menggangu proses tertentu dalam sel mikroba. Tetapi pengaruh minyak sereh dan cengkeh terhadap mikroba amilolitik dan selulolitik belum diketahui secara pasti untuk menghambat aktivitas enzim dari dalam lontar. Sehingga
pada penelitian ini akan membahas pengaruh minyak sereh dan cengkeh terhadap aktivitas selulase dan amilase pada lontar.
Enzim yang mengalami inhibisi oleh zat tertentu, maka diperlukan pengukuran aktivitas enzim. Aktivitas enzim akan mengalami penurunan atau bahkan tidak aktif apabila kerja enzim diganggu dengan inhibitor. Adanya aktivitas enzim dapat diketahui dari bertambahnya produk atau pengurangan substrat dalam reaksi enzimatis. Aktivitas enzim dapat ditentukan dengan mengukur gula pereduksi yang dihasilkan menggunakan metode dinitrosalicylic acid (DNS) [5].
Sampel lontar yang telah lapuk diambil dari Pesraman Dharmasila Tampaksiring, Gianyar, Bali. Minyak sereh (Ie Kim Tie) dan minyak cengkeh (Cap Gajah). Bahan kimia yang digunakan mempunyai kualitas pro-analysis antar lain: aquades, NaCl, carboxymethyl cellulase (CMC), pati (amilum), MgSO4, KNO3, K2HPO4, FeSO4, CaCl2, ekstrak yeast, bacto agar, bacto tripton, bacto pepton, iodin, congo red, 3,5-dinitrosalicylic acid (DNS), KH2PO4, KH2PO4.3H2O, D-Glukosa, NaOH, K-Na-tartrat, natrium sulfit, fenol.
Peralatan yang digunakan adalah pipet mikro, laminar, autoklaf, freezer, incubator (LabTech), incubator sheeker,
sentrifugasi, vortex, hot plate stirer, cawan petri, timbangan analitik, blender, waterbath, dan peralatan gelas. Alat instrument yang digunakan adalah spektrofotometer UV-Vis (Single Beam Genesys).
1.2 Metode
Preparasi suspensi lontar
Sampel lontar yang telah lapuk berumur +70 tahun. Sebanyak 10 gram sampel yang sudah diblender, disuspensi menggunakan 90 mL larutan NaCl 0,85% (b/v), selanjutnya divortex 1 menit, sehingga diperoleh sampel suspensi lontar dengan konsentrasi awal 0,1 g/mL. Satu mL suspensi dari konsentrasi awal diambil dan dimasukkan pada 9 mL larutan NaCl dan divortex, sehingga diperoleh pengenceran 100 kali. Kemudian pengenceran berseri dilakukan hingga pengenceran 10.000 kali. Tujuan dari pengenceran bertingkat tersebut yaitu memperkecil atau mengurangi jumlah mikroba.
Isolasi mikroba selulolitik dari lontar
Sebanyak 100 μL suspensi lontar diambil dari pengenceran 10.000 kali, dan diinokulasikan dengan metode sebaran (spread plate) pada 10 media padat selektif carboxymethyl cellulase (CMC). Kemudian diinkubasi pada suhu 37oC selama 1 minggu hingga tumbuh mikroba. Mikroba yang sudah tumbuh disimpan dalam kulkas 4oC.
Isolasi mikroba amilolitik dari lontar
Sebanyak 100 μL suspensi lontar diambil dari pengenceran 10.000 kali, dan diinokulasikan dengan metode sebaran (spread plate) pada 10 media padat selektif amilum. Kemudian diinkubasi pada suhu 37oC selama 1 minggu hingga tumbuh mikroba. Mikroba yang sudah tumbuh disimpan dalam kulkas 4oC.
Untuk pemurnian mikroba selulolitik atau amilolitik, koloni mikroba yang tumbuh secara terpisah pada media induk
sebelumnya. Mikroba diambil satu ose, digores ke tiap cawan petri lain yang mengandung media padat selektif selulolitik atau amilolitik.
Produksi enzim dari isolat
Kultur mikroba sebanyak 1 jarum ose diinokulasi pada media selektif selulolitik/ amilolitik cair yang sudah disterilkan untuk memancing terbentuknya selulase/ amilase. Komponen media selektif selulolitik/ amilolitik cair terbuat dengan kandungan yang sama dengan media padatnya, kecuali tanpa penambahan bacto agar. Media yang menandakan ada kultur mikroba selulolitik/ amilolitik diinkubasi dengan suhu 37oC selama 72 jam dalam shaker incubator dengan kecepatan rotasi 120 rpm. Filtrat dari kultur mikroba (ekstrak kasar enzim ekstraseluler) diperoleh dengan cara sentrifugasi kultur mikroba yang telah tumbuh. Sentrifugasi kultur mikroba dilakukan pada kecepatan 9000 rpm pada suhu kamar [6].
Uji aktivitas selulase dan amilase
Pengukuran aktivitas selulase atau amilase berdasarkan hasil dari pembentukan kadar gula pereduksi dari reaksi enzimatis selulase dengan substrat CMC serta dari amilase dengan substrat amilum. Kadar gula pereduksi diukur dengan metode DNS [5].
Kultur mikroba digunakan sebagai sampel enzim. Tabung mikro disediakan 2 buah, tabung untuk sampel yang diinkubasi (t = 20 menit) dan tabung untuk isolat sebagai standar tanpa inkubasi (t = 0 menit). Tabung standar ditambahkan sebanyak 100 µL enzim ekstrak kasar, 100 µL larutan CMC 1% atau amilum 1%, 100 µL buffer fosfat pH 6, 400 µL standar glukosa 10%, dan 100 µL DNS. Selanjutnya, dalam waktu 5 menit isolat dipanaskan dengan suhu 100oC hingga warna DNS berubah. Pada sampel sampel ditambahkan sebanyak 100 µL enzim ekstrak kasar, 100 µL larutan CMC 1% atau amilum
1%,, dan 100 µL buffer fosfat pH 6. Kemudian, diinkubasi selama 20 menit dalam suhu 37oC. Ditambahkan 400 µL standar glukosa 10%, dan 100 µL DNS. Kemudian dipanaskan pada suhu 100oC rentang waktu 5 menit hingga warna DNS berubah.
Selanjutnya standar dan sampel divortex hingga homogen. Tabung sampel dan standar disentrifugasi 9000 rpm selama 4 menit. Supernatannya dipindahkan sebanyak 600 µL ke kuvet dan ditambahkan aquades sebanyak 2400 µL. Selanjutnya, absorbansi diukur pada λmak 540 nm dengan spektrofotometer UV-Vis.
Uji inhibisi minyak sereh terhadap aktivitas selulase dan amilase
Sebelumnya, minyak sereh 5% (v/v) diambil 150 μL diencerkan menggunakan etanol 96% menjadi 0,5% (v/v) dalam tabung mikro 1500 μL. Kultur mikroba digunakan sebagai sampel enzim. Tabung mikro disiapkan untuk standar selulase CS0 dan amilase AS0 serta tabung sampel selulase CS1 dan amilase AS1. Pada tabung standar ditambahkan sebanyak 100 µL enzim ekstrak kasar, 41 µL minyak sereh 0,5% (v/v), 100 µL substrat (CMC 1% atau amilum 1%), 259 µL buffer fosfat pH 6, 400 µL standar glukosa 10%, dan 100 µL DNS. Kemudian dipanaskan pada suhu 100oC dalam waktu 5 menit hingga warna DNS berubah. Pada sampel ditambahkan sebanyak 100 µL enzim ekstrak kasar, 41 µL minyak sereh 0,5% (v/v), 100 µL larutan substrat (CMC 1% atau amilum 1%), dan 259 µL buffer fosfat pH 6. Diinkubasi pada suhu 37oC selama 20 menit. Ditambahkan 400 µL standar glukosa 10%, dan 100 µL DNS. Kemudian dipanaskan pada suhu 100oC rentang waktu 5 menit hingga warna DNS berubah.
Selanjutnya standar dan sampel divortex hingga warna homogen. Tabung standar dan sampel disentrifugasi 9000 rpm selama 4 menit. Supernatannya dipindahkan sebanyak 600 µL ke kuvet dan ditambahkan
aquades sebanyak 2400 µL. Selanjutnya, absorbansi diukur pada λmak 540 nm dengan spektrofotometer UV-Vis.
Uji inhibisi minyak cengkeh terhadap aktivitas selulase dan amilase.
Sebelumnya, minyak cengkeh 100% (v/v) diambil 150 μL diencerkan menggunakan etanol 96% menjadi 10% (v/v) dalam tabung mikro 1500 μL. Kultur mikroba digunakan sebagai sampel enzim. Tabung mikro disiapkan untuk standar selulase CC0 dan amilase AC0 serta sampel selulase CC1 dan amilase AC1. Pada tabung standar ditambahkan sebanyak 100 µL enzim ekstrak kasar, 11 µL minyak cengkeh 10% (v/v), 100 µL substrat (CMC 1% atau amilum 1%), 289 µL buffer fosfat pH 6, 400 µL standar glukosa 10%, dan 100 µL DNS. Kemudian dipanaskan pada suhu 100oC dalam waktu 5 menit hingga warna DNS berubah. Pada sampel ditambahkan sebanyak 100 µL enzim ekstrak kasar, 11 µL minyak cengkeh 10% (v/v), 100 µL larutan substrat (CMC 1% atau amilum 1%), dan 289 µL buffer fosfat pH 6. Diinkubasi pada suhu 37oC selama 20 menit. Ditambahkan 400 µL standar glukosa 10% (b/v), dan 100 µL DNS. Kemudian dipanaskan pada suhu 100oC rentang waktu 5 menit hingga warna DNS berubah.
Selanjutnya standar dan sampel divortex hingga warna homogen. Tabung standar dan sampel disentrifugasi 9000 rpm selama 4 menit. Supernatannya dipindahkan sebanyak 600 µL ke kuvet dan ditambahkan aquades sebanyak 2400 µL. Selanjutnya, absorbansi diukur pada λmak 540 nm dengan spektrofotometer UV-Vis.
Aktivitas Enzim
Pengukuran aktivitas enzim dengan metode DNS menggunakan spektrofotometer UV-Vis. Dilakukan penentuan Δ gula pereduksi dengan rumus:
Csp = × Cst (2.1)
Δ gula pereduksi = Csp – Cst (2.2)
Dimana:
Asp = Absorbansi sampel
Ast = Absorbansi standar
Csp = konsentrasi sampel (mg/mL)
Cst = konsentrasi standar glukosa
(mg/mL)
Sehingga aktivitas enzim ditentukan dengan
rumus:
A E =
Δ gul a p ereduksi ^≡i≡¾~^ μ m o 1 / m e n it
(2.3)
Dimana: AE = aktivitas enzim
t = waktu inkubasi
Konsentrasi inhibisi
Untuk menentukan besarnya suatu inhibitor dapat menginhibis aktivtas enzim maka digunakan rumus:
. . (bl a n k o - s a mp e l )
% Inhibisi = x 100% (2.4)
blanko
Dimana blanko sebagai aktivitas enzim dalam isolat tanpa minyak dan sampel adalah aktivitas enzim dengan penambahan minyak
Mikroba yang diisolasi dari lontar diamati pertumbuhannya selama 1 minggu pada media CMC. Hasil pengamatan pertumbuhan mikroba yang terpisah ditunjukan pada media C1, C3, dan C9.
Mikroba dalam media tersebut dikelompokan menjadi C1A; C1B; C3A, C3B, dan C9A yang diduplikat ke media CMC untuk mendapatkan kultur mikroba tunggal. Koloni mikroba pada media duplikat C1A, C1B, C3A, C3, dan C9A duji dengan congo red untuk mengetahui adanya aktivitas selulase ekstraseluler (Tabel 1).
Zona bening yang terbentuk, menandakan substrat CMC sudah terhidrolisis oleh selulase. Menurut [7], salah satu jenis selulase yang mampu menghidrolisis CMC dengan memutus ikatan glikosidik β-1,4 secara acak dalam daerah amorf dari serat selulosa seperti pada CMC.
Tabel 1. Uji Selulase Menggunakan Reagen Congo Red
Kode Isolat Zona Bening
Keterangan:
-
- : Tidak ada zona bening
-
+ : Ada zona bening
Sehingga congo red yang ditambahkan pada media CMC tidak dapat membentuk kompleks warna merah. Mikroba C3B dengan zona bening yang lebih luas digunakan sebagai uji aktivitas selulase selanjutnya.
Mikroba yang diisolasi dari lontar diamati pertumbuhannya selama 1 minggu pada media amilum. Hasil pengamatan pertumbuhan mikroba yang terpisah ditunjukan pada media A5, A6, A7, dan A10. Mikroba dalam media tersebut dikelompokan menjadi A5, A6A, A7A, A10A, dan A10B yang diduplikat ke media amilum untuk mendapatkan kultur mikroba tunggal. Koloni mikroba pada media duplikat A5, A6A, A7A, A10A, dan A10B duji dengan iodin untuk mengetahui adanya aktivitas amilase ekstraseluler (Tabel 2).
Tabel 2. Uji Aktivitas Amilase Menggunakan Reagen Iodin
|
Kode Isolat |
Zona Bening |
|
A5A |
+++ |
|
A6A |
- |
|
A7A |
- |
|
A10A |
++ |
|
A10B |
++ |
Keterangan:
- : tidak ada zona bening
+ : ada zona bening
Zona bening yang terbentuk, menandakan substrat amilum sudah terhidrolisis oleh amilase. sedangkan amilum yang tidak terhidrolisi membentuk senyawa kompleks dengan warna biru keunguan. Menurut penelitian yang dilakukan sebelumnya oleh [8], amilosa yang ditambahkan reagen iodin akan memberikan warna biru keunguan, sedangkan amilopektin yang ditambahkan reagen iodin akan memberikan warna coklat kemerahan. Mikroba A5A dengan zona bening yang lebih luas digunakan sebagai uji aktivitas amilase selanjutnya.
Pengukuran aktivitas selulase dan amilase yang sudah dilakukan menunjukkan adanya aktivitas selulase sebesar 0,065 U/mL sedangkan aktivitas amilase adalah 0,827 U/mL dari lontar yang telah lapuk. Hasil pengukuran absorbansi dari isolat tersebut menunjukan perbedaan serapan oleh isolat. Isolat dengan iknkubasi (sampel) akan menghasilkan gula pereduksi lebih banyak dari pada isolat tanpa inkubasi (standar).
Tabel 1. Aktivitas Selulase dan Amilase dengan Penambahan Minyak Sereh
|
Isolat |
Minyak Sereh (% v/v) |
At=0 |
At=20 |
Aktivitas Enzim (U/mL) |
|
Selulase |
- |
0,685 |
0,702 |
0,068 |
|
Selulase |
0,5 |
0,237 |
0,244 |
0,065 |
|
Amilase |
- |
0,104 |
0,135 |
0,827 |
|
Amilase |
0,5 |
0,222 |
0,279 |
0,571 |
Pengukuran aktivitas enzim dari uji inhibisi dilakukan untuk mengetahui adanya penurunan aktivitas enzim jika diberikan minyak sereh. Hasil aktivitas enzim dari
penambahan minyak sereh terhadap selulase dan amilase dengan metode DNS diperlihatkan pada Tabel 3 yang menunjukkan bahwa adanya penurunan aktivitas enzim pada isolat yang ditambahkan minyak sereh.
Dari persamaan (2.4), maka dapat ditentukan %inhibisi dari penambahan minyak sereh dengan konsentrasi 0,5% (v/v) membuat aktivitas selulase menjadi 0,065 U/mL atau terjadi penurunan aktivitas selulase 4,41%. Sedangkan, aktivitas amilase menjadi 0,571 U/mL atau terjadi penurunan aktivitas amilase sebesar 30,96%. Penurunan akvitas selulase yang ditambah minyak sereh ditunjukkan pada Gambar 1.
aktivitas enzim
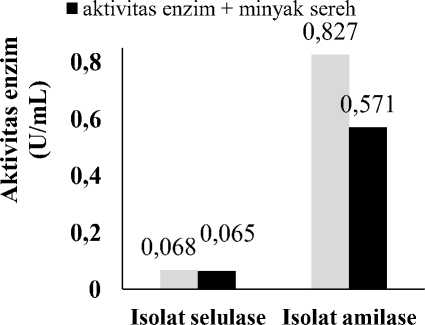
Gambar 1. Diagram perbandingan aktivitas enzim dengan penambahan minyak sereh dan tanpa penambahan minyak sereh
Dari hasil yang diperoleh pada isolat selulase dan amilase, minyak sereh berpotensi sebagai inhibitor pada lontar karena mampu menurunkan atau menghambat aktivitas selulase dan amilase. Minyak sereh sebagai inhibitor tersebut juga dikuatkan dengan penelitian dari [9] yang menemukan bahwa aktivitas α-amilase menurun dengan meningkatnya konsentrasi minyak sereh. Jadi, pada penelitian ini
terdapat beberapa komponen yang kemungkinan berperanan aktif dalam inhibisi minyak sereh serta sebagai data pendukung untuk uji inhibisi ini.
Sitronellal, sitronellol, dan geraniol merupakan beberapa komponen utama minyak sereh. Sitronellol menyebabkan penghambatan pertumbuhan miselia dari jamur Aspergillus sp., Penicillium sp., dan Fusarium sp. dalam mengurai makanannya [10]. Komponen minyak sereh pernah diuji sebelumnya dan menghasilkan aktivitas antijamur yang kuat terhadap pertumbuhan Aspergillus niger yang mampu menghasilkan enzim, seperti amilase, selulase, dan pektinase [11].
Uji inhibisi minyak cengkeh terhadap aktivitas selulase dan amilase
Uji inhibisi dengan minyak cengkeh dilakukan dengan metode yang sama dengan uji inhibisi sebelumnya. Hasil yang diperoleh pada Tabel 4. menunjukkan adanya penurunan aktivitas amilase pada sampel amilase, namun tidak dapat ditentukan pada sampel selulase. Hasil uji aktivitas selulase yang ditambahkan minyak cengkeh tidak menunjukan adanya inhibisi terhadap aktivitas selulase. Sedangkan pada isolat amilase menunjukkan adanya penurunan aktivitas enzim. Aktivitas amilase tanpa minyak cengkeh yang sudah diukur sebelumnya adalah 0,827 U/mL. Penambahan minyak cengkeh 10% (v/v) mengakibatkan aktivitas amilase menjadi 0,062 U/mL atau mengalami penurunan aktivitas sebesar 92,50%. Diagram akvitas amilase yang ditambah minyak cengkeh dan tanpa minyak cengkeh (Gambar 2) menunjukkan aktivitas selulase dengan penambahan minyak cengkeh meningkat. Hal ini mungkin disebabkan oleh kandungan minyak cengkeh mengandung eugenol. Eugenol sangat kuat menghambat selulase yang diisolasi dari mikroba Alternaria solani, Phytophthora infestans, Fusarium oxysporum, Aspergillus
niger, dan Penicilium. digitatum. Tetapi, eugenol menyebabkan efek penghambatan yang relatif lemah pada selulase yang diisolasi dari Rhizoctonia solani, Botrytis cinerea, dan Fusarium solani [12]. Sehingga, memungkinkan selulase tidak dapat terinhibisi oleh minyak cengkeh karena jenis mikroba yang tidak mampu diinhibisi oleh eugenol.
Tabel 4. Aktivitas Selulase dan Amilase dengan Penambahan Minyak Cengkeh
|
Isolat |
M.C % (v/v) |
At=0 |
At=20 |
AE (U/m L) |
|
Selulase |
- |
0,685 |
0,702 |
0,068 |
|
Selulase |
10 |
0,125 |
0,141 |
0,284 |
|
Amilase |
- |
0,104 |
0,135 |
0,827 |
|
Amilase |
10 |
0,143 |
0,147 |
0,062 |
M.C = Minyak Cengkeh AE = Aktivitas Enzim
■ Aktivitas enzim
■ Aktivitas enzim + minyak cengkeh
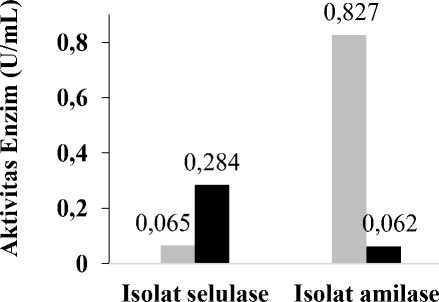
Gambar 2. Diagram perbandingan aktivitas enzim dengan penambahan minyak cengkeh dan tanpa penambahan minyak cengkeh
Aktivitas amilase menurun dengan ditambahkannya minyak cengkeh. Hal ini didukung dengan dengan penelitian eugenil asetat yang diproduksi secara enzimatik
menyebabkan aktivitas antimikroba yang lebih tinggi terhadap bakteri gram negatif [13]. Selain itu, menurut [14], ekstrak β-caryophyllene ini menunjukkan
penghambatan yang signifikan terhadap strain jamur Candida glabrata, Candida albicans. Dan Aspergillus niger.
Minyak sereh dan cengkeh berpotensi sebagai inhibitor dengan mempengaruhi aktivitas selulase dan amilase, yang dibuktikan dengan penurunan aktivitas selulase sebesar 4,41% dan amilase sebesar 30,96% setelah ditambahkan minyak sereh 0,5% (v/v). Serta minyak cengkeh mampu menurunkan aktivitas amilase sebesar 92,50% setelah ditambahkan minyak cengkeh 10% (v/v).
Penulis berterimakasih kepada kepala dan staff di Laboratorium Forensik Gedung Terpadu LPPM Universitas Udayana.
-
[1] Sancana, I.B. 2014. Kajian Efektivitas Teknik dan Bahan Konservasi pada Lontar di Bali. Konservasi Cagar Budaya Borobudur. 8 (2) : 11-23.
-
[2] Burford, M.A., Thompson, P.J., McIntosh, R.P., Bauman, R.H., dan Pearson, D.C. 2004. Nutrien and Microbial Dynamics in High-Intensity. Zero Exchange Shrimp Ponds of Belize. Aquaculture. 219, 393-411.
-
[3] Brugnera, D.F. 2011. Ricotta: Microbiological quality and use of spices in the control of Staphylococcus aureus. Dissertation. University of Lavras, Lavras. Brazil.
-
[4] Alma, M.H., Ertas M., Nitz S., Kollmannsberger H. 2007. Chemical composition and content of essential oil
from the bud of cultivated Turkish clove. BioResources. 2(2) : 265-269.
-
[5] Bailey, MJ. 1988. A note on the use to dinitrosalicyclic acid for determining the products of enzymatic reaction. App. Microbiol. Biotechnol. 29: 494 – 496.
-
[6] Wirajana, I.N., Kimura, T., Sakka, K., Wasito, E.B., Kusuma, E.K., &
Puspaningsih, N.N.T. 2016. Secretion of Geobacillus thermoleovorans IT-08 α-L Arabinofuranosidase (AbfA) in Saccharomyces cerevisiae by Fusion with HM-1 Signal Peptide. Procedia Chemistry 18: 69 – 74.
-
[7] Sakti, P.C., 2012, Optimasi Produksi Enzim Selulase dari Bacillus sp. BPPT CC RK 2 dengan Variasi pH dan Suhu menggunakan Response Surfance Methodology, Skripsi, Depok, Fakultas Teknik Universitas Indonesia.
-
[8] Oktavia AD, Indiawati N, Destiarti L., 2013, Studi Awal Pemisahan Amilosa dan Amilopektin Pati Ubi Jalar (Ipomea batatas Lam) dengan Variasi Konsentrasi n-Butanol. JKK. 2 (3):
153-156.
-
[9] Jumepaeng, T., Prachakool, Luthria, D. L. dan Chanthai, S. 2013. Determination of Antioxidant Capacity and α-Amylase Inhibitory Activity Of The Essential Oils from Citronella Grass and Lemongrass. International Food Research Journal 20(1): 481-485.
-
[10] Aoudou Y., Leopold T.N., Michel J.D.P., Xavier E.F., Moses M.C. 2010. Antifungal properties of essential oils and some constituents to reduce foodborne pathogen. Journal Yeast and Fungal Research. 1: 1–8.
-
[11] Tolouee M, Alinezhad S, Saberi R, Eslamifar A, Zad SJ, Jaimand K, Taeb
J, Rezaee MB, Kawachi M, Shams-Ghahfarokhi M, Razzaghi-Abyaneh M. 2010. Effect of Matricaria chamomilla L. flower essential oil on the growth and ultrastructure of Aspergillus niger van Tieghem. Int J Food Microbiol. 139:127–133.
-
[12] Marei, G.I.K., dan Abdelgaleil, S.A.M. 2018. Antifungal Potential and Biochemical Effects of Monoterpenes and Phenylpropenes on Plant Pathogenic Fungi. Plant Protect. Sci. 54 (1): 9–16.
-
[13] Vanin, A.B., Orlando T. Piazza, S.P., Puton, B.M.S., Cansian, R.L., Oliveira, D., dan Paroul N. 2014. Antimicrobial and Antioxidant Activities of Clove Essential Oil and Eugenyl Acetate Produced by Enzymatic Esterification, Appl Biochem Biotechnol. 12 (1): 0-14.
-
[14] Santos, A.O., T. Ueda-Nakamura, B. P. Dias Filho, V. F. Viega, A. C. Pinto, and C. Nakamura. 2008. Effect of Brazilian copaiba oils on Leishmania amazonensis. Journal of
Ethnopharmacology. 120: 204–20.
148
Discussion and feedback