IDENTIFIKASI DAN UJI AKTIVITAS ANTIKANKER EKSTRAK SPONS Ianthella basta TERHADAP LARVA Artemia salina L.
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 1, Nomor 1, Mei 2013
IDENTIFIKASI DAN UJI AKTIVITAS ANTIKANKER EKSTRAK SPONS
Ianthella basta TERHADAP LARVA Artemia salina L.
Ni Wayan Sri Sukmarianti1*, Ni Made Suaniti1 , I Made Dira Swantara1 1Program Magister Kimia Terapan, Universitas Udayana, Bali *Email : sukmaariesgirl@yahoo.com
ABSTRAK: Penelitian ini bertujuan untuk mengetahui toksisitas dari ekstrak spons Ianthella basta terhadap larva Artemia salina dan senyawa yang terkandung dalam isolat toksik tersebut. Metode yang digunakan sebagai uji pendahuluan adalah Brine Shrimp Lethality (BST). Dari hasil uji BST diperoleh bahwa ekstrak kloroform spons Ianthella basta bersifat paling toksik dengan nilai LC50 22,39 ppm. Selanjutnya ekstrak kloroform ini dipisahkan dan dimurnikan dengan kromatografi kolom menggunakan eluen kloroform : etilasetat : n-heksana (7:2:1) sehingga diperoleh 4 fraksi. Fraksi yang paling toksik adalah fraksi C (FC) dengan LC50 35,36 ppm. Berdasarkan hasil GC-MS, diduga senyawa yang terkandung dalam isolat toksik spons Ianthella basta adalah senyawa metil heksadekanoat dan asam heksadekanoat.
Kata kunci: Ianthella basta, uji toksisitas, aktivitas antikanker
ABSTRACT: The main purpose of this research is to determine the toxicity of extracts sponge Ianthella basta against Artemia salina larvae and to identify the chemical compounds contained in those toxic isolates. The preliminary test of the anticancer activity has conducted by Brine Shrimp Letalithy (BST) test. The results showed that the chloroform extract was the most toxic with LC50 value of 22,39 ppm. Futher, the cloroform extract was separated and purified by coloumn chromatography using eluent of solvent mixture of chloroform : ethyl acetate : n-hexane by 7 : 2 : 1 and 4 fractions were obtained. The most toxic fraction was the fraction C with LC50 value of 35,36 ppm. Based on the GC-MS results, the toxic isolate is allegedly containing chemicals compound of hexadecanoic methyl ester and hexadecanoic acid.
Keywords: Ianthella basta, toxicity test, anticancer activity
Kanker merupakan penyebab kematian ketiga di negara-negara berkembang setelah penyakit kardiovaskular dan infeksi. Menurut perkiraan WHO, pada tahun 2015 diperkirakan ada 9 juta orang meninggal karena kanker dan tahun 2030 diperkirakan meningkat menjadi 11,4 juta kematian karena kanker. Jumlah penderita kanker setiap tahun juga meningkat mencapai 6,25 juta orang dan dua pertiganya berasal dari negara berkembang seperti Indonesia [1].
Sampai saat ini belum ditemukan obat kanker yang ideal, yang menghancurkan sel-
sel kanker tanpa mencederai sel-sel yang normal. Penanganan kanker umumnya menggabungkan pembedahan dan radiasi dengan pengobatan kemoterapi [2]. Obat-obat tersebut di atas memberikan efek samping berupa mual, muntah, rambut rontok, iritasi kandung kemih (sistitis) disertai terdapatnya darah dalam air kemih. Hal ini mendorong peneliti-peneliti untuk mengeksplorasi senyawa-senyawa bioaktif antikanker dari bahan-bahan alam sehingga efek sampingnya bisa lebih kecil dan harganyapun lebih terjangkau [3].
Indonesia merupakan negara kepulauan terbesar di dunia, yang terletak di kawasan tropis merupakan salah satu negara
dengan keanekaragaman hayati laut tertinggi (megabiodiversity) salah satunya adalah spons. Jumlah spesies spons di Indonesia diperkirakan sebanyak 830 spesies [4]. Dengan banyaknya spesies spons tersebut semakin besar peluang untuk ditemukannya senyawa-senyawa bioaktif. Spons mensintesis metabolit sekunder (senyawa bioaktif) yang bersifat toksik untuk alat pertahanan diri melawan bakteri, fungi, dan virus [5].
Beberapa penelitian tentang bioaktivitas antikanker dari biota laut telah banyak dilaporkan. Rasyid (2009) [6] melaporkan bahwa spons Cryptotethia crypta berpotensi sebagai obat antikanker. Dari hasil penelitiannya, Puji et al. (2005) [7] mengungkapkan bahwa spons Petrosia.sp juga potensial sebagai antikanker. Selain itu, beberapa penelitian tentang uji sitotoksisitas dari spons juga telah banyak dilaporkan. Setyowati et al. (2007) [8] melaporkan bahwa dari hasil uji sitotoksik terhadap sel myeloma menunjukkan bahwa ekstrak kloroform spons Kaliapsis sp aktif terhadap sel myeloma dan noda-noda KLT yang diperoleh potensial sebagai senyawa sitotoksik dengan aktivitas tertinggi pada noda 1 dengan harga LC50 sebesar 0,28 µg/mL. Selain itu ekstrak metanol Crella papilata dilaporkan memiliki aktivitas sitotoksik yang tinggi terhadap sel tumor HeLa dan Mieloma. Trianto (2005) [9] melaporkan bahwa hasil uji antikanker ekstrak spons Haliclona sp memberikan LC 50 sebesar 8,16 µg/mL, sedangkan ekstrak spons Agelas nakamurai sebesar 4,50 µg/mL.
Uji pendahuluan untuk senyawa yang bersifat antikanker umumnya menggunakan uji toksisitas terhadap larva Artemia salina L. Jika dalam uji tersebut suatu bahan mempunyai LC50 lebih kecil dari 1000 ppm maka bahan tersebut berpotensi sebagai antikanker.
Pada uji pendahuluan telah dilakukan uji toksisitas menggunakan larva Artemia salina.L terhadap beberapa ekstrak spons Ianthella basta. Ekstrak kloroform menunjukkan toksisitas paling tinggi, selanjutnya ekstrak tersebut dimurnikan dan
diisolasi senyawanya. Selanjutnya fraksi yang paling toksik diidentifikasi senyawanya.
Bahan yang digunakan dalam penelitian ini adalah Spons Ianthella basta yang diperoleh dari Flores, Nusa Tenggara Timur, larva Artemia salina L. yang digunakan saat uji toksisitas. Bahan-bahan kimia yang dalam derajat p.a dan teknis yang telah didestilasi antara lain etanol, n-heksana, etilasetat, kloroform, silika gel GF254, silika gel 60, DMSO, kalsium klorida anhidrat (CaCl2).
Alat-alat yang digunakan dalam penelitian ini adalah : seperangkat alat gelas, penguap putar vakum, seperangkat alat Kromatografi Lapis Tipis (KLT), seperangkat alat kromatografi kolom, seperangkat alat Kromatografi Gas-Spektroskopi Massa (GC-MS), lampu UV 254 dan 366 nm, kertas saring, pipet mikro, timbangan elektronik, oven, dan blender.
Spons Ianthella basta sebanyak 500 gram diekstraksi secara maserasi dengan etanol sampai terendam. Setiap 24 jam filtratnya disaring dan ampasnya dimaserasi lagi dengan etanol. Ekstraksi dilakukan sampai diperkirakan semua metabolit terekstrak. Semua filtrat etanol diuapkan menggunakan penguap putar vakum (rotary vacuum evaporator) sampai menghasilkan ekstrak kasar (crude extract) etanol. Sebanyak kira-kira 5 gram crude ekstrak etanol dilarutkan dalam campuran air – etanol (7:3) sampai semua larut. Ekstrak air etanol ini selanjutnya dipartisi dengan menggunakan n-heksan (15 x50mL). Ekstrak n-heksan (EH) dikumpulkan. Ekstrak air yang mengandung etanol diuapkan etanolnya sampai bebas etanol lalu dipartisi dengan menggunakan
kloroform (15x50mL). Kemudian ekstrak kloroform (EK) dan ekstrak air (EA) dikumpulkan. Ketiga ekstrak (EH, EK, dan EA) diuapkan menggunakan penguap putar vakum sehingga diperoleh ekstrak kental EH, EK dan EA.
Pemisahan dengan teknik kromatografi kolom menggunakan fasa diam silika gel 60 (70-230 mesh ASTM) dan fasa geraknya menggunakan eluen campuran kloroform – etil asetat – n-heksan (7:2:1) Sebanyak kurang lebih 0,9 gram sampel dilarutkan dalam eluen kemudian dimasukkan ke dalam kolom dengan hati-hati sambil kran dibuka dengan kecepatan alir 1 mL/menit. Eluen secara terus-menerus dialirkan ke dalam kolom sampai terjadi pemisahan. Setiap 2 mL eluat ditampung dalam satu botol penampung. Elusi dihentikan setelah diperkirakan semua komponen keluar dari kolom. Setiap botol eluat dilihat pola nodanya pada plat kromatografi lapis tipis. Eluat yang memiliki pola pemisahan noda yang sama digabungkan sehingga diperoleh beberapa fraksi. Fraksi-fraksi yang diperoleh diuji toksisitasnya. Fraksi yang paling toksik akan diuji kemurniannya.
Uji toksisitas dengan larva A. salina Leach mengikuti metode Meyer (1982) [10]. Media untuk larva dibuat dengan menyaring air laut secukupnya. Air laut dimasukkan dalam akuarium yang dibagi menjadi dua bagian, yaitu satu bagian dibuat gelap dengan cara ditutup dengan kertas hitam dan bagian yang lain dibiarkan terbuka. Telur A. salina diletakkan secukupnya pada bagian yang gelap dan dibiarkan selama 48 jam sehingga telur menetas dan siap digunakan untuk pengujian. Seberat 20 mg ekstrak dilarutkan dengan 2 mL etanol. Larutan diambil
sebanyak 500µL, 50µL, dan 5µL, kemudian masingmasing dimasukkan ke dalam tabung reaksi dan pelarutnya diuapkan. Setelah kering, maka ke dalam masing-masing tabung reaksi tadi dimasuki 50µL dimetilsulfoksida, 1 mL air laut, dan 10 ekor larva. Kemudian ditambahi air laut sampai volumenya 5 mL sehingga dicapai konsentrasi ekstrak 1000 ppm, 100 ppm, dan 10 ppm. Konsentrasi 0 ppm juga dibuat sebagai kontrol tanpa penambahan ekstrak. Masing-masing tabung reaksi ditutup dengan aluminium foil yang berlubang kecil-kecil. Setelah 24 jam, dilakukan pengamatan terhadap kematian larva Artemia salina. Jumlah larva yang mati dicatat, kemudian dilakukan analisis data untuk mencari konsentrasi kematian (LC50).
Spons Ianthella basta sebanyak 500 gram diekstraksi secara maserasi dengan etanol sampai terendam. Setiap 24 jam filtratnya disaring dan ampasnya dimaserasi lagi dengan etanol. Ekstraksi dilakukan sampai diperkirakan semua metabolit terekstrak. Semua filtrat etanol diuapkan menggunakan penguap putar vakum (rotary vacuum evaporator) sampai menghasilkan ekstrak kasar (crude extract) etanol.
Ekstrak kasar etanol sebanyak 5 gram dilarutkan dalam etanol:air (3:7), lalu dipartisi dengan 15x50 mL n-heksan. Lapisan n-heksan dipisahkan dan dievaporasi, sehingga menghasilkan ekstrak n-heksan (EH) sebanyak 0,75 gram. Residunya (ekstrak etanol-air) diuapkan etanolnya menggunakan penguap putar vakum sampai etanolnya habis, lalu dipartisi dengan kloroform (15x50mL). Lapisan kloroformnya dipisahkan lalu diuapkan sehingga diperoleh ekstrak kloroform (EK) sebanyak 0,98 gram.
Ekstrak airnya diuapkan sehingga diperoleh ekstrak air (EA) sebanyak 2,71 gram. Ketiga ekstrak (EH, EK dan EA) diuji toksisitasnya terhadap larva Artemia Salina, diperoleh hasil seperti Tabel 1.
Tabel 1. Hasil Uji Toksisitas Ekstrak Spons Ianthella basta Terhadap Larva Artemia salina L.
|
No |
C (ppm) |
larva mati |
% kematian |
LC50 (ppm) | ||
|
I |
II |
III | ||||
|
Ekstrak n-heksan | ||||||
|
1 |
0 |
0 |
0 |
0 |
0 |
>1000 |
|
2 |
10 |
0 |
2 |
0 |
3,00 | |
|
3 |
100 |
2 |
3 |
2 |
17,00 | |
|
4 |
1000 |
3 |
4 |
3 |
49,00 | |
|
Ekstrak kloroform | ||||||
|
1 |
0 |
0 |
0 |
0 |
0 |
22,39 |
|
2 |
10 |
4 |
4 |
2 |
29,00 | |
|
3 |
100 |
9 |
9 |
8 |
88,00 | |
|
4 |
1000 |
10 |
9 |
10 |
98,00 | |
|
Ekstrak air | ||||||
|
1 |
0 |
0 |
0 |
0 |
0 |
41,69 |
|
2 |
10 |
2 |
4 |
4 |
23,00 | |
|
3 |
100 |
6 |
5 |
6 |
66,00 | |
|
4 |
1000 |
9 |
10 |
10 |
98,00 | |
Berdasarkan hasil uji toksisitas ketiga ekstrak tersebut diperoleh bahwa ekstrak kloroform dan air memberikan nilai LC50 yang kurang dari 1000 ppm, sehingga dapat dikatakan bahwa ekstrak kental kloroform dan air dari spons Ianthella basta bersifat toksik terhadap larva Arthemia salina L. Jika suatu sampel mempunyai nilai LC50 di bawah 1000 ppm maka sampel tersebut dikatakan bersifat sitotoksik (toksik tehadap sel) (Meyer, 1982)[10]. Ekstrak n-heksana memberikan nilai LC50 >1000 ppm. Hal ini disebabkan karena perlakuan konsentrasi yang diberikan (10,100,dan 1000 ppm) terlalu rendah sehingga tidak dapat membunuh 50 % dari larva Artemia salina L.
Pada proses kromatografi kolom, fase diam yang digunakan adalah silica gel 60 sebanyak 24 gram, fase gerak yang digunakan adalah campuran pelarut kloroform : etilasetat : n-heksana (7:2:1), sedangkan sampel (ekstrak kloroform) yang digunakan sebanyak 0,9 gram. Eluat ditampung setiap 2 mL sehingga dihasilkan 102 botol eluat. Setelah dilakukan pendeteksian noda dengan KLT maka berdasarkan kesamaan pola nodanya diperoleh empat fraksi yaitu FA-FD dengan berat berturut-turut 0,19 gram, 0,13 gram, 0,11 gram, dan 0,18 gram
Selanjutnya keempat fraksi hasil kromatografi kolom diuji toksisitasnya terhadap larva Artemia Salina L, ditunjukkan pada Tabel 2.
Tabel 2. Hasil Uji Toksisitas F5 Terhadap
Larva Artemia salina Leach
|
Fraksi |
C (pp m) |
larva mati |
% kematian |
LC50 (ppm) | ||
|
I |
II |
III | ||||
|
A |
0 |
0 |
0 |
0 |
0 |
501,12 |
|
10 |
0 |
0 |
1 |
2,00 | ||
|
100 |
4 |
3 |
3 |
23,00 | ||
|
1000 |
5 |
4 |
5 |
61,00 | ||
|
B |
0 |
0 |
0 |
0 |
0 |
151,36 |
|
10 |
1 |
1 |
2 |
7,00 | ||
|
100 |
5 |
4 |
5 |
43,00 | ||
|
1000 |
6 |
8 |
8 |
83,00 | ||
|
C |
0 |
0 |
0 |
0 |
0 |
35,36 |
|
10 |
0 |
2 |
2 |
11,00 | ||
|
100 |
9 |
9 |
8 |
79,00 | ||
|
1000 |
8 |
9 |
9 |
93,00 | ||
|
D |
0 |
0 |
0 |
0 |
0 |
36,31 |
|
10 |
2 |
4 |
2 |
20,00 | ||
|
100 |
7 |
6 |
7 |
72,00 | ||
|
1000 |
10 |
10 |
9 |
98,00 | ||
Berdasarkan hasil uji toksisitas pada Tabel 2, diperoleh bahwa semua fraksi nilai LC50 nya kurang dari 1000 ppm. Namun demikian, fraksi C mempunyai nilai LC50 paling kecil. Selanjutnya fraksi tersebut
diidentifikasi senyawa apa saja yang terkandung didalamnya.
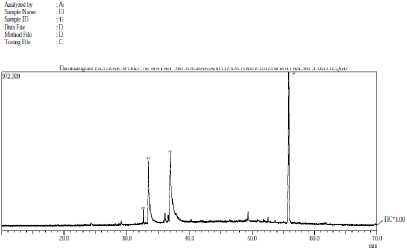
Identifikasi isolat toksik dilakukan dengan Kromatografi Gas-Spektroskopi Massa (GC-MS). Hasil kromatografi gas-spektroskopi massa isolat toksik FC spons memperlihatkan adanya 4 puncak seperti terlihat pada Gambar 1.

IabXlmia Orgaiuk FMlI1A UCM
Sample Infarniailan
Chraniatagrani
Chrairiao8IOT EKSTRAK SPONS, Nl WAYAN SRI SUKMARIANniMOKTOBER ZOiZtNI WAYAN SRI S.061Z12.QGD
Admln
EKSTRAK SPONS, NI WAYAN SRISUKMAR1 ANTI
1208.12
Iboktober 201 ⅛ιι wayan sris. Omzkqcd
Imoktoberzoizmade rayrahayu is&s 5-300 i5).wn
2ΛGCMSsnlιrtl□n¾⅛eπι∖Tιιιεll2MEl ZOIZqgI
Gambar 1. Kromatogram FC ekstrak
kloroform spons Ianthella basta
Masing-masing puncak diidentifikasi lebih lanjut dengan spektrometer massa, dimana setiap senyawa memiliki pola fragmentasi massa yang spesifik. Identifikasi dilakukan dengan membandingkan spektrum massa dengan senyawa-senyawa yang sudah diketahui dan terprogram dalam database GC-MS, sehingga dapat diduga senyawa-senyawa penyusun spons Ianthella basta. Dari 4 puncak yang diperoleh, hanya 2 puncak saja (puncak 1 dan 2) yang dapat dianalis. Sedangkan 2 puncak yang lainnya (yaitu puncak 3 dan 4) tidak dapat dianalisis karena tidak sesuai dengan database yang disediakan. Untuk menganalisis puncak 3 dan 4 diperlukan spektra pendukung yang lainnya seperti IR, 1H NMR, dan 13C NMR. Hasil analisis spektrum massa berdasarkan database WILLEY229 dapat dilihat pada Tabel 3.
Beberapa penelitian sebelumnya, menjelaskan bahwa senyawa turunan dari asam karboksilat memiliki sifat antikanker. Menurut hasil penelitian yang dilakukan oleh Ohashi dilaporkan bahwa senyawa aktif yang
diisolasi dari benalu teh yaitu oktadeka-
8,10,12-trinoat teruji secara in vivo dan in
Tabel 3 Senyawa yang Diduga dari Puncak FD Ekstrak Spons Ianthella basta
|
Peak |
M+ |
tR (menit) |
% area |
Senyawa yang diduga |
|
1 |
270 |
32,64 |
1,91 |
Metil heksadekanoat |
|
2 |
256 |
33,48 |
23,48 |
Asam dekanoat |
|
3 |
- |
36,951 |
28,42 |
Belum dapat diidentifikasi |
|
4 |
- |
55,89 |
46,19 |
Belum dapat diidentifikasi |
vitro bekerja menghambat invasi sel kanker sehingga sel tidak mengalami metastasis [11]. Winarno (2009) juga melaporkan bahwa asam oktadeka-8,10,12-triunoat memiliki aktivitas antiproliferasi terhadap empat jenis galur sel kanker manusia, yaitu sel HeLa, leukemia THPI, karsinoma paru-paru A549, dan limfoma HUT78 [12].
Berdasarkan penjelasan diatas, dapat diduga bahwa senyawa yang memberikan sifat toksik pada fraksi C adalah metilheksadekanoat. Dugaan ini didukung oleh hasil penelitian Kumar et al. (2010) yang dalam penelitiannya menjelaskan bahwa metil heksadekanoat memiliki aktivitas sebagai antioksidan [13].
-
1) Isolat (FC) dari ekstrak spons Ianthella basta memiliki sifat toksik terhadap larva Artemia Salina Leach dengan nilai LC50 sebesar 35,36 ppm.
-
2) Senyawa yang teridentifikasi dalam Isolat toksik (FC) dari ekstrak spons Ianthella basta adalah asam heksadekanoat dan metil heksadekanoat.
-
3) Dari senyawa yang teridentifikasi, senyawa yang diduga memiliki sifat toksik adalah metil heksadekanoat.
Pada kesempatan ini, penulis mengucapkan terimakasih kepada semua pihak yang telah membantu penelitian ini.
-
[1] Pariman, 2012, Guided Imagery (Sebuah Pendekatan Psikosintesis) untuk Penurunan Depresi pada Penderita Kanker, Fakultas Psikologi, Universitas Diponegoro, Semarang.
-
[2] Abeloff, M., Arnitage J., Niederhuber J., Kastan M., dan McKenna W. 2004. Clinical Oncology 3rd ed. Elsevier Churchill Livingstone: Philadelphia.
-
[3] Ixora, 2007. Antikanker yang alami. http:/www.ixoranet.com/index.p.hp.diaks es pada tanggal 21 Mei 2012.
-
[4] Sujatmiko, W., 2000, Inventarisasi Jenis Spons Disekitar Perairan Pulau Lombok dan Garam Di Pulau Sumbawa Nusa Tenggara Barat, Kerjasama : Yayasan Rinjani Bahari, Badan Pengkajian dan Penerapan Teknologi, Badan Perencanaan dan Pembangunan Propinsi Nusa Tenggara Barat
-
[5] Gudbjarnason, S. 1999. Bioactive Marine Natural Products.Ritfiskideiddal. 16:107–110.
-
[6] Rasyid,A., 2009, Senyawa-senyawa
Bioaktif dari Spons, Oseana, Volume XXXIV, Nomor 2.
-
[7] Puji, A., Gemini, A., Mae Sri, H.W., Subagus, W., 2005, Uji Sitotoksik Senyawa Alkaloid dari Spons Petrosia sp
: Potensial Pengembangan sebagai Antikanker, Majalah Farmasi Indonesia. 16(1), 58-62.
-
[8] Setyowati,E.P., Jenie, U.A., Sudarsono, Kardono, B., Rahmat, R., Meiyanto, E., 2007, Isolasi Senyawa Sitotoksik Spons Kaliapsis, Fakultas Farmasi, Universitas Gajah Mada, Yogyakarta
-
[9] Trianto, A., Ambariyanto, 2005, Isolasi Senyawa Antikanker Leukemia dari Sponge Agelas nakamurai dan Haliclona.sp, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro.
[10]Meyer, F., Putnam, Jacobsen N., dan Mc. Laughlin. 1982. “Brine Shrimp: A Convenient General Bioassay for Active Lant Constituents”. Plant Medica 45.
[11] Ohashi, Kazuyoshi, Hendig Winarno, Matsuko Mukao, Hirotaka Shibuya. 2003. Preparation and Cancer Cell Invasion Inhibitory Effects of C-16 Alkynic Fatty Acid. Chem. Pharm. Bull. 51 (4) 463 - 466 (2003).
[12]Winarno, Hendig. 2009.
Antiproliferative Activity of Octadeca-8,10,12-trynoic Acid Agains Human Cancer Cell Lines. Berita-Biologi 9(4)-April 2009. p-p 343 - 348.
[13] Kumar, P. Praveen, S. Kumaravel and C. Lalitha. 2010. Screening of Antioxidant Activity, Total Phenolic and GC-MS study of Vitex negundo. African Journal of Biochemistry Research Vol. 4(7), pp. 191 - 195, July 2010.
19
Discussion and feedback