FOTOKATALIS BENTONIT-Fe2O3 UNTUK DEGRADASI ZAT WARNA REMAZOL BRILLIANT BLUE
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 7 Nomor 1, Mei 2019
FOTOKATALIS BENTONIT-Fe2O3 UNTUK DEGRADASI ZAT WARNA REMAZOL BRILLIANT BLUE
Ermin Riskiani, Iryanti Eka Suprihatin, dan James Sibarani
Jurusan Kimia FMIPA Universitas Udayana, Bukit Jimbaran, Bali, Indonesia 80361 eka_suprihatin@unud.ac.id
ABSTRAK: Penelitian ini bertujuan untuk mengetahui karakter fotokatalis bentonit-Fe2O3, menentukan kondisi optimum fotodegradasi, dan efektivitas fotodegradasi remazol brilliant blue dengan fotokatalis bentonit-Fe2O3. Karakterisasi fotokatalis bentonit-Fe2O3 dilakukan dengan XRD, nanosizer, SEM, dan FTIR. Luas permukaan spesifik ditentukan dengan metode adsorpsi methylene blue. Penentuan konsentrasi zat warna setelah proses fotodgradasi dilakukan dengan spektrofotometer UV-Vis. Hasil penelitian menunjukkan bahwa bentonit-Fe2O3 memiliki puncak tajam yang menunjukkan tingkat kristalinitas tinggi, ukuran partikel bentonit dan bentonit-Fe2O3 sebesar 2707,6 nm dan 2726,9 nm, dan terdapatnya gugus fungsi Fe-O. Analisis dengan SEM menunjukkan permukaan bentonit-Fe2O3 lebih homogen daripada bentonit. Fotodegradasi optimum terjadi pada massa fotokatalis 100 mg, pH 4, waktu irradiasi 2 jam, dan konsentrasi zat warna 200 ppm. Efektivitas fotodegradasi yang dihasilkan sebesar (98,20 ± 0,0676) %.
Kata kunci: remazol brilliant blue, fotokatalis, bentonit-Fe2O3.
ABSTRACT: The purposes of this study were to characterize the prepared bentonite-Fe2O3 photocatalyst and to determine its optimum photodegradation conditions and the effectiveness of remazol brilliant blue degradation using bentonite-Fe2O3 photocatalyst. The characterizations of bentonite-Fe2O3 photocatalyst were carried out with Fourier Transform Infrared (FTIR), X-ray diffractometer (XRD), nanosizer, and scanning electron microscope (SEM). The Specific surface area was determined by methylene blue adsorption method. Further, the catalytic activity on methylene blue degradation was determined by UV-Vis spectrophotometer. The results showed that the synthesized bentonite-Fe2O3 has a sharp peak which showed a high level of crystallinity, with particle size of 2726.9 nm, and contains FeO. SEM analysis showed that the surface of bentonite-Fe2O3 was more homogeneous than bentonite. The optimum photodegradation conditions occurred at photocatalyst mass of 100 mg, pH of 4, 2 hours of irradiation time, and dye concentration of 200 ppm. The effectiveness of photodegradation produced was (98,20 ± 0,0676)%.
Keywords: remazol brilliant blue, photocatalyst, bentonite-Fe2O3.
Perkembangan industri tekstil di Indonesia yang semakin pesat menimbulkan dampak signifikan terhadap lingkungan perairan karena dalam prosesnya menggunakan zat warna. Zat warna yang digunakan biasanya
mengandung senyawa organik yang sulit didegradasi secara biologis. Zat warna sintesis banyak digunakan dalam industri tekstil karena terikat kuat pada kain yang menjadikan kain tidak mudah pudar, salah satu jenis zat warna ini adalah zat warna azo.
Zat warna azo bersifat sangat reaktif, salah satu contohnya adalah remazol brilliant blue yang memberikan warna-warna biru cerah dan tidak mudah luntur karena memiliki gugus kromofor dan auksokrom. Selain itu, zat warna ini juga memiliki kestabilan struktur aromatik kompleks yang sangat tahan terhadap reaksi oksidasi kimia. Namun, pewarna azo sangat beracun bagi biota perairan dan karsinogenik bagi manusia. Zat warna tekstil juga memberikan dampak negatif lain seperti pencemaran jika limbah yang mengandung zat warna tersebut dibuang secara langsung ke aliran sungai atau tidak diolah dengan baik sehingga masih mengandung zat yang berbahaya bagi makhluk hidup dan lingkungan [1].
Limbah cair dari zat warna tekstil harus diolah sebelum dibuang ke saluran air karena 95% limbah tersebut tidak dapat digunakan ulang [2]. Limbah cair dari zat warna tekstil yang tidak diolah akan menjadi permasalahan yang semakin luas di daerah industri. Molekul zat warna yang semakin banyak akan mengganggu proses fotosintesis dan merusak estetika.
Upaya penanganan masalah tersebut telah dilakukan dengan bermacam-macam cara. Secara konvensional misalnya adsorpsi menggunakan pasir aktif dan karbon aktif [3], atau lempung zeolite [4] sampai metode yang mutakhir seperti biodegradasi [5], irradiasi pengion [6], maupun teknologi plasma [7]. Namun, masing-masing metode tersebut memiliki kelebihan dan kekurangan. Metode konvensional tidak efektif dalam mendegradasi zat pencemar, sedangkan metode mutakhir memerlukan biaya yang cukup tinggi. Salah satu upaya alternatif pengolahan limbah adalah dengan menggunakan prinsip fotodegradasi [8] menggunakan fotokatalis [9].
Fotodegradasi dalam prosesnya menggunakan energi yang berasal dari cahaya (sinar matahari atau lampu UV) untuk mengaktifkan proses katalisis pada permukaan dari bahan semikonduktor yang akan menghasilkan radikal hidroksil (OH-)
pendegradasi polutan organik dan zat warna. Radikal hidroksil memiliki reaktivitas yang tinggi sehingga dengan meningkatnya jumlah radikal hidroksil maka semakin banyak zat warna yang terdegradasi. Sinar matahari yang sampai ke bumi memiliki intensitas yang lemah sehingga proses degradasi berlangsung lambat. Untuk meningkatkan laju tersebut maka digunakan fotokatalis berupa oksida logam yang memiliki sifat semikonduktor seperti TiO2, ZnO, CuO, CdO, Fe2O3, dan sebagainya. Bahan semikonduktor juga memiliki kemampuan fotokatalitik sehingga ketika terkena cahaya pada panjang gelombang (λ) tertentu akan menjadi oksidator yang memiliki kemampuan untuk mendegradasi polutan organik menjadi senyawa yang lebih sederhana [10].
Lempung bentonit merupakan lempung yang mengandung 85% montmorillonit. Montmorillonit merupakan suatu mineral yang bersifat unik karena memiliki kemampuan mengembang (swelling), kapasitas tukar kation, dan dapat diinterkalasi [11]. Bentonit digunakan sebagai material paduan karena merupakan nanoreinforcement yang memiliki lapisan-lapisan berukuran nano [12].
Bentonit dapat dimodifikasi dengan meletakkan suatu spesies partikel yang berukuran nano diantara dua lembaran (pillared clay) yang saat ini sedang banyak dilakukan. Modifikasi lempung bentonit ini dapat meningkatkan luas permukaan. Komposit bentonit memiliki kapasitas adsorpsi terhadap senyawa anorganik dan logam-logam berat [13] dan kemampuan untuk mendegradasi warna melalui proses fotokatalisis [14].
Sisi aktif katalis dapat diperbanyak dengan penambahan pendukung pada katalis tersebut, yang biasa disebut metode impregnasi. Impregnasi dilakukan dengan cara mengadsorpsikan garam logam yang mengandung komponen aktif logam dalam larutan ke padatan bentonit. Dalam proses fotodegradasi, zat warna akan teradsorpsi pada suatu permukaan fotokatalis yang
akan mengalami degradasi dengan bantuan sinar UV. Namun, daya adsorpsi merupakan suatu kelemahan dari proses fotokatalisis maka diperlukan adsorben yang berupa lempung bentonit [15].
Proses interkalasi dilakukan dengan membuat Fe2O3 dalam bentuk senyawa kompleks antara ion Fe3+ (FeCl3) dengan Na2CO3 agar membentuk Fe2O3 yang dapat masuk ke ruang antarlapis lempung. Selanjutnya prekursor diimpregnasi dan dikalsinasi pada suhu 350°C [16].
Karakterisasi padatan dilakukan dengan difraksi sinar-X (XRD) untuk
mengidentifikasi fasa kristalin yang terbentuk, nanosizer/zetasizer dan SEM untuk menentukan ukuran dan muatan partikel dari fotokatalis yang terbentuk. Karakterisasi menggunakan FTIR untuk menentukan gugus fungsi.
-
2. PERCOBAAN
Bahan dan Peralatan
Bahan-bahan yang digunakan dalam penelitian ini meliputi: bahan-bahan yang berkualitas pro analisis (p.a) yang meliputi: remazol brilliant blue, lempung bentonit, 0,1 M larutan FeCl3, methylene blue, 1 M larutan HCl, 0,1 N larutan AgNO3, 0,1 M larutan NaCl, serbuk Na2CO3, aqua demineralisasi (aqua DM), dan pH universal.
Peralatan yang digunakan dalam penelitian ini meliputi gelas beker, gelas ukur, timbangan analitik, magnetic stirrer, batang pengaduk, hot plate, tanur, pipet tetes, plastik hitam, kotak radiasi, oven, pengayak 106 µm, cawan porselin serta mortar, dan lampu Philips. Alat Fourier Transform Infra Red (FTIR), X-Ray Diffraction (XRD), Scanning Electron Microscopy (SEM), dan
Nanosizer/zetasizer.
Fotokatalis dibuat dengan
melarutkan 70 gram bentonit (Na-Bentonit)
yang telah diaktivasi dalam 500 mL aqua DM dan diaduk selama 3 jam sehingga membentuk suspensi yang homogen. Pada wadah lain, dibuat larutan pemilar 500 mL FeCl3 0,2 M. Ditambahkan Na2CO3 sedikit demi sedikit ke dalam larutan pemilar sambil diaduk selama 3 jam. Dicampurkan larutan pemilar tersebut ke dalam suspensi bentonit dan diaduk selama 3 jam. Selanjutnya didiamkan selama 48 jam Kemudian bentonit dicuci dengan aqua DM berkali-kali sampai pH 7. Endapan dikeringkan dalam oven pada temperatur 120oC selama semalam. Setelah kering padatan digerus dan diayak dengan pengayak ukuran 106 µm. Selanjutnya serbuk dikalsinasi pada suhu 3500C selama 4 jam. Terakhir, bentonit digerus pelan-pelan hingga menjadi bubuk halus dan diayak dengan pengayak 106 µm. Hasil kemudian dikarakterisasi menggunakan XRD, FTIR, Nanosizer/zetasizer, dan SEM.
Metode methylene blue digunakan untuk mengukur luas permukaan dengan adsorpsi methylene blue 200 ppm selama 5, 10, 15, 20, 40, dan 60 menit dengan 0,1 gram fotokatalis sambil diaduk dengan magnetic stirrer.
Penentuan Massa Fotokatalis Optimum Penentuan konsentrasi fotokatalis optimum dilakukan dengan memvariasikan massa fotokatalis sebanyak 50, 100, 150, 200, 250, dan 300 mg untuk mendegradasi larutan zat warna 200 ppm. Diirradiasi dengan lampu UV selama 5 jam, sambil diaduk dengan magnetic stirrer.
Penentuan pH Optimum Fotodegradasi
Penentuan pH optimum dilakukan dengan memvariasikan pH larutan zat warna 200 ppm pada pH 1, 2, 3, 4, 5, 6, 7, 8, 9, dan 10 untuk degradasi dengan massa fotokatalis 100 mg. Diirradiasi dengan lampu UV selama 5 jam, sambil diaduk dengan magnetic stirrer.
Penentuan Waktu Irradiasi Optimum
Penentuan waktu irradiasi optimum dilakukan dengan mendegradasi larutan zat warna 200 ppm pada pH 4, massa fotokatalis 100 mg untuk mendegradasi larutan zat warna 200 ppm. Diirradiasi dengan lampu UV dengan variasi waktu 1, 2, 3, 4, 5, dan 6 jam sambil diaduk dengan magnetic stirrer.
Penentuan Konsentrasi Zat Warna Optimum
Penentuan konsentrasi zat warna optimum dilakukan dengan mendegradasi larutan zat warna 50, 100, 150, 200, 250, dan 300 ppm pada massa fotokatalis 100 mg, pH 4, waktu optimum irradiasi 2 jam.
Penentuan Efektivitas Proses
Fotodegradasi
Efektivitas fotodegradasi dilakukan dengan menyiapkan sebanyak 3 buah gelas beker 250 mL yang telah dibungkus plastik hitam dan diisi 25,00 mL larutan remazol brilliant blue 200 ppm. Ke dalam gelas beker ditambahkan 100 mg fotokatalis bentonit-Fe2O3 dan diatur agar pH campuran 4. Selanjutnya, campuran diirradiasi sinar UV sambil diaduk dengan magnetic stirrer selama 2 jam.
Dalam semua proses, konsentrasi zat warna yang tidak terdegradasi ditentukan dengan mengukur absorbansi filtrat setelah campuran hasil fotodegradasi disaring. Konsentrasi ditrntukan dengan metode kalibrasi Kemudian konsentrasi remazol brilliant blue dimasukkan ke dalam rumus persentase degradasi (%D) dengan persamaan sebagai berikut:
Co-Ct
% D =
Co
Co = konsentrasi awal remazol brilliant blue
Ct = konsentrasi remazol brilliant blue setelah degradasi
-
3. HASIL dan PEMBAHASAN
Fotokatalis Bentonit-Fe2O3
Fotokatalis bentonit-Fe2O3 dibuat dengan mencampur bentonit alam dan larutan pemilar besi (III) klorida (FeCl3) dengan bubuk natrium karbonat (Na2CO3). Reaksi yang terjadi adalah:
2FeCl3 + 3Na2CO3 ÷ 6NaCl + Fe2(CO3)3
Endapan besi karbonat yang terbentuk dikeringkan dalam oven pada suhu 1200C selama 24 jam. Setelah kering, diayak dalam ayakan 106 µm. Selanjutnya dikalsinasi pada suhu 3500C selama 4 jam untuk merubah besi karbonat menjadi komposit Fe2O3, dengan reaksi sebagai berikut [17]:
Fe2(CO3)3 ÷ Fe2O3 + 3 CO2
Kristalinitas Bentonit-Fe2O3
Difraktogram XRD bentonit-Fe2O3 (Gambar 1) memperlihatkan puncak-puncak yang mempunyai intensitas tinggi sehingga sudah dapat dikatakan fasa kristalin. Intensitas dari difraksi sinar X mengindikasikan kesempurnaan kristal dan kerapatan susunan atom dalam kristal. Semakin runcing dan tinggi refleksi intensitas suatu material maka kristalitasnya semakin baik dan susunannya semakin rapat.
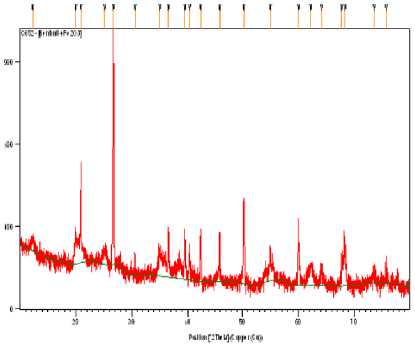
Gambar 1. Difraktogram bentonit-Fe2O3
Bentonit mempunyai ukuran yang lebih kecil dibandingkan dengan bentonit-Fe2O3, namun perbedaannya tidak signifikan (Tabel 1).
Tabel 1. Analisis Bentonit dan Bentonit-
Fe2O3 dengan Nanosizer/zetasizer
Bilangan gelombang 435,91 cm-1
merupakan vibrasi Fe-O (Gambar 3).
Nama sampel Hasil Analisis
PSA Zeta
(nm) Potensial(mV)
Bentonit 2707,6 -43,2
Bentonit- Fe2O3 2726,9 -80,5

Pengukuran zeta potensial menunjukkan permukaan bentonit dan bentonit-Fe2O3 bermuatan negatif. Namun, bentonit-Fe2O3 menunjukkan muatan yang lebih negatif daripada bentonit. Muatan negatif yang besar dari bentonit-Fe2O3 ini kurang efisien untuk mendegradasi zat warna remazol brilliant blue yang bermuatan negatif, sehingga diperlukan pengaturan pH agar proses degradasinya lebih efektif. Pada pH 4 permukaan fotokatalis Fe2O3 bermuatan positif dan warna remazol brilliant blue bermuatan negatif. Remazol brilliant blue yang bermuatan negatif akan lebih mudah teradsorpsi pada permukaan Fe2O3 yang bermuatan positif. Adsorpsi remazol brilliant blue menjadi meningkat dengan adanya interaksi elektrostatik antara Remazol brilliant blue dengan Fe2O3.
Morfologi Partikel Bentonit-Fe2O3
Hasil SEM pada perbesaran 1000 kali ini menunjukkan ukuran kristal dari bentonit-Fe2O3 hampir homogen. Pada perbesaran 50.000 kali bentonit-Fe2O3 mempunyai porositas yang cukup besar yang ditunjukkan oleh adanya cekungan yang berwarna hitam yang mengindikasikan bagian dari pori yang lebih besar (Gambar 2).
Karakterisasi dengan FTIR
Karakteristik vibrasi yang dimiliki oleh fotokatalis bentonit-Fe2O3 yaitu pada bilangan gelombang. 3622,32-3695,61 cm-1 yang merupakan serapan dari -OH (stretching). Pada bilangan 1111,0 cm-1 adalah serapan dari Si-O-Si (stretching), dan 928,12 cm-1 merupakan vibrasi Al-O.

Gambar 2. SEM perbesaran 1000 (atas) dan
50.000 kali (bawah)
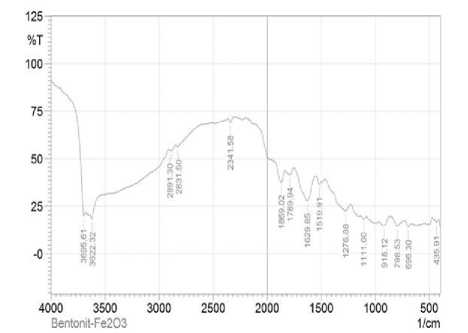
Gambar 3 . Spektra FTIR bentonit-Fe2O3
Luas Permukaan
Luas permukaan pada penelitian ini ditentukan dengan metode methylene blue. Luas permukaan rata-rata bentonit-Fe2O3 adalah 185,1109 m2/g. Luas permukaan suatu adsorben dipengaruhi oleh beberapa faktor yang meliputi: ukuran pori, letak pori, dan bentuk pori. Luas permukaan pori ini mewakili luas permukaan aktif dari pori yang bisa bereaksi dengan reaktan.
Hasil penelitian ini menunjukkan bahwa bentonit-Fe2O3 memiliki luas permukaan yang lebih besar daripada hasil penelitian Dewi dkk. [9] yang menunjukkan hasil pengukuran adsorben bentonit sebesar 47,6473 m2/g dan
adsorben bentonit dengan modifikasi Fe2O3 sebesar 47,8140 m2/g. Hal ini mungkin karena fotokatalis hasil penelitian mempunyai jumlah pori lebih banyak yang menyebabkan luas permukaannya lebih besar.
Massa Fotokatalis Bentonit-Fe2O3 Optimum
Gambar 4 menunjukkan bahwa penggunaan fotokatalis yang meningkat dari 50 mg ke 100 mg menghasilkan peningkatan persentase degradasi remazol brilliant blue. Persentase degradasi zat warna remazol brilliant blue terbesar terjadi pada saat penambahan fotokatalis sebanyak 100 mg. Massa fotokatalis diatas 100 mg justru menurunkan persentase degradasi. Kondisi ini menandakan penambahan jumlah fotokatalis yang melebihi kondisi optimum 100 mg tidak efektif dalam membentuk radikal hidroksil dan ion superoksida karena fotokatalis tidak mendapatkan penyinaran UV sepenuhnya yang menyebabkan semakin banyak fotokatalis yang tersuspensi.
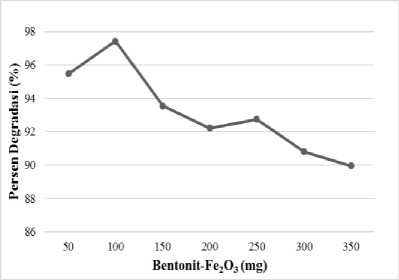
Gambar 4. Pengaruh massa fotokatalis bentonit-Fe2O3 terhadap persentase degradasi (%).
pH Optimum Fotodegradasi Remazol Brilliant Blue
Pada Gambar 5, terlihat bahwa persentase degradasi larutan remazol brilliant blue mencapai maksimum pada pH 4 dengan persentase degradasi rata-rata sebesar 97,03%. Persentase degradasi pada pH 1 sampai dengan 3 cenderung konstan, sedangkan pada pH diatas 4 cenderung
menurun. Remazol brilliant blue lebih mudah terdegradasi pada pH asam daripada pH basa. Hal ini karena zat warna remazol brilliant blue bermuatan negatif, sedangkan permukaan fotokatalis Fe2O3 bermuatan positif pada pH asam sehingga kontak antara keduanya dapat terjadi, yang berakibat terdegradasinya zat warna tersebut
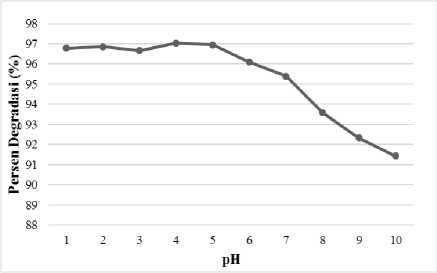
Gambar 5. Pengaruh pH larutan terhadap persentase degradasi (%).
Waktu Irradiasi Optimum
Hasil penelitian ini menunjukkan bahwa banyaknya remazol brilliant blue yang terdegradasi meningkat dari 1 jam ke 2 jam (Gambar 6). Hal ini disebabkan karena semakin lama waktu degradasi, maka semakin banyak kontak yang terjadi antara remazol brilliant blue dengan fotokatalis. Akibatnya, semakin banyak molekul remazol brilliant blue yang terdegradasi. Setelah mencapai diatas 2 jam, proses degradasi tergolong konstan. Hal ini membuktikan proses yangterjadi merupakan fotodegradasi karena tidak terjadinya desorpsi seirig penambahan waktu.
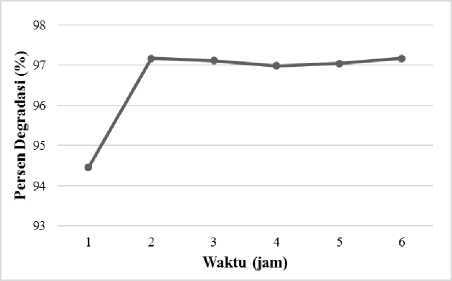
Gambar 6. Pengaruh lama irradiasi terhadap persentase degradasi (%).
Konsentrasi Optimum Remazol Brilliant Blue
Persentase degradasi secara optimum tercapai pada konsentrasi larutan 200 ppm, namun ketika konsentrasi larutan zat warna bertambah maka persentase degradasi menurun. Remazol brilliant blue pada konsentrasi lebih tinggi memiliki jumlah molekul yang lebih banyak, akibatnya molekul tersebut menutupi permukaan fotokatalis. Tertutupnya permukaan fotokatalis menyebabkan kurangnya pembentukan pasangan hole (h+vb) dan elektron (e-) sehingga OH radikal (•OH) dan radikal superoksida (•O2-) yang berfungsi untuk mereduksi dan mengoksidasi zat warna.
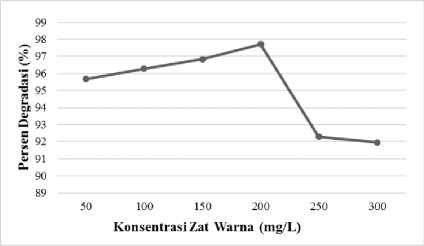
Gambar 7. Pengaruh konsentrasi zat warna
remazol brilliant blue terhadap persentase degradasi (%)
Efektivitas Fotodegradasi Remazol Brilliant Blue
Tabel. 2. Efektivitas Degdradasi dengan
|
Material |
Degradasi rata-rata dengan sinar UV (%) |
Degradasi rata-rata tanpa sinar UV (%) |
|
Bentonit |
46,56 ± 0,8094 |
45,37 ± 0,0812 |
|
Fe2O3 |
63,40 ± 0,6917 |
1,06 ± 0,0050 |
|
Bentonit- | ||
|
Fe2O3 |
98,20 ± 0,0676 |
47,20 ± 0,2408 |
dan Tanpa UV
Berdasarkan Tabel 2. dapat diketahui persentase degradasi (%) remazol brilliant blue dengan bentonit, katalis
Fe2O3, dan bentonit-Fe2O3 pada kondisi optimumnya yang dilakukan dengan cahaya dan tanpa cahaya. Pada kondisi dikenai cahaya, fotokatalis bentonit-Fe2O3 lebih efektif dalam mendegradasi larutan remazol brilliant blue blue pada 200 ppm. Hal ini sangat efektif untuk diaplikasikan dalam pengolahan limbah zat warna tekstil yang biasanya mengandung polutan seperti zat warna dengan konsentrasi tinggi. Jika dibandingkan, bentonit menghasilkan persentase degradasi rata-rata 46,56%, katalis Fe2O3 sebesar 63,40% dan fotokatalis bentonit-Fe2O3 sebesar 98,20%. Fotokatalis bentonit-Fe2O3 mempunyai kemampuan mendegradasi zat warna paling efektif mengacu pada Keputusan Menteri Lingkungan Hidup yaitu Kep-51/MENLH/10/1995 tentang baku mutu limbah cair, konsentrasi warna cair maksimum yang diperbolehkan yaitu 5-10 mg/L.
Pada kondisi dengan cahaya, bentonit murni menghasilkan persentase degradasi yang rendah karena hanya terjadi proses adsorbsi dan suatu saat jika dalam keadaan jenuh akan terjadi desorbsi. Katalis Fe2O3 mempunyai kemampuan mendegradasi yang lebih tinggi karena berfungsi sebagai katalis yang mempercepat reaksi redoks sehingga kontak antara zat warna dengan katalis tersebut besar. Fotokatalis bentonit-Fe2O3 memberikan persentase degradasi paling tinggi yang membuktikan terjadinya proses degradasi. Zat warna yang telah masuk ke dalam fotokatalis bentonit-Fe2O3 akan didegradasi oleh radikal hidroksil sehingga dihasilkan CO2, H2O, dan asam mineral. Hal inilah yang membedakan proses adsorbsi dan degradasi. Pada degradasi dihasilkan CO2, H2O, dan asam mineral sehingga tidak akan mengalami desorbsi. Terjadinya degradasi diperkuat dengan turunnya pH suspensi dari 4 menjadi 3, yang mengindikasikan terbentuknya asam mineral.
Pada kondisi tanpa cahaya, bentonit murni dapat menurunkan konsentrasi zat warna sebesar 45,37%, Fe2O3 sebesar
1,06%, dan bentonit-Fe2O3 sebesar 47,20%. Perbedaan persentase degradasi yang besar antara proses dengan dan tanpa radiasi ini membuktikan bahwa pada proses tanpa cahaya tidak terjadi degradasi, melainkan hanya adsorbsi. Penurunan konsentrasi oleh bentonit-Fe2O3 hampir sama dengan bentonit murni. Hal ini karena yang Fe2O3 telah masuk ke dalam bentonit tidak aktif sebagai fotokatalis pada keadaan tanpa cahaya sehingga hanya mempunyai kemampuan adsorbsi seperti bentonit murni. Sedangkan Fe2O3 merupakan suatu katalis sehingga tidak mempunyai kemampuan adsorpsi. Uji menggunakan pH universal juga tidak menunjukkan penurunan pH diakhir proses adsorbsi, yang menguatkan dugaan tidak terjadinya degradasi.
Berdasarkan penelitian yang telah dilakukan, maka diperoleh simpulan sebagai berikut: Persentase fotodegradasi paling optimum diperoleh pada massa bentonit-Fe2O3 100 mg, pH 4, waktu radiasi 2 jam, dan konsentrasi zat warna 200 ppm. Fotodegradasi menggunakan fotokatalis bentonit-Fe2O3 dengan sinar UV pada kondisi optimumnya dapat mendegradasi zat warna remazol brilliant blue sebesar 98,20%
Penulis mengucapkan terima kasih kepada Laboratorium Penelitian Kimia Universitas Udayana atas fasilitas yang telah diberikan, Ucapan terima kasih juga disampaikan kepada Dr. Ir. I Gusti Ayu Kunti Sri Panca Dewi, M.Si., I Nengah Simpen, S. Si., M. Si., dan A.A.I.A Mayun Laksmiwati, S.Si., M. Si., yang telah memberikan saran untuk perbaikan dan penyempurnaan penelitian ini
-
[1] Fayazi M., Taher M. A., Afzali D., and Mostafani, A. Enhanced Fenton Like Degradation of Methylene Blue
by Magnetically Activated
Carbon/Hidrogen Peroxide with Hidroxylamine as Fenton Enhancer. Journal of Molecular Liquids, 2016, 216, 751-787.
-
[2] Romiyati. Sintesis dan Karakterisasi Nanokatalis Ni(1X)VxFe2O4 sebagai Fotokatalis pada Fotodegradasi. M.Si. Tesis, Universitas Lampung, 2016.
-
[3] Sumarni. Adsorpsi Zat Warna dan Zat Padat Tersuspensi dalam Limbah Cair Batik. Prosiding : Seminar Nasional Aplikasi Sains dan Teknologi. Yogyakarta, 2012.
-
[4] Kamalia, L. Adsorpsi Zat Warna Methyl Orange Menggunakan Zeolit dari Abu Dasar Batubara. S.Si. Skripsi, UIN Sunan Kalijaga, 2013.
-
[5] Carliell C. M., Barclay S. J., Bucley C. A., Mulholland D. A., and Senior E. Microbial Decolorizaton of Reactiv Red Dye Under Anaerobic Condition. Water SA, 1995, 211, 6169
-
[6] Indragini. Degradasi 4,4-Dikloro Bifenil dengan Kombinasi Proses Fotokatalis dan Radiasi Gamma Menggunakan Nanokomposit Karbon Aktif Zeolit Alam TiO2. M.Si. Tesis, Universitas Indonesia, 2011
-
[7] Cristiana M., Mu’nisatun, Saptaaji R., dan Marjanto D. Studi Pendahuluan Mengenai Degradasi Zat Warna Azo dalam Pelarut Air Menggunakan Mesin Bekas Elektron 350 keV/10m. Sekolah Tinggi Teknologi Nuklir. 2005.
-
[8] Alinsafi A. F., Aveou E. M., Abdulkarim M. N., Pons O., Zahraa A.B., and Nejmeddine A. Treatment of Textile Industry Wastewater by Supported Photocatalysis. Dyes and Pigments, 2006, 72(2), 439-445
-
[9] Dewi M. A., Suprihatin I. E., dan Sibarani J. Fotodegradasi Zat Warna Remazol Brilliant Blue dengan Bentonit Terimpregnasi Fe2O3. Jurnal Kimia, 2017, 11(1), 82-87.
-
[10] Wijaya K., Sugiharto E., Fatimah I., Sudiono S., dan Kurniaysih D. Utilisasi TiO2-Zeolit dan Sinar UV untuk Fotodegradasi Zat Warna Congo Red. Berkala MIPA, 2006, 3, 27-35.
-
[11] Widihati I. A. G. Adsorpsi Ion Pb oleh Lempung Terinterkalasi Surfaktan, Jurnal Kimia, 2012, 3(1), 27-32.
-
[12] Dhena R, B., Rudi H., Santos, Pengaruh Komposisi Montmorillonit pada Pembuatan Polipropilen-Nanokomposit terhadap Kekuatan Tarik dan Kekerasannya, Seminar Nasional Teknik Kimia, 2011.
-
[13] Permanasari A., Della, dan Zackiyah. Adsorpsi Simultan Kitosan-Bentonit Terhadap Ion Logam dan Residu Pestisida dalam Air Minum dengan Teknik Batch. Seminar Nasional Kimia dan Pendidikan Kimia Universitas Negeri Yogyakarta. 2011.
-
[14] Ika M., dan Datin F. U. Pemanfaatan Bentonit sebagai Penjernih Minyak Pelumas Bekas Hasil Proses Daur Ulang dengan Batubara. Jurnal Bahan Galian Industri, 2008, 12(33), 17-21.
-
[15] Fisli Adel. Adsorben Nanokomposit Oksida Besi-Bentonit untuk
Pengolahan Limbah Nuklir dan Non-Nuklir. Pusat Teknologi Bahan Industri Nuklir BATAN. 2008.
-
[16] Feng J., Hu X., and Yue P.L. Novel Bentonite Clay-Based Fe-
Nanocompositas a Heterogeneous Catalyst for Photo-Fenton
Discoloration and Mineralization of Orange II. Environmental Sience and Technology Journal. 2004, 38(1),
269-275.
-
[17] Jazi F. S., Parvina N., Rabiei M., Tahriri M., Shabestari Z. M., and Azadmehr A. R. The Effect of The Synthesis Route on The Grain Size and Morphology of ZnO/Ag Nanocomposite. Journal of Ceramic Processing Research, 2012, 13(5),
523-526.
54
Discussion and feedback