ISOLASI DAN IDENTIFIKASI SENYAWA ANTIOKSIDAN GOLONGAN FLAVONOID DARI EKSTRAK ETIL ASETAT DAUN PRANAJIWA (Euchresta horsfieldii Lesch Benn.)
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 5, Nomor 1, Juli 2017
ISOLASI DAN IDENTIFIKASI SENYAWA ANTIOKSIDAN GOLONGAN FLAVONOID DARI EKSTRAK ETIL ASETAT DAUN PRANAJIWA (Euchresta horsfieldii Lesch Benn.)
Ni Wayan Rika Kumara Dewi1*, I Wayan Gunawan1,2, Ni Made Puspawati1,2
1Magister Kimia Terapan, Pascasarjana Universitas Udayana, Jl. PB. Sudirman, Denpasar, Indonesia 2Jurusan Kimia FMIPA, Universitas Udayana, Bukit Jimbaran, Denpasar, Telp (0361)703137, Indonesia *E-mail: rikakumara87@gmail.com
ABSTRAK: Penelitian ini bertujuan untuk menentukan aktivitas antioksidan dan mengidentifikasi senyawa golongan flavonoid yang terkandung dalam ekstrak etil asetat daun pranajiwa (Euchresta horsfieldii Lesch Benn.). Uji aktivitas antioksidan dilakukan secara invitro dengan metode DPPH (1,1-diphenyl-2-pycrylhidrazyl). Teknik pemisahan dilakukan dengan kromatografi kolom dan diidentifikasi dengan spektrofotometer FTIR dan UV-Vis. Hasil penelitian menunjukkan bahwa ekstrak etil asetat memiliki aktivitas antioksidan dengan nilai IC50 sebesar 393,95 µg/mL dan kadar total flavonoid sebesar 6619,72 mg QE/100g atau 6,62 % QE. Pemisahan dan pemurnian ekstrak etil asetat menggunakan fase diam silika gel 60 dan fase gerak n-heksana:kloroform: etanol (20:1:1) yang menghasilkan isolat aktif yang positif flavonoid (isolat FE) yang diduga merupakan senyawa flavonoid golongan flavonol yaitu 3,5,7,3’,4’-pentahidroksi flavonol.
Kata kunci : Eucresta horsfieldii Lesch Benn., antioksidan, flavonol
ABSTRACT: The present study was conducted to determine antioxidant activity and to identify the flavonoid active compounds from ethyl acetate extracts of Pranajiwa leaves. In vitro antioxidant activity was carried out using DPPH (1,1-diphenyl-2-pycrylhidrazyl) method. The separation of the ethyl acetate extracts was conducted by column chromatography and the identification by using FTIR and UV-Vis spectrophotometer. The results showed that ethyl acetate extract has antioxidant activity with IC50 value of 393,95 µg/mL and the total flavonoid of 6619,72 mg QE /100g or 6,62% QE. The separation and purification of ethyl acetate extract was chromatography column on silica gel 60 and the solvent n-hexane:chloroform:ethanol (20:1:1) based on UV-Vis and Infrared spectra positive flavonoid isolate (isolates FE) was tentaviely identified as 3,5,7,3',4'-pentadihydroxy flavonols.
Keywords: Eucresta horsfieldii Lesch Benn., antioxidant, flavonols
Indonesia adalah salah satu negara yang beriklim tropis, sehingga berbagai jenis tumbuhan dapat hidup dan berkembang. Berbagai jenis tumbuhan tersebut diketahui memiliki khasiat sebagai obat tradisional. Tumbuhan Pranajiwa (Euchresta horsfieldii Lesch Benn.) merupakan salah satu tumbuhan tradisional yang digunakan untuk obat kencing manis, obat asma, obat batuk, afrodisiak, dan merangsang muntah akibat keracunan makanan [1]. Akar dan batang tumbuhan pranajiwa mengandung flavonoid, isoflavon, pterocarpan, caumaronochromon dan flavonon. Jenis flavonoid yang terdapat pada daun adalah apigenin. Bijinya mengandung alkaloid berupa cytosine (1,5%), matrine dan matrine-N-oxide [2,3]. Senyawa golongan flavonoid merupakan salah satu jenis senyawa yang memiliki aktivitas antioksidan. Flavonoid berpotensi sebagai antioksidan karena mampu menyumbangkan ion H+ pada senyawa radikal bebas [4].
Hal ini di dukung oleh beberapa hasil penelitian yaitu pada fraksi n-butanol terong belanda memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 69,89 mg/L. Fraksi n-butanol tersebut diduga mengandung senyawa flavonoid golongan flavon, flavonol, dan isoflavon yang mungkin berkontribusi sebagai antioksidan alami [5].
Isolat aktif ekstrak n-heksana daun pranajiwa pada konsentrasi 8000 ppm, diketahui memiliki aktivitas antiradikal bebas dengan persentase peredaman sebesar 94,67% [6]. Selain itu diketahui pada ekstrak n-heksana daun pranajiwa memiliki kapasitas antioksidan sebesar 126,94 ppm GAEAC (Garlic Acid Equivalent Antioxidant Capacity) [7].
Berdasarkan beberapa penelitian tersebut, dapat dinyatakan daun pranajiwa merupakan salah satu sumber antioksidan, akan tetapi belum ada penelitian yang melaporkan kandungan flavonoid pada ekstrak etil asetat daun pranajiwa serta kontribusinya sebagai antioksidan.
Penelitian ini bertujuan untuk menentukan aktivitas antioksidan dan mengidentifikasi senyawa golongan flavonoid yang terkandung dalam ekstrak etil asetat daun pranajiwa.
-
2. PERCOBAAN
Bahan dan Peralatan
Bahan yang digunakan dalam penelitian ini adalah daun pranajiwa (Euchresta horsfieldii Lesch Benn.) yang diperoleh dari Bukit Tapak, Bedugul, Tabanan. Bahan-bahan yang digunakan untuk analisis adalah kristal DPPH (1,1-diphenyl-2-pycrylhidrazyl), n-heksana, etil asetat, asam klorida pekat, kloroform, etanol, asam sulfat pekat, asetat anhidrat, pereaksi Wagner, pereaksi Meyer, FeCl3, natrium hiroksida, aluminium klorida, serbuk magnesium, kuersetin, asam galat, dan akuades.
Alat-alat yang digunakan adalah seperangkat peralatan gelas, rotary vacuum evaporator, spektrofotometer UV-Vis Double Beam Shimadzu/UV-1800, spektrofotometer UV-Vis Thermo Scientific Genesys 10S, dan spektrofotometer FTIR Shimadzu/IR Prestige-21.
Ekstraksi
Sebanyak 2,5 kg daun pranajiwa dicuci dan dipotong kecil-kecil, selanjutnya kemudian dikering anginkan selama ± 5 hari. Sampel yang sudah kering tersebut dihaluskan sehingga diperoleh bahan dalam bentuk serbuk. Serbuk tersebut dimaserasi dengan pelarut n-heksana selama 48 jam dan dimaserasi lagi sebanyak lima kali, sehingga diperoleh ekstrak kental n-heksana. Ekstrak kemudian disaring dan filtratnya kemudian dipekatkan dengan rotary evapotarator pada temperatur 45ºC sehingga diperoleh ekstrak kental n-heksana. Ampas dari hasil maserasi tersebut kembali dimaserasi dengan etil asetat sehingga diperoleh juga ekstrak kental etil asetat. Setelah diperoleh ekstrak
kental, dilakukan uji fitokimia untuk mengetahui kandungan metabolit sekunder yang terdapat dalam ekstrak kental etil asetat. Jika ekstrak kental etil asetat positif mengandung flavonoid, maka dilanjutkan dengan penentuan kandungan total flavonoid.
Pengukuran Total Flavonoid
Kandungan total flavonoid ditentukan dengan metode kolorimetri dengan aluminium klorida. Sebanyak 1 mg standar kuersetin dilarutkan dalam labu ukur 10 mL dengan etanol sampai tanda batas. Selanjutnya dibuat larutan seri dengan konsentrasi 1; 2; 4; 8; dan 10 ppm. Larutan baku standar kuersetin 100 ppm dipipet masing-masing 10; 20; 40; 80; 100 µL. Sebanyak 5,23 mg ekstrak kental etil asetat daun pranajiwa ditimbang dan dilarutkan dengan etanol dalam labu ukur 10 mL sampai tanda batas. Larutan tersebut selanjutnya dikocok dan disaring. Masing-masing larutan seri standar kuersetin dan sampel diambil sebanyak 2 mL selanjutnya ditambahkan dengan 2 mL aluminium klorida 2 % yang telah dilarutkan dengan etanol. Campuran larutan tersebut selanjutnya divortex selama 20 menit dan diinkubasi selama 24 menit. Absorbansi dari campuran larutan tersebut kemudian diukur pada panjang gelombang 415 nm. Pengukuran dilakukan sebanyak tiga kali [8].
Pengukuran Aktivitas Antioksidan dengan DPPH
Uji aktivitas antioksidan menggunakan asam galat sehingga satuan pengukuran dinyatakan sebagai GAEAC (Gallic Acid Equivalent Antioxidant Capacity). Untuk melakukan penentuan kadar kapasitas antioksidan dari ekstrak etil asetat yang diuji, dilakukan melalui pembuatan kurva standar asam galat, dengan melakukan pengukuran absorbansi dari larutan standar DPPH dengan beberapa seri konsentrasi yaitu 0, 2, 4, 6, 8, dan 10 mg/L. Sampel dan standar asam galat masing-masing sebanyak 0,5 mL ditambahkan 3,5 mL
larutan pereaksi DPPH, divortex agar homogen. Didiamkan selama 30 menit kemudian dibaca serapan aktivitasnya pada panjang gelombang 517 nm. Asam galat digunakan sebagai baku pembanding [9].
Pemisahan dan Pemurnian
Pemisahan dan pemurnian senyawa flavonoid dapat dilakukan dengan menggunakan Kromatografi Lapis Tipis dan Kromatografi kolom sampai diperoleh isolat yang positif flavonoid dan relatif murni. Eluen yang digunakan pada kromatografi kolom adalah n-heksana : kloroform : etanol (20:1:1).
Identifikasi Senyawa Flavonoid
Hasil isolat yang didapatkan dari kromatografi kolom dianalisis dan diidentifikasi menggunakan spektrofoto-meter ultra violet-visible dengan penambahan pereaksi geser dan dilakukan identifikasi dengan menggunakan spektrofotometer FTIR.
-
3. HASIL DAN PEMBAHASAN
Ekstraksi
Dari 2,5 Kg daun pranajiwa diperoleh bahan dalam bentuk serbuk sebanyak 580 g. Serbuk tersebut dimaserasi sehingga diperoleh ekstrak kental n-heksana sebanyak 5,18 g. Ampas dari hasil maserasi tersebut kembali dimaserasi dengan etil asetat sehingga diperoleh juga ekstrak kental etil asetat sebanyak 13,16 g. Ekstrak kental etil asetat yang diperoleh memberikan hasil yang positif untuk senyawa golongan flavonoid, alkaloid, steroid, dan fenol.
Total Flavonoid
Hasil analisis terhadap larutan kuersetin menunjukkan kurva baku dengan persamaan regresi linear y = 0,080x + 0,017 dengan harga koefisien korelasi (R2) sebesar 0,997. Hasil pengukuran kandungan total flavonoid pada ekstrak etil asetat daun pranajiwa sebesar 6619,72 mg/100 g QE. Kandungan flavonoid total
dalam tumbuhan dinyatakan dalam QE (quercetin equivalent) yaitu jumlah kesetaraan milligram kuersetin dalam 1 gram ekstrak. Analisis kandungan total flavonoid dihitung sebagai ekuivalen kuersetin dalam % (b/b) sebesar 6,62 % yang berarti tiap 100 g ekstrak etil asetat daun pranajiwa mengandung 6,62 g kuersetin.
Aktivitas Antioksidan
Dari nilai pengukuran absorbansi larutan standar DPPH yang dilakukan, diperoleh hubungan yang berbanding terbalik antara konsentrasi dengan nilai absorbansi. Semakin besar konsentrasi larutan standar yang diukur, nilai absorbansi yang diperoleh semakin kecil. Absorbansi terbesar diperoleh dari larutan blanko yaitu pereaksi DPPH kemudian terjadi penurunan nilai absorbansi dengan semakin besarnya konsentrasi dari larutan standar DPPH yang diuji. Dari kurva standar dapat diketahui hubungan antara absorbansi dan konsentrasi, dan nilai persamaan koefisien regresi y = -0,064x + 0,891. Dari persamaan regresi linier ini kemudian ditentukan konsentrasi dari ekstrak kental etil asetat yang diuji yang nantinya digunakan dalam perhitungan dalam mencari nilai kapasitas antioksidan ekstrak (% GAEAC).
Kapasitas antioksidan menyatakan jumlah antioksidan yang terkandung dalam
suatu sampel. Parameter dalam penentuan kapasitas antioksidan adalah dengan menentukan besar daya hambat antioksidan terhadap radikal bebas yang dinyatakan dalam % IC50. Nilai IC50 ini dijadikan acuan untuk menentukan konsentrasi ekstrak yang diperlukan untuk dapat menangkap 50% radikal bebas. Hasil pengukuran kapasitas antioksidan pada ekstrak etil asetat daun pranajiwa yang diperoleh yaitu sebesar 1,961 % b/b GAEAC atau 19610 mg/100 g GAEAC.
Berdasarkan hasil pengukuran menunjukkan bahwa ekstrak etil asetat daun pranajiwa memiliki nilai IC50 sebesar
393,95 µg/mL, yang artinya dengan 393,95 µg/mL antioksidan telah mampu meredam 50% radikal DPPH. Berdasarkan studi literatur juga menyatakan bahwa suatu zat mempunyai sifat antioksidan bila nilai IC50 yang diperoleh berkisar antara 200-1000 μg/mL, dimana zat tersebut kurang aktif namun masih berpotensi sebagai zat antioksidan [10]. Aktivitas antioksidan ekstrak etil asetat daun pranajiwa tergolong lemah, hal ini kemungkinan disebabkan oleh senyawa tersebut masih belum murni, sehingga perlu dilakukan fraksinasi dan pemurnian dengan harapan agar didapat nilai IC50 dari senyawa spesifik yang memiliki aktivitas antioksidan yang lebih kuat. Adanya kandungan metabolit sekunder selain flavonoid kemungkin tidak memberikan respon sinergis sehingga aktivitas antioksidan yang dihasilkan lemah
Pemisahan dan Pemurnian
Pemisahan ekstrak kental etil asetat daun pranajiwa dilakukan dengan menggunakan kromatografi kolom dengan eluen n-heksana : kloroform : etanol (20:1:1) menghasilkan 100 fraksi yang selanjutnya diuji dengan kromatografi lapis tipis. Fraksi –fraksi yang menunjukkan noda dengan pola pemisahan yang sama digabungkan sehingga diperoleh 11 kelompok fraksi (FA, FB, FC, FD, FE, FF, FG, FH, FI, FJ, FK). Berdasarkan uji fitokimia, fraksi E menunjukkan positif flavonoid. Fraksi E diuji kemurnian secara kromatografi lapis tipis dengan berbagai eluen menunjukkan noda tunggal sehingga fraksi E dapat dinyatakan murni secara KLT dan dilanjutkan pada identifikasi dengan spektrofotometri UV-Vis dan IR.
Analisis Spektra Inframerah Isolat FE
Spektra yang dihasilkan oleh isolat FE menunjukkan adanya serapan-serapan yang khas untuk beberapa gugus fungsi, diantaranya adalah pada bilangan gelombang 3483,44-3221,12 cm-1 yang menunjukkan adanya serapan melebar
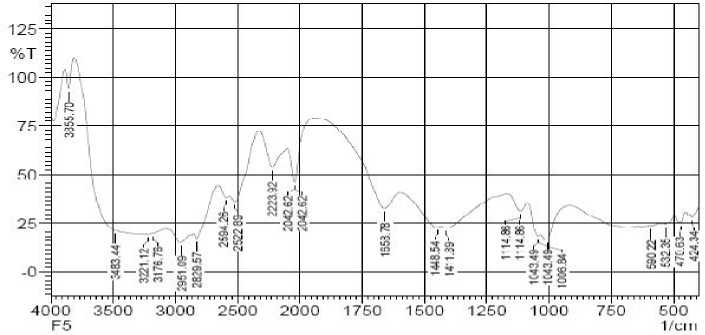
Gambar 3. Spektra FTIR isolat FE
sebagai vibrasi ulur –OH yang mendukung adanya senyawa flavonoid yang memiliki gugus OH bebas dan diperkuat dengan vibrasi tekuk C-O alkohol pada daerah 1114,86-1006,84 cm-1. Vibrasi pada bilangan gelombang 3176,76 cm-1 menunjukkan adanya serapan ulur C-H aromatik. Karakteristik lain yang mendukung adanya cincin aromatik ditunjukkan oleh serapan pada daerah bilangan gelombang 1658,78 cm-1 yang merupakan serapan dari regangan cincin C=C aromatik sebagai gugus kromofor yang khas dari flavonoid dalam sistem ikatan terkonjugasi. Hal ini diperkuat dengan adanya vibrasi pada 590,22-424,34 cm-1 yang menunjukkan adanya gugus C=C aromatik. Vibrasi pada 2951,09-2829,57 cm-1 menunjukkan adanya vibrasi CH alifatik stretching untuk gugus metil CH3 dan metilena CH2. Hal ini diperkuat dengan adanya vibrasi pada 1448,54-1411,89 cm-1 yang menunjukkan gugus CH alifatik. Pita serapan yang tajam pada daerah bilangan gelombang 1658,78 cm-1 dengan pita serapan yanga tajam juga menunjukkan adanya gugus C=O [20]. Hal ini didukung dengan penelitian mengenai isolasi dan identifikasi senyawa kaempferol pada daun jangkang (Homalocladium platycladum (F. Muell) Bailey) pada spektra inframerah menunjukkan adanya pita C=C dan C=O terlihat tumpang tindih di sekitar 1600,0 cm-1. Pita C=O yang muncul pada bilangan
gelombang yang rendah tersebut disebabkan karena resonansi pada struktur α,β–unsaturated carbonyl dan terbentuknya ikatan hidrogen intermolekuler [11].
Hasil uji konfirmasi dengan spektrofometer FTIR menunjukkan bahwa pada isolat FE terdapat vibrasi gugus –OH, C-H aromatik, C=C aromatik, C=O, C-O, dan C-H alifatik stretching. Hal tersebut memperkuat dugaan senyawa flavonoid golongan flavonol yaitu kaempferol atau kuersetin pada isolat FE.
Analisis Spektrum UV-Vis Isolat FE
Karakteristik isolat FE dengan spektrofotometer UV-Vis dengan pelarut etanol memberikan serapan maksimum pada panjang gelombang 269 nm (pita II) dan 362 nm (pita I). Serapan maksimum yang terjadi pada panjang gelombang yang ditunjukkan oleh pita II disebabkan oleh adanya transisi elektronik dari n – π* yang menunjukkan keberadaan gugus kromofor tunggal seperti ikatan C=O [12]. Sedangkan serapan maksimum yang terjadi pada panjang gelombang yang ditunjukkan oleh pita I disebabkan oleh adanya eksitasi elektron dari π – π* yang menunjukkan keberadaan gugus kromofor C=C terkonjugasi [13]. Berdasarkan studi literatur, senyawa yang memiliki spektrum UV-Vis pada pita II dengan rentang λmaks 250 – 280 nm dan pita I dengan λmaks 350 – 385 nm termasuk ke dalam golongan flavonol (3-OH bebas) [12]. Pola oksigenasi dari flavonoid dapat ditunjukkan dengan penambahan pereaksi geser pada isolat FE. Hasil pengukuran spektrum UV-Vis dari
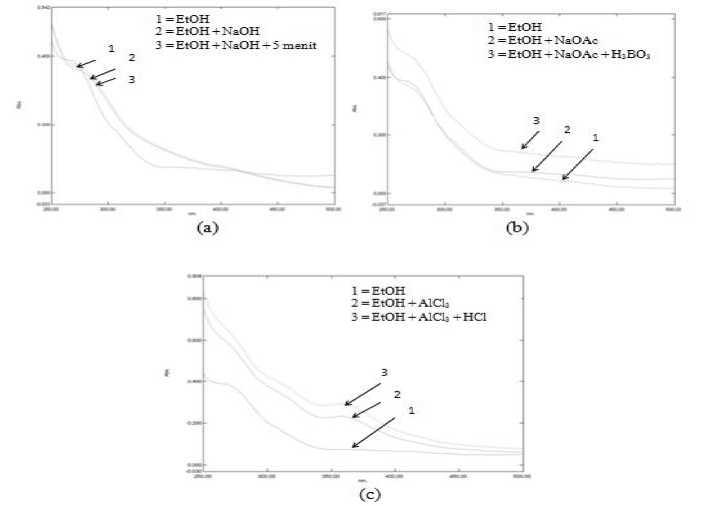
Gambar 2. Pergeseran spektrum UV-Vis pada isolat FE dengan penambahan pereaksi geser (a) NaOH dan NaOH+5 menit, (b) NaOAc dan NaOAc + H3BO3, dan (c) AlCl3 dan AlCl3 + HCl
isolat FE dengan penambahan pereaksi geser dapat dilihat pada Gambar 2.
Pereaksi geser natrium hidroksida (NaOH) merupakan basa kuat yang dipergunakan untuk mendeteksi adanya gugus hidroksi. Hasil penambahan pereaksi geser NaOH pada isolat FE menghasilkan pergeseran batokromik yang jelas pada pita I sebesar 44,4 nm, sedangkan pada pita II didapatkan pergeseran batokromik sebesar 7 nm. Adanya pergeseran batokromik pada pita I mengindikasikan adanya gugus hidroksi pada posisi atom C nomor 4’ pada cincin B, sedangkan pita II mengindikasikan adanya gugus hidroksi pada cincin A yaitu pada atom C nomor 7 [12]. Pergeseran panjang gelombang spektra UV-Vis isolat FE dapat dilihat pada Tabel 3.
Penambahan pereaksi NaOAc akan bereaksi dengan mengionisasi gugus hidroksil flavonoid yang paling tahan asam yaitu gugus 7-OH dan menyebabkan terjadinya pergeseran batokromik pada pita II, sedangkan penambahan H3BO3 (asam borat) akan menjembatani kedua gugus hidroksil pada gugus orto-dihidroksi
sehingga terbentuk kompleks borat. Dari penambahan pereaksi NaOAc dan NaOAc + H3BO3 pada isolat FE menunjukkan adanya pergeseran batokromik pada pita I sebesar 29,6 nm dan pita II sebesar 7,8 nm yang mengindikasikan adanya gugus 7-OH dan adanya gugus ortodihidroksi pada cincin B yaitu pada atom C-3’ dan C-4’ [12].
Penambahan pereaksi geser aluminium klorida (AlCl3) akan membentuk kompleks dengan gugus orto-dihidroksi maupun hidroksi keton. Sedangkan pada penambahan HCl akan mengakibatkan kompleks terurai kembali karena adanya Al tidak stabil yang terbentuk pada gugus orto-dihidroksi. Pada penambahan pereaksi aluminium klorida (AlCl3) menghasilkan pergeseran batokromik sebesar 0,8 nm pada pita II, selanjutnya pada penambahan pereaksi geser asam klorida (HCl) menunjukkan pergeseran batokromik sebesar 1,4 nm. Adanya pergeseran batokromik pada pita II setelah penambahan pereaksi AlCl3 + HCl sebesar 1,4 nm mengindikasikan adanya
Tabel 3. Pergeseran Panjang Gelombang Spektra UV-Vis Isolat FE
|
Pereaksi geser |
Panjang gelombang λmaks (nm) |
Geseran panjang gelombang λmaks (nm) |
Petunjuk penafsiran* | ||
|
Pita I |
Pita II |
Pita I |
Pita II | ||
|
Etanol |
362,00 |
269,00 |
- |
- |
Flavonol (3-OH bebas) |
|
Etanol + NaOH |
406,40 |
276,00 |
+44,4 |
+7 |
4’ –OH |
|
Etanol +NaOH + 5 menit |
406,40 |
276,00 |
+44,4 |
+7 | |
|
Etanol + NaOAc |
391,60 |
276,80 |
+29,6 |
+7,8 |
7 –OH |
|
Etanol + NaOAc + H3BO3 |
391,60 |
276,80 |
+29,6 |
+7,8 |
o-diOH pada cincin B |
|
Etanol + AlCl3 |
358,40 314,80 |
269,80 |
-3,6 -47,2 |
+0,8 |
o-diOH pada cincin B dan 5 –OH |
|
Etanol + AlCl3 + HCl |
355,60 |
270,40 |
-6,4 |
+1,4 | |
* (Markham, 1988 dan Mabry, 1970
gugus hidroksi pada cincin A yaitu pada C-5. Sedangkan pada pita I menghasilkan pergeseran hipsokromik sebesar 3,6 nm dan pita Ia sebesar 47,2 nm setelah penambahan pereaksi geser AlCl3 dan AlCl3+HCl. Hal ini menunjukkan adanya gugus ortodihidroksi pada cincin B [12, 14]. Berdasarkan hasil identifikasi isolat FE dengan spektrofotometer UV-Vis yang dikonfirmasi dengan hasil spektra FTIR serta penambahan pereaksi geser, dapat diduga kandungan senyawa flavonoid golongan flavonol. Isolat FE diduga mengandung senyawa flavonoid yaitu 3,5,7,3’,4’-pentahidroksi flavonol.
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa ekstrak etil asetat daun pranajiwa mengandung senyawa antioksidan golongan flavonoid yang diduga merupakan senyawa 3,5,7,3’,4’-pentahidroksi flavonol.
-
5. UCAPAN TERIMAKASIH
Pada kesempatan ini penulis menyampaikan terimakasih kepada bapak Dr. I Wayan Gede Gunawan, S.Si., M.Si., ibu Dra. Ni Made Puspawati, M.Phil., Ph.D, bapak Prof. Dr. Drs. I Made Dira Swantara, M.Si., bapak Dr. Drs. I Made Oka Adi Parwata, M.Si., dan Dr. Dra. Wiwik Susanah Rita, M.Si dan yang lainnya yang telah memberikan dukungan dan masukan dalam penelitian dan penulisan jurnal ini.
DAFTAR PUSTAKA
-
[1] Heyne, K. 1987. Tumbuhan Berguna Indonesia III. (Tjetjep Badan Penelitian dan Pengembangan Kehutanan Pentj). Jakarta: Yayasan Sarana Wana Jaya.
-
[2] Ardaka, I.M., Tirta, I.G., Dan Darma, I.D.P. 2011. Pengaruh Jumlah Ruas Dan Zat Pengatur Tumbuh Terhadap Pertumbuhan Stek Pranajiwa (Euchresta horsfieldii (Lesch.) Benn). Jurnal Penelitian Hutan Tanaman. 8(2): 81-87.
-
[3] Matsuura Nobuyasu, Iinuma Munekazu, Tanaka Toshiyuki. 1994. Phylogenetic Analysis in Genus Euchresta Based on Secondary Metabolites. Biochemical Systematic and Ecology. 22(6):621-629.
-
[4] Kandaswani, C. dan Middleton, E. 1997. Flavonoids as Antioxidant. In: Shahidi, F., editor. Natural Antioxidant Chemistry Health Effects and Applications. Champaign Illions: AOAC Press.
-
[5] Widayanti, N.P. 2015. “Identifikasi Fraksi Aktif Ekstrak N-Butanol Kulit Terong Belanda (Solanum betaceum Cav.) dan Uji Aktivitasnya Terhadap Superoksida Dismutase Pada Tikus Di Bawah Kondisi Stres” (tesis). Denpasar: Universitas Udayana.
-
[6] Sari, A. I., Gunawan, I W.G., dan Putra, K.G.D. 2015. Kapasitas
Antioksidan Senyawa Golongan
Triterpenoid Pada Daun Pranajiwa (Euchresta horsfieldii Lesch Benn). Jurnal Kimia 9 (1) : 61-66.
-
[7] Tirta, I.G., Ardaka, I.M., Dan Darma, I.D.P. 2010. Studi Fenologi Dan Senyawa Kimia Pronojiwo (Euchresta horsfieldii Lesch Benn). Bul. Littro. 21(1): 28 – 36.
-
[8] Chang, C., Yang, M. and Wen, H.C.J. 2002. Estimation of Total Flavonoid Content in Propolis by Two Complementary Colorinetric Methods. J.Food Drug Anal. 10: 178182.
-
[9] Almey, A., Khan A.J., Zahir S., Suleiman M., Aisyah, R.K. 2010. Total Phenolic Content and Primary Antioxidan Activity of Methanolic and Ethanolic Extract of Aromatic Plants’ Leaves. International Food Research Journal. 17:1077-1084. [10] Molyneux, P. 2004.The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. J. Sci. Technol. Songklanakarin. 26(2): 211219.
-
[11] Cut Nuria, M., Wahyono, dan Susidarti, R.A. 2011. Isolasi dan Identifikasi Kaempferol dari Daun Jangkang (Homalocladium
platycladum (F. Muell) Bailey) serta Aktivitas Antibakterinya. Farmasi Indonesia. UGM Yogyakarta, 22(1): 1–8
34

Discussion and feedback