FOTODEGRADASI RHODAMIN B MENGGUNAKAN ZnO/ UV/REAGEN FENTON
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 4, Nomor 1, Mei 2016
Il Ca⅛ra Il j fKimia ∣
FOTODEGRADASI RHODAMIN B MENGGUNAKAN ZnO/ UV/REAGEN FENTON
James Sibarani1.2, Dina Lindawati Purba1, Iryanti E. Suprihatin1, dan Manuntun Manurung2
-
1)Magister Kimia Terapan, Program Pascasarjana, Universitas Udayana, Denpasar-Bali, Indonesia
-
2)Jurusan Kimia FMIPA Universitas Udayana, Jimbaran, Badung-Bali, Indoneisa
ABSTRAK: Pada penelitian ini telah dipelajari pengaruh penambahan katalis ZnO, H2O2, dan Fe2+ terhadap fotodegradasi Rhodamin B. Penelitian ini meliputi penentuan jumlah ZnO, H2O2, FeSO4 dan pH dalam penentuan efektivitas fotodegradasi pada kondisi optimum. Hasil menunjukkan bahwa kondisi optimum yang diperoleh untuk mendegradasi larutan Rhodamin B 100 ppm yaitu 60 mg ZnO, 6 mL H2O2, 25 mg FeSO4 dan pH 4. Persentase degradasi tertinggi diperoleh pada sistem UV/ZnO/Reagen Fenton yaitu sebesar 91,55% dalam waktu degradasi 5 jam. Hasil penelitian menunjukkan bahwa semakin lama waktu irradiasi semakin banyak zat warna Rhodamin B yang terdegradasi. Pada penelitian ini waktu irradiasi optimum dicapai pada 5 jam.
Kata Kunci : Fotodegradasi, Rhodamin B, katalis ZnO, Reagen Fenton
ABSTRACT: The study about the effect of addition of ZnO, H2O2 and Fe2+ on photodegradation of Rhodamine B has been carried out. The research included the determination of optimum amount of ZnO, optimum concentration of H2O2, FeSO4, and pH. The effectiveness of the photodegradation on the optimum conditions was also determined. The results showed that the optimum conditions were 60 mg of ZnO, 6 mL of H2O2, 25 mg of FeSO4 and pH of 4. The highest percentage of photodegradation was 91,55% obtained in the system of UV/ZnO/Fenton with 5 hours irradiation. The result showed that increasing the irradiation time leads to the higher percentage of degradation of Rhodamine B. We found that the optimum irradiation time was 5 hours.
Keywords : Photodegradation, Rhodamine B, ZnO catalyst, Fenton
Tingkat pencemaran lingkungan dewasa ini semakin meningkat. Bahan-bahan pencemar utama bersumber dari senyawa-senyawa kimia yang dibuang ke lingkungan. Industri merupakan salah satu sumber dari limbah tersebut, karena masih banyak industri atau suatu pusat kegiatan yang membuang limbahnya langsung ke lingkungan sekitar melalui sungai, danau atau langsung ke laut, tanpa melalui proses pengolahan dan
penyaringan agar mempunyai kualitas yang sama dengan kualitas air lingkungan [1].
Dalam industri tekstil, Rhodamin B merupakan salah satu zat warna yang sering digunakan, karena harganya murah dan mudah diperoleh. Selain itu zat warna Rhodamin B sangat diperlukan juga dalam industri besar seperti industri kertas untuk menghasilkan warna kertas yang menarik.
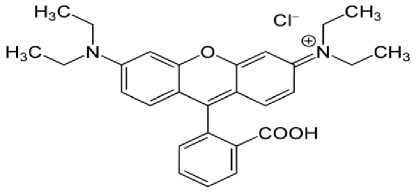
Gambar 1. Struktur Rhodamin B
Pengolahan limbah cair dengan menggunakan proses biologi juga banyak diterapkan untuk mereduksi senyawa organik dari limbah cair industri tekstil, namun efisiensi penghilangan warna melalui proses biologi ini seringkali tidak memuaskan, karena zat warna mempunyai sifat tahan terhadap degradasi biologi. Sebagai alternatif, dikembangkan metode fotodegradasi dengan menggunakan bahan fotokatalis dan radiasi sinar ultraviolet yang energinya sesuai atau lebih besar. Dengan metode fotodegradasi ini, zat warna akan diuraikan menjadi komponen-komponen yang lebih sederhana yang lebih aman untuk lingkungan [2]. Proses penghilangan zat warna limbah cair yang dihasilkan dari industri tekstil menjadi isu diskusi dan regulasi di seluruh dunia. Fotokatalisis menawarkan solusi terbaik untuk permasalahan tersebut [3].
Proses fotokatalisis memiliki beberapa keuntungan dibandingkan dengan proses oksidasi atau proses biologi. Fotokatalis yang digunakan dalam metode fotodegradasi merupakan semikonduktor seperti TiO2, Fe2O3, SnO2, ZnO, ZnS, CuS dan CeO2. Sebagian besar penelitian degradasi zat warna sintetis menggunakan fotokatalis TiO2, namun baru-baru ini beberapa penelitian menggunakan semikonduktor ZnO. Banyak semikonduktor yang memiliki celah pita yang cukup untuk digunakan dalam proses fotokatalis, seperti TiO2 (energi celah = 3,2 eV) ; ZnO (energi celah = 3,4 eV); CdS (energi celah = 2,25 eV) dan lain-lain. Besarnya energi celah pada ZnO lebih besar dibandingkan TiO2 [4].
Sifat inilah yang menjadi dasar penggunaan ZnO dalam penelitian ini. Fotokatalis ZnO sangat baik digunakan untuk menggantikan TiO2, karena keduanya memiliki persamaan mekanisme fotodegradasi dengan harga yang cukup terjangkau [5].
Dalam teknologi pengolahan limbah zat warna, metode foto-fenton juga merupakan salah satu teknik yang sedang berkembang, diantaranya karena dapat meningkatkan efisiensi dan nilai ekonomis dari proses. Teknik ini didasarkan pada kemampuan oksidasi dari Fe2+ karena adanya cahaya dan H2O2 sebagai sumber radikal dapat mengoksidasi senyawa organik secara lebih efektif [3].
Reagen fenton adalah senyawa peroksida yang direaksikan dengan katalis Fe2+ menghasilkan hidroksil radikal yang efektif mengoksidasi senyawa organik. Hidrogen peroksida merupakan oksidator kuat, tetapi pada konsentrasi rendah kinetika reaksinya terlalu lambat untuk mendegradasi kontaminan, sehingga perlu penambahan Fe2+ untuk meningkatkan kekuatan oksidasi peroksida hingga dihasilkan radikal baru. Penambahan H2O2 untuk menghasilkan radikal hidroksida (OH∙) yang berfungsi menguraikan senyawa polutan. Reaksi oksidasi peroksida terkatalisis besi ini biasanya terjadi pada pH 3-5 [6]. Dalam proses fotodegradasi, pH berperan untuk menghasilkan radikal hidroksi. Dengan meningkatnya jumlah radikal hidroksi maka semakin banyak zat warna yang terdegradasi.
Pada penelitian sebelumnya, Widiantini, 2013 [7] telah melalukan fotodegradasi menggunakan sistem ZnO/UV/Reagen Fenton untuk mendegrada-si Congo Red dan diperoleh bahwa efektivitas fotodegradasi tertinggi diperoleh pada sistem ZnO/UV/Reagen Fenton dibandingkan dengan hanya menggunakan sinar UV maupun dengan sistem ZnO/UV dan ZnO/UV/H2O2. Berdasarkan latar belakang di atas, maka pada penelitian ini dilakukan fotodegradasi zat warna Rhodamin B dengan sistem ZnO/UV/Reagen Fenton. Pengaruh variasi
jumlah ZnO, konsentrasi H2O2 serta variasi penambahan konsentrasi Fe2+ terhadap efektifitas degradasi senyawa Rhodamin B akan dipelajari. Penentuan efektifitas dilihat dari waktu yang tercepat, biaya yang lebih ekonomis dan persentase degradasi tertinggi. Dalam penelitian ini dipelajari juga kondisi terbaik dan optimum dari proses fotodegradasi seperti pH dan waktu optimum fotodegradasi.
-
2. MATERI DAN METODE
Bahan
Bahan–bahan kimia yang digunakan dalam penelitian ini adalah berkualitas pro analisis (p.a) yaitu : zat warna Rhodamin B (C28H31N2O3Cl), ZnO (seng oksida), FeSO4 (besi(II)sulfat), NaOH (natrium hidroksida), H2O2 (hidrogen peroksida), HCl (asam klorida).
Peralatan
Peralatan yang digunkan dalam penelitian ini adalah : alat-alat gelas, timbangan analitik, pH meter, pengaduk magnetik, pemanas, plastik hitam, kotak radiasi dan lampu UV-C (15 watt dengan panjang gelombang 259 nm) dipasang dengan ketinggian 20 cm dari sampel, centrifuge IEC HN-SII, dan
spektrofotometer UV-Vis Merk Genesys 10S.
METODE KERJA
Enam buah gelas beker 100 mL yang telah dibungkus plastik hitam masing-masing diisi dengan 50 mL larutan Rhodamin B 100 ppm. Ke dalam masing – masing gelas beker dimasukkan seberat ZnO optimum 60 mg yang diperoleh pada penelitian sebelumnya [7]. Ke dalam masing-masing larutan tersebut ditambah H2O2 35 % sebanyak 0; 2 ; 4 ; 6 ; 8 dan 10 mL. Gelas beker dimasukkan ke kotak radiasi dan pembungkus plastik hitam
dilepaskan dan selanjutnya disinari dengan sinar UV selama 5 jam, sambil diaduk dengan pengaduk magnetik.
Setelah proses radiasi, suspensi dari masing – masing campuran dan kontrol dimasukkan ke dalam tabung reaksi, kemudian disentrifuge dengan kecepatan 3000 – 3500 rpm untuk memisahkan filtrat dan endapannya. Kemudian filtrat diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum dari Rhodamin B (503 nm). Persentasi degradasi (%D) dapat dihitung dengan persamaan berikut:
Co — Ct
Persen degradasi (%D) = —---x 100% Co
Dimana Co dan Ct merupakan konsentrasi awal dan konsentrasi setelah irradiasi, berturut-turut. Berdasarkan nilai % D yang paling besar maka konsentrasi optimum H2O2 dapat diketahui.
Enam buah gelas beker 100 mL yang telah dibungkus plastik hitam masing – masing diisi dengan 50 mL larutan Rhodamin B 100 ppm. Ke dalam masing – masing gelas beker dimasukkan seberat ZnO dan konsentrasi H2O2 optimum yang telah diperoleh pada studi sebelumnya kemudian ditambahkan FeSO4 masing-masing seberat 0, 5, 10, 15, 20, 25 mg. Gelas beker
dimasukkan ke kotak radiasi dan pembungkus plastik hitam dilepaskan. Selanjutnya diradiasi dengan sinar UV selama 5 jam.
Setelah proses radiasi, suspensi dari masing-masing campuran dan kontrol dimasukkan ke dalam tabung reaksi, kemudian disenrifuge dengan kecepatan 3000 – 3500 rpm untuk memisahkan filtrat dan endapannya. Kemudian filtrat diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum dari Rhodamin B. Persentase degradasi (% D) dihitung untuk mengetahui konsentrasi optimum FeSO4.
Delapan buah gelas beker 100 mL yang telah dibungkus plastik hitam masing-masing diisi dengan 50 mL larutan Rhodamin B 100 ppm. Ke dalam masing – masing gelas beker dimasukkan seberat ZnO, sejumlah H2O2 optimum dan FeSO4 optimum diperoleh sebelumnya. Kedelapan larutan tersebut diatur pHnya dengan nilai yang berbeda yaitu pH 3 sampai 10, dengan menambahkan HCl atau NaOH ke dalam larutan. Gelas beker dimasukkan ke kotak radiasi dan pembungkus plastik hitam dilepaskan. Selanjutnya diradiasi dengan sinar UV selama 5 jam, sambil diaduk dengan pengaduk magnetik.
Setelah proses radiasi, suspensi dari masing – masing campuran dan kontrol dimasukkan ke dalam tabung reaksi, kemudian disentrifuge dengan kecepatan 3000- 3500 rpm untuk memisahkan filtrat dan endapannya. Kemudian filtrat diukur absorbansinya dengan spektrofometer UV-Vis pada panjang gelombang maksimum dari Rhodamin B. Persentase degradasi (% D) dihitung sehingga pH optimum dapat diketahui.
Enam buah gelas beker 100 mL yang telah dibungkus plastik hitam masing – masing diisi dengan 50 mL larutan Rhodamin B 100 ppm. Ke dalam masing-masing gelas beker dimasukkan seberat ZnO optimum, sejumlah H2O2 optimum, sejumlah FeSO4 optimum dan pH diatur pada pH optimum. Gelas beker dimasukkan ke kotak radiasi dan pembungkus plastik hitam dilepaskan. Selanjutnya diradiasi sinar UV dengan variasi waktu selama 1, 2, 3, 4 dan 5 jam, sambil diaduk dengan pengaduk magnetik. Setelah proses radiasi, suspensi dari masing-masing campuran dan kontrol ke dalam tabung reaksi, kemudian disentrifuge dengan kecepatan 3000-3500 rpm untuk memisahan filtrat dan endapannya. Kemudian filtrat diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum
dari Rhodamin B. Persentase degradasi (% D) dihitung. Berdasarkan nilai % D yang paling besar maka efektifitas fotodegradasi Rhodamin B dapat diketahui.
Konsentrasi H2O2 optimum dalam proses fotodegradasi dapat ditentukan dengan memvariasikan jumlah volume H2O2 dari 0 - 10 ml, dengan penambahan katalis ZnO optimum 60 mg. Campuran larutan Rhodamin B dengan katalis ZnO optimum tanpa penambahan H2O2 digunakan sebagai kontrol. Berdasarkan hasil penelitian ini, dapat diketahui bahwa H2O2 mampu meningkatkan persentase degradasi dari 36, 36 % (tanpa H2O2). Hal ini menunjukkan adanya reaksi fotokatalitik dimana saat fotokatalis ZnO yang disinari UV akan menghasilkan lubang (h+VB) dan elektron (e-CB). Lubang (hole) bereaksi dengan H2O membentuk radikal hidroksil (•OH) yang mampu mendegradasi Rhodamin B menjadi intermediet yang lebih sederhana yang kurang atau tidak beracun yang kemudian akan didegradasi lebih lanjut menghasilkan CO2 dan H2O. Mekanisme proses fotokatalisis menggunakan ZnO ditunjukkan pada tahapan berikut [8]:
ZnO + hv ZnO (ecb– + hvb+)
hvb+ + H2O H+ + OH-
hvb+ + OH– •OH
-
•OH + Rhodamin B CO2+ H2O +
Senyawa yang lebih sederhana
Penambahan H2O2 sebanyak 2 ml mengalami peningkatan persentase
degradasi. Penambahan H2O2 sangat berpengaruh dalam meningkatkan
konsentrasi radikal hidroksil. H2O2 mempunyai dua fungsi dalam proses degradasi, yaitu mengikat elektron sehingga terjadi pemisahan muatan dan sebagai pembentuk radikal •OH. Hal tersebut terbukti dimana pada penambahan 2 ml
H2O2 persentase degradasi Rhodamin B menjadi sebesar 50,15 % dibandingkan hanya dengan menggunakan katalis dan sinar UV sebesar 36,36 %. Data yang diperoleh ditunjukkan pada Gambar 2.
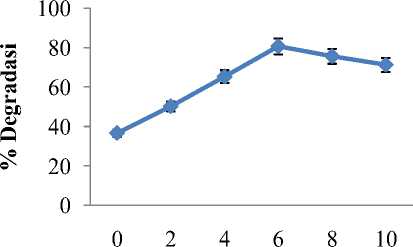
Volume H2O2 (mL)
Gambar 2. Kurva pengaruh penambahan H2O2 terhadap persentase degradasi larutan Rhodamin B 100 ppm yang telah dimasukkan 60 mg ZnO dengan lama penyinaran 5 jam.
Peningkatan persentase degradasi terjadi secara signifikan pada penambahan H2O2 dari 2 sampai 6 ml seperti yang ditunjukkan Gambar 4. Persentase fotodegradasi paling tinggi terjadi pada penambahan H2O2 sebanyak 6 ml yaitu sebesar 80,53 % sedangkan penambahan jumlah H2O2 lebih lanjut 8 ml dan 10 ml mengalami penurunan persentase fotodegradasi menjadi 70,92 %. Hal ini disebabkan karena konsentrasi yang ditambahkan dalam larutan terlalu tinggi. Penambahan H2O2 yang berlebihan akan menurunkan persentasi degradasi karena terjadinya fenomena •OH yang bereaksi dengan H2O2 (1) sehingga terbentuknya radikal HO2• (2) yang kurang reaktif dibandingkan radikal •OH dan adanya pembentukan molekul gas O2 (3) dalam sistem. Molekul gas ini tidak terlarut, sehingga akan mengalami reaksi kembali dan menghalangi transfer energi foton . Reaksi yang terjadi dapat dilihat sebagai berikut [9]:
Pengaruh penambahan FeSO4 terhadap persentase degradasi Rhodamin B diamati dengan memvariasikan FeSO4 dari 0 – 25 mg. Campuran larutan Rhodamin B tersebut selanjutnya disinari UV selama 5 jam. Berdasarkan hasil penelitian campuran larutan Rhodamin B dengan penambahan FeSO4 memberikan persentase degradasi yang lebih tinggi dibandingkan tanpa penambahan FeSO4. Persentase degradasi tanpa penambahan FeSO4 sebesar 82,08 %, sedangkan persentase degradasi pada penambahan sebanyak 5 mg FeSO4 meningkatkan persentase degradasi menjadi 85,72 %. Penambahan FeSO4 sebesar 25 mg memberikan hasil persentase degradasi paling besar yaitu 94,53 %. Penambahan FeSO4 25 mg masih mengalami kenaikan dan dianggap sudah kurang baik, sehingga jumlah FeSO4 yang terlalu banyak justru menghambat pembentukan hole. Hal ini menunjukkan bahwa FeSO4 yang terbaik untuk mendegradasi Rhodamin B adalah sebanyak 5 mg karena penambahan katalis Fe2+ lebih banyak tidak memberikan yang cukup signifikan. Hasil yang diperoleh dapat dilihat pada Gambar 3.
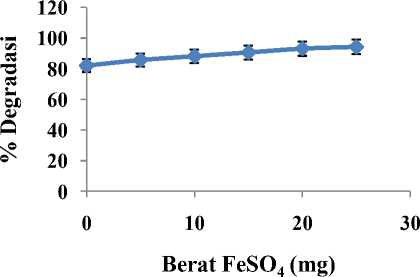
Gambar 3. Kurva pengaruh penambahan Fe2+ terhadap persentase degradasi Rhodamin B 100 ppm yang telah dimasukkan 60 mg ZnO dan 6 mL H2O2 dengan lama penyinaran 5 jam.
Peningkatan persentase degradasi Rhodamin B seperti yang ditunjukkan Gambar 3 dengan sistem
UV/ZnO/H2O2/Fe2+ ini disebabkan
terjadinya peningkatan jumlah radikal bebas yang kuat bila katalis Fe2+ bereaksi dengan H2O2 (5) hingga dihasilkan radikal •OH. Radikal OH yang terbentuk bereaksi dengan cepat dalam air (4). Ion Fe2+ merupakan katalis dari dekomposisi H2O2 sehingga terbentuknya radikal •OH, kemudian reaksi 2+ tersebut mendorong pembentukan ion Fe2+ kembali dari ion Fe3+ (6) [10]. Secara
lengkap reaksi yang terjadi dalam sistem
sebagai berikut :
-
• OH + H2O —► 2 •OH + H+…......(4)
Fe2+ + H2O2 » Fe3+ + OH- + •O...(5)
Fe3+ + H2O2 ► Fe2+ + •OH + OH+(6)
Pengaruh pH terhadap fotodegradasi Rhodamin B pada berbagai pH larutan (asam, netral dan basa) dengan rentang 3 sampai 10 digunakan untuk mendapatkan pH optimum. Untuk mengatur pH menjadi suasana asam ditambahkan beberapa tetes larutan HCl sedangkan mengatur pH dalam suasana basa maka ditambahkan larutan NaOH. Persentase degradasi yang diperoleh menunjukkan bahwa degradasi Rhodamin B terjadi lebih efektif pada pH rendah. Hal yang sama juga didapatkan oleh Leksono, 2012 [11] yang menunjukkan bahwa degradasi Rhodamin B terjadi dalam suasana asam pH 3 dengan persentase degradasi 93,24 %. Untuk mengetahui pH optimum larutan Rhodamin B dalam proses fotodegradasi dibuat kurva dengan menghubungkan pH Rhodamin B dengan persentase degradasi. Kurva tersebut ditunjukkan pada Gambar 4.
120
100
’W 80
So 60 4» o 40
X®

0
2 4 6 8 10 12
pH
Gambar 4. Pengaruh pH pada fotodegradasi Rhodamin B 100 ppm yang telah dimasuk kan 60 mg ZnO, 6 ml H2O2 dan 25 mg FeSO4.
Persentase degradasi yang ditunjukkan pada Gambar 6 mengalami peningkatan pada pH rendah yaitu dari pH 3 sampai pH 4. Persentase degradasi pada pH 5 mengalami penurunan sehingga disimpulkan bahwa pH optimum untuk mendegradasi zat warna adalah pada pH 4 dengan persentase degradasi sebesar 95,05 %. Persentase degradasi yang diperoleh pada pH 7 tidak beda jauh dengan hasil yang diperoleh pada pH rendah. Hal ini menunjukkan bahwa pada pH 7 juga bisa digunakan untuk mendegradasi Rhodamin B, sedangkan persentase degradasi pada pH tinggi (pH 10) mengalami penurunan menjadi 79,28 %.
Rhodamin B merupakan zat warna yang larut dalam air dan bermuatan negatif. Hal ini yang menyebabkan Rhodamin B tidak efektif terdegradasi dalam pH tinggi (Maria, et.al, 2013). Persentase degradasi pada pH rendah juga dipengaruhi selama proses dekomposisi H2O2 untuk pembentukan radikal (7). Proses dekomposisi H2O2 pada suasana asam terjadi dengan cepat karena OH- akan berikatan dengan H+ sehingga meningkatkan jumlah radikal hidroksi, yang menyebabkan degradasi zat warna semakin besar. Pada suasana basa justru menghambat dekomposisi H2O2 yang disebabkan penambahan konsentrasi •OH- dari larutan
[9]. Zat warna akan didegradasi oleh OH• menjadi mineralnya yaitu CO2 dan H2O (8). Secara lengkap reaksi yang terjadi dalam sistem sebagai berikut :
H2O2 OH- + OH• .........(7)
-
•OH + senyawa organik H2O + CO2 +
Senyawa yang lebih sederhana..................(8)
Fotodegradasi larutan Rhodamin B dengan variasi waktu 0 - 6 jam dilakukan untuk mengetahui efektifitas fotodegradasi. Proses fotodegradasi dapat diketahui dengan menghubungkan kurva antara persentase degradasi dengan waktu. Waktu optimum dapat diketahui dalam mendegradasi Rhodamin B pada kondisi optimum (jumlah katalis maksimum, volume H2O2 optimum, dan pH optimum).
Penentuan efektifitas untuk
mendegradasi zat warna Rhodamin B dapat dilakukan dengan empat sistem yaitu sistem I dengan katalis ZnO/pH tanpa penyinaran, sistem II dengan UV/ZnO/pH, sistem III UV/ZnO/H2O2/pH dan sistem IV
UV/ZnO/Fenton dan pH. Perbedaan sistem degradasi tersebut memberikan keefektifan degradasi zat warna Rhodamin B yang berbeda. Perbedaan karakter katalis ZnO dan Fenton yang mungkin akan memberikan keefektifan degradasi zat warna Rhodamin B yang berbeda. Proses degradasi suatu larutan zat warna akan menyebabkan intensitas warnanya berkurang. Oleh karena itu, tingkat keefektifan reaksi degradasi zat warna bisa dilihat dari waktu yang tercepat mendegradasi Rhodamin B, biaya yang lebih ekonomis dan persentase degradasi yang tertinggi. Sistem yang paling efektif akan digunakan untuk mendegradasi limbah zat warna yang mengandung Rhodamin B. Hasil keempat sistem tersebut dapat dilihat pada Gambar 5.
Fotodegradasi Rhodamin B pada Gambar 7 menunjukkan hubungan antara lama waktu radiasi UV dengan lamanya pengadukan. Bertambahnya waktu radiasi maka semakin banyak foton mengenai ZnO sehingga persentase degradasi yang diperoleh semakin
besar. Hal yang sama juga ditemukan oleh Widiantini, et.al [7] yang menyatakan bahwa semakin meningkat waktu radiasi maka persentase degradasi semakin tinggi.
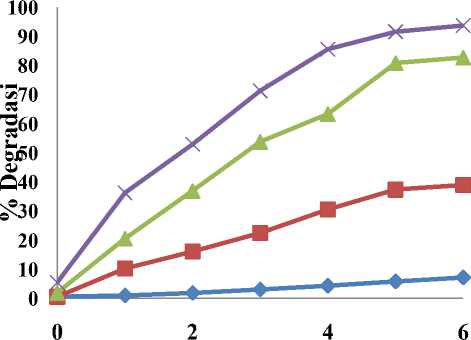
Waktu (Jam)
Gambar 5. Pengaruh waktu irradiasi terhadap persentase degradasi (%D) dari larutan Rhodamin B 100 ppm pada sistem yang berbeda. I : sistem I (ZnO/pH optimum tanpa penyinaran) ; I : sistem II (ZnO/UV/pH optimum); ▲ : sistem III (ZnO/UV/H2O2/pH optimum); X : sistem IV (ZnO/UV/H2O2/Fe2+/pH optimum).
Pada perlakuan sistem pertama, yaitu dengan katalis ZnO/pH pengadukan selama 1 jam menghasilkan persentase degradasi yang sangat rendah yaitu sebesar 1,00 %. Hal ini dikarenakan tidak adanya energi foton yang mengenai ZnO sehinga proses degradasi yang dihasilkan sangat kecil. Efektifitas tertinggi katalis ZnO 60 mg dalam degradasi Rhodamin B pada pengadukan selama 5 jam yaitu sebesar 5,81 %. Hal ini menunjukkan katalis ZnO tidak bisa mendegradasi zat warna tanpa adanya radiasi UV.
Pada perlakuan sistem kedua, yaitu dengan katalis ZnO/pH/UV, radiasi selama 1 jam menghasilkan persentase degradasi yang sangat rendah yaitu 10,29 % sedangkan dengan sistem pertama untuk menghasilkan
persentase degrdasi 7,20 % dilakukan
pengadukan selama 5 jam. Persentase degradasi Rhodamin B dengan waktu 1 jam mendapatkan persentase yang rendah dikarenakan sedikitnya jumlah energi foton yang mengenai ZnO sehinga proses degradasi yang dihasilkan tidak maksimal. Efektifitas tertinggi katalis ZnO 60 mg dalam mendegradasi Rhodamin B 100 ppm diperoleh pada waktu 5 jam yaitu sebesar 37,35 %. Hal ini menunjukkan bahwa katalis ZnO berperan penting dalam fotodegradasi karena katalis dapat memberikan hole (h+) yang akan bereaksi dengan ion hidroksi (OH-) membentuk radikal hidroksi (•OH) yang akan mendegradasi zat warna tersebut sehingga proses degradasi berjalan lebih cepat. Semakin tinggi pembentukan hidroksil radikal maka akan semakin besar pula kemampuan fotokatalis untuk mendegradasi [9]. Secara lengkap reaksi yang terjadi sebagai berikut :
HO- + h+ ----* HO•
Pada perlakuan sistem ketiga (sinar UV/ZnO/H2O2/pH) terjadi peningkatan persentase degradasi seiring dengan bertambahnya waktu. Pada sistem ketiga persentase degradasi dengan penyinaran 1 jam sebesar 20,55 % dibandingkan
persentase degradasi yang hampir sama pada sistem kedua dengan penyinaran 3 jam. Persentase degradasi tertinggi yang diperoleh dengan penyinaran 5 jam sebesar 37,35 % dibandingkan persentase degradasi yang hampir sama pada sistem ketiga dengan penyinaran 2 jam yaitu dengan persentase degradasi sebesar 37,00 %.
Persentase degradasi menggunakan katalis ZnO dan H2O2 menunjukkan hasil yang sangat tinggi dibandingkan pada sistem I dan II. Persentase degradasi Rhodamin B tertinggi diperoleh pada sistem ketiga dengan radiasi selam 5 jam yaitu sebesar 80,51 %.
Sistem keempat (sinar
UV/ZnO/Fenton/pH) menunjukkan
peningkatan persentase degradasi.
Persentase degradasi selama 1 jam sebesar
36,26 % sementara persentase degradasi yang hampir sama untuk sistem kedua dicapai pada waktu 5 jam dan dengan sistem ketiga dicapai dengan waktu 2 jam. Pada sistem keempat persentase degradasi pada waktu 4 jam sebesar 85,23 %, sedangkan pada sistem ketiga dicapai dengan waktu 6 jam. Persentase degradasi Rhodamin B pada sistem keempat dengan waktu 5 jam sebesar 91,55 %, sedangkan dengan waktu 6 jam mengalami kenaikan persentase degradasi menjadi sebesar 93,14 %. Peningkatan persentase degradasi pada waktu 5 jam sebesar 6 % dan peningkatan persentase degradasi pada 6 jam sebesar 2 %, sehingga waktu optimum dalam mendegradasi Rhodamin B adalah 5 jam. Fotodegradasi pada sistem keempat (UV/ZnO/Fenton /pH) paling efektif dalam menurunkan kadar zat warna Rhodamin B dibandingkan pada sistem I (ZnO/pH), sistem II (UV/ZnO/pH) dan sistem III (UV/ZnO/H2O2) yaitu mampu mendegradasi Rhodamin B hingga 93,14 % yang artinya bahwa semua parameter yang di periksa saling mendukung satu sama lain dalam mendegradasi Rhodamin B, hanya saja tidak diamati parameter yang paling dominan peranannya.
Efektifitas fotodegradasi limbah pencelupan tenun dilakukan dengan kondisi optimum. Kondisi optimum katalis ZnO 60 mg, H2O2 6 mL, FeSO4 25 mg dan dengan waktu 5 jam, sedangkan limbah tenun yang digunakan sebagai kontrol dilakukan penyinaran dengan waktu 5 jam. Proses fotodegradasi dapat diketahui dengan membandingkan warna larutan secara visual. Warna kontrol limbah tekstil berwarna orange pekat dengan absorbansi sebesar 2,644 dengan persentase degradasi sebesar 15,34 %, sedangkan warna setelah didegradasi selama 5 jam berubah menjadi orange muda dengan absorbansi sebesar 0,441 dengan persentase degradasi sebesar 85,95 %. Fotodegradasi limbah tekstil
memberikan penurunan warna yang cukup signifikan seperti yang ditampilkan pada Gambar 6.
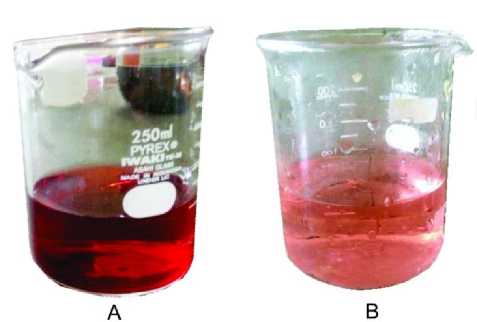
Gambar 6. Limbah tekstil sebelum (A) dan setelah (B) didegradasi.
Berdasarkan penelitian yang telah dilakukan maka diperoleh simpulan bahwa kondisi optimum degradasi Rhodamin B adalah berat ZnO sebanyak 60 mg, H2O2 sebanyak 6 mL, FeSO4 sebanyak 25 mg, pH 4 dan waktu irradiasi selama 5 jam. Fotodegradasi dengan sistem sinar UV/ ZnO/H2O2/Fe+2 dan pH pada kondisi optimum paling efektif mendegradasi Rhodamin B 100 ppm dengan persen degradasi sebesar 91,55%. Aplikasi sistem ini pada fotogegradasi limbah pencelupan menunjukkan bahwa sistem ini sangat efektif untuk mendegradasi limbah zat warna Congo Red.
DAFTAR PUSTAKA
-
[1] Sastrawijaya, T., 2000, Pencemaran
Lingkungan, PT. Rineka Cipta, Jakarta.
-
[2] Wijaya , K., Sugiharto, E., Fatimah, S., Sudiono, S., Kurniaysih, D.,2006, “Penggunaan TiO2-Zeloit dan Sinar UV untuk fotodegradasi Zat Warna Congo Red,” Berkala MIPA, vol. 3, p: 27-35.
-
[3] Huling, S.G. and Pivetz, B. E., 2003, “Photoelectrocatalytic degradation and removal of organic and inorganic contaminants in ground waters,” Journal of Environmental, p: 1-60.
-
[4] Fatimah. I., Wang. S. and Wulandari. D., 2010, “ZnO/Montmorillonit for
Photocatalytic and Photochemical
Degradation of Methylene Blue,” Journal Science, vol. 53, p: 553-560.
-
[5] Stafford, U. Gary, K.A., & Kamat, P.V. 1997,”Photocatalytic Degradation of 4 -
Chlorophenol: The Effects of Varying TiO2 Concentration and Light Wavelength,” Journal of Catalysis., vol. 167, p: 25–32.
-
[6] Alba. R., Ana C., Jose S., Gonzalez., Josefa M., 2010, “Heterogeneous”, Journal of
Catalysis, vol. 149, p: 281-287.
-
[7] Widiantini. N.L.P., Sibarani J., Manurung. M., 2013, “Fotodegradasi Congo Red
dengan sinar UV, katalis ZnO, H2O2/Fe2+”, Jurnal Kimia, vol. 7, p : 82-90.
-
[8] Marquez, J.A.R., Herrera, C.M, Fuentes, M.L., & Rosas, L.M., 2012, “Effect of Three Operating Variables on Degradation of Methylene Blue by Electrodeposited ZnO”, International Journal of Electrochemical Science, vol. 7, p: 11043-11051.
-
[9] María del C. Cotto-Maldonado, Teresa, C., Eduardo, E., Arancha Gomez-Martínez, Carmen M. and Francisco, M.., 2013,
“Photocatalytic Degradation of Rhodamine-B Under UV-Visible Light Irradiation Using Different Nanostructured Catalysts,”
American Chemical Science Journal, vol. 3, p: 178-202.
[10]Mohd. Fadhil Md. Din, Mohd. Razman Salim, Azmi Aris dan Wan Azlee Abu Bakar, 2001, “Fotodegradasi Heterogenous Orange G Dengan Kehadiran Pelbagai Bahan Pengoksida.” Malaysian Journal of Analytical Sciences, vol. 7, p: 355-362.
-
[11] Leksono. V. A., 2012, “Processing Textile Dyes Rhodamine B Using Bentonite
Pillared TiO2”, Journal Chemistry, vol. 24, p: 1-7.
94
Discussion and feedback