DESAIN PRIMER UNTUK AMPLIFIKASI FRAGMEN GEN inhA ISOLAT 134 MULTIDRUG RESISTANCE TUBERCULOSIS (MDR-TB) DENGAN METODE POLYMERASE CHAIN REACTION
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 3, Nomor 2, Oktober 2015
i Ca&a ∣ • %imia ∣
DESAIN PRIMER UNTUK AMPLIFIKASI FRAGMEN GEN inhA ISOLAT 134 MULTIDRUG RESISTANCE TUBERCULOSIS (MDR-TB)
DENGAN METODE POLYMERASE CHAIN REACTION
Luh Ketut Budi Maitriani 1, I Nengah Wirajana2,3 dan Sagung Chandra Yowani1,3
-
1Jurusan Farmasi, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia, 80361 budimaitriani@gmail.com
-
2Jurusan Kimia, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia, 80361 nwirajaya@gmail.com
-
3Kelompok Studi MDR-TB & XDR-TB, FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-
Indonesia, 80361
ABSTRAK : Penelitian ini bertujuan untuk memperoleh sepasang primer terbaik hasil desain secara in silico menggunakan program Clone Manager Suite 6 (University of Groningen). Primer ini didesain untuk digunakan dalam mengamplifikasi fragmen gen inhA isolat klinis Multidrug Resistance Tuberculosis (MDR-TB) mencakup kodon 94 (nukleotida 280-282). Kodon 94 gen inhA merupakan posisi yang sering mengalami mutasi dan mengakibatkan koresisten terhadap isoniazid dan ethionamid. Desain primer menggunakan sekuen gen inhA Mycobacterium tuberculosis yang diperoleh dari situs www.ncbi.nlm.nih.gov (GenBank : AF106077). Hasil desain diperoleh sepasang primer terbaik dan diuji secara in vitro menggunakan metode Polymerase Chain Reaction (PCR). Template DNA yang digunakan adalah isolat klinis MDR-TB. Proses amplifikasi diawali dengan denaturasi awal pada 95°C selama 15 menit dan diikuti oleh 45 siklus amplifikasi (denaturasi pada suhu 94°C selama 1 menit, annealing pada 56°C selama 1 menit 20 detik dan elongasi pada 72°C selama 2 menit) serta diakhiri dengan elongasi akhir pada 72°C selama 10 menit. Produk PCR dideteksi menggunakan elektroforesis gel agarosa 1,5%. Kesimpulan penelitian adalah diperoleh sepasang primer terbaik berdasarkan kriteria pada program Clone Manager Suite 6 (University of Groningen), meliputi: panjang primer, %GC, Tm (melting temperature), interaksi primer (dimers dan hairpins), stabilitas primer, repeats, runs dan false priming. Primer tersebut meliputi, primer forward (pF-inhA) 5’ CTGGTTAGCGGAATCATCAC 3’ dan primer reverse (pR-inhA) 5’ CGACCGTCATCCA-GTTGTA 3’ dengan ukuran produk 460 pb.
Kata kunci : Clone Manager Suite 6, desain primer, gen inhA, MDR-TB, Polymerase Chain Reaction
ABSTRACT: The aim of this study was to obtain the best pair of primer as result in silico design using Clone Manager Suite 6 program (University of Groningen). The primer was designed for amplifying inhA gene fragment of Multidrug Resistance Tuberculosis (MDR-TB) clinical isolates include codon 94 (nucleotide 280-282). Codon 94 of inhA gene is frequently mutated position and can lead to coresistance of isoniazid and ethionamide. The primer was designed using sequences of inhA gene Mycobacterium tuberculosis from www.ncbi.nlm.nih.gov (bank genes: AF106077). Results obtained the best primer pair and tested in vitro using Polymerase Chain Reaction method. DNA template used were MDR-TB clinical isolate. Amplifying process was begun with predenaturation at 95°C for 15 minutes and followed by 45 cycles of amplification (denaturation at 94°C for 1 minutes, annealing at
56°C for 1 minute 20 seconds and extension at 72°C for 2 minutes) with a final extension at 72°C for 10 minutes. The PCR products were detected using 1,5% b/v agarose gel electrophoresis. In conclusion the best primer pair selected based on the criteria of the Clone Manager Suite 6 program (University of Groningen) such as: primer length, %GC, Tm (melting temperature), primers interaction (dimers and hairpins), stability, repeats, runs, and false priming. The primer sequence were forward primer (pF-inhA) 5’ CTGGTTAGCGGAATCATCAC 3' and reverse primer (pR-inhA) 5' CGACCGTCATCC-AGTTGTA 3' with the length 460 bp.
Keywords: Clone Manager Suite 6, primer design, inhA gene, MDR-TB, Polymerase Chain Reaction
Multidrug Resistance Tuberculosis (MDR-TB) merupakan penyakit tuberkulosis yang disebabkan oleh resistensi dari Mycobacterium tuberculosis (bakteri penyebab tuberkulosis) terhadap minimal dua jenis obat antituberkulosis lini pertama, yaitu isoniazid dan rifampisin [1].
Indonesia merupakan salah satu dari 27 negara dengan kasus MDR-TB tinggi di dunia. Pada tahun 2013 tercatat sebanyak 5700 kasus baru dan 1100 kasus MDR-TB dari pengobatan TB sebelumnya [2]. Salah satu upaya dalam pengendalian tuberkulosis di Indonesia adalah dengan melakukan pendeteksian dini adanya kasus MDR-TB [1].
InhA adalah gen yang bertanggung jawab terhadap resistensi isoniazid. Pada beberapa penelitian sebelumnya, telah dilaporkan salah satu penyebab terjadinya MDR-TB adalah adanya mutasi pada gen inhA. Pada isolat MDR-TB di Myanmar, telah dilaporkan adanya mutasi pada kodon 94 gen inhA. Selain terjadi resisten terhadap isoniazid, mutasi pada kodon 94 dengan perubahan asam amino Serin menjadi Alanin (S94A) juga dilaporkan mengakibatkan resistensi silang terhadap ethionamid (antituberkulosis lini kedua) [3].
Identifikasi adanya mutasi pada fragmen gen dapat dilakukan dengan teknik PCR. Pada proses amplifikasi fragmen gen diperlukan suatu komponen yang disebut primer. Primer berfungsi sebagai pembatas fragmen DNA target yang akan
diamplifikasi [4]. Setiap satu fragmen target, memerlukan sepasang primer yang sesuai dengan DNA target [5]. Primer yang digunakan harus memenuhi kriteria primer yang baik sehingga dapat mengamplifikasi fragmen gen inhA secara spesifik. Kriteria tersebut meliputi : panjang primer, %GC, Tm (melting temperature), interaksi primer (dimers dan hairpins), stabilitas primer, repeats, runs dan false priming [6].
Seiring dengan perkembangan teknologi informatika, telah dirancang software yang dapat digunakan dalam mendesain dan menganalisis primer. Desain primer secara in silico akan memudahkan dalam memperoleh primer yang baik untuk proses amplifikasi fragmen gen. Namun diperlukan pula suatu proses deteksi secara in vitro dalam menguji keberhasilan primer dalam membentuk produk yang diinginkan. Deteksi produk dapat dilakukan dengan elektroforesis. Penelitian ini menjadi tahapan dalam deteksi adanya mutasi gen inhA pada isolat MDR-TB. Tujuan khusus dari penelitian adalah mendesain sepasang primer yang dapat digunakan dalam proses amplifikasi fragmen gen inhA mencakup kodon 94 dengan teknik PCR.
Bahan yang digunakan pada penelitian ini adalah sepasang primer (IDT) dengan primer forward (pF-inhA) 5’ CTGGTTA-GCGGAATCATCAC 3’ dan primer reverse (pR-inhA) 5’ CGACCGTCATCC-
AGTTGTA 3’ hasil desain. master mix (Go Taq green master mix), nuclease free water (Promega) dan isolat klinis 134 Multidrug Resistance Tuberculosis yang diperoleh dari Laboratorium Mikrobiologi Klinik Rumah Sakit Umum Sanglah, Denpasar, Bali untuk tahap amplifikasi gen inhA. Deteksi produk PCR digunakan Top Vision Agarosa 1,5% b/v dalam TBE 1x (Thermo Scientific), TBE 0,5x (Invitrogen) dan Gel red.
Peralatan yang digunakan diantaranya Aplikasi Clone Manager Suite 6 (University of Groningen), mesin PCR (Veriti® Thermal Cycler), horizontal elektroforesis (Mupid-eXU Advance), Gel Doc (Bio-Rad).
-
2.2 Metode
Gen inhA M. tuberculosis
Sekuen gen inhA M. tuberculosis (kode genbank AF106077) yang diperoleh pada situs www.ncbi.nlm.nih.gov digunakan sebagai template dalam mendesain
sepasang primer.
Software dalam Desain Primer
Pada penelitian ini dilakukan desain primer secara in silico menggunakan program Clone Manager Suite 6 (University of Groningen).
Tahapan Desain Primer Menggunakan
Software Clone Manager Suite 6
Desain primer dilakukan melalui beberapa tahapan, meliputi :
-
1. Menginstal Program Clone Manager
Suite 6.
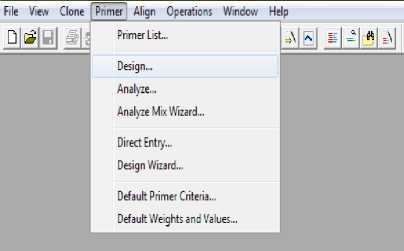
Gambar 1. Menu Bar Primer Design
-
2. Mengunduh atau menyimpan sekuen gen inhA pada situs www.ncbi.nlm.nih.gov.
-
3. Membuka Program Clone Manager Suite 6, pilih menu primer pada menu bar, kemudian pilih design (Gambar 1).
-
4. Pada kotak dialog yang muncul, load atau masukkan data sekuen yang telah disimpan sebelumnya, sehingga muncul kotak dialog design primer.
-
5. Pada kotak dialog tersebut dimasukkan panjang primer forward dan reverse yang diinginkan (18-24 basa); regio target dilengkapi dengan posisi basa yang diinginkan sebagai awal dan akhir regio target, pilih ok (Gambar 2). Posisi basa didasarkan oleh nukleotida target yaitu 280-282 sehingga berada di tengah range [3].
-
6. Pada kotak dialog yang muncul akan diperoleh rank sort dan hasil primer didasarkan pada kriteria primer.
-
7. Langkah 3-6 dapat diulangi dan hasil primer yang baik dibandingkan sehingga diperoleh primer terbaik berdasarkan acuan yang tersedia pada program.
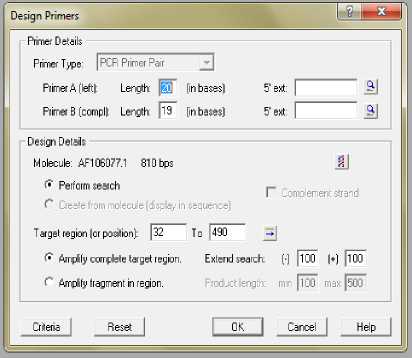
Gambar 2. Kotak Dialog Primer Design
Amplifikasi Fragmen Gen inhA dengan Teknik PCR
Template DNA yang digunakan untuk amplifikasi berasal dari DNA kromosomal yang diisolasi dari isolat klinis 134 MDR-TB. Proses amplifikasi dimulai dengan denaturasi awal pada 95°C selama 15 menit
dan diikuti oleh 45 siklus amplifikasi yang terdiri dari denaturasi pada 94°C selama 1 menit, annealing pada 56°C selama 1 menit 20 detik dan elongasi pada 72°C selama 2 menit. Proses amplifikasi diakhiri dengan elongasi akhir pada 72°C selama 10 menit.
Deteksi Produk PCR
Produk PCR dideteksi dengan elektroforesis gel agarosa 1,5% b/v.
Sekuen gen inhA M. tuberculosis (gen bank: AF106077) dimasukkan ke dalam program Clone Manager Suite 6. Selanjutnya dimasukkan panjang primer dapat dimulai dari panjang primer 18 hingga 22 basa. Penggunaan rentang panjang primer tersebut karena primer dengan panjang kurang dari 18 basa memiliki kemungkinan mispriming (penempelan primer pada tempat yang tidak diinginkan) tinggi. Hal ini akan mengurangi spesifisitas primer sehingga produk yang dihasilkan tidak sesuai dengan yang diinginkan. Namun bila primer yang digunakan terlalu panjang, spesifisitas primer tidak dapat ditingkatkan secara bermakna, hanya mengakibatkan biaya yang lebih mahal [4]. Sehingga saat desain primer panjang primer yang dimasukkaan berkisar antara 18-22 bp.
Posisi target primer yang dimasukkan didasarkan pada posisi basa yang paling sering dilaporkan mengalami mutasi. Titik mutasi diharapkan berada pada tengah produk. Urutan nukleotida 280-282 menjadi target titik tengah produk yang ingin dihasilkan dari desain primer [3]. Sepasang primer terbaik hasil desain dapat dilihat pada Tabel 1. Pemilihan primer tersebut didasarkan pada kriteria primer, meliputi: panjang primer, %GC, Tm (melting temperature), interaksi primer
(dimers dan hairpins), stabilitas primer, repeats, runs dan false priming.
Analisis hasil desain primer dengan program Clone Manager Suite 6 ditampilkan pula pada Gambar 4 dan 5.
Tabel 1. Hasil Desain Primer
|
Kriteria |
pF-inhA* |
pR-inhA* |
Acuan pada Clone Manager Suite 6 |
|
Panjang |
20 |
19 |
18-22 |
|
Persen (%) |
50 |
52 |
50-60 |
|
Tm (°C) |
60 |
61 |
55-80 |
|
Dimer pada ujung 3’ |
2 |
2 |
<3 |
|
Dimer selain ujung 3’ |
2 |
3 |
<7 |
|
Stabilitas (kcals) |
2,3 |
2,3 |
≥1,2 |
|
Runs |
2 |
2 |
<3 |
|
Repeats |
Tidak ada |
Tidak ada |
<3 |
|
Hairpins |
Tidak ada |
Tidak ada |
Tidak ada |
|
False priming |
Tidak ada |
Tidak ada |
Tidak ada |
Keterangan:
Primer pF-inhA):
5’-CTGGTTAGCGGAATCATCAC-3’
Primer pR-inhA:
5’-CGACCGTCATCCAGTTGTA-3’
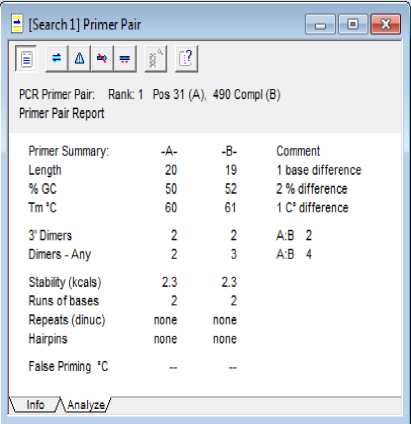
Gambar 4. Hasil Analisis Desain Primer
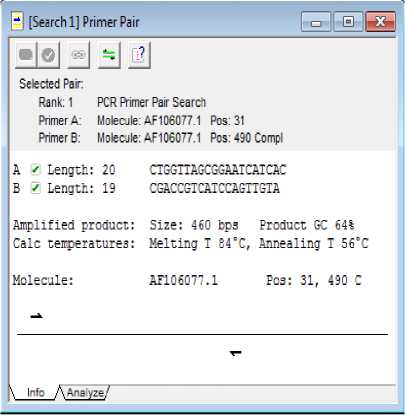
Gambar 5. Info Primer
Pada program Clone Manager Suite 6 ditampilkan analisis terhadap hasil desain primer yang diperoleh. Berdasarkan gambar 4 dan 5 diketahui bahwa kedua primer telah memenuhi kriteria primer yang baik. Baik primer forward maupun reverse telah memenuhi kriteria acuan yang ditetapkan pada program Clone Manager Suite 6, yang meliputi: panjang primer, %GC, Tm (melting temperature), interaksi primer
(dimers dan hairpins), stabilitas primer, repeats, runs dan false priming.
Secara berturut-turut primer forward dan reverse memiliki persen (%) GC 50 dan 52. Persen GC yang disarankan adalah 5060. Persen GC primer hasil desain telah memenuhi acuan program. Persen GC akan berpengaruh pada pada ikatan antar untai DNA. Persen GC yang tinggi akan mengakibatkan ikatan antar untai DNA menjadi kuat karena GC mengandung lebih banyak ikatan antar nukleotida daripada AT sehingga akan berpengaruh pada nilai Tm [7].
Tm primer hasil desain yaitu 60 dan 61°C. Tm (melting temperature) merupakan temperatur saat setengah untai DNA ganda terpisah. Nilai Tm akan berpengaruh pada suhu denaturasi untai double helix DNA dan suhu annealing (penempelan) primer. Primer dengan Tm terlalu tinggi melebihi 70°C akan mudah mengalami mispriming pada temperatur rendah. Selain itu, terbentuknya ikatan yang terlalu kuat antara template DNA dan primer akan mengakibatkan produk PCR yang dihasilkan rendah [7]. Sedangkan primer dengan Tm rendah tidak akan dapat bekerja pada temperatur tinggi. Tm primer hasil desain telah memenuhi acuan pada program. Pada kedua primer tersebut terdapat perbedaan nilai Tm sebesar 1°C. Perbedaan nilai Tm antar dua primer yang diperbolehkan adalah tidak lebih dari 5°C. Hal ini akan menjamin diperolehnya temperatur annealing yang tepat dan spesifik pada proses PCR [8].
Dari hasil analisis in silico nilai dimers pada ujung 3’ adalah masing-masing 2. Dimers selain ujung 3’ adalah untuk forward 2 dan reverse 3. Kedua primer tidak memiliki hairpins. Sehingga kedua primer telah memenuhi kriteria primer yang baik. Pada primer forward dan reverse sebaiknya tidak ada dimers maupun hairpins [6]. Dimers menunjukkan adanya hibridisasi antara basa primer yang identik. Apabila terdapat dimers pada primer maka DNA polimerase dapat mengikat bagian yang identik dan memperpanjang kedua arah. Hal
ini dapat mengakibatkan penurunan efisiensi amplifikasi bahkan produk yang dihasilkan tidak sesuai dengan keinginan [9]. Adanya dimers pada ujung 3’ dapat menghambat proses amplifikasi karena amplifikasi dimulai dari ujung 3’ sehingga dapat mengurangi bahkan tidak membentuk produk PCR. Hairpins memiliki kesamaan dengan dimers, namun pada hairpins ujung-ujung primer saling berkomplemen [10]. Interaksi hairpins pada primer sama sekali tidak diperbolehkan.
Stabilitas primer menentukan efisiensi false priming. Primer yang ideal memiliki ujung 5' yang lebih stabil dari pada ujung 3'. Jika primer memiliki ujung 3' yang lebih stabil, maka ikatan ke situs komplemen akan menggantung di tepi. Hal ini akan mengakibatkan band sekunder. [11]. Stabilitas primer yang disarankan adalah 1,2 kcals atau lebih. Primer yang dihasilkan telah memenuhi kriteria dengan stabilitas 2,3 kcals meskipun kedua ujung primer memiliki stabilitas yang sama.
Repeats merupakan pengulangan dinukleotida secara berurutan. Runs merupakan pengulangan nukleotida secara berurutan. Primer tidak diperbolehkan mengandung tiga atau lebih repeats dan runs [11]. Hal ini dikarenakan adanya repeats dan runs akan meningkatkan kemungkinan false priming.
Adanya false priming atau kesalahan penempelan primer di luar suhu annealing akan mengakibatkan kesalahan pembentukan produk pada suhu tertentu sehingga hasil yang diinginkan tidak sesuai.
Keberhasilan desain primer secara in silico dapat diuji secara in vitro melalui teknik PCR. Melalui teknik PCR, dapat diketahui kemampuan amplifikasi primer dan deteksi produk PCR dengan teknik elektroforesis gel agarosa 1,5%. Proses amplifikasi dimulai dengan denaturasi awal pada suhu 95°C selama 15 menit dan diikuti oleh 45 siklus yang terdiri dari denaturasi pada suhu 94°C selama 1 menit, annealing pada suhu 56°C selama 1 menit 20 detik dan elongasi pada suhu 72°C selama 2 menit. Proses amplifikasi diakhiri dengan elongasi
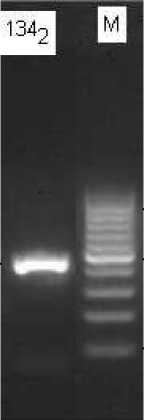
akhir pada suhu 72°C selama 10 menit. Template DNA yang digunakan berasal dari DNA kromosomal yang diisolasi dari isolat klinis 134 multidrug resistance tuberculosis. Hasil yang diperoleh berupa elektroforegram yang diperlihatkan pada Gambar 6.
Hasil elektroforesis pada gambar 6 menunjukkan bahwa primer pF-inhA dan pR-inhA telah berhasil mengamplifikasi fragmen gen inhA dengan ukuran produk 460 pb (0,4 kb) sesuai dengan hasil analisis secara in silico.
0,4 kb
1 kb
0,5 kb
0,1 kb
Gambar 6. Elektroforegram amplifikasi fragmen gen inhA isolat 134 pada suhu annealing 56°C. Marker DNA ladder 100 pb (0,1 kb) (M); isolat 134 (1342)
Desain primer secara in silico menghasilkan primer terbaik dan telah memenuhi kriteria panjang primer, persen GC, melting temperature, interaksi primer (dimers dan hairpins), stabilitas primer, serta repeats dan runs. Sepasang primer yang diperoleh dari hasil desain adalah primer forward (pF-inhA) 5’ CTGGTTAG-CGGAATCATCAC 3’ dan primer reverse (pR -inhA) 5’ CGACCGTCATCCAGTT-GTA 3’. Sepasang primer hasil desain, secara in vitro mampu mengamplifikasi fragmen inhA dan menghasilkan amplikon dengan ukuran 460 pb sesuai dengan hasil
analisis secara in silico pada program Clone Manager Suite 6.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu baik secara langsung maupun tidak langsung sehingga penelitian ini dapat dilaksanakan dengan baik.
-
[1] European Lung Foundation (ELF), Mutidrug-Resistant Tuberculosis (MDR-TB). Report, 2009.
-
[2] World Health Organization (WHO), Global Tuberculosis Report 2014. Global Report, 2014.
-
[3] Valvatne, H., H. Syre, M. Kross, R. Stavrum, Ti Ti, S. Phyu and H. M. S. Grewal, Isoniazid and rifampicin resistance-associated mutations in Mycobacterium tuberculosis isolates from Yangon, Myanmar:
implications for rapid molecular testing. Journal of Antimicrobial Chemotherapy, 2009, 64: 694–701.
-
[4] Handoyo, D. dan A. Rudiretna, , Prinsip Umum Dan Pelaksanaan Polymerase Chain Reaction (PCR) (General Principles and
Implementation Of Polymerase Chain Reaction). Unitas., 2000, 9 (1): 17-29.
-
[5] Zador, E., , The Polymerase Chain Reaction. PCR Lectures, 2011
-
[6] Henegariu, O., N. A. Heerema, S. R. Dlouhy, G. H. Vancee and P. H. Vogt, , Multiplex PCR: Critical by Step Protocol. BioTechniques., 1997, 23: 504-511.
-
[7] Borah, P., 2011, Primer Designing for PCR. Science Vision., vol. 11(3): 134-136.
-
[8] Bartlett, J. M. S. dan Stirling, D., Methods in Molecular Biology. Vol. 226 : PCR Protocols 2nd Editions. Totowa, NJ : Human Press Inc. 2003: 81-604.
-
[9] Yuryev, A., PCR Primer Design. Santalucia : Humana Press, 21-22.
-
[10] Judelson, H., Guidelines For Designing Primers. Primer
Guidelines., 2006, 10 (6): 1-5.
-
[11] Premier Biosoft International (PBI), Net Primer Manual. 2009
96
Discussion and feedback