AKTIVITAS ANTIKANKER ISOLAT TOKSIK DARI EKSTRAK METANOL SPONS GENUS Haliclona Grant, 1836 TERHADAP SEL HELA
on
Cakra Kimia (Indonesian E-Journal of Applied Chemistry)
Volume 3, Nomor 12, Mei 2015

AKTIVITAS ANTIKANKER ISOLAT TOKSIK DARI EKSTRAK METANOL SPONS GENUS Haliclona Grant, 1836 TERHADAP SEL HELA
Ni Made Diani1*), I Made Dira Swantara1,2, dan I Gede Mahardika3 1Program Studi Magister Kimia Terapan Universitas Udayana, Denpasar, Bali-Indonesia 2Jurusan Kimia FMIPA, Universitas Udayana, Bukit Jimbaran, Bali-Indonesia 3Fakultas Peternakan Universitas Udayana, Bukit Jimbaran, Bali-Indonesia *made.diani@yahoo.com
ABSTRAK: Telah dilakukan uji aktivitas antikanker isolat toksik dari ekstrak metanol spons genus Haliclona Grant, 1836 terhadap sel HeLa. Uji untuk mengetahui toksisitas spons genus Haliclona Grant, 1836 dilakukan dengan metode Brine Shrimp Lethality Test (BSLT) menggunakan larva Artemia salina Leach terhadap ekstrak etanol dan metanol spons tersebut. Hasil uji menunjukkan ekstrak metanol bersifat lebih toksik dengan nilai LC50 32,36 ppm. Hasil partisi ekstrak metanol menghasilkan ekstrak n-heksana, kloroform dan air. Ekstrak kloroform memiliki toksisitas paling tinggi dengan LC50 64,57 ppm. Ekstrak kloroform dipisahkan dengan kromatografi kolom silika gel menggunakan eluen etil asetat : n-heksana (2 : 8), diperoleh 5 fraksi (F1 – F5). Fraksi satu (F1) memberikan nilai toksisitas paling tinggi dengan LC50 70,79 ppm dan berdasarkan uji fitokimia diduga mengandung senyawa golongan steroid. Isolat toksik (F1) selanjutnya diuji secara in vitro terhadap sel HeLa, namun memiliki daya hambat yang sangat rendah dalam membunuh sel HeLa dengan nilai IC50 sebesar 2187,5 ppm.
Kata kunci : spons, toksisitas, antikanker, sel HeLa
ABSTRACT: A research to test the anticancer activity toxic isolate of the methanol extract genus sponge of Haliclona Grant, 1836 to HeLa cells was conducted. Preliminary test to determine the toxicity of the ethanol and methanol crude extract genus sponge of Haliclona Grant, 1836 was conducted using Brine Shrimp Lethality Test. The results showed that the methanol extract was more toxic with the LC50 value of 32,36 ppm. Partitions of the methanol extract using n-hexane, chloroform and water were conducted and it was found that the chloroform extract was the most toxic against Artemia salina L. larvae with LC50 of 64,57 ppm. The chloroform extract was separated by column chromatography using ethyl acetate : n-hexane (2 : 8) as eluent and 5 fractions (F1, F2, F3, F4 and F5) were obtained. First fraction (F1) was the most toxic with LC50 of 70,79 ppm. Based on the phytochemical tests the toxic compounds were suspected to be a steroid. Furthermore, the toxic isolates (F1) was tested in vitro against HeLa cells, but it was not able to inhibit the growth and kill HeLa cells with IC50 value of 2187,5 ppm.
Keywords: sponge, toxicity, anticancer, HeLa cells
Spons merupakan salah satu ekosistem terumbu karang di laut yang sangat potensial sebagai sumber bahan aktif. Spons sebagai invertebrata yang menghasilkan senyawa bioaktif terbesar [3].
Penelitian potensi metabolit sekunder yang dimiliki spons asal perairan di Indonesia sudah dimulai sejak hampir empat dekade yang lalu, saat Corley pada tahun
1988 mengisolasi laulimalida dan isolaulimalida dari spons Hyatella sp. yang memiliki sifat sitotoksik. Senyawa antioksidan berhasil diidentifikasi dari spons Callyspongia sp. asal Kepulauan Seribu [4]. Spons Kaliapsis sp. asal Pulau Menjangan, Bali Barat bersifat sitotoksik terhadap sel tumor myeloma [5]. Spons Cryptotethia crypta dilaporkan berpotensi sebagai obat antikanker [6]. Hasil uji antikanker ekstrak spons Haliclona sp. dilaporkan memberikan LC50 sebesar 8,16 µg/ml, sedangkan ekstrak spons Agelas nakamurai sebesar 4,50 µg/ml [7]. Berdasarkan berbagai penelitian di atas, beberapa jenis spons memiliki sifat toksik dan berpotensi sebagai agen antikanker.
Senyawa aktif dari bahan alam menjadi prioritas dalam penemuan obat baru untuk mengatasi masalah pengobatan kanker. Agen antikanker dari bahan alam mampu mengobati pada sumber penyakit dengan memperbaiki sel-sel, jaringan, dan organ tubuh yang rusak serta meningkatkan sistem kekebalan tubuh [8].
Spons potensial dijadikan bahan eksplorasi pencarian senyawa baru antikanker karena spons merupakan penghasil senyawa bioaktif antiviral maupun senyawa sitotoksik [9]. Bali yang memiliki wilayah laut yang kaya akan terumbu karang menyimpan potensi untuk pengembangan penelitian tentang spons.
Pada uji pendahuluan telah dilakukan uji toksisitas ekstrak etanol dan metanol dari spons genus Haliclona Grant, 1836. Berdasarkan uji terhadap ekstrak etanol dan metanol salah satu genus spons koleksi dari Pantai Semawang, Sanur Bali ini, diperoleh nilai LC50 masing-masing 46,77 ppm dan 32,36 ppm terhadap uji Brine Shrimp Lethality Test (BSLT). Uji sitotoksisitas BSLT digunakan untuk praskrining terhadap senyawa-senyawa yang diduga berkhasiat sebagai antikanker [10]. Berdasarkan nilai LC50, ekstrak metanol bersifat lebih toksik. Dengan demikian, pada penelitian ini dilakukan uji aktivitas antikanker terhadap sel HeLa pada isolat yang difraksinasi dari ekstrak metanol spons genus Haliclona Grant, 1836.
Penelitian ini menggunakan dua rancangan penelitian, yaitu: deskriptif
eksploratif dan eksperimental. Penelitian deskriptif eksploratif meliputi isolasi dan identifikasi, sedangkan penelitian
eksperimental meliputi uji toksisitas dan aktivitas antikanker.
Bahan yang digunakan dalam penelitian ini adalah spons genus Haliclona Grant, 1836 yang diperoleh dari Pantai Semawang, Sanur Bali. Bahan biologi sebagai uji toksisitas adalah larva Artemia salina Leach dan bahan untuk uji antikanker menggunakan sel kanker serviks (human servical cell line), HeLa.. Bahan-bahan kimia yang digunakan dalam penelitian ini adalah dalam derajat p.a dan teknis yang telah didestilasi seperti: metanol, etanol, n-heksana, etilasetat, kloroform, silika gel GF254, silika gel 60, DMSO, kalsium klorida anhidrat (CaCl2), asam asetat glasial, asam formiat, aseton. NaOH 10%, asam sulfat pekat, asam klorida pekat dan 2 N, benzena, pereaksi Liebermann-Burchard, pereaksi Dragendorff, pereaksi Meyer, natrium klorida.
Alat yang digunakan dalam penelitian ini adalah seperangkat alat gelas, neraca analitik, pisau, penguap putar vakum, lampu UV, seperangkat alat kromatografi lapis tipis dan kolom, desikator, tabung reaksi, plat tetes, bak kaca/akuarium, plastik hitam, pipet tetes, pipet mikro dengan berbagai ukuran, multiwall plate (96 well), culture flask (25 cm), culture flask (75 cm), pippetes tip (1 mL), pippetes tip (10 mL), kertas saring.
Spons genus Haliclona Grant, 1836 sebanyak 3000 g diekstraksi secara maserasi dengan 5 L metanol sampai terendam. Setiap 24 jam filtratnya disaring dan ampasnya
dimaserasi lagi dengan metanol. Ekstraksi dilakukan selama 3 hari dan diperkirakan semua metabolit terekstrak. Semua filtrat metanol diuapkan menggunakan penguap putar vakum sampai menghasilkan ekstrak kasar metanol.
Ekstrak kasar metanol dilarutkan dalam 250 mL air, selanjutnya dipartisi dengan n-heksana dan kloroform. Kemudian dievaporasi sehingga diperoleh ekstrak kental n-heksana (EH), kloroform (EK) dan ekstrak kental air (EA). Ketiga ekstrak diuji toksisitasnya terhadap larva Artemia salina Leach. Fraksi yang paling toksik dilanjutkan untuk dipisahkan dan dimurnikan.
Pemisahan metabolit dilakukan menggunakan metode kromatografi kolom dengan fase diam silika gel 60 (70 – 230 mesh ASTM) dengan eluen terbaik hasil kromatografi lapis tipis (KLT). Kemudian isolat hasil kolom diuji toksisitasnya terhadap larva Artemia salina Leach.
Uji toksisitas dengan larva Artemia salina Leach mengikuti metode Meyer (1982) [10]. Media untuk larva dibuat dengan menyaring air laut secukupnya. Air laut dimasukkan dalam akuarium yang dibagi menjadi dua bagian, yaitu satu bagian dibuat gelap dengan cara ditutup dengan kertas hitam dan bagian yang lain dibiarkan terbuka. Sebanyak 50 mg telur Artemia salina Leach diletakkan atau direndam pada bagian yang gelap dan dibiarkan selama 48 jam sampai menetas menjadi benur (larva) yang matang dan siap digunakan untuk pengujian.
Dua puluh miligram ekstrak dilarutkan dengan 2 mL pelarut. Larutan diambil sebanyak 500 µL, 50 µL dan 5 µL, kemudian masing-masing dimasukkan ke dalam tabung reaksi dan pelarutnya diuapkan. 50 µL dimetilsulfoksida, 1 mL air laut, dan 10 ekor larva dimasukkan ke dalam tabung reaksi yang pelarutnya telah diuapkan. Air laut ditambahkan ke dalam tabung sampai volumenya 5 mL sehingga dicapai konsentrasi ekstrak 1000 ppm, 100
ppm, dan 10 ppm. Konsentrasi 0 ppm juga dibuat sebagai kontrol tanpa penambahan ekstrak. Masing-masing tabung reaksi ditutup dengan aluminium foil yang berlubang kecil-kecil. Setelah 24 jam, dilakukan pengamatan terhadap kematian larva Artemia salina Leach. Kriteria standar untuk menilai kematian larva adalah bila larva Artemia salina Leach tidak menunjukkan pergerakan selama beberapa detik observasi [11]. Jumlah larva yang hidup dan yang mati dicatat, kemudian dilakukan analisis data untuk mencari konsentrasi kematian (LC50).
Persen mortalitas larva untuk setiap konsentrasi dapat dihitung dengan rumus:
% jumlah, larva mati 1 nn n.
mortalitas =
jumlah larva total awal
Dari persen mortalitas bioindikator, kemudian dibuat grafik antara % mortalitas vs log konsentrasi, dan diperoleh garis lurus dengan persamaan: y = mx + b. Nilai LC50 diperoleh dari anti log konsentrasi, dengan x merupakan logaritma konsentrasi bahan toksik pada y = 50. Suatu zat dikatakan toksik bila nilai LC50 < 1000 ppm untuk ekstrak dan < 30 ppm untuk suatu senyawa [10].
Isolat toksik terhadap larva Artemia salina Leach diidentifikasi golongan senyawanya menggunakan uji fitokimia. Uji fitokimia dapat dilakukan dengan menggunakan pereaksi pendeteksi golongan senyawa [12].
Sel HeLa dikultur pada media DMEM, FBS 10 %, 100 µg/mL dan streptomycin 100 µg/mL dan dihitung jumlah sel awal di bawah mikroskop. Sel diinkubasi dalam inkubator suhu 370 C, 5 % CO2. Kemudian sel dipanen dengan penambahan tripsin. Selanjutnya sampel disentrifugasi hingga terbentuk dua lapisan yaitu endapan dan supernatan. Supernatannya dibuang,
sedangkan endapan dibentuk pelet dan ditambahkan media pertumbuhan baru.
Setelah sel mencukupi, sel ditanam pada 96 multi-well plate. Tiap sumuran berisi 5 x 103 sel dalam 100 µL media DMEM. Inkubasi sel selama 1-2 jam hingga sel melekat. Selanjutnya sebanyak 100 µL ekstrak sampel dengan berbagai konsentrasi ditambahkan pada setiap well, jadi total setiap well berisi 200 µL. Sumuran yang hanya berisi media DMEN sebagai kontrol media, sedangkan sumuran yang mengandung media DMEM dan sel komplit tanpa ekstrak sebagai kontrol sel. Inkubasi dalam inkubator CO2 5% selama 24 jam pada suhu 370 C. Setelah 24 jam sel dilihat di bawah mikroskop. MTT sebanyak 10 µL dengan konsentrasi 5 mg/mL ditambahkan pada masing-masing well. Inkubasi kembali selama 4 jam sampai terbentuk formazan. Reaksi MTT dihentikan dengan cara menambahkan SDS 50 µL sebagai stop solution, diinkubasi kembali dalam ruang gelap selama 12 jam. Formazan dielusikan dari sel dengan 150 µL DMSO. Pembacaan absorbansi dilakukan dengan ELISA microplate reader pada panjang gelombang 595 nm.
Aktivitas antikanker dapat ditentukan dari nilai IC50 yang diperoleh dari nilai x, dengan mensubstitusikan y = 50, yaitu nilai yang menyebabkan penurunan absorbansi sebanyak 50 % pada persamaan garis y = mx + b. Persamaan garis diperoleh dengan membuat grafik hubungan antara % daya hambat vs konsentrasi sampel.
Senyawa pada ekstrak metanol spons genus Haliclona Grant, 1836 lebih banyak terlarut pada pelarut air dibandingkan dalam n-heksana maupun kloroform. Hal ini menunjukkan senyawa yang terkandung dalam spons genus Haliclona Grant, 1836 sebagian besar bersifat polar.
Ketiga ekstrak kemudian diuji toksisitasnya terhadap larva Artemia salina L. Berdasarkan hasil uji toksisitas terhadap larva Artemia salina L., diperoleh bahwa ekstrak kloroform bersifat paling toksik yaitu memiliki nilai LC50 sebesar 64,57 ppm sedangkan ekstrak air dan n-heksana masing-masing memiliki nilai LC50 sebesar 112,20 ppm dan 426,58 ppm. Hasil uji ini mengindikasikan bahwa senyawa-senyawa yang memiliki toksisitas tinggi pada spons genus Haliclona Grant, 1836 bersifat semipolar. Selanjutnya terhadap ekstrak kloroform dilakukan pemisahan dengan kromatografi kolom.
Pada proses kromatografi kolom, fase diam yang digunakan adalah silika gel 60 sebanyak 60 g dan eluen etil asetat : n-heksana (2 : 8). Ekstrak kloroform yang digunakan sebanyak 1,5 g. Kecepatan alir fase gerak adalah 1 mL/menit. Eluat ditampung setiap 3 mL.
Seluruh eluat hasil kolom selanjutnya dilihat nodanya dengan cara KLT. Berdasarkan kesamaan pola nodanya diperoleh lima fraksi yaitu F1 – F5. Hasil uji toksisitas masing-masing fraksi ditunjukkan pada Tabel 1. Diantara semua fraksi yang diujikan, fraksi satu memiliki toksisitas paling tinggi terhadap larva Artemia salina L. dengan
Tabel 1.
Toksisitas Fraksi Hasil Kromatografi Kolom terhadap Larva Artemia salina Leach
|
Fraksi |
LC50 (ppm) |
|
F1 |
70,79 |
|
F2 |
128,82 |
|
F3 |
213,79 |
|
F4 |
323,59 |
|
F5 |
575,44 |
nilai LC50 sebesar 70,79 ppm. Nilai LC50 dari ekstrak kasar metanol, ekstrak partisi kloroform dan isolat toksik F1 berturut-turut sebesar 32,36 ppm; 64,57 ppm dan 70,79 ppm. Nilai LC50 ini menunjukkan kecenderungan yang menurun. Hal ini kemungkinan disebabkan senyawa-senyawa toksik yang terkandung dalam ekstrak spons genus Haliclona Grant, 1836 bekerja sinergis sehingga ketika dipisahkan toksisitasnya cenderung menurun.
Fraksi satu (F1) menunjukkan satu spot dengan nilai Rf paling besar yaitu sebesar 0,506 dibandingkan spot pada fraksi lainnya. Hal ini mengindikasikan bahwa senyawa yang terkandung dalam fraksi satu sangat lemah teradsorpsi pada silika gel sehingga terelusi paling awal. Fraksi satu selanjutnya diidentifikasi golongan senyawanya dengan uji fitokimia.
-
3.3 Identifikasi Isolat Toksik Spons Genus Haliclona Grant, 1836 (F1) dengan Uji Fitokimia
Fraksi satu spons genus Haliclona Grant, 1836 diidentifikasi golongan senyawanya secara fitokimia. Hasil uji fitokimia menunjukkan bahwa fraksi satu mengandung senyawa steroid yang ditunjukkan dengan munculnya warna biru saat diberikan pereaksi Liebermann-Burchard.
-
3.4 Aktivitas Antikanker Isolat Toksik Spons Genus Haliclona Grant, 1836 terhadap Sel HeLa
Berdasarkan uji sitotoksisitas dengan MTT diperoleh nilai optical density (OD), kemudian nilai rata-rata OD tersebut dikonversi menjadi % daya hambat. Grafik hubungan antara % daya hambat vs konsentrasi fraksi digunakan untuk perhitungan IC50. Adapun grafik penentuan IC50 digambarkan pada Gambar 1.
Hubungan antara konsentrasi F1 dengan persen daya hambat mengikuti model persamaan y = 0,016x + 15,00, dengan y adalah % daya hambat dan x adalah konsentrasi F1 (ppm). Setelah nilai y
disubstitusikan sama dengan 50, maka diperoleh nilai IC50 adalah 2187,5 ppm.
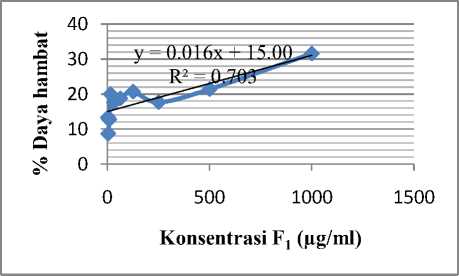
Gambar 1. Grafik % Daya Hambat Fraksi Satu Ekstrak Spons Genus Haliclona Grant, 1836 terhadap Sel HeLa
Nilai IC50 menunjukkan nilai
konsentrasi yang menghasilkan hambatan proliferasi sel sebesar 50 % dari populasi. Klasifikasi aktivitas sitotoksik ekstrak terhadap sel kanker dapat digolongkan kategori sangat aktif jika nilai IC50 < 10 μg/mL, kategori aktif jika nilai IC50 10 – 100 μg/mL dan kategori cukup aktif jika nilai IC50 100 - 500 μg/mL [13]. Senyawa murni digolongkan sangat aktif apabila memiliki nilai IC50 < 5 μg/mL, aktif 5-10 μg/mL, sedang 11-30 μg/mL dan tidak aktif >30 μg/mL [14]. Berdasarkan klasifikasi tersebut, isolat F1 spons genus Haliclona Grant, 1836 mempunyai aktivitas menghambat sel Hela dengan nilai IC50 2187,5 ppm (μg/mL), akan tetapi tidak berpotensi untuk dikembangkan sebagai obat antikanker.
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa:
-
1. Isolat (F1) dari fraksi kloroform
ekstrak metanol spons genus Haliclona Grant, 1836 bersifat toksik terhadap larva Artemia salina leach, dengan nilai LC50 sebesar 70,79 ppm.
-
2. Hasil uji fitokimia isolat F1 diduga mengandung senyawa steroid.
-
3. Isolat (F1) dari fraksi kloroform ekstrak metanol spons genus Haliclona Grant, 1836 memiliki aktivitas antikanker terhadap sel HeLa, dengan IC50 sebesar 2187,5 ppm.
Pada kesempatan ini, penulis mengucapkan terimakasih kepada semua pihak yang telah membantu penelitian ini.
-
[1] Jimeno, J. M. 2002. A Clinical Armamentarium of Marine Derived Anti-Cancer Compounds. Anticancer Drugs, 13(suppl 1): S15 – 19. Pomponi S A.
-
[2] Proksch, P., Ebel, R., Edrada, R. A., Schupp, P., Lin, W. H., Sudarsono, Wray, V. and Steube, K. 2003. Detection of Pharmacologically Active Natural Products Using Ecology, Selected Examples from Indopacific Marine Invertebrates and Spons-Derived Fungi. Pure Applied Chem. 75: 343-352.
-
[3] Murniasih, Tutik. 2005. Sustansi Kimia untuk Pertahanan Diri dari Hewan Laut Tak Bertulang Belakang. Oseana, Vol. 2 : 19-27.
-
[4] Hanani, Endang, Abdul Mun’im, Ryany Sekarini. 2005. Identifikasi Senyawa Antioksidan dalam Spons Callyspongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian, Vol. II, No.3, Desember 2005 : 127-133 (ISSN : 1693-9883).
-
[5] Setyowati, E., Anggara, U., Sudarsono, Kardono, B., Rahmat, R., dan Meiyanto, E. 2007. Isolasi Senyawa Sitotoksik Spons Kaliapsis. Majalah Farmasi Indonesia, 18 (4) : 183-189.
-
[6] Rasyid, Abdullah. 2009. Senyawa-senyawa Bioaktif dari Spons. Oseana, Vol. XXXIV, No. 2.
-
[7] Trianto, A., Ambariyanto. 2005. Isolasi Senyawa Antikanker Leukemia dari Sponge Agelas nakamurai dan Haliclona sp. Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro.
-
[8] Kamuhabwa, A., Nshimo, C., dan de Witte, P. 2000. Cytotoxicity of Some Medicinal Plant Extracts Used in Tanzanian 12 Tradisional Medicine. J. Ethnopharmacol. 70 : 143-149.
-
[9] Garson, M. J. 1994. The Biosynthesis of Secondary Metabolits: Why is
Important. In: Sponss in Time and Space, edited by R. W. M. Van Soest, Th. M. G. Van Kempen and J. C Braekman (eds.)., Proceeding 4th
International Porifera Conggress, Amsterdam/Netherland, : 428-429.
-
[10] Meyer, B. N, Ferrigni, N. R, and Mclaughlin. 1982. Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents. Journal of Planta Medical Research, Volume 45 :31-34.
-
[11] Carballo, J.L., Hernandez Inda, Z.L., Perez, P., Garcia Gravaloz, M.D. 2002. Comparison Between Two Brine Shrimp Assays to Detect in vitro Cytotoxicity in Marine Natural Products. BMC Biotechnology. Vol. 2 : 1472-6570.
-
[12] Harborne, J. B. 1987. Metode Fitokimia: Penuntun Cara Modern
Menganalisis Tumbuhan, Terjemahan Kosasih Padmawinata dan Iwang Soediro. Terbitan kedua. Bandung : ITB.
-
[13] Weerapreeyakul N, Nonpunya A, Barustux S, Thitimetharoch T, Sripanidkulchai B. 2012. Evaluation of the anticancer potential of six herbs against a hepatoma cell line. Chinese Med. 7(15) : 1-7.
-
[14] Cao, S. G., Valerie, H.L., Wu, X.H., Sim, K.Y., Tan, B.H.K., Pereira, J.T., and Goh, S.H. 1998. Novel Cytotoxic Polyprenylated Xanthones from Garcinia gaudichaudii. Tetrahedron, 54 : 10915-10924.
44
Discussion and feedback