THE SECONDARY ANTIBODY TITER AGAINST STREPTOCOCCUS SUIS VACCINE WITH DIFFERENT ADJUVANTS IN RAT
on
Volume 14 No. 6: 676-684
Desember 2022
DOI: 10.24843/bulvet.2022.v14.i06.p10
Buletin Veteriner Udayana
pISSN: 2085-2495; eISSN: 2477-2712
Online pada: http://ojs.unud.ac.id/index.php/buletinvet
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Titer Antibodi Sekunder Terhadap Vaksin Streptococcus suis dengan Adjuvant Berbeda pada Tikus Putih
(THE SECONDARY ANTIBODY TITER AGAINST STREPTOCOCCUS SUIS VACCINE WITH DIFFERENT ADJUVANTS IN RAT)
Sumanna Rumapea1, I Gusti Ngurah Kade Mahardika2, I Nengah Kerta Besung3
-
1Mahasiswa Program Profesi Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB. Sudirman, Denpasar, Bali, Indonesia;
-
2Laboratorium Biomedik dan Biologi Molekuler Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. Raya Sesetan, Gg. Markisa No.6, Denpasar, Bali, Indonesia;
-
3Laboratorium Mikrobiologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB Sudirman, Denpasar, Bali Indonesia.
*Email: sumanna17069@gmail.com
Abstrak
Streptococcus suis merupakan bakteri patogen yang dapat menyebabkan infeksi baik pada hewan maupun manusia. Penelitian ini bertujuan untuk mengetahui perbedaan titer antibodi sekunder dari pemberian vaksin S. suis dengan adjuvant yang berbeda terhadap antibodi sekunder. Jenis penelitian ini adalah eksperimental dengan rancangan acak lengkap. Sebanyak 15 ekor tikus dibagi menjadi 3 kelompok, yaitu kelompok perlakuan diberikan vaksin S. suis dengan MontanideTM ISA 78; MontanideTM ISA 201; MontanideTM Gel 01. Serum diambil pada minggu ke-0 (pravaksinasi), ke-1, ke-2, dan ke-3 pasca vaksinasi sekunder untuk pengukuran titer antibodi melalui sinus orbitalis dengan menggunakan metode ELISA tak langsung. Data dianalisis dengan Sidik Ragam dan dilanjutkan dengan uji LSD. Hasil penelitian menunjukkan bahwa pemberian vaksin S. suis dengan penambahan adjuvant berbeda mempunyai pengaruh yang nyata (P<0,05) terhadap titer antibodi sekunder. Vaksin S. suis dengan MontanideTM ISA 78 (w/o) menghasilkan titer antibodi sekunder paling tinggi (OD = 0,331), kemudian vaksin S. suis dengan MontanideTM Gel 01 (OD = 0,256). Titer antibodi sekunder terendah dihasilkan vaksin S. suis dengan MontanideTM ISA 201 (w/o/w) (OD = 0,208). Dari hasil tersebut dapat disimpulkan bahwa formulasi vaksin S. suis dengan MontanideTM ISA 78 (w/o) merupakan vaksin yang paling baik dalam produksi antibodi sekunder.
Kata kunci: Adjuvant; ELISA; Streptococcus suis; titer antibodi sekunder
Abstract
Streptococcus suis is a pathogenic bacteria which can cause an infection in animals nor humans. This study aimed to determine the difference in secondary antibody from the administration of S. suis vaccine with different adjuvants. This research is experimental with complete randomized design. Total of 15 rats was divided into 3 groups. Each groups was given S. suis vaccine with adjuvant MontanideTM ISA 78; MontanideTM ISA 201; MontanideTM Gel 01 by IM. The serum were taken from sinus orbitalis on the week 0 (pravacination), 1st week, 2nd week and 3rd week after booster. The secondary antibody titer were measured by indirect ELISA method. Data were analyzed using analysis of variance, then continued by LSD test. The result showed that S. suis vaccine with different adjuvants had a significant effect (P<0,05). S. S. suis vaccine with MontanideTM ISA 78 (w/o) produced the highest secondary antibody (OD = 0,331), then S. suis vaccine with MontanideTM Gel 01 (OD = 0,256). The lowest titer antibody was produced by S. suis vaccine with MontanideTM ISA 201 (w/o/w) adjuvant (OD = 0,208). From the results of this study, it can be concluded that the S.suis vaccine formulation with MontanideTM ISA 78 (w/o) is the best vaccine formulation in production of secondary antibody.
Keywords: Adjuvant; ELISA; Streptococcus suis; secondary antibody titer
PENDAHULUAN
Penyakit infeksi merupakan salah satu dalam urutan teratas penyebab penyakit dan kematian, tanpa terkecuali di negara maju maupun negara berkembang seperti Indonesia. Streptococcus suis pada babi merupakan bakteri Gram positif berbentuk coccus, bersifat fakultatif anaerob yang menimbulkan penyakit zoonosis pada manusia (Gottschalk dan Segura, 2000). Infeksi S. suis dapat menyebabkan septisemia, meningitis, artritis dan kematian terutama pada babi muda. Infeksi juga dapat terjadi pada saluran pernafasan sehingga dapat menyebabkan
bronkopneumonia (Wisselink et al., 2000).
Salah satu alternatif untuk menanggulangi infeksi S. suis yaitu antibiotika penisilin, namun S. suis menjadi semakin resisten terhadap penisilin, sehingga dokter sering menggabungkan berbagai jenis antibiotika untuk mencoba membunuh S. suis (Slipranata et al., 2016). Alternatif lain yaitu dengan vaksinasi. Salah satu upaya untuk meningkatkan efektivitas vaksinasi dalam mempercepat peningkatan titer antibodi adalah dengan penggunaan adjuvant pada vaksin (Suartha et al., 2011).
Adjuvant adalah bahan yang ditambahkan pada vaksin untuk merangsang respon imun. Vaksin dengan penambahan adjuvant dapat meningkatkan potensi sistem imun serta menambah lamanya perlindungan terhadap suatu infeksi penyakit pada hewan dan manusia (Rajput, 2007) sehingga akan terjadi kontak lebih lama dengan makrofag dan limfosit (Hadie et al., 2010). Dalam penelitian ini terdapat tiga jenis adjuvant yang digunakan untuk mendukung efektivitas vaksin Streptococcus suis dalam produksi titer antibodi sekunder yaitu adjuvant MontanideTM ISA 78 (water in oil), MontanideTM ISA 201 (water in oil in
water), dan MontanideTM Gel 01. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pemberian vaksin Streptococcus
Volume 14 No. 6: 676-684 Desember 2022 DOI: 10.24843/bulvet.2022.v14.i06.p10 suis dengan adjuvant berbeda terhadap titer antibodi sekunder.
METODE PENELITIAN
Penelitian dilaksanakan pada bulan Maret-Mei 2021 di Laboratorium Biomedik Veteriner Fakultas Kedokteran Hewan Universitas Udayana. Rancangan yang digunakan dalam penelitian ini yaitu rancangan acak lengkap (RAL). Penelitian menggunakan adjuvant yang ditambahkan ke dalam vaksin inaktif S. suis dengan 3 perlakuan dan 5 kali pengulangan. Pada penelitian ini digunakan sampel serum dari darah tikus putih yang divaksinasi sekunder S. suis dengan adjuvant berbeda dan berumur 2 bulan dengan berat badan 100130 gr. Total sampel yang diambil sebanyak 60.
Pembuatan Vaksin
Metode pembuatan vaksin S. suis dengan penambahan adjuvant adalah isolat bakteri S. suis dikultur pada media cair TSB, lalu diinkubasi selama 24 jam pada inkubator shaker. Kemudian sampel disentrifuge selama 10 menit dengan kecepatan 5000 rpm, supernatan dibuang dan sisa endapan kemudian dicampurkan dengan NaCl sampai mencapai volume 80 ml. Vaksin diinaktivasi dengan 3 langkah yaitu sonikasi dengan amplitudo 50% dalam waktu 20 menit menggunakan ultrasonikator, dan penambahan
formaldehid 37% dengan konsentrasi 0,4 sebanyak 864 µl. Sampel vaksin disimpan dalam inkubator shaker selama 24 jam dengan kecepatan 120 rpm dan suhu 300C. Selanjutnya dilakukan pemanasan dengan suhu 800C selama 2 jam dengan menggunakan inkubator. Kemudian uji viabilitas bakteri pada medium MHA dan diinkubasi selama 24 jam pada suhu 370C. Jika bakteri sudah tidak tumbuh kemudian vaksin S. suis inaktif ditambahkan masing-masing adjuvant dan NaCl. Perbandingan masing-masing konsentrasi adjuvant, NaCl dan antigen dalam sediaan vaksin S. suis yaitu 25%, 25%, 50% dari total sediaan akhir vaksin S. suis sebanyak 50 ml.
Pemisahan Serum
Vaksin S. suis diberikan pada setiap tikus uji dengan metode penyuntikan secara intra muskular (i.m) dengan volume pemberian 1 ml/tikus dengan kepadatan bakteri 4,5 x 107 CFU/ml. Tikus putih uji sebelumnya telah diberikan vaksinasi pertama S. suis dengan penambahan adjuvant berbeda pada minggu ke-2 pemeliharaan, dan vaksinasi kedua diberikan minggu ke-3 setelah vaksinasi pertama. Pengambilan darah dilakukan pada minggu ke-0 (pravaksinasi), minggu ke-1, ke-2 dan ke-3 setelah vaksinasi sekunder dengan menggunakan mikrohematokrit dari sinus orbitalis mata kemudian darah ditampung dalam tabung eppendorf 1,5 ml. Darah tikus yang telah diambil kemudian disentrifuse dengan kecepatan 10000 rpm selama 10 menit untuk mendapatkan serumnya. Serum disimpan di dalam refrigator selama 24 jam untuk digunakan dalam uji titer antibodi sekunder.
Enzyme Linked Immunosorbant Assay (ELISA)
Serum darah tikus putih setelah vaksinasi kedua diukur titer antibodinya menggunakan metode indirect ELISA. Secara ringkas sebagai berikut: antigen diencerkan dengan menggunakan ELISA coating buffer dengan perbandingan 1:1000. Sumur plate mikrotiter dilapisi 50µl antigen pengenceran dengan dengan cara pipeting. Plate ditutup dan diinkubasi semalaman pada suhu 40C. Kemudian plate dicuci sebanyak tiga kali dengan PBS tween. Sebanyak 0,25 gr susu skim dilarutkan dengan 5 ml PBS tween, dan dipipetting sebanyak 57 µl ke dalam masing-masing sumur plate. Plate ditutup dan diinkubasi 1 jam pada suhu kamar. Selanjutnya, plate dicuci sebanyak tiga kali dengan PBS tween, dan pada setiap sumur plate ditambahkan 50 µl PBS tween. Kemudian 2 µl sampel/serum ditambahkan ke masing-masing plate. Plate ditutup dan diinkubasi selama 1 jam pada suhu kamar. Kemudian, plate dicuci sebanyak tiga kali dengan PBS tween. Sebanyak 50µl
konjugat antirat IgG alkaline fosfat ditambahkan pada masing-masing sumur dan diinkubasi selama 1 jam. Selanjutnya, plate dicuci sebanyak tiga kali dengan PBS tween. Susbtrat p-NPP (p-nitriphenyl phospatase) dimasukkan ke dalam microplate sebanyak 50 µl per-sumuran dan diinkubasi pada suhu kamar selama 15-30 menit hingga terjadi perubahan warna. Hasil dibaca serapannya pada ELISA reader dengan panjang gelombang 400 nm.
Analisis Data
Data yang didapatkan dianalisis dengan analisis sidik ragam. Jika terdapat beda nyata antar perlakuan maka dilanjutkan uji LSD pada selang kepercayaan 95%.
HASIL DAN PEMBAHASAN
Hasil
Dari Tabel 1 dapat dilihat bahwa hasil rata-rata OD serum pasca booster paling tinggi dihasilkan perlakuan vaksin S. suis dengan penambahan MontanideTM ISA 78 (w/o) yaitu 0,331; dan hasil rata-rata OD serum perlakuan vaksin S. suis dengan penambahan MontanideTM Gel 01 yaitu 0,256; dan yang terendah yaitu perlakuan vaksin S. suis dengan penambahan MontanideTM ISA 201 (w/o/w) yaitu 0,208 (Tabel 1). Penambahan adjuvant ternyata dapat meningkatkan imunogenisitas vaksin. Hal ini kemungkinan dikarenakan adjuvant merupakan suspensi yang ditambahkan ke dalam vaksin dan dapat memperlambat proses penghancuran antigen dalam tubuh sehingga akan terjadi kontak lebih lama dengan makrofag dan limfosit serta merangsang pembentukan sistem imun yang tinggi (Hadie et al., 2010). Hasil analisis univariate menunjukkan penambahan adjuvant yang berbeda pada vaksin S. suis memiliki pengaruh yang nyata terhadap titer antibodi sekunder (P<0,05) (Tabel 1).
Hasil dari uji lanjutan menunjukkan adanya perbedaan yang bermakna antara kelompok MontanideTM ISA 78 (w/o) dan MontanideTM ISA 201 (w/o/w) (P<0,05), demikian juga terdapat perbedaan yang
bermakna antara kelompok MontanideTM ISA 78 (w/o) dan MontanideTM Gel 01 (P<0,05). Selanjutnya, hasil uji lanjutan juga menunjukkan bahwa ada perbedaan yang bermakna antara kelompok MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01 (P<0,05). Vaksin S. suis dengan MontanideTM ISA 78 (w/o) menghasilkan tingkat titer antibodi sekunder yang paling tinggi hal ini dilihat dari nilai rata-rata OD yang paling tinggi dibandingkan vaksin S. suis dengan MontanideTM ISA 201 (w/o/w) maupun MontanideTM Gel 01 yang menghasilkan tingkat titer antibodi sekunder paling tinggi adalah MontanideTM ISA 78 (w/o) dengan nilai rata-rata OD yang paling tinggi dibandingkan jenis adjuvant lainnya.
Hasil analisis sidik ragam univariate menunjukkan bahwa waktu pengambilan serum berpengaruh sangat nyata (P<0,05) terhadap nilai OD S. suis pasca vaksinasi kedua. Hal ini dapat dilihat dari nilai signifikansi yaitu 0,024 (P<0,05).
Hasil uji LSD menunjukkan terjadi peningkatan nilai rata-rata OD tikus setelah vaksinasi kedua S. suis dengan penambahan adjuvant MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01 yang sangat nyata (P<0,05) dari minggu ke-0 sampai dengan minggu ke-2. Pada minggu selanjutnya mengalami penurunan dari minggu ke-2 sampai minggu ke-3. Hal ini dapat dilihat dari signifikansi pada uji LSD yaitu (P>0,05). Sedangkan pada vaksinasi S. suis kedua dengan penambahan MontanideTM ISA 78 hasil uji LSD menunjukkan terjadi peningkatan nilai rata-rata OD dari minggu ke-0 sampai minggu ke-1. Pada minggu selanjutnya mengalami penurunan dari minggu ke-1 sampai minggu ke-2. Hal ini dapat dilihat dari signifikansi pada uji LSD yaitu (P>0,05). Kemudian pada minggu selanjutnya cenderung mengalami peningkatan dari minggu ke-2 sampai dengan minggu ke-3.
Gambar 1 menunjukkan rerata OD serum S. suis tikus pasca vaksinasi kedua dengan penambahan adjuvant berbeda
mengalami peningkatan setiap minggunya. Pada minggu ke-0 (pravaksinasi), masing-masing rerata OD S. suis dengan penambahan MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01 adalah 0,247; 0,229; dan 0,136. Pada minggu ke-1, masing-masing rata-rata hasil pemeriksaan OD S. suis dengan MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan
MontanideTM Gel 01 adalah 0,334; 0,270; dan 0,226. Pada minggu ke-2. masing-masing rata-rata hasil pemeriksaan OD S. suis dengan MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan
MontanideTM Gel 01 adalah 0,315; 0,281; dan 0,247. Pada minggu ke-3, masing-masing rata-rata hasil pemeriksaan OD S. suis dengan MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan
MontanideTM Gel 01 adalah 0,347; 0,242; dan 0,221. Nilai rata-rata OD serum tertinggi dari vaksin S. suis dengan adjuvant MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01 dihasilkan pada minggu ke-2 pasca vaksinasi kedua. Untuk nilai rata-rata OD serum tertinggi dari perlakuan vaksin S. suis dengan MontanideTM ISA 78 (w/o), dihasilkan pada minggu ke-3 setelah vaksinasi kedua. Hal ini menunjukkan bahwa waktu pengambilan serum S. suis berpengaruh sangat nyata (P<0,05) terhadap rerata OD pada serum tikus yang divaksinasi S. suis dengan penambahan adjuvant berbeda.
Pembahasan
Pengukuran titer antibodi sekunder berdasarkan intensitas warna yang terbentuk dari reaksi enzim yang terlabel di konjugat dengan substrat, dalam hal ini berwarna kuning. Intensitas warna yang dihasilkan sebanding dengan jumlah titer antibodi sekunder. Titer antibodi sekunder serum ditentukan berdasarkan nilai Optycal Density. Hal ini sesuai dengan pendapat Santoso et al., (2021) bahwa titer antibodi berkorelasi dengan nilai absorbansi (Optical Density).
Vaksin Streptococcus suis merupakan alat penting untuk pencegahan dan pengendalian penyakit akibat bakteri Streptococcus suis pada hewan. Salah satu langkah terpenting dalam pengembangan vaksin ini adalah pemilihan adjuvant yang sesuai. Dalam penelitian ini tiga jenis adjuvant berbeda diformulasikan dengan vaksin inaktif S. suis, ketiga formulasi tersebut memiliki tingkat viskositas yang berbeda. Vaksin S.suis dengan MontanideTM ISA 78 (w/o) memiliki viskotitas yang paling tinggi dan sulit diinjeksi dibandingkan dengan vaksin S. suis dengan penambahan MontanideTM ISA 201 (w/o/w) maupun MontanideTM Gel 01. Hal ini sesuai dengan pendapat Krasucka et al. (2014) yang mengatakan bahwa adjuvant water in oil memiliki fase minyak yang berkelanjutan sehingga tingkat viskositas nya tinggi dan mengakibatkan sulit untuk diinjeksi.
Hasil dari penelitian ini menunjukkan terdapat perbedaan titer antibodi sekunder dari serum tikus pasca vaksinasi kedua terhadap vaksin S. suis dengan penambahan ajuvant MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01. Perbedaan tingkat respon imun pasca vaksinasi dapat dipengaruhi oleh beberapa vaktor diantaranya adalah kemungkinan karena perbedaan respon individu, perbedaan kemampuan antigenik dari antigen vaksin yang digunakan serta komposisi adjuvant (Kencana et al., 2016). Vaksin inaktif akan menjadi lebih baik, bila ditambahkan adjuvant untuk meningkatkan respon kekebalannya. Adjuvant pada vaksin inaktif memiliki fungsi untuk melindungi antigen dari kerusakan yang disebabkan oleh respon imun. Adanya adjuvant dalam vaksin inaktif membuat vaksin membutuhkan waktu yang relatif lama untuk memicu pembentukan antibodi, namun respon kekebalan yang terbentuk akan bertambah lebih lama (Suwartini et al., 2018). Hal ini diakibatkan adanya perbedaan mekanisme kerja dari adjuvant yang berbeda. Pada penelitian (Burakova et
al., 2018) menunjukkan bahwa jenis adjuvant yang berbeda memiliki mekanisme yang berbeda pula dalam formulasi vaksin. Menurut Vogel (2000) secara umum sebagian besar mekanisme kerja adjuvant yaitu meningkatkan presentasi antigen, meningkatkan stabilitas antigen, atau bertindak sebagai immunomodulator (Vogel, 2000). Adjuvant dapat memberikan perlindungan fisik terhadap antigen yang akan memperlambat proses penghancuran dalam tubuh. Sehingga pada akhirnya adjuvant diyakini dapat meningkatkan kualitas respon dari kekebalan antibodi yang dihasilkan (Hadie et al., 2010).
MontanideTM ISA 78 (w/o) merupakan generasi baru adjuvant water in oil yang dikembangkan Seppic dengan menggambungkan minyak mineral yang diperkaya dan senyawa imunostimulan untuk mencapai kekebalan lebih tinggi dibandingkan dengan formulasi standar adjuvant yang lain. MontanideTM ISA 78 (w/o) akan menarik makrofag dan limfosit untuk bereaksi dengan antigen teridentifikasi untuk menghasilkan antibodi. Bersamaan dengan hal tersebut adjuvant ini berdifusi mentransportasi antigen ke seluruh organ limfoid sekunder, serta berinteraksi dengan antigen termasuk fagosit, makrofag dan sel dendrit dan terus-menerus merangsang kekebalan tubuh, memperbarui efisiensi dari imun yang lama sehingga menghasilkan antibodi yang lebih tinggi (Haizhou et al., 2012). Berbagai studi skrining pada tikus dengan antigen virus, bakteri atau parasit, telah menunjukkan bahwa adjuvant ini mampu menginduksi tingkat antibodi IgG yang lebih tinggi daripada jenis adjuvant yang lain. Selain itu, sifat viskositas yang dimiliki MontanideTM ISA 78 (w/o) mengakibatkan pelepasan antigen secara perlahan dan dapat memberikan kekebalan jangka panjang yang baik (Aucouturier et al., 2001).
MontanideTM Gel 01 merupakan adjuvant jenis gel yang didasarkan pada polimer sintetik yang tergolong dalam
kategori high molecular weight polyacrylic acid, dan memiliki karakteristik viskositasnya dan kemampuan untuk bekerja di bawah semua kondisi pH. Adjuvant ini memicu respon imun humoral dan respon imun diperantarai sel tanpa mortalitas, toksisitas atau efek pirogenik. Adjuvant ini diproduksi oleh Seppic, Paris (Alsaid et al., 2020). Injeksi vaksin dengan adjuvant MontanideTM Gel 01 akan menginduksi respon imun terhadap antigen melalui tiga cara yaitu: 1) Antigen secara berkelanjutan dilepaskan di lokasi suntikan; 2) Rekrutmen sistem kekebalan bawaan oleh profil pro-inflamasi pada otot yang disuntikkan; 3) Peningkatan fagositosis kompleks antigen sehingga meningkatkan aktivitas sel penyaji antigen (Vialle et al., 2010).
MontanideTM ISA 201 (w/o/w) dikembangkan berdasarkan minyak mineral yang ringan yang diperkaya khusus dan dengan sistem surfaktan berbasis mannide-oleat. Formula baru ini dipilih untuk meningkatkan respon imun yang diperantarai sel dari vaksin w/o/w dan juga mempertahankan profil keamanan yang konstan dan respon imun humoral (Bouguyon, 2015). Adjuvant ini memiliki viskositas yang rendah dan memiliki kemampuan untuk meningkatkan respon imun.
Dari hasil penelitian MontanideTM Gel 01 memiliki tingkat imunogenisitas yang tinggi dibandingkan dengan Montanide ISA 201 (w/o/w) dikarenakan adjuvant berbasis polimer dalam fase berair yang mengandung senyawa imunostimulan akan lebih cepat didistribusikan ke jaringan-jaringan, serta tingkat penyebaran dan penyerapan yang lebih cepat dibandingkan MontanideTM ISA 201 (w/o/w). Dalam hal ini, Deville et al., (2012) mengatakan adjuvant berbasis polimer merupakan formulasi yang dapat memberikan perlindungan pada tingkat yang lebih tinggi dan secara signifikan lebih efisien daripada formulasi komersial lainnya.
Pada minggu ke-3 titer antibodi yang terdeteksi dari vaksinasi kedua S. suis dengan penambahan adjuvant
MontanideTM Gel 01 dan MontanideTM ISA 201 (w/o/w) mulai mengalami penurunan, hal ini sesuai dengan pernyataan Malole (2005) dalam Hartati (2005) yang menyatakan bahwa titer antibodi protektif akan mengalami penurunan yang disebabkan oleh adanya proses waktu paruh antibodi. Namun, pada minggu ke-3 titer antibodi yang terdeteksi dari vaksinasi kedua S. suis dengan penambahan adjuvant MontandieTM ISA 78 (w/o) cenderung
mengalami peningkatan, hal ini karena antigen terperangkap dalam fase air yang dikelilingi fase minyak secara terus menerus dan secara perlahan-lahan akan dilepaskan setelah injeksi. Efek depot pada tempat suntikan menjaga antigen dari pemrosesan oleh fagositosis dan hati, oleh karena itu memperpanjang waktu yang tersedia untuk perekrutan sel imun dan pemrosesan antigen (Burakova et al., 2018).
Tingginya respon imun pasca vaksinasi kedua ini karena adanya sel memori yang tetap aktif setelah diberikan vaksinasi ulangan. Menurut Kurnianto et al., (2017), antibodi sekunder memiliki titer dan afinitas yang lebih tinggi serta fase lag yang lebih pendek dibandingkan respon imun primer. Hal tersebut disebabkan sel memori yang terbentuk pada respon imun primer, akan cepat mengalami transformasi dan diferensiasi menjadi penghasil antibodi.
SIMPULAN DAN SARAN
Simpulan
Pemberian vaksin inaktif S. suis dengan penambahan adjuvant yang berbeda memiliki pengaruh yang nyata terhadap titer antibodi sekunder (P<0,05). Formulasi vaksin S. suis dengan penambahan adjuvant MontanideTM ISA 78 memproduksi titer antibodi sekunder yang paling baik (OD = 0,331) dibandingkan jenis adjuvant MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01.
Saran
Disarankan perlu dilakukan penelitian lebih lanjut mengenai efek dari adjuvant MontanideTM ISA 78 (w/o), MontanideTM ISA 201 (w/o/w) dan MontanideTM Gel 01 dengan konsentrasi antigen yang lebih tinggi untuk menghasilkan titer antibodi sekunder yang lebih tinggi terhadap vaksin S. suis. Waktu pengamatan untuk titer antibodi sekunder perlu diperpanjang untuk mengetahui puncak produksi titer antibodi sekunder dari vaksin S. suis dengan penambahan adjuvant berbeda.
UCAPAN TERIMAKASIH
Terimakasih kepada Direktorat Sumber Daya, Direktorat Jenderal Pendidikan Tinggi, Kemenristek Dikti atas pembiayaannya dengan no kontrak: B/136-27/UN14.4.1/PT.01.05/2021. Ucapan
terimakasih kepada staf laboratorium Biomedik FKH Universitas Udayana yang telah membantu selama penelitian ini berlangsung.
DAFTAR PUSTAKA
Alsaid SA, Abdul MDM, Atwa MH, Soliman SM. 2020. Evaluation of the cellular humoral immune respone of sheep vaccinated with inactivated rift valley fever vaccine adjuvanted with montanideTM Gel 01. J. Appl. Sci. 5(1): 22-34.
Aucouturier, J., L. Dupuis, V. Ganne. 2001. adjuvants designed for veterinary and human vaccines. Vaccine. 19(17-19): 2666–2672.
Bouguyon. E., Elodie G, Alexander S, Pauline M, Stepan R, Oleg G, Sebastian D, Nicolas B, dan Juliette B A. 2015. A new adjuvant combined with inactivated influenza enhances specific CD8 T cell respone in mice and decreases symptoms in swine upon challenge. Viral Immunol. 28(9): 1-9.
Burakova Y, Rachel M, Scott M, John RS, Jishu S. 2018. Adjuvants for animals. Viral Immunol. 31(1): 11-22.
Deville S, Juliette BA, Francois B, Vladimir B, Laurent D. 2012. Efficacy of intranasal and spray delivery of adjuvanted live vaccine against nfectious bronchitis virus in experimentally infected poultry. Proc. Vaccinol. 6: 85-92.
Gottschalk M, Segura M. 2000. The pathogenesis of the menigitis caused by Streptococcus suis: the unresolved question. J. Vet. Microbiol. 76: 259272.
Hartati Y. 2005. Respon kekebalan vaksin influenza pada ayam indukan pedaging strain hubbard. Skripsi. Bogor: Institut Pertanian Bogor.
Hadie W, Angela ML, Sularto, Evi T. 2010. Imunitas maternal terhadap aeromonas hydrophila: pengaruhnya terhadap
fekunditas dan daya tetas ikan patin siam (Pangasionodon hypophthalmus). J. Riset Akuakultur. 8: 229-235.
Haizhou Z, Zou J, Dai J, Gao Z. 2012. Water in oil emulsion system and preparation process thereof. J. Eur. Patent Office. 12(82): 1-5.
Kencana GAY, Suartha IN, Paramita NMAS, Handayani AN. 2016. Vaksin kombinasi newcastle disease dengan avian influenza memicu imunitas protektif pada ayam petelur terhadap penyakit tetelo dan flu burung. J. Vet. 17(2): 257-264.
Krasucka DM, Katarzyna K, Aneta DW. Wojciech AC. 2014. Determination of the Viscosity and Density of Veterinary Vaccines. Acta Poloniae Pharm.-Drug Res. 71(6): 1090-1094.
Kurnianto AB, Kencana GAY, Astawa INM. 2017. Respon antibodi sekunder terhadap penyakit tetelo pada ayam peterlur pascavaksinasi ulangan dengan vaksin tetelo aktif. J. Vet. 17(3): 331336.
Malole. 2005. Bahan Teori dan Praktikum Apresiasi Teknik Virologi dan PCR Penyakit Hewan Aquatik. Balai Besar Karantina Ikan Soekarno-Hatta. Jakarta.
Rajput Z, Iqbal HUS, Xiao C, Ariko AG. 2007. Adjuvant Effects of Saponins on Animal Immune Responses. J. Zhejiang Univ. Sci. B 8(3): 153-161.
Santoso K, Ulfatin KH, Dordia AR, Sri M, Muhammad YR, Denny WH, Abdul Z, Ardilasunu W, Arifin BN, Usamah A, Agus W, Ridi A, Ronald T, Edi S. 2021. Perbandingan deteksi titer antibodi pascavaksinasi rabies berbasis kolorimetri menggunakan ELISA
reader dan kamera telepon genggam. J. Vet. 22(1): 79-85.
Slipranata M, Lestari FB, Sandi NA, Salasia SIO. 2016. Potensial ekstrak daun sage (Salvia offcinalis.L) sebagai Anti Streptococcus suis penyebab zoonotik meningitis. J. Sain Vet. 34(2): 198-202.
Suartha IN, Wibawan IWT, Putra IGNN, Dewi NMRK, Mahardika IGNK. 2011. Pemilihan adjuvant pada vaksin avian influenza. J. Ked. Hewan 5(2): 49-52.
Suwartini NK, Kencana GAY, Suartha IN. 2018. Respon imun ayam petelur pascavaksinasi newcastle disease pada peternakan komersial di Desa Denbantas, Kecamatan Tabanan. Indon. Med. Vet. 7(3): 185-193.
Vialle R, Dupuis L, Deville S, Betrand F, Gaucheron J, Aucouturier J. 2010. Microgel particulate adjuvant:
characterisation and mechanism of action. Proc. Vaccinol. 2(1):12-16.
Vogel FR. 2000. Improving vaccine performance with adjuvants. Clin.
Infect. Dis. 30: S266–S270.
Wisselink HJ, Smith HE, Stockhofe ZN, Peperkamp K, Vecht U. 2000. Distribution of capsular types and production muramidase released protein (MRP) and extracellular factor (EF) of Streptococcus suis strains isolated from diseased pigs in seven european countries. Vet. Microbiol. 74: 237-248.
Tabel 1. Rata-rata OD±SD serum tikus pasca booster vaksin S. suis dengan adjuvant berbeda
|
Kelompok |
n |
Rata-rata OD±SD |
P |
|
MontanideTM ISA 78 (W/O) |
20 |
0,331±0,085 |
0,000 |
|
MontanideTM ISA 201 (W/O/W) |
20 |
0,208±0,068 | |
|
MontanideTM Gel 01 |
20 |
0,256±0,054 |
Tabel 2. Nilai rata-rata OD ± SD serum tikus berdasarkan waktu pengamatan setelah booster Waktu pengamatan n Rata-rata OD±SD P
|
Minggu ke-0 |
15 |
0,204 ± 0,024 |
0,024 |
|
Minggu ke-1 |
15 |
0,277 ± 0,071 | |
|
Minggu ke-2 |
15 |
0,281 ± 0,062 | |
|
Minggu ke-3 |
15 |
0,270 ± 0,084 |
Mean Optical Density
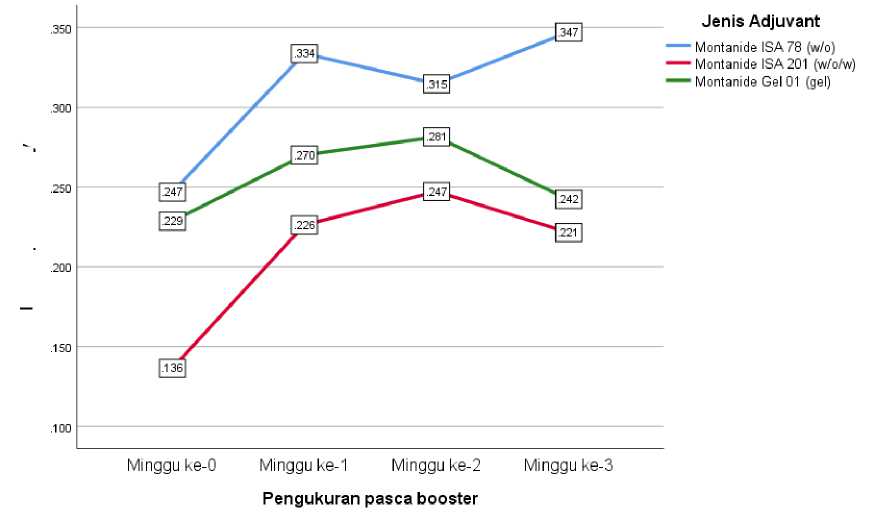
Gambar 1. Grafik nilai OD serum tikus setelah vaksinasi kedua
684
Discussion and feedback