PRIMARY ANTIBODY TITERS AGAINST STREPTOCOCCUS SUIS IN WHITE RATS VACCINATED WTH DIFFERENT ADJUVANTS
on
Buletin Veteriner Udayana Volume 14 No. 4: 363-373
pISSN: 2085-2495; eISSN: 2477-2712 Agustus 2022
Online pada: http://ojs.unud.ac.id/index.php/buletinvet DOI: 10.24843/bulvet.2022.v14.i04.p08
Terakreditasi Nasional Sinta 4, berdasarkan Keputusan Direktur Jenderal Pendidikan Tinggi, Riset, dan Teknologi No. 158/E/KPT/2021
Titer Antibodi Primer Terhadap Streptococcus suis pada Tikus Putih Yang Divaksin Dengan Adjuvant Berbeda
(PRIMARY ANTIBODY TITERS AGAINST STREPTOCOCCUS SUIS IN WHITE RATS VACCINATED WTH DIFFERENT ADJUVANTS)
Pipit Dwi Pramesti1*, I Gusti Ngurah Kade Mahardika2, I Nengah Kerta Besung3 1Mahasiswa Program Profesi Dokter Hewan, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB Sudirman, Denpasar, Bali.
-
2Laboratorium Biomedik dan Biologi Molekuler Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. Raya Sesetan, Gg. Markisa No. 6, Denpasar, Bali.
-
3Laboratorium Mikrobiologi Veteriner, Fakultas Kedokteran Hewan, Universitas Udayana, Jl. PB Sudirman, Denpasar, Bali.
*Email: pipitdwipramesti977@gmail.com
Abstrak
Streptococcus suis merupakan bakteri gram positif yang dapat menyebabkan berbagai masalah penyakit pada babi dan juga merupakan pathogen yang bersifat zoonosis. Oleh karena itu, vaksin yang efektif untuk S. suis sangat dibutuhkan untuk mengurangi kerugian ekonomi serta risiko zoonosis akibat patogen ini. Sebagian besar vaksin inaktif memerlukan zat tambahan untuk membantu meningkatkan efikasi vaksin dalam menginduksi titer antibodi dengan menggunakan adjuvant. Penelitian ini bertujuan untuk mengetahui perbedaan titer antibodi primer dari vaksin inaktif S. suis dengan penambahan adjuvant yang berbeda. Adjuvant yang digunakan yaitu water in oil (w/o) Montanide ISA 78 VG, water in oil in water (w/o/w) Montanide ISA 201 VG, dan gel Montanide 01 PR. Hewan coba yang digunakan yakni tikus putih yang divaksin secara intramuskular (IM) dengan dosis 0,5 ml. Pengambilan darah dilakukan pada minggu ke-1, minggu ke-2 dan minggu ke-3 setelah vaksinasi. Selanjutnya serum dari darah diuji menggunakan uji ELISA. Hasil ELISA secara kuantitatif dapat diamati dari nilai optical density (OD) yang diukur dengan menggunakan ELISA reader. Hasil menunjukkan bahwa terdapat perbedaan yang nyata terhadap nilai OD dengan nilai signifikan 0.001 (P<0.01). Respon antibodi terbaik ditunjukkan dengan nilai OD tertinggi. Vaksin dengan adjuvant w/o memiliki nilai OD lebih tinggi sebesar 0,175, jika dibandingkan dengan adjuvant gel sebesar 0,143 dan adjuvant w/o/w sebesar 0,103.
Kata kunci: Adjuvant; antibodi; gel; Streptococcus suis; vaksin; water in oil; water in oil in water
Abstract
Streptococcus suis is a gram-positive bacterium causing various diseases in pigs and a zoonosis pathogen. Therefore, an effective vaccine for S. suis is crucial to reduce the economic loss due to this pathogen. Most of the inactivated vaccines required additional substances to help increase the vaccine’s efficacy in inducing antibody titers using adjuvant. The study aimed to know the difference of primary antibody titer of inactivated S. suis vaccine with different adjuvant addition. The adjuvant employed was water in oil (w/o) Montanide ISA 78 VG, water in oil in water (w/o/w) Montanide ISA 201 VG, and gel Montanide 01 PR. The test animals were white rats intramuscularly (IM) vaccinated under a 0.5 ml dosage. Blood sampling was conducted in week-1, -2, and -3 post-vaccination. Then, the blood serum was tested using the ELISA test. Quantitative results of ELISA were observed from the optical density (OD) value measured using the ELISA reader. The results show a significant difference in the OD value with a significance value of 0.001 (P<0.01). The best antibody response was indicated by the highest OD value. Vaccine with adjuvant w/o has the highest OD value i.e. 0,175, when compared with adjuvant gel i.e. 0,143, and adjuvant w/o/w i.e 0,103.
Keywords: adjuvant; antibody; gel; Streptococcus suis; vaccine; water in oil; water in oil in water
PENDAHULUAN
Salah satu penyakit yang sering terjadi pada babi dan menimbulkan dampak yang cukup signifikan yakni akibat infeksi dari bakteri Streptococcus suis. Menurut Feng et al. (2014), S. suis merupakan bakteri gram positif yang dapat menyebabkan berbagai masalah kesehatan pada industri babi di seluruh dunia. S. suis merupakan patogen yang bersifat zoonosis yang menyebabkan berbagai infeksi klinis pada manusia. Bakteri S. suis terdiri dari 35 serotipe, dengan serotipe 2 yang paling virulen dan bersifat zoonosis (Higgins dan Gottschalk, 1990; Wertheim et al., 2009).
Menurut Li (2011), S. suis adalah patogen pada babi yang menyebabkan berbagai penyakit, seperti meningitis, septikemia, pneumonia, endokarditis, dan artritis. Oleh karena itu, vaksin yang efektif untuk S. suis, sangat dibutuhkan untuk mengurangi kerugian ekonomi akibat patogen ini sekaligus ancaman bagi kesehatan masyarakat. Menurut penelitian yang dilakukan oleh Susilawathi et al. (2019), memastikan bahwa S. suis ada dan menginfeksi manusia di Bali. Infeksi S. suis pada manusia sebagian besar terkait dengan peternakan babi dan makanan produk turunan babi. Besung et al. (2019) juga memastikan bahwa S. suis memang ada dan menyebabkan penyakit pada babi di Bali. Kasus diduga berasal dari semua kabupaten di Provinsi Bali. Namun kasus yang terkonfirmasi berasal dari empat kabupaten, yakni Tabanan, Denpasar, Gianyar, dan Karangasem. Dengan angka morbiditas 18,7%, mortalitas 8,4% dan case fatality rate mencapai 44,9%.
Selama ini pengobatan pada penyakit akibat dari infeksi bakteri S. suis yaitu dengan mengandalkan antibiotika. Disisi lain antibiotika juga dapat menimbulkan resistensi terhadap mikroba. Menurut Soeripto (2002), sehingga juga perlu alternatif lain dalam hal pencegahan dan pengendalian terhadap penyakit
streptococcosis pada babi, salah satunya yakni dengan pembuatan vaksin. Pengurangan penggunaan antibiotik pada ternak di seluruh dunia telah meningkatkan kebutuhan akan vaksin S. suis, namun vaksin saat ini belum tersedia (Segura et al., 2017; Segura, 2015)
Salah satu upaya untuk meningkatkan efektivitas vaksinasi untuk mempercepat peningkatan titer antibodi adalah dengan penggunaan adjuvant pada vaksin. Adjuvant adalah bahan yang ditambahkan pada vaksin untuk merangsang respon imun. Penggunaan adjuvant mampu meningkatkan titer dua kali lebih tinggi dibandingkan tanpa adjuvant (Suartha et al., 2011). Di bidang kedokteran hewan, dapat ditemukan tambahan adjuvant seperti air dalam emulsi minyak atau minyak dalam emulsi air dan adjuvant berbahan dasar produk saponin (Verdier, 2003). Selain itu, juga ditemukan bahan adjuvant baru, yakni gel. Bahan pembantu baru ini adalah dispersi partikel gel mikronik yang sangat stabil dari natrium poliakrilat dalam air.
Adjuvant yang digunakan dalam kombinasi dengan antigen diharapkan mampu menghasilkan lebih banyak kekebalan dibandingkan antigen saja. Selain itu, efektivitas dari vaksin Streptococcus suis juga sangat ditentukan oleh seed bakteri vaksin yang digunakan. Vaksin yang baik mampu mencegah dengan sempurna timbulnya gejala klinis saat babi terpapar infeksi. Penelitian ini didasarkan pada pembuatan vaksin inaktif, dari isolat bakteri S. suis yang telah diinaktivasi dengan tiga tahapan dan kemudian ditambahkan dengan adjuvant yang berbeda yaitu water in oil (w/o), water in oil in water (w/o/w) dan gel. Selanjutnya diamati perbedaan titer antibodi primer yang ditimbulkan oleh vaksin dari penambahan berbagai adjuvant dengan Enzyme-Linked Immunosorbent Assay (ELISA).
METODE PENELITIAN
Objek Penelitian
Objek penelitian yang digunakan dalam penelitian ini yaitu tikus putih (Rattus norvegicus) galur Wistar. Tikus putih yang digunakan memiliki berat badan rata-rata sekitar 100-150 gram, jenis kelamin betina dan berumur 2 bulan.
Rancangan Penelitian
Pertama yang perlu dilakukan adalah sterilisasi, untuk memperoleh ruangan yang steril dan memenuhi persyaratan, ruang LAF (Laminar Air Flow) dibersihkan terlebih dahulu bagian dinding, lantai, dan langit-langitnya dari debu dan kotoran. Lalu bagian-bagian tersebut dibersihkan dengan cairan disinfektan. Disinfektan yang digunakan yaitu alkohol 70 % (Hadioetomo, 1985). Lalu mempersiapkan alat dan bahan. Isolat murni S. suis dikultur dalam volume besar, yakni sebanyak 500 ml. media yang digunakan dalam kultur yaitu media cair Tryptic Soy Broth (TSB). Media TSB sebanyak 500 ml ditambahkan dengan 200 μl isolat murni S.suis. Lalu disimpan pada incubator shaker pada suhu 370C selama 24 jam.
Sebelum pembuatan vaksin, terlebih dahulu dilakukan identifikasi dan perhitungan CFU. Metode identifikasi untuk konfimasi S.suis dengan Teknik PCR dilakukan menggunakan primer JP4/JP5 (gen GDH). Primer yang digunakan untuk gen GDH menghasilkan fragmen ampifikasi sebesar 688 bp (Okwumabua et al., 2003). Untuk perhitungan jumlah koloni, dilakukan plating pada media Blood Agar dan diinkubasi selama 24 jam untuk selanjutnya dilakukan perhitungan. Menurut Hsueh et al. (2017), untuk pembuatan vaksin S. suis digunakan 1 x 109 CFU/mL. Selain itu menurut Esgleas et al. (2009) menyebutkan sebanyak 1 x 107 CFU/mL untuk babi dan 1 x 108 CFU/mL untuk hewan coba mencit. Dalam penelitian ini digunakan 107 CFU/mL.
Kultur pada media cair TSB disentrifuge dengan 5000 rpm selama 10 menit. Lalu supernatan dibuang dan
endapan ditambahkan dengan NaCl untuk pengenceran sampai volume mencapai 80 ml. Selanjutnya 80 ml seed bakteri S. suis sebagai bahan vaksin diinaktivasi dengan 3 (tiga) tahapan, yaitu: (1). Pemecahan sel bakteri melalui proses sonikasi pada amplitude 50% selama 10 menit (sonicated killed), (2). Penambahan formaldehid 0,4% sebanyak 864 μl (formalin killed), dan (3). Pemanasan pada suhu 800C selama 2 jam (heat killed).
Digunakan tiga jenis adjuvant yang akan ditambahkan pada vaksin, yakni water in oil (w/o) Montanide ISA 78 VG, water in oil in water (w/o/w) Montanide ISA 201 VG, dan Montanide Gel 01 PR. Formulasi yang digunakan adalah sebanyak 25% antigen ditambahakan dengan 25% NaCl. Selanjutnya ditambahkan adjuvant seanyak 50% dari total jumlah sediaan vaksin yang akan dibuat. Proses pencampuran adjuvant dan antigen sebagai bahan vaksin menggunakan alat magnetic stirrer. Selama proses percampuran berlangsung ditambahkan 5 μL Thimerosal dan 50 μL Polysorbate Montanox 80 VG DF. Thimerosal berfungsi sebagai pengawet untuk mencegah pertumbuhan jamur dan lainnya sedangkan Polysorbate berfungsi sebagai stabilitas emulsi pada vaksin.
Vaksinasi
Sebelum vaksinasi dipastikan kembali bahwa tikus benar-benar dalam keadaan sehat dan siap untuk menerima vaksin. Untuk kelompok P0 tidak dilakukan vaksinasi karena akan digunakan sebagai kontol. Vaksin diberikan pada setiap kelompok tikus putih, yakni pada kelompok P1, P2 dan P3 dengan metode penyuntikan secara intramuskular (IM) dengan dosis vaksin 0,5 ml/ekor tikus putih.
Pengambilan Darah
Pengambilan darah dilakukan pada minggu ke-1, minggu ke-2 dan minggu ke-3 setelah vaksinasi. Kecuali pada kelompok P0 pengambilan darah hanya dilakukan sekali, karena hanya akan digunakan sebagai kontol. Darah diambil sebanyak 1 untuk dapat menghasilkan serum sekitar 50
μL yang akan digunakan dalam uji ELISA. Darah diambil menggunakan tabung hematokrit di sinus orbitalis atau plexus retro orbitalis pada daerah medial canthus sinus orbitalis di bawah bola mata ke arah foramen opticus, seperti penelitian yang pernah dilakukan oleh Widyastuti (2013) yakni juga melakukan pengambilan darah melalui sinus orbitalis sebanyak ±1 ml selama satu minggu sekali. Selanjutnya darah ditampung pada eppendorf tube dan ditempatkan dengan cara dimiringkan, kemudian disentrifuse dengan 5000 rpm selama 10 menit untuk mendapatkan serumnya. Serum dipisahkan dari bekuan darah dan di tampung pada microtube. Serum disimpan di dalam refrigator untuk digunakan dalam uji titer antibodi menggunakan ELISA
Uji ELISA
Prosedur indirect ELISA pertama yang perlu dilakukan yaitu mengencerkan antigen dalam coating buffer (perbandingan 1:1000), 13 μl antigen dan 13 ml coating buffer. Selanjutnya dipipet dalam setiap lubang mikroplit sebanyak 50 μl. Lalu menutup mikroplit dengan film plastic atau penutup yang tersedia dan diinkubasi dalam almari pendingin selama 1 malam. Lubang mikroplit dicuci 3 kali dengan PBS Tween. Lubang mikroplit diisi dengan larutan susu skim dengan volume 75 μl, lalu ditutup dengan penutup yang tersedia dan inkubasikan pada suhu ruang selama 1 jam. Lubang mikroplit dicuci 3 kali dengan PBS Tween. Selanjutnya dimasukkan 50 μl PBS Tween dan ditambahkan dengan sampel/serum sebanyak 2 μl. Mikroplit ditutup kembali dan inkubasikan pada suhu ruang selama 1 jam. Lubang mikroplit dicuci 3 kali dengan PBS Tween. Kemudian dimasukkan antibodi sekunder atau yang biasanya disebut dengan konjugat (anti-rat) yang sudah diencerkan (perbandingan 1:1000) sebanyak 50 μl. Mikroplit ditutup dan inkubasikan pada suhu ruang selama 1 jam. Lubang mikroplit dicuci kembali 3 kali dengan PBS Tween. Terakhir ditambahkan substrat sebanyak 50 μl. Jika perubahan
warna yang cukup telah terjadi (umumnya setelah 15-30 menit), ditambahkan 50 μl larutan penghenti (stop solution) pada setiap lubang. Hasil nilai OD dibaca pada ELISA reader. Panjang gelombang UV untuk peroksidase-TMB adalah 450 nm, sedangkan NPP-BCIP NBT biasanya 405 nm. Panjang gelombang UV pada alat umumnya dapat diatur, dan juga perlu memperhatikan saran produsen jika menggunakan kit komersial.
Analisis Data
Perbedaan titer antibodi antar kelompok dianalisis menggunakan aplikasi
(Statistical Product and Service Solutions (SPSS)) IBM versi 25. Selanjutnya dianalisis secara statistik dengan analisis sidik ragam/Analysis of Variance
(ANOVA). Apabila dari data ANOVA diketahui pengaruh yang berbeda nyata (signifikan) (P<0,05) atau dengan hasil berbeda sangat nyata (highly significant) (P<0,01) maka untuk membandingkan nilai antar perlakuan dilanjutkan dengan uji Games-Howell.
HASIL DAN PEMBAHASAN
Hasil
Pada Tabel 1 diketahui hasil tertinggi yaitu pada kelompok perlakukan vaksin dengan penambahan adjuvant water in oil (w/o), total rata-rata sebesar 0,175. Sedangkan nilai OD terendah yaitu pada kelompok perlakuan vaksin dengan adjuvant water in oil in water (w/o/w), total rata-rata sebesar 0,103. Dan hasil nilai OD pada kelompok perlakuan adjuvant gel sebesar 0,143.
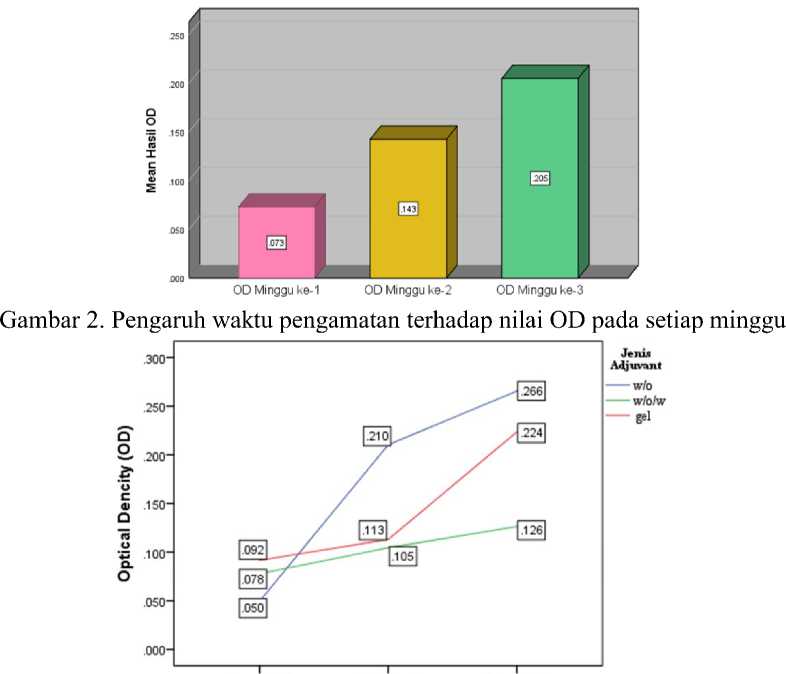
Pada Tabel 2 diketahui nilai OD pada setiap minggu juga mengalami kenaikan. Nilai OD pada minggu ke-1 sebesar 0,073, minggu ke-2 sebesar 0,143 dan pada minggu ke-3 sebesar 0,205.
Pada Tabel 3 diketahui rata-rata nilai OD setiap minggu dari berbagai adjuvant. Pada minggu ke-1, adjuvant gel menunjukkan hasil tertinggi yaitu sebesar 0,092, sedangkan adjuvant w/o menunjukkan hasil terendah yaitu sebesar
0,050 dan adjuvant w/o/w menunjukkan hasil sebesar 0,078. Pada minggu ke-2, adjuvant w/o menunjukkan hasil tertinggi yaitu sebesar 0,210, sedangkan adjuvant w/o/w menunjukkan hasil terendah yaitu sebesar 0,105 dan adjuvant gel menunjukkan hasil sebesar 0,113. Pada minggu ke-3, adjuvant w/o menunjukkan hasil tertinggi yaitu sebesar 0,266, sedangkan adjuvant w/o/w menunjukkan hasil terendah yaitu sebesar 0,126 dan adjuvant gel menunjukkan hasil sebesar 0.223.
Tabel 5 menunjukkan hasil uji Games-Howell bahwa perbandingan antara water in oil (w/o) dan water in oil in water (w/ow) terdapat perbedaan yang nyata dengan nilai signifikan 0,043 (P<0,05). Perbandingan antara water in oil (w/o) dan gel tidak terdapat perbedaan yang nyata dengan nilai signifikan 0,574 (P>0,05). Dan antara water in oil in water (w/ow) dan gel juga tidak terdapat perbedaan yang nyata dengan nilai signifikan 0,179 (P>0,05)
Tabel 6 menunjukkan hasil uji Games-Howell bahwa perbandingan antara Minggu ke-1 dan Minggu ke-2 terdapat perbedaan yang nyata dengan nilai signifikan 0,002 (P<0,05). Perbandingan antara Minggu ke-1 dan Minggu ke-3 juga terdapat perbedaan yang nyata dengan nilai signifikan 0,000 (P<0,01). Dan antara Minggu ke-2 dan Minggu ke-3 tidak terdapat perbedaan yang nyata dengan nilai signifikan 0,059 (P>0,05).
Pembahasan
Vaksinasi adalah strategi utama untuk pencegahan dan pengendalian penyakit, dan penggunaan adjuvant merupakan strategi yang efektif dalam meningkatkan efikasi vaksin untuk mempercepat peningkatan titer antibodi. Hal inilah yang diterapkan pada penelitian ini dalam pembuatan vaksin inaktif S. suis dengan penambahan berbagai jenis adjuvant untuk mengetahui titer yang dihasilkan. Menurut Rajput et al. (2007), vaksin inaktif dengan penambahan adjuvant dapat meningkatkan potensi sistem imun serta menambah
lamanya perlindungan terhadap suatu infeksi penyakit pada hewan dan manusia.
Dalam konteks vaksin, adjuvant didefinisikan sebagai suatu komponen yang mampu meningkatkan dan/atau membentuk respon imun yang spesifik. Beragam teknologi adjuvant untuk vaksin veteriner telah dikembangkan dalam dekade terakhir (Reed et al., 2013). Menurut Petrovsky dan Aguilar (2004), beberapa komponen yang terlibat dalam pemilihan adjuvant adalah: antigen, spesies yang akan divaksinasi, rute pemberian dan kemungkinan efek samping. Idealnya, adjuvant harus stabil dengan umur simpan yang lama, dapat terurai secara hayati, murah untuk diproduksi, dan meningkatkan respon imun yang sesuai. Adjuvant berbahan dasar minyak dan surfaktan banyak digunakan untuk memformulasikan vaksin inaktif di bidang veteriner (Bouguyon et al., 2015).
Berdasarkan hasil statistik dari uji Twoway ANOVA pada Tabel 4 menunjukkan bahwa terdapat perbedaan respon antibodi yang sangat signifikan dengan nilai 0,001 (P<0,01) dari vaksin dengan penambahan adjuvant yang berbeda terhadap nilai OD. Selain itu, lama waktu pengamatan pasca vaksinasi pada minggu ke-1, minggu ke-2 dan minggu ke-3 juga memberikan pengaruh yang sangat nyata terhadap nilai OD, yakni sebesar 0,000 (P<0,01).
Pada Tabel 1 dan Gambar 1 diketahui bahwa vaksin dengan penambahan adjuvant w/o dapat menginduksi titer yang lebih tinggi jika dibandingkan dengan gel maupun w/o/w. Menurut Jensen et al. (2005), emulsi air dalam minyak (w/o) dikenal sebagai bahan pembantu paling efektif untuk menghasilkan respon antibodi yang lama terhadap antigen vaksin, karena kandungan minyak mineral yang tinggi terbukti paling efektif untuk pembentukan respon antibodi. Selain itu, pada Tabel 2 dan Gambar 2 menunjukkan bahwa nilai OD pada setiap juga minggu mengalami kenaikan. Karena semakin lama waktu pengamatan, terjadi peningkatan titer antibodi dengan nilai tertinggi yaitu
didapatkan pada pengamatan pada minggu ke-3 pasca vaksinasi.
Dalam Tabel 3 dan Gambar 3 menunjukkan bahwa pada minggu pertama pasca vaksinasi, vaksin adjuvant gel mampu menginduksi titer antibodi lebih awal dan lebih tinggi jika dibandingkan dengan w/o dan w/o/w. Adjuvant w/o yang semula paling rendah dalam menghasilkan titer pada minggu pertama, ketika pada minggu ke-2 mengalami kenaikan yang cukup drastis dan paling tinggi dalam menginduksi titer jika dibandingkan dengan adjuvant gel dan w/o/w. Pada minggu ke-3, adjuvant gel memberikan peningkatan yang cukup drastis. Tetapi hasil tertinggi tetap ditunjukkan oleh adjuvant w/o dalam menginduksi titer jika dibandingkan dengan gel dan w/o/w. Secara keseluruhan, semua adjuvant mampu menginduksi titer antibodi dan memberikan peningkatan nilai OD setiap minggunya. Namun, adjuvant w/o yang mampu menginduksi titer yang relatif lebih tinggi jika dibandingkan dengan adjuvant w/o/w maupun gel.
Menurut Wisselink et al. (2001),
adjuvant emulsi air dalam minyak (w/o) telah terbukti lebih unggul dari adjuvant berbasis aluminium hidroksida dalam kapasitasnya untuk merangsang respon imun dan dalam mengurangi kematin yang yang terkait dengan galur S. suis serotipe 2. Adjuvant w/o mampu memberikan efek depot sehingga memperpanjang waktu pelepasan antigen. Adjuvant w/o mampu menginduksi respon seluler dan sedangkan w/o/w meningkatkan respon humoral dan juga seluler. Hal ini sesuai dengan Hsueh (2017) dalam penelitiannya membuat vaksin streptococcus suis menyebutkan, bahwa adjuvant w/o/w yang digunakan dalam vaksin tersebut telah terbukti mampu merangsang kekebalan humoral.
Pada tabel 5, meskipun vaksin dengan adjuvant w/o dapat menginduksi titer lebih tinggi dibandingkan gel, tetapi secara statistik dari hasil uji Games-Howell tidak terdapat perbedaan yang signifikan antara keduanya. Berbeda dengan vaksin adjuvant
w/o dan w/o/w yang secara statistik memang terdapat perbedaan yang signifikan dalam menginduksi titer. Sedangkan pada Tabel 6, menunjukkan hasil uji Games-Howell dari berbandingan waktu pengamatan pada minggu ke-1, minggu ke-2 dan minggu ke-3. Antara minggu ke-1 dan minggu ke-2 terdapat berbedaan yang sangat nyata, begitupun juga antara minggu ke-1 dan ke-3 juga terdapat perbedaan yang sangat nyata. Seperti yang telah dijelaskan sebelumnya, ini berarti bahwa waktu pengamatan memberikan pengaruh yang nyata terhadap nilai OD. Meskipun antara minggu ke-2 dan minggu ke-3 tidak terdapat perbedaan yang nyata.
Rata-rata nilai OD pada setiap minggu untuk masing-masing kelompok perlakuan adjuvant mengalami kenaikan. Hal ini sesuai dengan Tizard (1998), bahwa antibodi baru ditemukan sekitar satu minggu setelah pemberian antigen pertama dan kadarnya meningkat dalam serum dan mencapai puncaknya setelah 10-14 hari sebelum menurun lagi. Jumlah antibodi yang terbentuk dan tingkat daya proteksi selama respon imun primer relatif kecil. Limfosit B mengandung IgM pada permukaannya sebagai reseptor antigen, sehingga IgM terbentuk paling awal pada respon imun primer, tetapi respon IgM umumnya pendek (Kresno, 2001). Namun dengan vaksin yang ditambahkan dengan adjuvant ini mampu memberikan kekebalan jangka panjang yang cukup baik. Terlihat dari pengamatan sampai dengan minggu ke-3, respon imun primer tetap mengalami kenaikan. Sehingga
memungkinkan akan terus naik jika telah dilakukan booster. Menurut Abbas et al. (2005), respon imun primer mengakibatkan aktivasi pada sel B sedangkan respon imun sekunder menstimulasi peningkatan jumlah sel B memori. Oleh karena itu respon imun sekunder memiliki kandungan antibodi yang diproduksi lebih tinggi jika dibandingkan respon imun primer.
Ukuran partikel merupakan parameter penting dalam proses emulsifikasi. Secara
umum emulsi yang memiliki ukuran partikel kecil dan terdistribusi merata yang akan lebih stabil. Selain itu, kualitas emulsi dan viskositas merupakan parameter penting karena memiliki dampak langsung pada adjuvant yang akan digunakan untuk vaksin. Menurut Klimka et al. (2015), kriteria emulsi vaksin dengan adjuvant yang baik adalah viskositas rendah, stabilitas tinggi, pelepasan antigen lambat, mampu menginduksi untuk merangsang respon imun humoral maupun seluler.
Viskositas dipengaruhi oleh fase terdispersi dan fase kontinyu. Fase terdispersi menyebabkan peningkatan viskositas emulsi akhir, sehingga fase kontinyu harus ditingkatkan untuk menurunkan viskositas (Aucouturier et al., 2001). Dalam proses pencampuran vaksin pada penelitian ini, adjuvant w/o menghasilkan emulsi yang lebih kental dan memerlukan waktu yang lama dalam proses pencampuran bersama antigen. Selain itu, adjuvant ini juga memiliki viskositas tinggi dan membuatnya sulit untuk disuntikkan. Sedangkan adjuvant w/o/w memiliki tingkat viskositas lebih rendah jika dibandingkan dengan w/o. Dalam penelitian ini, untuk mengatasi masalah viskositas dari adjuvant w/o yang tinggi, sebelum dilakukan pencampuran bersama antigen terlebih dahulu adjuvant w/o perlu diencerkan. Pengenceran dilakukan dengan menambahkan larutan NaCl dan pada saat proses pencampuran menggunakan alat magnetic stirrer juga ditambahkan Polysorbate yang berfungsi sebagai stabilitas emulsi. Dengan cara tersebut membuat viskositas dari adjuvant w/o dapat diturunkan, sehingga didapatkan emulsi dari vaksin yang sesuai.
Adjuvant berbahan dasar minyak dikenal sebagai bahan pembantu yang kuat dan digunakan di lapangan ketika diperlukan respon imun yang kuat. Emulsi w/o diproduksi dengan mencampurkan fase air ke dalam fase minyak, dan distabilkan oleh surfaktan. Adjuvant ini melepaskan antigen vaksin secara perlahan dan dapat memberikan kekebalan jangka panjang
yang baik. Adjuvant w/o/w mengandung mikrodoplet air dalam minyak yang terdispersi melalui fase air. Adjuvant ini melepaskan antigen lebih cepat daripada adjuvant w/o. Emulsi w/o/w dapat meningkatkan kekebalan jangka pendek dan jangka panjang serta kurang kental dibandingkan dengan emulsi w/o (Aucouturier et al., 2001).
Banyak parameter fisiokimia dan sifat biologis telah dioptimalkan untuk membuat bahan adjuvant baru berdasarkan dispersi dari polimer poliakrilat. Bahan pembantu baru ini adalah dispersi partikel gel mikronik yang sangat stabil dari natrium poliakrilat dalam air. Montanide™ Gel 01 telah digunakan dalam beberapa model vaksin dengan profil keamanan dan kemanjuran yang menjanjikan. Kemanjuran vaksin berbasis Montanide™ Gel 01 telah dipelajari pada babi, tetapi masih menjadi tantangan pada model anjing dan sapi (Parker et al., 2009).
Adjuvant gel ini mampu memberikan titer yang cukup tinggi jika dibandingkan dengan w/o/w, namun tidak lebih tinggi jika dibandingkan dengan w/o. Menurut Vialle et al. (2010), adjuvant Montanide™ Gel 01 memiliki ukuran partikel kecil dan homogen. Sehingga vaksin berbasis Montanide™ Gel 01 ini dapat membuat antigen melepaskan diri dari tempat injeksi secara perlahan. Sistem imun bawaan kemudian akan memicu sistem imun adaptif untuk membangun respon imun yang sangat spesifik.
SIMPULAN DAN SARAN
Simpulan
Kesimpulan dari penelitian ini adalah pengaruh adjuvant yang berbeda pada vaksin S. suis menyebabkan perbedaan respon antibodi yang sangat signifikan sebesar 0,001 (P<0,01). Respon antibodi terbaik ditunjukkan dengan nilai OD tertinggi yaitu pada adjuvant w/o jika dibandingkan dengan adjuvant gel maupun w/o/w.
Saran
Perlu dilakukan penelitian lebih lanjut, dengan meningkatkan konsentrasi antigen dalam proses pembuatan vaksin sehingga titer yang dihasilkan bisa lebih tinggi.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Dekan Fakultas Kedokteran Hewan Universitas Udayana dan dosen pembimbing atas fasilitas, arahan dan kesempatan yang diberikan. Direktorat Sumber Daya, Direktorat Jenderal Pendidikan Tinggi, Kemenristek Dikti atas biaya penelitian dengan kontrak No: B/136-
27/UN14.4.A/PT.01.05/2021, tertanggal 29 Juni 2021. Penulis juga mengucapkan terima kasih kepada staf Laboratorium Biomedik dan Biologi Molekuler Veteriner FKH UNUD serta semua pihak yang turut membantu dalam proses penelitian.
DAFTAR PUSTAKA
Abbas AK, Lichtman AH, Pober JS. 2005. Cellular and molecular immunology. Ed 5. WB Saunders Company. Philadelphia.
Aucouturier J, Dupuis L, Ganne V. 2001.
Adjuvants designed for veterinary and human vaccines. Vaccine, 19(17-19), 2666-2672.
Besung INK, Suarjana IGK, Agustina KK, Winaya IBO, Soeharsono H, Suwiti NK, Mahardika IGN. 2019. Isolation and identification of Streptococcus suis from sick pigs in Bali, Indonesia. BMC Res. Notes. 12(1): 1-6.
Bouguyon E, Goncalves E, Shevtsov A, Maisonnasse P, Remyga S, Goryushev O, Deville S, Bertho N, Ben Arous, J. 2015. A new adjuvant combined with inactivated influenza enhances specific CD8 T cell response in mice and decreases symptoms in swine upon challenge. Viral Immunol. 28(9): 524531.
Esgleas M, Dominguez-Punaro MDLC, Li Y, Harel J, Dubreuil JD, Gottschalk M.
2009. Immunization with SsEno fails to protect mice against challenge with Streptococcus suis serotype 2. FEMS Microbiol. Letters. 294(1): 82-88.
Feng Y, Zhang H, Wu Z, Wang S, Cao M, Hu D, Wang C. 2014. Streptococcus suis infection: an emerging/reemerging challenge of bacterial infectious diseases?. Virulence. 5(4): 477-497.
Hadioetomo RS. 1985. Mikrobiologi Dasar-dasar Praktek. 42-96. Gramedia. Jakarta.
Higgins R, Gottschalk M. 1990. Review article: An update on Streptococcus suis identification. J. Vet. Diagn. Invest. 2: 249-252.
Hsueh KJ, Cheng LT, Lee JW, Chung YC, Chung WB, Chu CY. 2017.
Immunization with Streptococcus suis bacterin plus recombinant Sao protein in sows conveys passive immunity to their piglets. BMC Vet. Res. 13(1): 1-9.
Jansen T, Hofmans MP, Theelen MJ, Schijns VE. 2005. Structure–activity relations of water-in-oil vaccine formulations and induced antigenspecific antibody
responses. Vaccine. 23(8), 1053-1060.
Klimka A, Michels L, Glowalla E, Tosetti B, Krönke M, Krut O. 2015. Montanide ISA 71 VG is advantageous to Freund's adjuvant in immunization against S. aureus Infection of mice. Scandinav. J. Immunol. 81(5): 291-297.
Li W, Hu X, Liu L, Chen H, Zhou R. 2011. Induction of protective immune response against Streptococcus suis serotype 2 infection by the surface antigen HP0245. FEMS Microbiol. Letters. 316(2): 115-122.
Kresno SB. 2001. Imunologi: Diagnosis dan Prosedur Laboratorium. Ed 4. Jakarta. Penerbit Fakultas Kedokteran, Universitas Indonesia.
Okwumabua O, O'Connor M, Shull E. 2003. A polymerase chain reaction (PCR) assay specific for Streptococcus suis based on the gene encoding the glutamate dehydrogenase. FEMS
Microbiol. Letters. 218(1): 79-84.
Parker R, Deville S, Dupuis L, Bertrand F, Aucouturier J. 2009. Adjuvant formulation for veterinary vaccines: Montanide™ Gel safety profile. Proc. Vaccinol. 1(1): 140-147.
Petrovsky N, Aguilar JC. 2004. Vaccine adjuvants: current state and future trends. Immunol. Cell Biol. 82(5): 488496.
Reed SG, Orr MT, Fox CB. 2013. Key roles of adjuvants in modern vaccines. Nat. Med. 19(12): 1597-1608.
Rajput ZI, Hu S, Xiao C, Arijo AG. 2007. Adjuvant effects of saponins on animal immune responses. J. Zhejiang Univ. Sci. B. 8(3): 153-161.
Segura M. 2015. Streptococcus suis
vaccines: candidate antigens and
progress. Expert Rev. Vac. 14: 1587– 1608.
Segura M, Fittipaldi N, Calzas C, Gottschalk M. 2017. Critical Streptococcus suis virulence factors: are they all really critical?. Trends Microbiol. 25(7): 585–599.
Soeripto. 2002. Pendekatan konsep kesehatan hewan melalui vaksinasi. Bogor. J. Litbang Pertanian. 21(2): 4855.
Spencer T. 1993. Standardization of serology. Penyakit Hewan. 25(46A): 16.
Suartha IN, Wibawan IWT, Putra IGNN, Dewi NMRK, Mahardika IGNK. 2011. Pemilihan adjuvant pada vaksin Avian
Influenza. Indonesia J. Vet. Sci. 5(2): 49-52.
Susilawathi NM, Tarini NMA, Fatmawati NND, Mayura PI, Suryapraba AAA, Subrata M, Mahardika GN. 2019.
Streptococcus suis–associated
meningitis, Bali, Indonesia, 2014– 2017. Emerg. Infect. Dis. 25(12): 22352242.
Tizard I. 1988. An Introduction to Vetenrinary Immunology. Surabaya. Airlangga University Press.
Verdier F, Barrow PC, Burge J. 2003. Reproductive toxicity testing
ofvaccines. Toxicol. 185(3): 213–219.
Vialle R, Dupuis L, Deville S, Bertrand F, Gaucheron J, Aucouturier J. 2010. Microgel particulate adjuvant:
characterisation and mechanisms of action. Proc. Vaccinol. 2(1): 12-16.
Wertheim HF, Nghia HD, Taylor W, Schultsz C. 2009. Streptococcus suis: an emerging human pathogen. Clin. Infect. Dis. 48(5): 617-625.
Widyastuti DA. 2013. Profit darah tikus putih wistar pada kondisi subkronis pemberian natrium nitrit. J. Sain Vet. 31(2): 201-215.
Wisselink HJ, Vecht U, Smith HE, Stockhofe‐Zurwieden N. 2001. Protection of pigs against challenge with virulent Streptococcus suis serotype 2 strains by a muramidase‐ released protein and extracellular factor vaccine. Vet. Rec. 148(15): 473-477.
Tabel 1. Hasil rata-rata nilai OD dan standar deviasi dari berbagai jenis adjuvant
|
Jenis Adjuvant | ||
|
w/o w/o/w |
gel | |
|
Rataan± SD |
0.175± 0.110 0.103± 0.046 |
0.143± 0.080 |
Tabel 2. Hasil rata-rata nilai OD dan standar deviasi dari total setiap minggu
Waktu
Minggu ke-1 Minggu ke-2 Minggu ke-3
Rataan ± SD 0.073 ± 0.041 0.143 ± 0.064 0.205 ± 0.091

Waater In Oil (w∕o) Water In Oil In Water Adjuvant Gel (w∕o⅛v)
Jenis Adjuvant
Gambar 1. Pengaruh penambahan berbagai adjuvant terhadap nilai OD
Minggu ke-1 Minggu ke-2 Mlnggu ke-3
Waktu
Gambar 3. Penambahan berbagai adjuvant terhadap nilai OD menunjukkan pengaruh yang signifikan dalam kenaikan nilai OD pada setiap minggu
Tabel 3. Hasil rata-rata nilai OD dan standar deviasi setiap minggu dari berbagai adjuvant.
|
Waktii - |
Rata-rata nilai OD = SD | ||
|
w/o |
w/o/w |
gel | |
|
Minggu ke-1 |
0.050 ± 0.044 |
0.078 ±0.021 |
0.092 ± 0.049 |
|
Minggu ke-2 |
0.210 ± 0.061 |
0.105 ±0.025 |
0.113 ±0.038 |
|
Minggu ke-3 |
0.266 ± 0.071 |
0.126 ±0.068 |
0.223 ± 0.078 |
Tabel 4. Hasil statistik dari uji Two-way ANOVA terhadap nilai OD
|
Sumber |
Jumlah π . , , Deraiat Kuadrat . . Kuadrat τ , FHitung Sig. Bebas lengah Tipe III |
|
Model koreksi Intersep Waktu Adjuvant Waktu4Adjuvant Galat Total Total koreksi |
0,265a 8 0,033 11,342 0,000 1,062 1 1,062 362,426 0,000 0,157 2 0,079 26,872 0,000 0,047 2 0,024 8,070 0,001 0,061 4 0,015 5,213 0,002 0,132 45 0,003 1,459 54 0,397 53 |
Tabel 5. Hasil uji Games-Howell antara berbagai adjuvant terhadap nilai OD
|
(I) Jenis Adjuvant (J) Jenis Adjuvant |
Perbedaan „. Sig. Rataan " |
|
tiλ i y Water in oil in water (w/o/w) Water in oil (w∕o) „ , Crel |
0,07228* 0,043 0,03244 0,574 |
|
Water in oil in Water in oil (w/o) water (w/o/w) Gel |
-0,07228* 0,043 -0,03983 0,179 |
|
, Water in oil (w/o) Water in oil in water (w/o/w) |
-0,03244 0,574 0,03983 0,179 |
Tabel 6. Hasil uji Games-Howell antara waktu terhadap nilai OD
|
(I) Waktu |
(J) Waktu |
Perbedaan Rataan |
Sig- |
|
Minggu ke-1 |
Minggu ke-2 |
-0,06956* |
0,002 |
|
Minggu ke-3 |
-0,13206* |
0,000 | |
|
Minggu ke-2 |
Minggu ke-1 |
0,06956* |
0,002 |
|
Minggu ke-3 |
-0,06250 |
0,059 | |
|
Minggu ke-3 |
Minggu ke-1 |
0,13206’ |
0,000 |
|
Minggu ke-2 |
0,06250 |
0,059 |
373
Discussion and feedback