BIOLOGY ACTIVITIES OF IgY PARVOVIRUS AFTER HEAT TREATMENT
on
Buletin Veteriner Udayana
p-ISSN: 2085-2495; e-ISSN: 2477-2712
Volume 8 No. 1: 79-85
Pebruari 2016
Aktivitas Biologis Imunoglobulin Yolk Anti Parvovirus Setelah Perlakuan Suhu
(BIOLOGY ACTIVITIES OF IgY PARVOVIRUS AFTER HEAT TREATMENT)
I Gusti Ayu Agung Suartini1, Ni Luh Putu Agustini2, Ni Luh EkaSetiasih3, Sisyawati Putriningsih4, Defi Lega Nurwidana5
1Laboratorium Biokimia Veteriner Universitas Udayana 2Laboratorium Bioteknologi Balai Besar Veteriner Denpasar 3Laboratorium Histologi Veteriner Universitas Udayana 4Laboratorium Ilmu Penyakit Dalam Veteriner Universitas Udayana 5Mahasiswa Fakultas Kedokteran Hewan Universitas Udayana Jl. PB. Sudirman Denpasar-Bali Email: gaa.suartini@gmail.com
ABSTRAK
Penelitian ini bertujuan mengetahui pengaruh berbagai suhu terhadap aktivitas biologi Imunoglobulin (Ig)Y crude dan presipitat spesifik Canine parvovirus (CPV). Hiperimun serum dilakukan pada ayam Isa Brown yang diinjeksi dengan antigen CPV. Ig yolk sediaan crude berasal dari serum ayam tanpa pemurnian sedangkan Ig yolk presipitat diperoleh dengan mengendapkan serum ayam dengan ammonium sulfat dan didialisis. Kedua jenis Ig yolk diberikan perlakuan suhu 50ºC, 60ºC, 70ºC, dan 80ºC selama 15 menit. Aktivitas biologi kedua jenis Ig dideteksi dengan uji Hambatan Hemaglutinasi (HI). Penelitian menggunakan Rancangan Acak Lengkap pola faktorial. Hasil penelitian menunjukkan bahwa suhu berpengaruh sangat nyata terhadap aktivitas IgY crude dan presipitat. Aktivitas IgY crude maupun presipitat turun pada perlakuan suhu 50ºC, 60ºC, 70ºC, dan 80ºC. Geometric Mean Titer IgY crude berturut - turut 26,67, 26, 25,33, dan < 20 Unit HI sedangkan IgY presipitat berturut-turut adalah 26,33 , 25,67, 24, dan < 20 Unit HI. Berdasarkan hasil penelitian ini disimpulkan bahwa aktivitas biologi IgY crude lebih baik dibandingkan IgY presipitat.
Kata kunci : imunoglobulin yolk, crude, presipitat, canine parvovirus,suhu
ABSTRACT
This study aims to determine the effect of temperature on the biological activity of various crude and precipitate specific Immunoglobulin (Ig)Y Canine parvovirus (CPV). Hiperimun serum conducted on Isa Brown chickens injected with antigen CPV. Crude yolk Ig preparations derived from chicken serum without purification while the yolk Ig preparations precipitates obtained by the chicken serum was precipitated with ammonium sulfate and dialyzed. Both types of Ig yolk given treatment temperature 50ºC, 60ºC, 70ºC, and 80ºC for 15 minutes. To test Gel Precipitation Test (AGPT) is performed to determine whether there is a specific IgY CPV in the serum of chickens. Biological activity of both types of Ig detected with Barriers Haemagglutination test (HI). The design used in this study is completely randomized design factorial. The results of this study indicate that the temperature was highly significant on the activities of IgY crude and precipitates. Activities IgY crude and precipitate down to the treatment temperature of 50ºC, 60ºC, 70ºC, and 80ºC. Geometric Mean Titer crude IgY respectively - were 26.67, 26, 25.33, and <2º Unit HI while IgY precipitates are respectively 26.33, 25.67, 24, and <2º Unit HI. Based on the results of this study concluded that the biological activity of crude IgY better than IgY precipitates after treatment of a wide range of temperatures.
Keywords: immunoglobulin yolk, crude, precipitates, canine parvovirus, temperature
PENDAHULUAN
Parvovirus merupakan penyakit yang umum ditemukan pada anjing dan kucing. Pada tahun 1970-an saat vaksin belum tersedia, parvovirus merupakan penyakit endemik dan membunuh ribuan anjing di seluruh dunia (Kapil et al., 2007). Angka kematian pada kejadian parvovirus mencapai 15-90 % (Ettinger dan Feldman, 1995; Yilmaz, 2005 )
Vaksinasi merupakan langkah awal pencegahan infeksi parvovirus pada anjing. Vaksinasi mulai dilakukan pada anak anjing umur dibawah enam bulan. Namun pemilihan waktu vaksinasi yang tidak tepat dapat menimbulkan kegagalan vaksinasi karena antibodi maternal dalam darah anak anjing akan menetralkan virus parvo yang ada di dalam vaksin. Hal ini menyebabkan respon pembentukan antibodi di dalam tubuh anjing tidak mencapai kadar yang protektif terhadap virus parvo. Selain itu vaksinasi secara intramuskular menimbulkan rasa sakit dan abses akibat jarum suntik pada jaringan yang disuntik (Ziad et al., 2000).
Teknik immunisasi pasif secara oral telah banyak digunakan, terutama untuk penyakit-penyakit yang menyerang saluran pencernaan. Pada metode ini digunakan antibodi yang spesifik terhadap antigen tertentu, selanjutnya antibodi tersebut diaplikasikan langsung secara oral. Aplikasi metode ini lebih mudah daripada menyuntikkan vaksin ke dalam tubuh, selain tidak harus merestrain hewan yang akan disuntik, juga akan menghindarkan efek sakit, mengurangi kesalahan teknik dalam pemberian vaksin dan biaya yang murah.
Penggunaan ayam sebagai pabrik biologis penghasil antibodi memiliki peluang yang sangat baik untuk di masa depan. Ayam yang diimunisasi dengan antigen tertentu akan menghasilkan antibodi (Imunoglobulin yolk) yang spesifik terhadap antigen yang disuntikkan kedalam tubuhnya. Antibodi
tersebut beredar didalam darah dan terakumulasi didalam kuning telur. Ayam memiliki sensitifitas yang tinggi terhadap antigen asing sehingga respon untuk terbentuknya antibodi sangat baik (Hau dan Hendriksen, 2005). Imunoglobulin Yolk dapat diisolasi dari kuning telur sehingga dalam proses produksinya tanpa harus menyakiti ayam (Narat, 2003).
IgY yang terdapat dalam kuning telur merupakan substansi yang dipilih untuk immunisasi pasif oral. Selain dapat dipanen dalam jumlah banyak dari kuning telur (Schade et al., 2008) IgY juga mempunyai valensi yang tinggi, sehingga dapat berikatan dengan berbagai epitop dari antigen (Nolan and Mine, 2004). Menurut Hau dan Henddriksen (2005) kemampuan IgY dalam menetralisasi virus parvo di dalam usus anjing bertahan sampai 48 jam setelah pemberian.
Imunoglobulin yolk spesifik terhadap virus parvo nampaknya sangat menjanjikan digunakan untuk imunisasi pasif pada anak anjing, tapi dalam aplikasinya secara oral, IgY harus melalui pemanasan/perebusan telur agar terhindar dari infeksi bakteri yang mungkin masih ada di dalam telur, misalnya Salmonella dan Escherichia coli. Berdasarkan hal di atas perlu diketahui bagaimana aktivitas biologis IgY spesifik terhadap parvovirus setelah mengalami pemanasan berbagai suhu. Penelitian ini bertujuan memberikan informasi tentang pengaruh berbagai suhu pemanasan terhadap aktivitas biologis IgY crude dan presipitat spesifik canine parvovirus
METODE PENELITIAN
Materi Penelitian
Delapan ekor ayam petelur galur Isabrown diadaptasikan selama satu minggu. Ayam dikandangkan dengan sistem batterai, diberi pakan komersial dan air minum secukupnya.
Hiperimun Serum Ayam
Ayam diimunisasi dengan antigen Canine Parvovirus titer 213 HA. Imunisasi dilakukan secara intramuscular (Carlender, 2002). Sebanyak 0,5 cc antigen dihomogenkan dengan 0,5 cc adjuvan komplit (Freund’s adjuvant complete) digunakan untuk imunisasi pertama. Imunisasi ke dua dan ke tiga dilakukan dengan interval dua minggu setelah imunisasi pertama. Imunisasi ayam pada minggu ke dua dan ke tiga berturut-turut adalah 0,75 cc antigen dihomogenkan dengan satu cc adjuvan tidak komplit (Freund’s adjuvant incomplete) (Narat, 2003). Serum diambil seminggu sebelum dan setelah penyuntikan antigen. Darah diambil sebanyak dua ml melalui vena Brachialis menggunakan spuite.
Keberadaan IgY spesifik terhadap CPV dalam serum ayam dideteksi dengan metode AGPT. Reaksi positif ditandai dengan terbentuknya garis presipitasi diantara sumur tengah dan sumur luar yang menunjukkan adanya reaksi antigen dan antibodi spesifik dalam serum ayam. Imunoglobulin yolk dimurnikan dengan cara diendapkan menggunakan amonium sulfat ((NH4)2SO4) jenuh konsentrasi 60%, selanjutnya didialisis menggunakan kantong dialisis untuk menghilangkan garam ammonium sulfat (Carlender, 2002 ; Woolley et al.,1995).
Uji Haemaglutinasi (HA)
Uji hemaglutinasi dilakukan untuk mendapatkan antigen CPV delapan unit HA. Antigen CPV delapan unit HA akan digunakan sebagai standar antigen pada uji hambatan hemaglutinasi (HI). Hasil positif HA ditandai dengan terjadinya aglutinasi yang jelas dari eritrosit babi. Titer HA menunjukkan pengenceran tertinggi yang masih memperlihatkan 100% aglutinasi eritrosit. Titer HA dinyatakan sebagai antilog dari pengenceran tertinggi serum CPV yang masih mampu mengaglutinasi eritrosit
babi 0,5 % dengan sempurna.
Perlakuan Suhu Pada IgY Crude Dan Presipitat
Lima botol masing-masing sampel IgY crude dan presipitat disiapkan untuk perlakuan berbagai suhu. Titer awal sampel diketahui 27 HI unit berdasarkan uji HI. Tiap botol sampel dipanaskan di waterbath selama 15 menit pada suhu 50ºC, 60ºC, 70ºC, 80ºC. Setelah 15 menit, sampel diambil dan langsung dicelupkan pada icebath untuk menghentikan reaksi. Selanjutnya sampel siap untuk diuji aktivitasnya.
Uji Hambatan Haemaglutinasi (HI)
Serum ayam yang telah mendapatkan perlakuan suhu selanjutnya diuji menggunakan uji Hambatan Hemaglutinasi (Sendow dan Syafriati, 2004). Kedalam lubang mikrotiter bentuk dasar V , ditambahkan 50μl serum yang akan diuji yang telah diencerkan dengan larutan buffer. Pengenceran dilakukan dua kali mulai dari lubang pertama hingga lubang ke-10 secara duplo sedangkan lubang 11-12 digunakan untuk kontrol. Sebanyak 50 μl Canine parvovirus yang telah disiapkan dengan konsentrasi delapan HA unit, dimasukkan ke dalam lubang 1-12. Campuran tersebut dibiarkan pada suhu 4ºC selama satu jam. Setelah itu masing-masing lubang ditambahkan 100 μl sel darah merah (SDM) babi dengan konsentrasi 0,5% dan diinkubasikan pada suhu 40C selama semalam. Reaksi positif ditandai dengan tidak terjadi aglutinasi sel darah merah. Titer antibodi tertinggi adalah tingkat pengenceran tertinggi yang mampu menghambat aglutinasi sel darah merah.
Titer HI dihitung dengan asumsi bahwa serum awal telah diencerkan sebanyak empat kali saat penambahan kaolin, sehingga titer pada lubang pertama adalah 23 Unit HI dan seterusnya. Titer yang dibawah 22 Unit HI di asumsikan sebagai < 20 Unit HI.
Selanjutnya titer ditranformasikan ke dalam bentuk –log 2.
Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap Pola Faktorial, IgY crued dan presipitat yang dipanaskan pada suhu 50ºC, 60ºC, 70ºC dan 80ºC dengan tiga kali ulangan. Nilai titer IgY ditranformasikan kedalam –Log 2 Unit HI. Selanjutnya data tersebut dianalisis Ragam, jika didapatkan pengaruh yang nyata selanjutnya dilakukan uji berganda Duncan menggunakan program SPSS 12 (Sampurna dan Nindhia, 2007).
HASIL DAN PEMBAHASAN
Garis presipitasi yang terbentuk pada uji AGPT menunjukkan bahwa di dalam serum ayam telah terbentuk antibodi yang spesifik terhadap CPV. Garis presipitasi terdeteksi diantara sumur luar (IgY) dan
sumur dalam (CPV). Reaksi ini terjadi karena adanya reaksi homolog antara antibodi dengan antigen CPV. Teknik AGPT merupakan uji serologis yang dapat digunakan untuk mendeteksi adanya antibodi spesifik dalam serum secara kualitatif. Mohammad et al. (2001) menyebutkan bahwa AGPT dapat digunakan untuk mendeteksi adanya antigen maupun antibodi secara kualitatif, bersifat dan murah. Aktivitas IgY crude dan presipitat sebelum perlakuan berbagai suhu adalah 27 HI unit. Aktivitas IgY crude dan presipitat setelah perlakuan suhu ditunjukkan pada (Tabel 1). Pembacaan titer IgY pada lubang plate yang pertama dianggap memiliki titer 23 Unit HI karena pada proses penambahan kaolin dilakukan pengenceran. Penambahan kaolin pada sampel IgY menyebabkan pengenceran empat kali.
Tabel 1. Hasil uji hi terhadap IgY sediaan kasar dan IgY presipitat pada berbagai perlakuan suhu (-Log 2 Unit HI)
Titer HI pada Berbagai Suhu
|
Jenis IgY Ulangan |
37°C (kontrol) |
50°C |
60°C |
70°C |
80°C |
|
1 |
7 |
7 |
6 |
5 |
0 |
|
IgY crude 2 |
7 |
7 |
6 |
5 |
0 |
|
3 |
7 |
6 |
6 |
6 |
0 |
|
GMT (Unit HI) |
7 |
6,67 |
6 |
5,33 |
0 |
|
1 |
7 |
6 |
5 |
4 |
0 |
|
IgY presipitat 2 |
7 |
7 |
6 |
4 |
0 |
|
3 |
7 |
6 |
6 |
4 |
0 |
|
GMT (Unit HI) |
7 |
6,33 |
5,67 |
4 |
0 |
Ket: GMT=Geometric Mean Titer (Titer Rataan Geometrik)
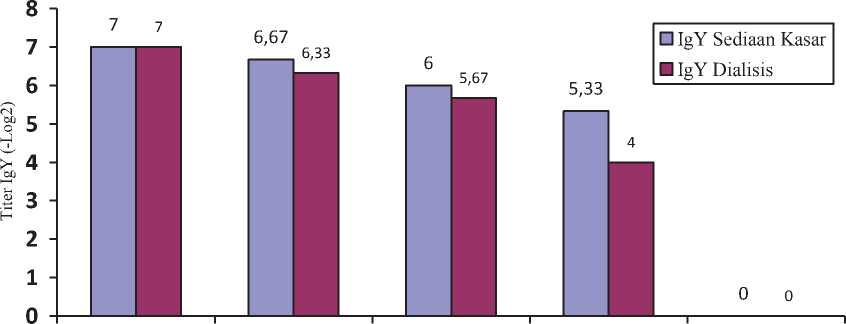
Perlakuan suhu 50ºC, 60ºC, 70ºC dan 80ºC pada IgY crude dan presipitat menyebabkan penurunan aktivitas biologis yang ditunjukkan dari penurunan titer antibodi. Geometric Mean Titer (GMT) IgY crude setelah perlakuan suhu
berturut-turut adalah 26,67, 26, 25,33, dan 20 Unit HI dan Geometric Mean Titer IgY presipitat berturut-turut adalah 26,33, 25,67, 24, dan < 20 Unit HI. Besar pengaruh suhu terhadap aktivitas IgY crude dan presipitat (Gambar 1).
Perlakuan suhu berpengaruh sangat nyata (P<0,01) terhadap aktivitas IgY crude dan presipitat. Perlakuan suhu 50ºC pada IgY crude dan presipitat tidak menyebabkan penurunan aktivitas biologi yang nyata dibandingkan dengan kontrol (P>0,05). Sedangkan perlakuan suhu 60ºC, 70°C, dan 80°C pada IgY crude dan presipitat menunjukkan penurunan titer yang berbeda nyata (P<0,05) dibandingkan dengan control.
Uji HI sensitif dan mampu mengukur titer antibodi dengan indikator berupa ada-tidaknya aglutinasi sel darah merah (Sendow dan Syafriati, 2004). Jika terdapat antibodi spesifik dalam serum maka aglutinasi sel darah merah akan dihambat dan pada dasar lubang mikroplate terbentuk bulatan seperti kancing (Wise et al., 2005; Swango, 1995).
Kontrol
50oC
60oC 70oC 80oC
Gambar 4. Diagram GMT (-Log 2) IgY sediaan kasar dan IgY presipitat setelah perlakuan suhu
Hasil tersebut membuktikan bahwa titer IgY spesifik CPV mengalami penurunan sejalan dengan semakin tinggi pemanasan. IgY crude memiliki titer IgY lebih tinggi dibanding dengan IgY presipitat. IgY presipitat memiliki aktivitas lebih rendah sebagai akibat dari adanya komponen permukaan yang hilang pada saat presipitasi (Narat, 2003). Sedangkan pada IgY crude ada komponen-komponen permukaan yang membantu untuk terjadinya perlekatan antigen-antibodi secara sempurna (Polson et al., 1990). Menurut Burgess (1995) semakin spesifik suatu antibodi maka akan semakin berkurang sensifitasnya.
Pada perlakuan suhu 80°C aktivitas IgY crude dan IgY presipitat mengalami penurunan secara drastis. Hasil uji HI
menunjukkan pada suhu 80°C kedua jenis IgY tersebut sebesar < 20 Unit HI. Denaturasi pada molekul IgY menyebabkan terjadi pemecahan ikatan-ikatan non kovalen pada struktur IgY. Winarno (1998) menjelaskan bahwa denaturasi dapat diartikan suatu proses terpecahnya ikatan hidrogen, interaksi hidrofobik, ikatan garam dan terbukanya lipatan molekul protein. Pemanasan akan mengakibatkan terputusnya interaksi ikatan non-kovalen yang ada pada struktur protein tetapi tidak memutuskan ikatan peptidanya (Ophart, 2003; Suartini et al., 2007). Hatta et al. (1993) menyebutkan bahwa IgY mulai terdenaturasi pada suhu 74ºC. Ziad et al. (2000) melaporkan bahwa pada suhu 80ºC dan 90ºC menyebabkan IgY
kehilangan aktivitasnya. Hal tersebut juga dilaporkan oleh Suartini (2007) menyebutkan bahwa pemanasan pada suhu diatas 70ºC IgY menunjukkan penurunan aktivitas secara signifikan.
Berdasarkan hasil penelitian ini diketahui bahwa titer IgY crude dan IgY presipitat mulai menunjukkan penurunan titer yang nyata pada suhu 70ºC. IgY crude dan IgY presipitat kehilangan aktivitasnya pada suhu 80ºC. Untuk mengetahui seberapa besar pengaruh suhu terhadap titer IgY diperlukan rentang perlakuan suhu yang lebih sempit antara 70ºC sampai 80ºC.
SIMPULAN DAN SARAN
Simpulan
Perlakuan suhu 50ºC tidak menurunkan aktivitas biologis IgY crude dan presipitat secara nyata dibandingkan kontrol. Aktivitas biologis IgY crude dan presipitat turun drastis setelah perlakuan suhu 80ºC.
Saran
Untuk mengetahui aktivitas IgY spesifik CPV diperlukan rentang perlakuan suhu yang lebih sempit. Sehingga seberapa besar pengaruh suhu terhadap setiap penurunan titer IgY dapat dilihat dengan jelas sampai titer IgY menunjukkan < 20 Unit HI.
UCAPAN TERIMAKASIH
Terimakasih disampaikan kepada Ketua LPPM Unud dan Kepala BBVet yang memberikan fasilitas Lab. selama penelitian serta petugas teknis yang membantu proses penelitian
DAFTAR PUSTAKA
Burgess GW. 1995. Teknik serologi dalam mendiagnosis penyakit infeksius. Penerjemah WT Artama. Gadjah Mada University Press.
Yogyakarta.
Carlender D. 2002. Avian IgY antibody in vitro and in vivo. Acta Universitas Upsaliensis. Comprehensive
Summaries of Uppsala Dissertations from the Faculty of Medicine, Uppsala.
Ettinger SJ, Feldman EC. 1995. Text book of Veterinary Internal Medecine Vol. 2. Academic Press. USA.
Hatta H, Tsuda K, Kim M, Yamamoto T. 1993. Productivity and some properties of egg yolk antibody (IgY) against human rotavirus. Biosci Biotechnol Biochem, 57: 450454.
Hau J, Hendriksen M. 2005. Refinement of polyclonal antibody production by combining oral immunization of chickens with harvest of antibodies from the egg yolk. ILAR J, 46: 294299.
Kapil S, Cooper E, Lamm C, Murray B, Rezabek G, Johnston L, Cambell G, Johnson B. 2007. Canine Parvovirus Types 2c and 2b Circulating in North American Dogs in 2006 and 2007. J Clin Microbiol, 45(12): 4044-4047.
Muhammad KF, Rabbi I, Seed K, Hussain T. 2001. Passive immunization againt infectious disease in chicks. Int J Agric Biol, 3(2):12-18.
Narat M. 2003. Production of Antibodies in Chickens. Food Technol Botechnol, 41:259-267.
Nolan JK, Mine Y. 2004. Avian egg Antibodies: basic and potential application. Avian and Poultry Biology Reviews, 15(1): 25-46.
Ophart CE. 2003. Virtual chembook. elmhurst college. London.
Polson A, von Wechmar MB, Rogenmortel J. 1990. Antigenion of
viral igy antibodies from yolk of immunized hens. Immunoglical Communication. 9:75-83.
Sampurna IP, Nindhia TS. 2007.
Metodologi ilmiah dan rancangan percobaan. Udayana University
Press. Denpasar.
Schade R. 2008. Chicken egg yolk antibodies production and
application: IgY-technology.
Suartini IGAA, Wibawan IWT,
Suhartono MT, Suartha IN. 2007. Aktivitas IgY dan IgG antitetanus setelah perlakuan pada berbagai pH, suhu dan enzim proteolitik. J Veteriner, 8(4): 160-166.
Sendow I, Syafriati. 2004. Seroepidemiologi infeksi canine parvovirus pada anjing. J ITV, 9(3): 54-58.
Swango LJ. 1995. Canine viral diseases: textbook of veterinary internal medicine. W.B. Saunders,
Philadelphia.
Winarno FG. 1998. Kimia pangan dan gizi. Gramedia. Jakarta.
Wise DJ, Carter GR, Flores EF. 2005. Laboratory diagnsis of viral infections. in: a concise review of veterynary virology. IVIS. A 3407.0305.
Woolley JA, London J, Failen T. 1995. Comparison of antibody production to human interleukin-6 (Il-6) by sheep and chicken. Immunol Methods, 2: 253-256.
Yilmaz Z. 2005. Distribution of antigen types of canine parvovirus type 2 in dogs with hemorrhagic enteritis in Turkey. Turk J Vet Anim Sci, 29: 7376.
Ziad W, Ronald J, Marquardt R. 2000. Studies on the stability of chiken igy in different sugars, complex
carbohydrates. J Food and Agric
Immunology. 12(4): 263-272.
85
Discussion and feedback