APLIKASI KARBON GRAFIT UNTUK IMOBILISASI ION PB DALAM CAIRAN DENGAN METODE ELEKTROLISIS
on
Buletin Fisika Vol 17 No. 2 Agustus 2016 : 8 - 15
APLIKASI KARBON GRAFIT UNTUK IMOBILISASI ION PB DALAM CAIRAN DENGAN METODE ELEKTROLISIS
Ni Wayan Sariasih, Hery Suyanto, Nyoman Wendri
1Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Udayana, Kampus Bukit Jimbaran, Badung, Bali Indonesia 80361.
Email : hery@unud.ac.id
Abstrak
Penelitian ini bertujuan untuk menentukan deteksi limit unsur Pb yang masih dapat diimobilisasi oleh karbon grafit dengan metode elektrolisis. Elektrolisis menggunakan elektroda karbon grafit sebagai anoda dan katoda dengan arus 52,7 mA. Konsentrasi larutan Pb yang dielektrolisis mulai dari 100 ppm sampai konsentrasi terendah 0,1 ppm. Unsur Pb yang terdeposisi pada katoda diirradiasi laser Nd-YAG (1064 nm, lebar pulsa 7 ns) dengan energi 100 mJ dan emisi unsur Pb dengan panjang gelombang 405,78 nm ditangkap oleh spektrometer HR 2500+ yang ditampilkan spektrum intensitas sebagai fungsi panjang gelombang. Data menunjukkan bahwa jumlah muatan optimum untuk proses elektrolisis adalah 80 coulomb dan konsentrasi larutan minimum (deteksi limit) logam berat Pb yang mampu diimobilisasi oleh karbon grafit adalah 0,06 ppm.
Kata Kunci : Karbon Grafit, Elektrolisis, Deteksi Limit, LIBS, Unsur Pb
Abstract
This study aims to determine the lowest concentration of Pb element that can be immobilized by carbon graphite with electrolysis method. Electrolysis used carbon electrodes of graphite as the anode and cathode with current of 52.7 mA. The concentrations of Pb solution used in this research started from of 100 till 0.1 ppm. Pb element deposited on the cathode then irradiated by Nd - YAG laser ( 1064 nm, pulse width 7 ns ) of 100 mJ and its emission intensity of 405.78 nm was captured by the spectrometer HR 2500+, then the data plotted in intensity as a function of wavelength . The optimum data of charged for the electrolysis process was 80 coulomb and minimum concentration (limit of detection) of Pb that was capable immobilized by carbon graphite was 0,06 ppm.
Keywords : Carbon Graphite, Electrolysis, Limit of Detection, LIBS, Pb Element
Analisis kualitatif maupun kuantitatif suatu unsur yang terkandung dalam sampel cair merupakan hal yang sangat penting dalam aplikasi kehidupan sehari-hari. Berbagai teknik spektroskopi atomik digunakan untuk tujuan tersebut diantaranya AAS dan ICP (James, 1988), tetapi peralatan tersebut harus menggunakan perlakuan awal yang sedikit rumit. Salah satu peralatan sederhana yang
dapat digunakan untuk analisis unsur tesebut adalah metode elektrolisis. Bila dua elektroda dialiri arus listrik (arus DC) 52,7 mA, maka akan terjadi reaksi redoks yang menyebabkan terjadinya pertukaran ion antara ion-ion dalam larutan dengan ion-ion dalam senyawa elektroda dan menarik ion-ion tersebut menempel pada salah satu elektroda menjadi endapan logam (Arianti, 2014).
Dalam penelitian ini, untuk memperoleh hasil yang optimal yakni deteksi limit terendah yang mampu diimobilisasi oleh elektroda karbon grafit, maka dilakukan pengoptimasian konsentrasi larutan Pb dan memvariasikan waktu yang menghasilkan muatan pada elektroda. Hasil dari endapan logam Pb pada elektoda selanjutnya dianalisis menggunakan Laser Induced Breakdown Spectroscopy (LIBS).
Elektrolisis berasal dari kata elektro (listrik) dan lisis (penguraian), yang berarti terjadinya penguraian zat/senyawa atau reaksi kimia oleh arus listrik (Laird, 2009). Arus listrik yang digunakan adalah arus searah (DC). Pengaliran arus listrik menggunakan suatu medium sebagai penghantar arus listrik ke dalam elektrolit, juga menjadi tempat berlangsungnya reaksi redoks, medium tersebut disebut elektroda. Reaksi reduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung pada anoda. Elektroda yang digunakan pada penelitian ini adalah karbon grafit.
Karbon grafit dapat menghantar arus listrik dan panas dengan baik. Sifat daya hantar listrik yang dimiliki oleh grafit dipengaruhi oleh elektron-elektron yang tidak digunakan untuk membentuk ikatan kovalen. Dalam struktur grafit setiap atom karbon membentuk ikatan kovalen dengan tiga atom karbon lainnya membentuk susunan heksagonal dengan struktur berlapis. Elektron-elektron ini tersebar secara merata pada setiap atom karbon karena terjadi tumpang tindih orbital. Oleh sebab itu ketika diberi beda potensial, elektron-elektron yang tersebar tersebut sebagian besar akan mengalir menuju
anoda, aliran elektron inilah yang menyebabkan arus listrik dapat mengalir (Chemistry Operations, 2003).
-
2.2 Karakteristik Unsur Timbal/
Plumbum (Pb)
Timbal atau plumbum merupakan unsur kimia dengan lambang Pb. Logam ini termasuk ke dalam kelompok logam golongan IVA. Pb mempunyai nomor atom (Z) 82 dengan massa atom (A) 207,2. Konfigurasi elektron pada keadaan dasar untuk atom Pb I adalah
1s22s22p63s23p64s23d104p65s24d105p64f 145d106p21/2
Bila atom Pb tersebut mendapatkan tambahan energi dari luar, maka elektron-elektron pada level energi tertentu akan pindah ke level energi yang lebih tinggi. Keadaan seperti ini disebut atom dalam tereksitasi. Elektron-elektron yang pindah ini hanya beberapa saat saja (nanosecond) kemudian kembali lagi ke keadaan semula sambil memancarkan emisi atau foton dengan panjang gelombang tertentu.
Diketahui bahwa probabilitas elektron berpindah dari konfigurasi 6Pi/ 2 6P3 /2, j=2 atau level 10650,327 cm-1 ke konfigurasi 6p1/ 2 7 S1 / 2 , j=1 atau level 35287,224 cm - 1 dengan memancarkan foton dengan panjang gelombang 4057,81 A (atau 405,781 nm) adalah 0,89 ∙ 108 s~ 1 (NIST, 2005). Panjang gelombang ini ditangkap detektor dan ditampilkan dalam spektrum. Panjang gelombang tersebut diperoleh dari persamaan
E2-E 1=γ (1)
λ
Dengan:
E1 = Energi level awal (cm-1)
E2 = Energi level akhir (cm-1)
c = Kecepatan cahaya (2,998 x 108 m/s) h= Konstanta Planck (6,626 x 10-34 J.s)
λ = Panjang gelombang (nm)
Pada elektrolisis larutan Pb terjadi reaksi redoks:
A n o da : (C) → oksi das i∙. H2O^ 1 +
→ 2°2⅛) + 2^(aq) + 2e
Ka to da : (C) → re duks i∙. P b^ + 2e → pb (S)
Reaksi oksidasi terjadi pada elektron karbon (C), dimana hal ini yang dioksidasi di anoda adalah H2O → O O2 + 2H + + 2e , sedangkan di katoda terjadi reduksi ion Pb2 + dari larutan yang bergerak menuju katoda sambil menerima dua elektron, dan mengendap menjadi atom Pb di permukaan/melapisi katoda. Kemudian ion Pb2+mengendap dan 2 ion H+ masuk ke dalam larutan, sehingga muatan tetap terjaga dalam larutan. Proses ini berlangsung terus menerus, yang dapat diamati berupa terjadinya gelembung gas dan perubahan warna larutan.
Alat yang digunakan dalam penelitian ini adalah wadah elektrolit, multimeter 2 buah, sumber arus DC, penggaris, dan gelas ukur 100 mL. Untuk alat yang
digunakan dalam pembuatan sampel melalui metode elektrolisis dapat dilihat pada Gambar 3.1.
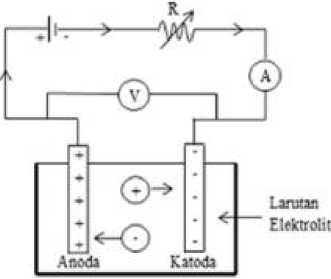
Gambar 3.1 Sel elektrolisis. (Yudiandika, 2010)
Untuk menganalisis hasil dari elektrolisis menggunakan LIBS seperti diperlihatkan pada Gambar 3.2. Adapun bahan yang digunakan dalam penelitian ini: karbon grafit sebagai elektroda, larutan standar Pb 1000 ppm, dan aquades.
Optimasi konsentrasi larutan Pb dan waktu imobilisasi pada elektrolisis unsur dilakukan dengan beberapa tahap seperti yang terlihat pada Gambar 3.3.
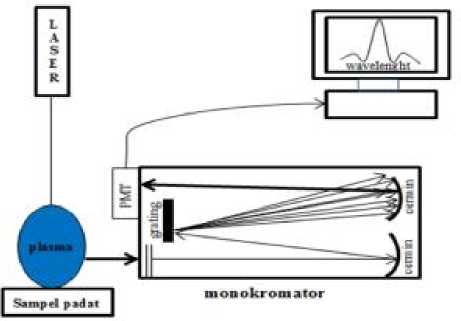
Gambar 3.2 Skema sederhana komponen utama LIBS. (Utomo, 2014)
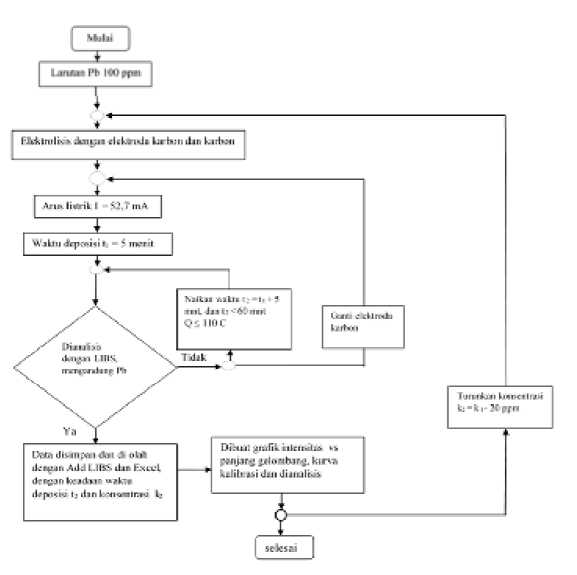
Gambar 3.3 Diagram alir penentuan keadaan optimum konsentrasi dan waktu imobilisasi (deposisi)
Untuk mengetahui konsentrasi minimum unsur Pb yang dapat dideteksi dengan metode LIBS perlu dihitung deteksi limit melalui persamaan regresi linier dari 5 data konsentrasi terkecil. Selanjutnya data-data regresi tersebut digunakan untuk mengetahui konsentrasi Pb terendah yang mampu diimobilisasi oleh katoda karbon yang biasa disebut deteksi limit (Limit of Detection/LOD). Perhitungan nilai LOD menggunakan rumus seperti pada Persamaan 3.1 (Cremers, 2006).
Cl = k .Sbi. m (2)
Dengan :
CL = Deteksi Limit (Limit of Detection/LOD)
Sbi = standar deviasi terkecil
i m = gradien k = level confidence
untuk nilai k didapatkan berdasarkan nilai R2,
k = 3 untuk R2 ≥ 0,90
Untuk menentukan waktu
imobilisasi unsur Pb dalam proses elektrolisis yaitu menggunakan larutan elektrolit standar Pb dengan konsentrasi 100 ppm, arus listrik 52,7 mA, dan waktu bervariasi yang menghasilkan muatan pada katoda sebesar 20 C, 30 C, 40 C, 50 C, 60 C, 70 C, 80 C, 90 C, 100 C, dan 110 C.
Hasil endapan logam Pb pada elektroda karbon (katoda) yang telah dielektrolisis kemudian diirradiasi laser dengan energi 100 mJ (Sinaga, 2013), akumulasi 3 kali, dan waktu tunggu deteksi 1 µs. Hasil spektrum intensitas untuk masing-masing muatan dilihat pada grafik intensitas terhadap fungsi muatan listrik untuk sampel Pb yang hasilnya seperti ditunjukkan pada Gambar 4.1.
180
Bahan
160
140
120
« 100
S
80
Konsentrasi Arus listrik Muatan Energi Laser ■ Akumulasi
Cleaning
Delay time
Tekanan udara
: Karbon Grafit sudah dielektrolisis : 100 ppm : 52,7 mA
: 20 C -110 C
: 100 mJ
: 3
: 0
-
: 1 μs
-
: 1 atm
C
60
C
40
20
0
20 30 40 50 60 70 80 90 100 110
Intensitas emisi Pb I 405,78nm
Muatan (C)
Intensitas emisi Pb
Gambar 4.1 Grafik intensitas emisi unsur Pb I 405,78 nm fungsi muatan.
Berdasarkan Gambar 4.1 intensitas emisi unsur Pb pada awal elektrolisis (20 coulomb sampai 60 coulomb) adalah relatif konstan. Ini disebabkan karena energi listrik pada range muatan tersebut sebagian besar digunakan untuk mengurai larutan menjadi ion-ion dan sebagian digunakan untuk menarik ion Pb ke katoda. Selanjutnya pada saat 80 coulomb, sebagian besar energinya digunakan untuk menarik muatan Pb ke katoda sehingga jumlah atau massa Pb yang tereduksi ke katoda semakin banyak sebagai konsekuensinya intensitasnya meningkat. Selain itu pada muatan 80 coulomb yang mana sesuai dengan nilai potensial standar reduksi dari Pb. Tetapi setelah 80 coulomb, intensitas unsur Pb menurun dan kemudian konstan setelah 100 coulomb. Hal ini disebabkan katoda mengalami kejenuhan atau melebihi dari nilai potensial standar reduksi dari Pb.
Penentuan deteksi limit dilakukan dengan menggunakan muatan 80 coulomb
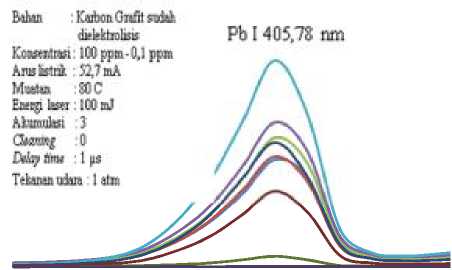
(atau waktu imobilisasi 25,30 menit) dengan variasi konsentrasi larutan Pb. Konsentrasi larutan Pb yang digunakan adalah 100 ppm, 80 ppm, 60 ppm, 40 ppm, 20 ppm, 10 ppm, 5 ppm, 1 ppm, dan 0,1 ppm. Elektroda karbon (katoda) hasil elektrolisis selanjutnya diirradiasi laser dengan energi 100 mJ, akumulasi 3 kali, waktu tunggu deteksi 1 µs dan hasilnya ditampilkan dalam spektrum intensitas fungsi panjang gelombang untuk masing-masing kosentrasi seperti pada Gambar 4.2.
Deteksi limit konsentrasi adalah perkiraan konsentrasi minimum yang masih bisa di analisis melalui LIBS dengan metode elektrolisis. Penentuan deteksi limit dimulai dengan membuat kurva kalibrasi intensitas terhadap fungsi konsentrasi. Berdasarkan Gambar 4.2 kemudian dibuat grafik hubungan intensitas dengan konsentrasi seperti pada Gambar 4.3.
0
405
1600
1200
S' ⅛ .1 800
IZl S
400
405.5
406
^^^^^^^^M 100 ppm
^^^^^^^^^^^ 80 ppm
^^^^^^^M 60 ppm
^^^^^^^M 40 ppm
^^^^^^^M 20 ppm
^^^^^^^^ 10 ppm
^^^^^^^ 5 ppm
^^^^^^^^M 1 ppm ^^^^^^^^M 0,1 ppm
Panjang Gelombang (nm)
Gambar 4.2 Grafik intensitas emisi unsur netral Pb I 405,78 nm fungsi konsentrasi larutan
240
M £ 200
C 160
S ^
I = 120
S go
S o 80
’K ^
-W 40
C —
0
Bahan Kubon Qnfit sudah Cbeleklrolisis
Konsemnei: IOOppm-O,! ppm
Aiuslistrik : 52,7 mA
JvIiatui : SO C
Encrp laser : IOOmJ
Akumuhsi : 3
Gsanι⅛f : 0
φ Delay time : 1 μs
Tekanan udara.: 1 aim
0 10 20 30 40 50 60 70 80 90 100
■•■■■ Intensitas emisi Pb I
405,78 nm
Konsentrasi (ppm)
Gambar 4.3 Grafik intensitas fungsi konsentrasi untuk unsur Pb.
Gambar 4.3 merupakan grafik intensitas fungsi konsentrasi untuk unsur Pb. Grafik menunjukkan intensitas meningkat dengan bertambahnya konsentrasi unsur Pb dalam larutan dan kemudian menurun setelah 20 ppm. Penurunan ini disebabkan karena katoda mengalami kejenuhan dan kemudian melepaskan sebagian ion Pb ke larutan untuk menjaga kesetimbangan larutan. Untuk keperluan kalibrasi maka digunakan data 0,1 ppm sampai dengan 20 ppm yang kemudian diplot intensitas fungsi
konsentrasi dan hasilnya seperti Gambar 4.4.
Gambar 4.4 merupakan grafik intensitas emisi unsur Pb terhadap fungsi konsentrasi larutan Pb yang terendapkan di katoda. Grafik menunjukkan bahwa intensitas emisi unsur netral Pb I (405,78 nm) meningkat dengan bertambah besarnya konsentrasi larutan dari 0,1 ppm sampai 20 ppm. Hal ini disebabkan karena kerapatan unsur Pb tiap satuan luas yang menempel di katoda karbon pada konsentrasi tinggi lebih besar dibandingkan pada konsentrasi rendah,
|
≡ 180 y = 9,554x + 3,239 ∞ 160 R² = 0,990 o' 140 - 120 ⅛ S 100 ≡ S 80 SΛ 60 i 40 I 20 0 ⅜~----------1--------------1--------------1--------------1 0 5 10 15 20 |
Bahan : Karbon Grafit sudah dielektrolisis Konsentrasi : Unsur Pb 0,1 ppm sampai 20 ppm Arus listrik : 52,7 mA Muatan : 80 C Energi Laser : 100 mJ Akumulasi : 3 Cleaning : 0 Delay time : 1 μs Tekanan udara : 1 atm Intensitas emisi Pb I 405,78 nm ♦ Intensitas emisi Pb |
Konsentrasi (ppm)
Gambar 4.4 Grafik kurva kalibrasi konsentrasi larutan Pb.
sehingga jumlah unsur Pb di luasan titik fokus laser yang terablasikan lebih banyak dan menyebabkan intensitas emisi unsur Pb meningkat.
Regresi linier untuk 5 data konsentrasi terkecil larutan Pb tersebut, yaitu y = 9,554x + 3,239. Dengan koefisien determinasi (R2) adalah 0,990. Kemudian dicari standar deviasi dari konsentrasi terkecil yaitu 0,1 ppm dan hasilnya adalah 0,2. Sehingga dengan menggunakan Persamaan 3.1 diperoleh konsentrasi larutan Pb terendah (deteksi limit) yang mampu diimobilisasi oleh katoda karbon dan dianalisis oleh LIBS adalah 0,06 ppm.
Karbon grafit dapat digunakan untuk imobilisasi unsur Pb dengan keadaan optimum muatan dalam proses elektrolisis adalah 80 coulomb dan konsentrasi terendah yang mampu diimobilisasi oleh karbon grafit berdasarkan analisis menggunakan LIBS untuk larutan Pb yaitu 0,06 ppm.
UCAPAN TERIMAKASIH
Ucapan terimakasih penulis haturkan kepada pihak-pihak yang telah membantu demi terselesaikannya penelitian ini yaitu yang pertama kepada PNBP Universitas Udayana melalui Hibah Penelitian Unggulan Program Studi Tahun Anggaran 2015 dengan Surat Perjanjian Penugasan Nomor: 1308/UN 14.1.28.1/PP/2015 (a.n Nyoman Wendri) yang telah membiayai penelitian ini dalam hal penggunaan alat dan bahan yang digunakan. Kedua, kepada orang tua, rekan-rekan mahasiswa Fisika Universitas Udayana yang selalu mendoakan dan mendukung selama penelitian.
DAFTAR PUSTAKA
Arianti. 2014. Pengaruh Nilai Potensial Standar Reduksi Unsur Cr, Fe, Dan Cu Terhadap Kemampuan
Elektrodeposisi Dengan Analisis Laser Induced Breakdown Spectroscopy (LIBS). Skripsi. Jurusan Fisika
Fakultas MIPA Universitas Udayana.
Chemistry Operations. 2003. Carbon. Los Alamos National Laboratory. [Diakses 9 Oktober 2008].
Cremers D. A dan L. J Radziemski. 2006.
Laser Induced Breakdown
Spectroscopy (LIBS) Fundamental and ApplicationsI. UK: Cambridge
University Press.
James, D. Ingle, JR and Stanley R. Crough.
1988. Spectrochemical Analysis. Prentice-Hall, Inc. Englewood, New Jerset.
NIST. 2005. Handbook of Basic Atomic Spectroscopic Data Vol. 3 No. 4.
American Institute of Physic. 15592259.
Laird, B. Brian. 2009. University Chemistry. Mc Graw-Hill Companies, Inc. New York.
Sinaga, D. N. 2013. Analisis Unsur Pb dan Ag dengan LIBS melalui Metode Elektrolisis. Skripsi. Jurusan Fisika Fakultas MIPA Universitas Udayana.
Suyanto, Hery. 2013. Diktat Kuliah
Spektroskopi Terapan. Bukit Jimbaran: Universitas Udayana.
Utomo, Aji Priyo. 2014. Analisis Batu Alam Sebagai Filter Unsur Logam Berat Dengan Metode Laser Induced
Breakdown Spectroscopy (LIBS).
Skripsi. Jurusan Fisika Fakultas MIPA Universitas Udayana.
Yudiandika, Putu. 2010. Studi Pemisahan Logam Perak (Ag) dari Limbah Fotografi Rumah Sakit dengan Metode Elektrolisis melalui Variasi Arus Listrik dan Bahan Elektroda. Skripsi. Jurusan Fisika Fakultas MIPA
Universitas Udayana.
15
Discussion and feedback