ANALISIS UNSUR Ag PADA SAMPEL CAIR DENGAN LASER INDUCED BREAKDOWN SPECTROSCOPY (LIBS)
on
Analisis Unsur Ag Pada Sampel Cair Dengan Laser Induced Breakdown Spectroscopy (LIBS)
(Sinaga Natalia Declarossy, dkk.)
ANALISIS UNSUR Ag PADA SAMPEL CAIR DENGAN
LASER INDUCED BREAKDOWN SPECTROSCOPY (LIBS)
Sinaga Natalia Declarossy1, Suyanto Hery1, Manurung Manuntun2
1Jurusan Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana 2Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Udayana
Kampus Bukit Jimbaran, Kuta Selatan, Badung, Bali, Indonesia, 80361
Email: decla_nathalie@yahoo.co.id
Abstrak
Telah dilakukan penelitian tentang analisis unsur Ag dalam cairan elektrolit dengan Laser Induced Breakdown Spectroscopy (LIBS) melalui metode elektrolisis. Pengamatan dilakukan dengan LIBS menggunakan laser Nd-YAG (1064nm, 7ns). Penelitian diawali dengan mencari kondisi optimum eksperimen. Hasil penelitian menunjukkan bahwa waktu deposisi dan arus listrik yang optimum untuk elektrolisis unsur Ag dalam larutan elektrolit adalah sebesar 10 menit dan 4,93 mA serta energi laser yang optimum untuk karakterisasi unsur Ag ini adalah 100 mJ. Berdasarkan kondisi optimum ini selanjutnya digunakan untuk melakukan analisis kuantitatif dari konsentrasi 300 ppm hingga konsentrasi terendah dan diperoleh deteksi limit sebesar 1 ppm.
Kata Kunci : Ag, elektrolisis, LIBS, energi laser, arus listrik, waktu deposisi, deteksi limit
Abstract
It has been done research on the analysis of Ag element in the liquid electrolyte with Laser Induced Breakdown Spectroscopy (LIBS) through electrolysis method. Observations conducted by LIBS using Nd-YAG laser (1064nm, 7ns). Prior to analyze, first looking for the optimum conditions of experiments had been done. The results showed that the optimum laser energy to the characterization of the elements Ag was 100 mJ and optimum conditions of electric current and time deposition on electrolysis process were 4.93 mA and 10 minutes, respectively. These conditions, next, for the application of quantitative analysis of Ag solution that started from concentration 300 ppm to the lowest concentration and limit of detection obtained 1 ppm.
Keywords : Electrolysis, Pb element, Ag element, electric current, deposition time, LIBS, laser energy, limit of detection
Laser Induced Breakdown
Spectroscopy (LIBS) merupakan
spektroskopi atomik yang sangat handal untuk analisis kualitatif maupun kuantitatif untuk sampel padat dan gas. Hal ini tidak
terjadi untuk sampel cair, karena sampel ini akan terhambur saat diiradiasi laser dan menghasilkan plasma dengan temperatur rendah serta waktu yang sangat singkat. Keadaan ini menyebabkan analisis LIBS secara langsung pada sampel cair menjadi
kurang akurat dibandingkan dengan analisis pada sampel padat atau gas. Sehingga pada penelitian ini dilakukan penelitian untuk mengatasi kelemahan LIBS dengan mentransformasikan sampel dalam fase cair ke padat melalui proses elektrolisis.
Elektrolisis merupakan pemisahan suatu elektrolit menggunakan arus listrik. Pada penelitian ini, ion-ion dalam larutan terlebih dahulu dideposisikan pada elektroda. Selanjutnya, dianalisis dengan LIBS. Agar didapat hasil yang baik, maka pada penelitian ini akan dioptimasi beberapa parameter yang berpengaruh terhadap elektro deposisi, seperti jenis elektroda, kuat arus listrik, waktu deposisi dan kosentrasi larutan. Selain itu juga energi laser yang digunakan saat analisis.
Pada penelitian ini diamati bagaimana analisis unsur Ag dalam sampel cair dengan LIBS melalui proses elektrolisis. Pengamatan akan dilakukan dengan LIBS melalui pengukuran intensitas emisi atom Ag yang terdeposisi pada elektroda karena adanya perbedaan/variasi arus listrik, waktu deposisi dan konsentrasi larutan. Hal ini bertujuan untuk memberikan pengetahuan serta informasi tentang análisis limbah sampel cair Ag dengan LIBS melalui metode elektrolisis.
-
II. TINJAUAN PUSTAKA
-
2.1 Elektrolisis
-
Elektrolisis berasal dari kata elektro (listrik) dan lisis (penguraian), yang berarti terjadinya penguraian zat/senyawa atau reaksi kimia (oleh arus listrik (Laird, B.Brian,2009). Zat yang terurai dapat berupa cairan, atau larutan.
Proses penggunaan arus listrik untuk menghasilkan reaksi kimia disebut sel elektrolisis. Arus listrik yang digunakan adalah arus searah (direct current (DC)). Larutan yang ingin dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin dielektrolisis.
Pada elektrolisis larutan Ag terjadi reaksi redoks,
Anoda : (C) → oksidasi: H2Om → 12 O2(g) + 2H+(aq) + 2e Katoda : (Cu) → reduksi: 2 Ag+(aq) + 2e → 2Ag(s)
Reaksi oksidasi terjadi pada elektroda karbon (C). Dalam hal ini yang dioksidasi di anoda adalah H2O → O2 + 2H+ + 2e, sedangkan di katoda terjadi reduksi 2 ion Ag+ dari larutan bergerak menuju katoda sambil menerima dua elektron, dan mengendap menjadi 2 atom Ag di permukaan/melapisi katoda (Cu). Dalam hal ini 2 ion Ag+ mengendap dan 2 ion H+ masuk ke dalam larutan, sehingga tetap terjaga muatan dalam larutan. Proses ini berlangsung terus menerus, yang dapat
diamati berupa terjadinya perubahan warna larutan dan gelembung gas.
-
2.3 Laser Induced Breakdown Spectroscopy (LIBS)
Laser Induced Breakdown
Spectroscopy (LIBS) merupakan peralatan spektroskopi emisi atomik yang menggunakan laser sebagai sumber energi ablasi (Radziemski et all, 2006). Laser difokuskan ke permukaan sampel yang mana sebagian sampel akan terablasikan dan terbentuk plasma. Plasma berisikan elektron-elektron, atom-atom netral, ion-ion dan atom-atom tereksitasi. Atom-atom tereksitasi ini dalam waktu sangat singkat menyebabkan elektron-elektron kembali ke keadaan dasar (ground state) sambil memancarkan emisi photon. Selanjutnya emisi ini dianalisis secara kualitatif maupun kuantitatif oleh spektrograp. Optimasi hasil analisis ini sangat tergantung pada kondisi proses pembentukan plasma dan proses pendeteksiannya. Pembentukan plasma dipengaruhi oleh beberapa faktor diantaranya, jenis laser, jenis sampel serta tekanan gas penyangga.
Elektroda yang digunakan adalah karbon sebagai anoda dan tembaga sebagai katoda, yang berbentuk lempengan dengan panjang 5 cm dan lebar 0,8 cm. Larutan
elektrolit yang digunakan adalah larutan standar Ag (1000 ppm).
Dalam pelaksanaanya, proses
elektrolisis ini menggunakan elektroda tembaga (Cu) sebagai katoda dengan karbon (C) sebagai anoda. Pasangan elektroda ini dirangkai secara seri dan diberikan arus listrik DC. Untuk menjaga arus listrik DC yang diinginkan agar tetap konstan dipasang sebuah tahanan geser. Selanjutnya elektroda dimasukkan ke dalam larutan elektrolit yang akan dielektrolisis, Hasil elektrolisis selanjutnya dianalisis dengan Laser Induced Breakdown Spectroscopy (LIBS).
Analisa data dilakukan dengan metode-metode fisika yang umum digunakan seperti menentukan nilai rata-rata, standard deviasi pengukuran dan analisa grafik. Dari data hasil pengukuran intensitas emisi Ag dapat dihitung nilai rata-rata intensitas emisi sebagai penentuan optimasi pengukuran untuk energi laser, arus listrik, waktu deposisi serta deteksi limit kosentrasi larutan. Kemudian dibuat grafik antara energi laser dengan intensitas emisi Ag, grafik arus listrik dengan intensitas emisi Ag, grafik waktu deposisi dengan intensitas emisi Ag dan grafik deteksi limit kosentrasi larutan dengan intensitas emisi Ag.
-
IV. HASIL DAN PEMBAHASAN 4.1 Penentuan Optimasi Energi Laser Pada Ag
Penentuan optimasi energi laser pada analisis unsur Ag dilakukan pada sampel hasil elektrolisis larutan Ag dengan kosentrasi 300 ppm, arus listrik tetap 5.56 mA dan waktu 30 menit. Kemudian dianalisis melalui LIBS dengan variasi energi laser dari 20 mJ sampai 120 mJ.
Berdasarkan data hasil Tabel 4.1 dibuat grafik intensitas emisi Ag fungsi energi laser seperti pada Gambar 4.1. Gambar 4.1 menunjukkan bahwa intensitas emisi atom netral Ag I (328.06 nm) meningkat dengan bertambah besarnya energi laser sampai energi laser 100 mJ karena yang menyerap adalah atom-atom netral tereksitasi dan menurun pada energi laser 120 mJ. Hasil regresi menunjukkan bahwa range energi laser 60 mJ sampai dengan 100 mJ memiliki nilai R2 (0.941) yang paling tinggi dibandingkan range energi laser lainnya. Ini berarti bahwa pada energi laser 100 mJ sangat cocok untuk mengeksitasikan elektron-elektron dalam unsur Ag pada sampel thin film.
Tabel 4.1 Data Intensitas emisi Ag terhadap energi laser dari range 20 mJ-120 mJ.
|
Energi laser (mJ) |
Rata-rata Intensitas Emisi (a.u) |
|
20 |
30.67 |
|
40 |
31.67 |
|
60 |
41.00 |
80 76.33
100 170.00
120 147.33
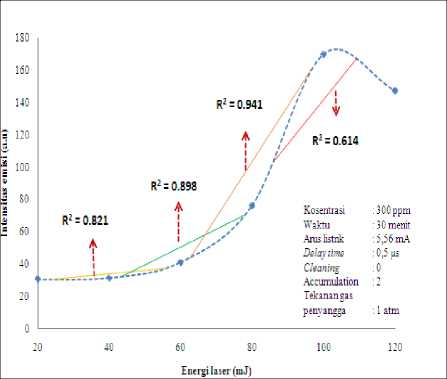
Gambar 4.1 Trendline Intensitas emisi Ag I 328.06 nm fungsi energi laser pada sampel Ag dalam rentang energi laser 20 mJ-120 mJ
Penentuan ini dilakukan pada sampel hasil elektrolisis larutan Ag dengan kosentrasi 300 ppm, waktu tetap 30 menit dan arus listrik yang bervariasi mulai 2.54 mA, 3.87 mA, 4.93 mA, 5.56 mA dan 6.82 mA dan massa Ag yang menempel pada katoda Cu. Unsur Ag yang menempel pada elektroda Cu kemudian dianalisis melalui LIBS menggunakan optimum energi laser optimum 100 mJ. Hasilnya seperti pada Gambar 4.2.
Gambar 4.2 menunjukkan bahwa intensitas emisi atom netral Ag I (328.06 nm) meningkat dengan bertambah besarnya
nilai arus listrik sampai 4.93 mA dan menurun pada arus listrik 5.56 mA sampai 6.82 mA. Analisis yang sama untuk massa Ag yang terendapkan di katoda juga meningkat dengan bertambahnya arus listrik sampai 4.93 mA. Penurunan ini disebabkan karena ketika diberikan arus listrik semakin besar maka dapat menyebabkan panas yang dapat menyebabkan kelarutan Ag naik sehingga elektron-elektron yang menempel
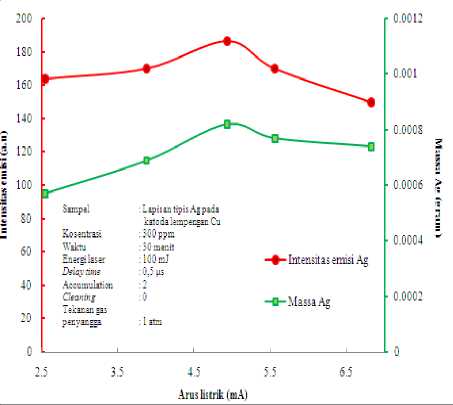
Gambar 4.2 Grafik intensitas emisi Ag I 328.06 nm fungsi arus listrik dan grafik massa Ag yang terendapkan di katoda fungsi arus listrik
makin sedikit. Sehingga dengan kondisi ini, maka arus listrik optimum yang digunakan pada proses elektrolisis untuk sampel Ag 4.93 mA
Penentuan ini dilakukan pada sampel
hasil elektrolisis larutan Ag dengan
kosentrasi 300 ppm, dan arus listrik optimum 4.93 mA dalam waktu deposisi yang bervariasi mulai 5 menit, 10 menit, 15 menit, 20 menit, 25 menit sampai 30 menit dan massa Ag yang menempel pada katoda. Unsur Ag yang menempel pada elektroda Cu kemudian dianalisis melalui LIBS menggunakan optimum energi laser optimum 100 mJ. Hasilnya seperti pada Gambar 4.3.
Gambar 4.3 menunjukkan bahwa intensitas emisi atom netral Ag I (328.06 nm) meningkat dengan bertambah besarnya nilai waktu deposisi sampai 10 menit dan menurun pada waktu 15 menit sampai 30 menit. Penurunan ini disebabkan karena mengalami kejenuhan sehingga semakin besar waktu deposisi yang diberikan, hasil intensitas emisi maupun massa akan tetap pada daerah tersebut. Untuk itu ditentukan waktu deposisi yang optimum pada sampel Ag ini adalah 10 menit.
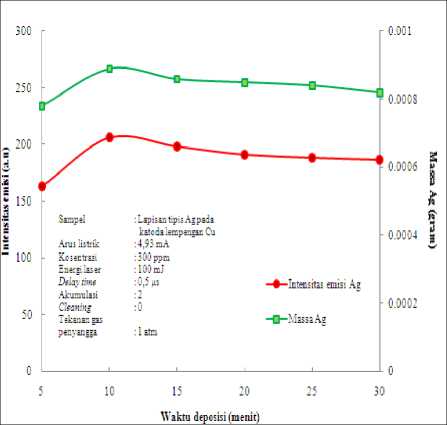
Gambar 4.3 Grafik Intensitas emisi Ag I 328.06 nm fungsi waktu deposisi dan grafik massa Ag yang terendapkan di katoda fungsi
waktu deposisi
Penentuan ini dilakukan pada sampel hasil elektrolisis larutan Ag dengan kosentrasi larutan bervariasi mulai kosentrasi tertinggi 300 ppm sampai kosentrasi terendah 0.5 ppm, menggunakan hasil optimum arus listrik 4.93 mA dalam waktu deposisi yang optimum 10 menit. Kemudian unsur Ag yang menempel pada elektroda Cu kemudian dianalisis melalui LIBS menggunakan optimum energi laser optimum 100 mJ. Hasilnya seperti pada Gambar 4.4.
Pada Gambar 4.4 menunjukkan bahwa intensitas emisi atom netral Ag I (328.06 nm) meningkat dengan bertambah besarnya nilai kosentrasi larutan mulai 1 ppm yang memiliki intensitas emisi terendah sampai 300 ppm yang memiliki intensitas emisi tertinggi. Hal tersebut dapat menunjukkan bahwa semakin kecil kosentrasi larutan yang diberikan maka semakin kecil kemungkinan intensitas emisi yang muncul dan sebaliknya. Untuk kosentrasi rendah < 50 ppm mempunyai kecenderungan dengan slop yang sama antara intensitas emisi atom dengan jumlah massa yang terdeposisi fungsi kosentrasi. Tetapi untuk kosentrasi di atas 50 ppm, slop kemiringan intensitas
emisi atom lebih besar dibanding dengan jumlah massa yang terdeposisi. Ini disebabkan kerapatan unsur Pb tiap satuan luas di kosentrasi fungsi lebih besar dibandingkan di kosentrasi rendah, sehingga intensitas emisi unsur Pb meningkat tajam.
Untuk mengetahui kosentrasi minimum
unsur Pb yang dapat dideteksi dengan
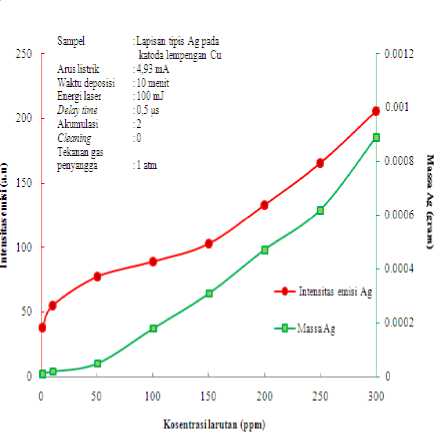
Gambar 4.4 Grafik intensitas emisi Ag I 328.06 nm fungsi kosentrasi larutan Ag dan grafik massa Ag yang terendapkan di katoda fungsi kosentrasi larutan Ag
metode LIBS ini, maka perlu dihitung deteksi limit melalui persamaan regresi linier dari empat data terkecil. Sehingga deteksi limit kosentrasi minimum unsur Ag seperti pada Gambar 4.5.
Pada Gambar 4.5 menunjukkan bahwa hasil regresi yang mana nilai kosentrasi larutan Ag dari 100 ppm sampai 1 ppm memiliki nilai R2 yaitu 0.897. Sehingga diperoleh nilai deteksi limitnya
berdasarkan perumusan deteksi limit sebesar 1 ppm.
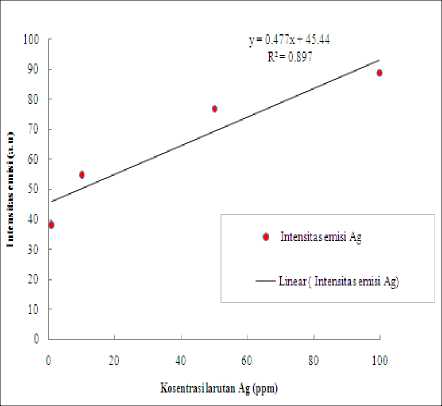
Gambar 4.5 Grafik deteksi limit kosentrasi larutan Ag I 328,06 nm
Berdasarkan hasil penelitian Tugas Akhir yang telah dilakukan tentang analisis unsur Ag dalam cairan elektrolit dengan Laser Induced Breakdown Spectroscopy (LIBS) melalui metode elektrolisis, dapat disimpulkan bahwa pengamatan dengan LIBS melalui pengukuran intensitas emisi atom Ag yang terdeposisi pada elektroda menggunakan energi laser yang optimum sebesar 100 mJ dengan kondisi arus listrik optimum yang digunakan pada saat elektrolisis sampel Ag sebesar 4,93 mA dan waktu deposisi optimum yang digunakan pada saat elektrolisis sampel Ag sebesar 10 menit. Metode elektro deposisi ini mampu mendeteksi unsur Ag dalam larutan hingga pada kosentrasi sebesar 1 ppm dan nilai
deteksi limit kosentrasi larutan Ag sebesar 1 ppm.
Agustiningrum, Ulfa. 2012. Analisis
Kualitatif Batu Paras sebagai
Penyaring Unsur Pb, Ag dan Zn dengan Metode Laser Induced
Breakdown Spectroscopy (LIBS). Bukit Jimbaran: Program Sarjana Fakultas MIPA Universitas Udayana.
Laird, B. Brian. 2009. University Chemistry. New York: McGraw-Hill Companies, Inc.
Radziemski L.J. and D.A Cremers. 2006.
Handbook of Laser Induced Breakdown Spectroscopy . England: John Wiley and Sons Ltd.
Suyanto, H., Rupiasih, N., T.B, Winardi, Manurung, M., Kurniawan, K.H. 2012. Qualitative Analysis of Pb Liquid Sample Using Laser-Induced
Breakdown Spectroscopy (LIBS). The 2nd International Conference on
Theoretical and Applied Physics (ICTAP-2012), Palangkaraya,
Indonesia.
Suyanto, Hery. 2003. Study of Shock Wave Plasma Confimoment and Bending Effectsfor The Application of Laser Induced Shock Wave Plasma Spectroscopy to Powder Samples.
Jakarta: Program Pascasarjana Fakultas Teknik Universitas Udayana.
Yudiandika, Putu. 2010. Studi Pemisahan Logam Perak (Ag) dari Limbah Fotografi Rumah Sakit dengan Metode
Elektrolisis melalui Variasi Arus
Listrik dan Bahan Elektroda.
Denpasar: Universitas Udayana
23
Discussion and feedback