RESPONS PERILAKU BULU BABI Deadema setosum TERHADAP LOGAM BERAT KADMIUM
on
RESPON PERILAKU BULU BABI Deadema setosum TERHADAP LOGAM BERAT KADMIUM
Dominggus Rumahlatu
Program Studi Pendidikan Biologi, FKIP Universitas Pattimura, Jl. Dr. Tamaela Ambon, Telp/Fax. 0911-312343
E-mail: dominggus_amq@yahoo.co.id
Abstract
Deadema setosum are sea urchins which are very sensitive to heavy metal pollutants. In this research, the observation of behavioral responses namely the behavior of moving and resting Deadema setosumare conducted. They are caused by exposure of different heavy metals Cd at 4 agurium tanks for 4 weeks. Analysis of levels of heavy metals Cd that accumulates in the gonad and intestine Deadema setosum using Atomic Absorbsion Spectrofotometer (AAS). The observations shows responses of switching behavior and resting Deadema setosum that fluctuats during 4 weeks of observation. In addition, behavioral end point’s observations about the losing of spines is not observed during these 4 weeks. The content levels of Cd which accumulates in the intestine and the gonads increase from the first tank (lowest value) to the fourth tank (the highest), the result show that tanks 1 <2 <3 <4. The results of these observations indicate that the behavior of moving and resting Deadema setosum influenced by heavy metal concentrations of Cd that accumulates in the body of Deadema setosumwhich occurs through a process of absorption.
Key words: behavioral responses, behavioral end point’s, Deadema setosum, heavy metal cadmium
-
1. Pendahuluan
Bulu babi telah banyak digunakan sebagai bioindikator pencemaran laut selama beberapa dekade terakhir (Flammang et al., 1997; Soualili et al., 2007). Hasil penelitian telah menunjukkan akumulasi logam berat dalam bulu babi mencerminkan kelimpahan dan bioavailabilitas dalam air terkontaminasi (Phillips et al., 2003; Bielmyer et al., 2005). Russo et al. (2003) menjelaskan bahwa invertebrata laut memiliki sensitivitas yang tinggi terhadap logam berat.
Bulu babi sangat sensitif terhadap polutan logam (Soualili et al., 2008). Ayeni et al. (2010) dan Chakrabortty and Paratkar (2006) mengungkapkan bahwa untuk menentukan suatu organisme dapat digunakan sebagai bioindikator logam berat di perairan harus memiliki kriteria berupa spesies yang dominan dalam populasi, dapat di sampling pada semua musim, toleran terhadap polutan, dan mudah dipelihara pada kondisi laboratorium. Penelitian yang dilakukan oleh Bielmyer et al. (2005) menggunakan dua tahap perkembangan Sea Urchin jenis Deadema
antillarum tahap embrio dan dewasa sebagai bioindikator logam berat, menunjukkan sensivitas yang tinggi terhadap logam berat Cu pada level kontaminasi yang rendah. Penelitian yang dilakukan oleh Temara et al. (1998) juga telah memberikan gambaran terkait dengan penentuan status tingkat pencemaran dengan indikator berat kering Asterias ruben. Bulu babi jenis Tripneustes ventricosus dan Lytechinus variegates telah digunakan untuk melihat perilaku covering dari radiasi sinar UV (Fierce and Lapin, 2004). Nichols (2009) meneliti efek predator dan habitat terhadap kepadatan dan perilaku bulu babi di California Selatan dan melaporkan bahwa perubahan perilaku bulu babi dipengaruhi oleh material covering, yaitu lamun. Di sisi lain, perubahan perilaku bulu babi juga dipengaruhi oleh stressor lingkungan, seperti logam berat (Dumont et al., 2007).
Terkait dengan penggunaan bulu babi berduri panjang Deadema setosum dalam penelitian ini, Salmanu (2010) melaporkan bahwa Deadema setosum merupakan spesies kunci di perairan pulau Ambon
dan pengaruhnya secara ekologis dalam komunitas lamun. Deadema setosum merupakan anggota dari famili Diadematidae kelas Ecninoidea filum Echinodermata. Aziz (1996) mengungkapkan bahwa tubuh hewan ini berbentuk bulat dan cangkang yang beraturan. Bentuk cangkang berupa buah delima atau dengan bentuk lebih tertekan memipih memberikan kesan setengah bola. Ukuran cangkang yang telah dewasa bisa mencapai 90 mm dengan cincin putih di sekitar system apical dan juga cincin merah bata di pangkal kerucut anus dan mempunyai duri-duri berwarna hitam yang tajam dengan panjang 8-10 cm. Rumahlatu (2007) mengungkapkan bahwa Deadema setosum hidupnya di bawah garis batas surut terendah. Makanannya alga dan hidupnya mengelompok untuk dapat saling melindungi terhadap ancaman musuh. Secara alami, Deadema setosum melakukan mekanisme pertahanan akibat stressor lingkungan. Mekanisme pertahanan tersebut merupakan respons terhadap lingkungan berupa perilaku covering/menutup diri dengan materi di sekitar habitatnya (preferensi dan grazing) dan perilaku harian (perilaku berpindah, makan, dan istirahat/resting). Schoettger (1996) menjelaskan bahwa respons yang timbul pada organisasi seluler memang diperlukan untuk memastikan keberadaan logam berat di lingkungan. Meskipun bulu babi pada umumnya merupakan organisme perairan yang digunakan dalam banyak penelitian, tetapi penelitian tentang perilaku harian, yaitu perilaku berpindah, makan, dan resting akibat paparan logam berat belum banyak dikaji. Kajian lebih banyak di fokuskan pada penelitian perilaku covering bulu babi (Aziz, 1994; Fierce and Lapin, 2004; Dumont et al., 2007; Nichols, 2009). Selain itu, bulu babi jenis D. setosum telah digunakan untuk menentukan status kontaminasi logam berat pada ekosistem coral reefs di perairan Singapore (Flammang et al., 1977), di laut Pasifik Hindia Barat (Phillips, 1990), dan bagian barat laut Mediterania (Augier et al., 1989; Warnau et al., 1995). Itulah sebabnya penelitian ini dilakukan untuk melihat respons perilaku Deadema setosum terhadap paparan logam berat kadmium pada bak perlakuan sebagai indikator pencemaran.
-
2. Metode Penelitian
Penelitian ini diawali dengan mengumpulkan individu bulu babi Deadema setosum dewasa sebanyak 30 individu jantan dan betina dari perairan pantai desa Hila Pulau Ambon. Selanjutnya dilakukan penangkaran terhadap bulu babi jenis Deadema
setosum selama 1 tahun pada balai budidaya biota laut LIPI Ambon dengan tujuan untuk mendaptkan individu Deadema setosum yang bebas dari logam berat Cd. Perlakuan dan pengumpulan data dilakukan antara tanggal 10 Agustus-10 September 2011 di balai budidaya biota laut LIPI Ambon dengan metode eksprimen laboratorium. Sampel Deadema setosum yang digunakan ditentukan secara purposive sampling. Sugioyono (1999) mengungkapkan bahwa teknik purposive sampling adalah penentuan sampel dengan pertimbangan tertentu, sehingga sampel yang ditentukan dalam penelitian ini adalah individu Deadema setosum yang memiliki karakteristik berat badan, lingkar tubuh, dan jenis yang sama sebanyak 20 Individu.
Proses pengumpulan data diawali dengan penentuan individu Deadema setosum untuk digunakan dalam perlakuan. Sebanyak 20 individu Deadema setosum yang digunakan memiliki karakteristik yang sama yaitu berat tubuh 90-95 gr dan lingkar tubuh 15-20 cm. Selanjutnya, 20 individu Deadema setosum dibagi menjadi 4 kelompok untuk 3 tingkatan konsentrasi logam berat Cd dan kontrol, pada masing-masing kelompok digunakan 5 individu sehingga total unit analisis adalah 20. Bak aguarium berukuran 100 x 60 x 70 cm diletakan di atas meja kayu dan diisi dengan air laut sebanyak 200 L. Sampel individu Deadema setosum selanjutnya dimasukan ke dalam bak aquarium, dimana setiap bak ditempati 5 individu Deadema setosum untuk fase adaptasi selama 1 minggu. Pemberian konsentrasi Cd pada tiap bak aguarium (1 bak control dan 3 bak perlakuan), yaitu 0.0, 1.0, 6.0, dan 12.0 µg/L Cd terlarut selama 4 minggu dalam bak aquarium 200L dengan sirkulasi udara bak perlakuan menggunakan aeratorlistrik..
Selama perlakuan, dilakukan pengukuran faktor fisika kimia pada bak perlakuan (aquarium) berupa suhu, pH, salinitas, dan oksigen terlarut pada waktu pagi, siang dan sore hari sebagai variabel kontrol dengan tujuan untuk pergantian air perlakuan apabila faktor fisika kimia air perlakuan berubah dari batas tertinggi dan terendah untuk kehidupan bulu babi pada kondisi alami. Untuk kebetuhan makanan D. Setosum, maka diberi pakan berupa lamun dan pemberian pakan dilakukan setiap pagi dengan cara mengikat lamun pada bongkahan karang dan diletakan dalam bak perlakuan serta menebar lamun pada permukaan air bak perlakuan.
Pengamatan perilaku Deadema setosum untuk melihat respons perilaku Deadema setosum akibat paparan logam berat Cd dilakukan selama 4 minggu
perlakuan difokuskan pada pengamatan aktivitas harian, yaitu perilaku berpindah dan perilaku isrirahat Deadema setosum dan pengamatan titik perilaku (behavioral end point). Setelah 4 minggu perlakuan, dilakukan pembedahan terhadap 20 individu Deadema setosum untuk memisahkan bagian tubuh gonad dan usus. Selanjutnya bagian tubuh gonad dan usus dimasukan ke dalam pot sampel.
Sampel bagian tubuh gonad dan usus Deadema setosum yang telah diperoleh kemudian dianalisa kandungan kadmiumnya di laboratorium kimia Universitas Brawijaya. Sampel gonad dimasukkan dalam cawan teflon dan dikeringkan dalam oven pada suhu 105oC selama 24 jam. Setelah kering dikocok beberapa kali dengan air suling. Sampel gonad dikeringkan kembali pada suhu 100oC selama 24 jam, kemudian digerus hingga halus. Sebanyak 3 gram sampel gonad kering dimasukkan dalam cawan teflon, didestruksi dengan menggunakan HNO3/HCL pekat dan biarkan pada suhu ruang ± 4 jam. Destruksi dilanjutkan pada suhu 90oC selama 8 jam. Analisis Cd ditentukan dengan menggunakan Atomic Absorbsion Spectrofotometer (AAS) (Bilmeyer et al., 2005). Cara kerja yang sama juga dilakukan untuk sampel usus Dedaema setosum. Analisis kandungan Cd di dalam bagian tubuh Deadema setosum penting dilakukan karena kebiasaan masyarakat Maluku mengkonsumsi biota tersebut.
Analisis data secara deskriptif menggunakan metode kuantitatif dalam bentuk persentase untuk menggambarkan respons perilaku Deadema setosum akibat paparan logam berat Cd dan konsentrasi logam berat Cd dalam bagian tubuh Deadema Setosum.
-
3. Hasil dan Pembahasan
-
3.1. Respons Perilaku Deadema setosum Terhadap
-
Logam Berat Cd
Hasil pengamatan respons perilaku Deadema setosum pada 4 bak aquarium (1 bak kontrol dan 5 tingkatan konsentrasi Cd), yakni 0.0, 1.0, 6.0, dan 12.0 µg/L Cd terlarut selama 4 minggu pengamatan, akan dibahas lebih lanjut sebagai berikut.
-
3.1.1. Respons Perilaku Berpindah Deadema setosum Terhadap Logam Berat Cd
Hasil pengamatan respons perilaku berpindah Deadema setosum akibat paparan logam berat Cd pada tiap bak perlakuan menunjukan bahwa jarak rata-rata perilaku berpindah Deadema setosum pada bak pertama (kontrol) menunjukan perilaku berpindah Deadema setosum mengalami fluktuasi selama 4 minggu pengamatan. Jarak perpindahan tertinggi teramati pada minggu ke empat, yakni 15,27 cm sedangkan jarak perpindahan terendah teramati pada minggu ke tiga, yakni 2.31 cm. Sedangkan pada bak perlakuan 2, 3, dan 4 yang diberi konsentrasi Cd
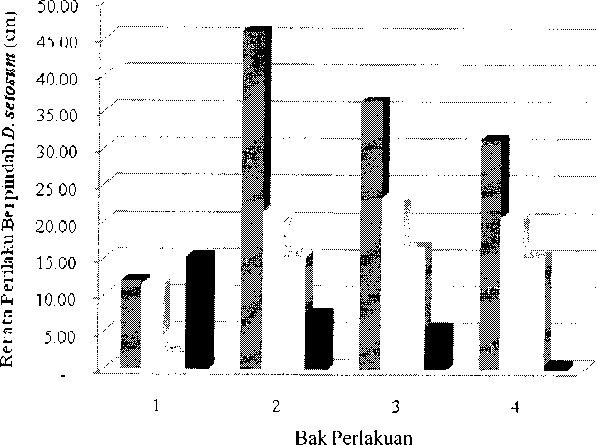
Gambar 1. Perilaku Berpindah Deadema setosum Akibat Paparan Cd
^Mingguke-I
Miuggu ke-2
Minggu ke-3
«Minggu k c-4
berturut-turut 1, 6, dan 12 µg/200L air laut teramati jarak perpindahan dari minggu pertama sampai dengan minggu ke empat (tinggi ke rendah), yakni bak 2 > 3 > 4 (Gambar 1). Hasil pengamatan ini menunjukan adanya perbedaan perilaku berpindah pada bak kontrol dengan bak yang diberi konsentrasi Cd berbeda.
Pada bak kontrol, perilaku berpindah Deadema setosum teramati bergerak secara acak dengan jarak rata-rata tertinggi, sebesar 15.27 cm dan terendah, sebesar 2.31 cm. Perilaku berpindah Deadema setosum seperti ini terkait dengan pergerakannya untuk mencari makan. Menurut Kawamata (2010), bulu babi menunjukkan kemampuan minimal untuk berpindah sekitar 0,7 m/s. Perilaku berpindah Deadema setosum seperti ini terkait dengan pergerakannya untuk mencari makan. Dijelaskan oleh Urriago et al. (2011), secara alami pola perpindahan bulu babi dalam sehari bersifat acak dan terutama untuk menghindari gangguan predator atau mencari makanan. Menurut Aziz (1994) bahwa perilaku berpindah bulu babi juga dipengaruhi oleh pemilihan atau kesukaan terhadap jenis makanan tertentu (preferensi).
Pada bak perlakuan 2, 3, dan 4 yang diberi konsentrasi Cd berbeda menujukan bahwa perilaku berpindah Deadema setosum mengalami variasi jarak perpindahan namun jaraknya terus menurun dari minggu pertama sampai dengan minggu ke empat. Hal ini mengindikasikan bahwa semakin lamanya waktu pengamatan terhadap perilaku berpindah Deadema setosum maka jarak perpindahan semakin rendah. Menurunnya perilaku berpindah Deadema setosum dipengaruhi oleh konsentrasi logam berat Cd yang terakumulasi di dalam tubuh Deadema setosum terjadi melalui proses penyerapan. Walaupun tidak menunjuk langsung pada Deadema setosum, Fierce et al. (2004) menjelaskan bahwa bulu babi jenis Tripneustes ventricosus dan Lytechinus variegatus melakukan mekanisme pendektesian dengan menggunakan sensor tactilenya terhadap kondisi ekstrim. Hal ini menyebabkan Deadema setosum melakukan mekanisme diam untuk mengurangi pergerakannya. Menurut Soualili et al. (2007) kebiasaan bulu babi untuk tidak bergerak (sedentary) menunjukan sensitivitasnya terhadap logam berat. Dapat disimpulkan bahwa mekanisme lebih banyak diam dan pergerakan lambat yang dilakukan oleh Deadema setosum merupakan
mekanisme pertahanan diri akibat akumulasi logam berat Cd. Menurut Sloman et al. (2003) bahwa perubahan perilaku pada organisme merupakan indikator terjadinya kerususakan pada sistem saraf sebagai akibat dari paparan logam berat Cd dan berasosiasi dengan pola agresif pada ikan. Selain bulu babi Deadema setosum yang digunakan dalam penelitian ini, penelitian sebelumnya oleh Almeida et al. (2009) melaporkan bahwa paparan logam berat Cd menyebabkan penurunan aktivitas atau perilaku agresif pada ikan Nile tapia. Hal ini menunjukan bahwa paparan logam berat Cd menyebabkan penurunan aktivitas pada berbagai jenis hewan, termasuk bulu babi Deadema setosum.
-
3.1.2. Respons Perilaku Istirahat/Resting
Deadema setosum Terhadap Logam Berat Cd
Hasil pengamatan respons perilaku istirahat Deadema setosum akibat paparan logam berat Cd pada tiap bak perlakuan menunjukan bahwa waktu rata-rata perilaku istirahat Deadema setosum pada bak pertama (kontrol) mengalami fluktuasi selama 4 minggu pengamatan. Perilaku istirahat tertinggi teramati pada minggu ke tiga, yakni 134,19 menit, sedangkan perilaku istirahat terendah teramati pada minggu ke satu, yakni 102,33 menit. Sedangkan pada bak perlakuan 2, 3, dan 4 yang diberi konsentrasi Cd berturut-turut 1, 6, dan 12 µg/200L air, teramati waktu istirahat dari minggu pertama sampai dengan minggu ke empat (rendah ke tinggi), yakni bak 2 < 3 < 4 (Gambar 2). Hasil pengamatan ini menunjukan adanya perbedaan waktu istirahat Deadema setosum pada bak kontrol dengan bak yang diberi konsentrasi Cd berbeda.
Pada bak kontrol, perilaku istirahat Deadema setosum dipengaruhi oleh kebiasaan alami Deadema setosum di alam yang selalu melakukan aktivitas meliang, aktivitas mencari makan (feeding habit) ataupun daya grazing (kesukaan akan lamun). Aktivitas ini memungkinkan perilaku istirahat Deadema setosum pada bak kontrol mengalami fluktuasi, dimana Deadema setosum kadang melakukan aktivitas istirahat yang lama maupun kadang cepat. Menurut Aziz (1994), Deadema setosum merupakan salah satu jenis bulu babi pemakan segala (omnivora), sehingga pada penelitian ini yang diberi pakan lamun, teramati aktivitas isttirahat Deadema setosum pada bak kontrol aktivitasnya sangat dipengaruhi oleh
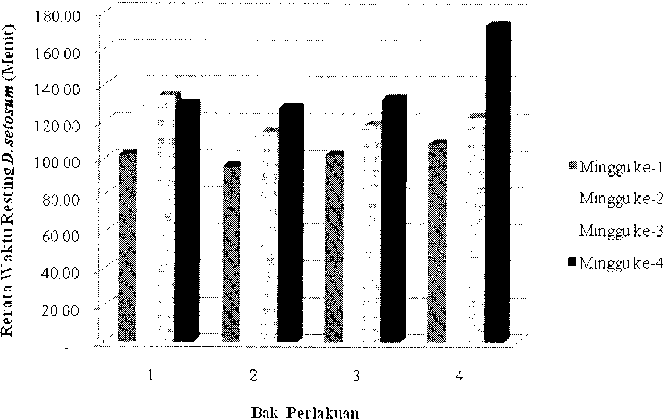
Gambar 2. Perilaku Resting Deadema setosum Akibat Paparan Cd
keberadaan jenis makanan.
Pada bak perlakuan 2, 3, dan 4 yang diberi konsentrasi Cd berbeda menujukan bahwa perilaku istirahat Deadema setosum mengalami variasi waktu istirahat namun waktunya terus menurun dari hari pertama sampai dengan hari ke tiga puluh. Hal ini mengindikasikan bahwa semakin lamanya waktu pengamatan terhadap perilaku istirahat Deadema setosum maka perilaku istirahatnya semakin lama. Dapat diduga bahwa perilaku istirahat Deadema setosum dipengaruhi oleh adanya daya grazing dan keberadaan logam berat Cd pada tiap bak perlakuan. Walaupun secara alami, perilaku istirahat Deadema setosum dipengaruhi oleh preferensi dan daya grazing (Kawamata, 2010), namun pada penelitian ini menunjukan bahwa logam berat Cd menyumbangkan pengaruh yang sangat besar terhadap perilaku istirahat D. setosum. Hal ini dibuktikan dengan semakin lamanya perilaku istirahat akibat paparan Cd berbeda. Semakin tinggi konsentrasi Cd yang di paparkan, maka perilaku istirahat Deadema setosum juga semakin lama.
-
3.1.3. Respons Perilaku Berdasarkan Pengamatan Titik Perlaku (Behavioral end Point) Deadema setosum
Hasil pengamatan respons perilaku terhadap titik perilaku (behavioral end point) Deadema setosum pada tiap bak perlakuan menunjukan bahwa
titik perilaku pada bak kontrol, yakni lepasnya duri tidak teramati selama 4 minggu pengamatan. Penutupan duri (spine closure) terjadi pada pengamatan minggu ke empat. Posisi hewan berada di dasar bak dan terkadang bergerak menuju bagian dinding bak secara berkelompok (Tabel 1). Fenomena ini menunjukan bahwa, secara alami perilaku Deadema setosum mengikuti karakteristik habitat dan pola distribusinya atau terjadi karena faktor lain yang tidak di ukur, seperti penyebaran nutrien dalam kumunitas, selain dari faktor interaksi yang kuat antar jenis yang ada. Menurut Rumahlatu (2007), distribusi merupakan konsekuensi atau akibat dari respons atau interaksi di antara jenis, namun faktor ini bukan merupakan faktor tunggal yang berperan sendiri tetapi bersama-sama faktor lingkungan lainnya, seperti respons untuk mendapatkan cahaya, penyebaran makanan dalam komunitas, atau pemanfaatan sumberdaya dan respons terhadap variasi musiman terhadap temperatur maupun akibat stressor lingkungan, seperti logam berat.
Respons perilaku berdasarkan pengamatan titik perilaku (behavioral end point) Deadema setosum pada tiap bak perlakuan yang diberi konsentrasi Cd berbeda (Tabel 1) menunjukan bahwa penutupan duri (spine closure) terjadi pada konsentrasi rendah, posisi hewan berada di dasar bak dan pada akhirnya kehilangan sebagian durinya. Deadema setosum mula-mulai memposisikan diri di dasar bak pada
Tabel 1. Hasil Pengamatan Titik Perlaku (behavioral end point) Deadema setosum
|
.Minggu ke- |
Titik Periiaku (behavioral end point) |
Deadema setos u m Tiap ____Bak Periakuan_____ | |||
|
1 |
2 |
3 |
4 | ||
|
Lepasnya duri |
X |
X |
X |
X | |
|
1 |
Penutupan duri spine closure |
X |
X |
X |
X |
|
Orientasi spasial dalam tanki (khususnya jatuh ke dasar tanki) |
X |
X |
X |
X | |
|
Lepasnya duri |
X |
X |
X |
X | |
|
2 |
Penutupan duri/spine closure |
X |
X |
X | |
|
Orientasi spasial dalam tanki (khususnya jatuh ke dasar tanki) |
X |
X |
X |
_x__ | |
|
Lepasnya duri |
X |
√ |
X |
X' | |
|
3 |
Penutupan duri/spine closure |
X |
√ |
X |
X' |
|
Orientasi spasial dalam tanki (khususnya jatuh ke dasar tanki) |
X |
X |
X |
X | |
|
Lepasnya duri |
X |
X |
X |
\ | |
|
4 |
Penutupan duri/spine closure |
√ |
√ |
x' |
√ |
|
Orientasi spasial dalam tanki (Ichususnyajatuh ke dasar tanki) |
√ |
X |
X |
_x__ | |
√
a
Keterangan:
• Tanda centang (√) terdapat behavioral end point dan tanda silang (“x”) tidak terdapat behavioral end point.
konsentrasi Cd rendah, diikuti dengan spine closure untuk level konsentrasi Cd yang sedikit lebih tinggi dan kehilangan duri terjadi dalam dua perlakuan konsentrasi tertinggi, yakni konsentrasi 6 dan 12 µg/ L Cd air laut. Walaupun secara alami perilaku Deadema setosum dipengaruhi oleh cahaya, ataupun faktor temperatur musiman, namun dalam kasus ini Deadema setosum menunjukan senisitivitas yang tinggi terhadap keberadaan logam berat Cd, terutama pada paparan konsentrasi 12 µg/L Cd air laut. Deadema setosum yang terpapar logam berat Cd menunjukkan perubahan pada titik perilaku. Deadema setosum dalam perlakuan konsentrasi Cd tertinggi cenderung mengalami perubahan titik perilaku lebih awal daripada yang berada dalam perlakuan lebih rendah di akhir pengamatan minggu ke empat. Pernyataan ini didukung oleh respon perilaku teramati pada Deadema setosum tersebut. Deadema setosum yang terpapar pada konsentrasi Cd tertinggi menutup duri pada minggu ke dua, sementara penutupan duri dalam perlakuan untuk Cd yang lebih rendah terjadi pada minggu ke dua s.d minggu ke empat pengamatan. Menurut Urriago et al. (2011) bahwa perilaku menutup duri bulu babi meniru kebiasaan alaminya untuk menghindari diri dari predator dan stressor lingkungan oleh logam berat. Menurut Bielmyer et al. (2005 bahwa pada konsentrasi rendah, Cu dapat menyebabkan Deadema antilarum menutup durinya, sedangkan
dalam konsentrasi yang tinggi akan memicu terlepasnya duri dari tubuh Deadema antilarum. Perilaku menutup duri, lepasnya duri dan orientasi spasial di dalam bak perlakuan dari Deadema setosum disebabkan oleh daya akumulasi logam berat Cd dan berhubungan dengan mekanisme homoestasis. Penelitian yang dilakukan oleh Fufeyin et al. (2008) melaporkan bahwa kadmium dapat terakumulasi di dalam sel saraf sehingga menimbulkan perilaku abnormal pada Cavia porcellus. Hasil penelitian ini mengindikasikan bahwa respon perilaku Deadema setosum dapat menjadi aplikasi yang berguna sebagai biomonitoring non-invasif dalam lingkungan laut yang terpolusi.
-
3.2. Kadar Logam Berat Cd pada Bagian Tubuh Deadema setosum
Hasil analisis kandungan logam berat Cd pada bagian tubuh Deadema setosum (usus dan gonad) setelah paparan logam berat Cd selama 4 minggu pada 4 bak perlakuan menunjukan perbedaan nilai rata-rata kandungan logam berat Cd pada usus dan gonad Deadema setosum, namun kadar logam berat Cd mengalami peningkatan, mulai dari bak ke satu (nilai terndah) sampai dengan bak ke empat (nilai tertinggi), yaitu bak 1 < 2 < 3 < 4 (Gambar 3).
Berkaitan dengan keberadaan kadar logam berat Cd di dalam bagian tubuh (usus dan gonad) Deadema setosum, maka perlu dipahami proses masuknya kadar
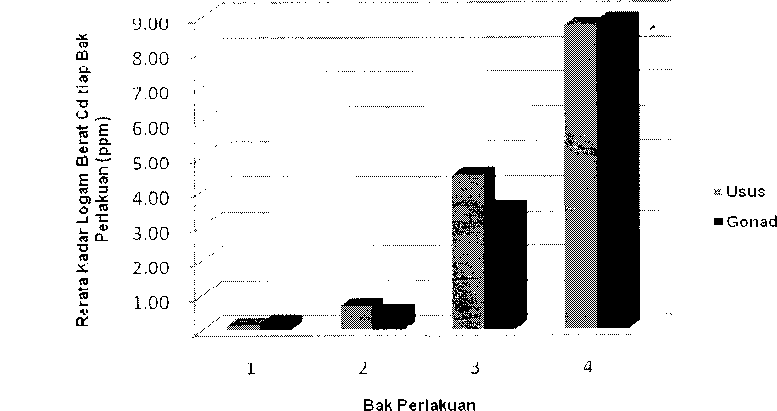
Gambar 3. Kadar Logam Berat Cd dalam Gonad dan Usus Deadema setosum
logam berat tersebut ke dalam bagian tubuh Deadema setosum. Pada penelitian ini, keberadaan Cd pada tubuh Deadema setosum didapat melalui proses penyerapan dengan pemberian konsentrasi Cd berbeda terlarut di dalam air bak perlakuan dan makanan berupa lamun yang diletakan pada dasar bak perlakuan. Menurut Umar et al. (2001) logam berat yang masuk ke perairan akan mengalami pengendapan, pengenceran dan dispersi kemudian diserap oleh organisme tersebut.
Kadar logam berat Cd yang terakumulasi di dalam usus dan gonad Deadema setosum menunjukan nilai yang bervariasi karena penyerapan (absorbsi) logam berat pada bagian tubuh Deadema setosum umumnya tergantung pada kebutuhan selnya, walaupun diketahui fungsi usus untuk penyerapan. Kandungan Cd yang tinggi menunjukan sifat logamnya yang bioakumulatif. Warnau et al. (1996) melaporkan konsentrasi logam berat Cd pada bagian tubuh Paracentrotus lividus bervariasi, dan terjadi peningkatan berturut-turut dinding sistem pencernaan, gonad, Aristotle’s lantern, dan cairan coelom dan berhubungan dengan unsur-unsur dari air dan makanan. Penelitian yang dilakukan oleh Temara et al. (1998) menemukan bahwa akumulasi logam berat Cd pada Asterias rubens terjadi relatif lebih cepat dibanding Pb dan Zn. Akumulasi Pb dan Cd pada bagian tubuh Asterias rubens berhubungan dengan kadar logam berat tersebut pada air laut. Penelitian lain menggunakan echinoidea jenis
Paracentrotus lividus oleh Soualili et al. (2007) menemukan bahwa gonad betina dapat mengakumulasi logam berat dengan konsentrasi yang tinggi, yakni 0.14 µg g-1 dry wt dan berhubungan dengan konsentrasi logam berat dalam sedimen. Hal ini mengindikasikan bahwa logam berat yang terakumulasi di dalam bagian tubuh biota laut berbeda, tergantung pada fisiologi organ tersebut, sehingga Rochyatun and Rozak (2007) menyimpulkan bahwa logam berat tidak dapat diuraikan (non degradable) oleh organisme hidup dan terakumulasi ke lingkungan membentuk senyawa kompleks bersama bahan organik dan anorganik secara adsorbsi dan kombinasi pada berbagai jenis biota. Hal ini berarti bahwa logam berat dapat berpindah ke matriks lingkungan lainnya. Tingginya kandungan Cd dalam tubuh mengindikasikan bahwa daya akumulasi Deadema setosum semakin cepat dan dapat digunakan sebagai bioindikator kualitas perairan sekaligus sebagai spesies biomonitoring dalam lingkungan laut yang terpolusi.
Berbagai penelitian melaporkan bahwa logam berat Cd umumnya terakumulasi di dalam organ ginjal (Quig, 1998), liver (Shah, 2005; Vinodhini and Narayanan, 2008; Almeida et al., 2009;), insang, otot, testis dan ovarium ikan Nile tapia (Shah, 2005), dan gonad P. lividus (Soualili et al., 2007). Disisi lain, jumlah logam berat yang terakumulasi dalam tubuh biota perairan bergantung pada efek kimia logam berat tersebut dan cenderung berikatan dengan protein
dan lipid pada jaringan biologis (Gbrauko and Friday, 2007). Jenis protein yang menjadi target utama bagi perlekatan dengan logam berat adalah proteinprotein yang memiliki kandungan logam pada struktur proteinnya (Gong et al., 2000).
-
4. Simpulan dan Saran
-
4.1. Simpulan
-
Hasil interpretasi data respons perilaku berpindah, perilaku resting, dan behavior end point Deadema setosum akibat paparan kadmium menunjukan bahwa semakin tinggi konsentrasi logam berat yang di paparkan, maka perilaku resting Deadema setosum semakin lama dan memperlambat perilaku berpindahnya. Menurunnya perilaku berpindah dan resting Deadema setosum dipengaruhi oleh konsentrasi logam berat Cd yang terakumulasi di dalam tubuh Deadema setosum yang terjadi melalui proses penyerapan dan berkaitan dengan mekanisme pertahanan diri akibat akumulasi logam berat Cd dan daya grazing. Di sisi lain, semakin
tinggi paparan konsentrasi logam berat Cd maka behavior end point Deadema setosum mengalami perubahan, seperti lepasnya duri dan penutupan duri (spine closure).
-
4.2. Saran
Saran yang menjadi harapan peneliti, yakni perlu dilakukan penelitian lanjutan tentang: (1) respons biomolekuler Deadema setosum terhadap logam berat kadmium pada kondisi laboratorium, (b) efek logam berat kadmium terhadap perilaku covering dan radiasi sinar matahari pada Deadema setosum pada kondisi laboratorium.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada Kepala Balai Budidaya Biota Laut LIPI Ambon beserta staff dan kepada semua pihak yang telah membantu jalannya penelitian hingga tahap akhir penulisan artikel ini.
Daftar Pustaka
Augier, H., G. Ramonda, J. Rolland, and M. Santimone. 1989. Teneurs en metaux lourds desoursins comestibles Paracentrotus lividus (Lamarck) preleves dans quatre secteurs tests du littoral de Marseille (Mediterranee, France). Vie Marine, 10. 226–239.
Almeida, J.A., R.E, Barreto, L.B. Novelli, F.J. Castro, and S.E. Moron. 2009. Oxidative stress biomarkers and aggressive behavior in fish exposed to aquatic cadmium contamination. Neotropical Ichtyology, 7(1). 103-108.
Aziz, A. 1994. Pengaruh Salinitas terhadap Sebaran Fauna Echinodermata. Oseana, 14. 23-32.
Aziz, A. 1996. Habitat dan Zonasi Fauna Echinodermata di Ekosistem Terumbu Karang. Oseana, 24(2). 33-43.
Ayeni, O.O., P.A. Ndakidemi, R.G. Snyman, and J.P. Odendaal. 2010. Chemical, Biological and Physiological Indicators of Metal Pollution in wetlands. Review. Scientific Research and Essays, 5(15).1938-1949.
Bielmyer G.K., K.V. Brix, T.R. Capo, and Grosell. 2005. The effects of metals on embryo-larval and adult life stages of the sea urchin, Diadema antillarum. Aquatic Toxicology, 74. 254-263.
Dumont, C.P., D. Drolet, I. Descheˆnes, and Himmelman, J.N. 2007. Multiple factors explain the covering behaviour in the green sea urchin, Strongylocentrotus droebachiensis. Animal Behaviour, published online by Elsevier Ltd. All rights reserved; MS. number: A10403.
Fierce, S.E.B and H.E. Lapin. 2004. Selectivity of Covering Material in Two Sea Urchins, Tripneustes ventricosus and Lytechinus variegatus. Dartmouth Studies in Tropical Ecology.
Flammang, P., M. Warnau, A. Temara, D.J.W. Lane, and M. Jangoux. 1997. Heavy metals in Diadema setosum (Echinodermata Echinoidea) from Singapore coral reefs. J. Sea Res, 38. 35–45.
Fufeyin, P.T., E.A. Odia, O.C. Asemota, and A.F. Balogun. 2008. Use of Amaranthus hybridus to reduce toxic effects of some heavy metals in Guinea Pig (Cavia porcellus) tissues. Bioscience Research
Communications, 20 (5).
Gbaruko, B.C and O.U. Friday. 2007. Bioaccumulation of heavy metals in some fauna and flore. Email: bgbaruko@yahoo.com. diakses 03 September 2010.
Gong, P., Y. Ogra, and S. Koizumi. 2000. Inhibitory effects of heavy metals on transcription factor Sp1. Short Communication. Industrial Health, 38. 224-227.
Kawamata, S. 2010. Inhibitory effects of wave action on destructive grazing by sea urchins: a review. Bull. Fish. Res. Agen, 32. 95-102.
Nichols, K.D. 2009. The Effects of Predators and Habitat on Sea Urchin Density and Behavior in Southern California Kelp Forests. http://escholarship.org/uc/item/3zv9w2w2. diakses tanggal 25 Januari 2010.
Phillips, D.J.H., 1990. Use of macroalgae and invertebrates as monitors of metal levels in estuaries and coastal waters. In: Furness, R.W. and P.S. Rainbow (Eds.), Heavy Metals in the Marine Environment. CRC Press, Boca Raton, FL, pp. 81–99.
Phillips, B.M., P.A. Nicely, J.W. Hunt, B.S. Anderson, R.S. Tjeerdema, S.E. Palmer, F.H. Palmer, and H.M. Puckett. 2003. Toxicity of cadmium–copper–nickel–zinc mixtures to larval purple sea urchins. Bull. Environ. Contam. Toxicol, 70. 592–599.
Rumahlatu, D. 2007. Hubungan antara Faktor Fisik-Kimia Lingkungan dengan Keanekaragaman dan Pola Distribusi Echinodermata pada Daerah Pasang Surut Kabupaten Seram Bagian Barat Sebagai Sumber Pembelajaran Ekologi Kelautan. Tesis. Program Pascasarjana Universitas Negeri Malang, Malang.
Russo, R., Bonaventura, R., Zito, F., Schroder, H., Muller, I., Muller, W E.G., and V. Matranga. 2003. Stress to cadmium monitored by metallothionein gene induction in Paracentrotus lividus embryos. Cell Stress and Chaperones, 8 (3). 232-231.
Quig, D. 1998. Cysteine metabolism and metal toxicity. Alternative Medicine Review, 3. 262-270.
Rochyatun, E dan A. Rozak. 2007. Pemantauan kadar logam berat dalam sedimen di perairan teluk Jakarta. Makara Sains, 11(1). 1-7.
Salmanu, S. 2010. Keanekaragaman dan Pola Asosiasi Gastropoda Di Padang Lamun (Seagrass) Sebagai Sarana Penunjang Pembelajaran Mata Kuliah Ekologi Laut. Tesis. Program Pascasarjana Universitas Negeri Malang, Malang.
Schoettger, R.A. 1996. Problems of Aquatic Toxicology, Biotesting and Water Quality Management. Proceedings of USA-Rusia Symposium, Borok, Jaroslavl Oblast. 21-23 Juli 1996. Published by Ecosytems Research Division Athens.
Sloman, K. A., G. R. Scott, Z. Diao, C. Rouleau, C. M. Wood and D. G. McDonald. 2003. Cadmium affects the social behaviour of rainbow trout, Oncorhynchs mykiss. Aquatic Toxicology, 65. 180-185.
Shah, S.L. 2005. Effects of heavy metal accumulation on the 96-h LC50 values in Tech Tinca tinca. L., 1758. Research article. Turk. J. Vet. Anim Sci, 29. 139-144.
Soualili, D., P. Dubois, P. Gosselin, P. Pernet, and M. Guillou. 2007. Assessment of seawater pollution by heavy metals in the Neighbourhood of Algiers: use of sea urchin, Paracentrotus lividus, as Bioindicator. Email: mgluillou@univ-brest.fr. diakses tanggal 8 September 2010.
Sugiono. 2000. Statistik untuk penelitian. Bandung: Ikatan Penerbit Indonesia.
Temara, A., J.M. Skei, D. Gillan, M. Warnau, M. Jangoux, and P. Dubois. 1998. Validation of the Asteroid Asterias rubens (Echinodermata) as a bioindicator of spatial and temporean trends of Pb, Cd, and Zn
contamination in the field. Elsevier. Marine Enviromental Research, 45 (4/5). 341-356.
Umar, M.T., W.M. Meagaung, and L. Fachrudi. 2001. Kandungan logam berat tembaga (Cu) pada air, sediment dan kerang Marcia, sp. di Teluk Parepare, Sulawesi Selatan. Schi. and Tech, 2 (2). 9-21.
Urriago, J.D., J.H. Himmelman, and C.F. Gaymer. 2011. Responses of the black sea urchin Tetrapygus niger to its sea-star predators Heliaster helianthus and Meyenaster gelatinosus under field conditions. Journal of Experimental Marine Biology and Ecology, 399. 17–24.
Vinodhini, R., and M. Narayanan. 2008. Bioaccumulation of heavy metals in organs of fresh water fish Cyprinus carpio (Common carp). Int. J. Environ. Sci. Tech, 5 (2). 179-182.
Warnau, M., G. Ledent, A. Temara, J.M. Bouquegneau, M. Jangoux, and P. Dubois. 1995. Heavy metals in Posidonia oceanic and Paracentrotus lividus from seagrass beds of northwestern Mediterranean. Sci. Total Environ, 171. 95-99.
Warnau, M., J.L. Teyssie, and S.W. Fowler. 1996. Biokinetics of selected heavy metals and radionuclides in the common Mediterranean echinoid Paracentrotus lividus: sea water and food exposures. Mar. Ecol. Prog. Ser, 141. 83-94.
Zhou, Q., J. Zhang, J. Fu, J. Shi, and G. Jiang. 2008. Biomonitoring: an appealing tool for assessment of metal pollution in the aquatic ecosystem. Review. Analytica Chimica Acta, 606. 135–150.
54
Discussion and feedback