KAJIAN PENYERAPAN LOGAM BERAT AIR RAKSA (Hg) DENGAN MENGGUNAKAN KARBON AKTIF BATUBARA SUB-BITUMINUS YANG DIKARBONISASI (COALITE)
on
KAJIAN PENYERAPAN LOGAM BERAT AIR RAKSA (Hg) DENGAN MENGGUNAKAN KARBON AKTIF BATUBARA
SUB-BITUMINUS YANG DIKARBONISASI (COALITE)
Solihin, Chusharini Chamid, Garlan Sugarba
Jurusan/ Prodi Teknik Pertambangan, Fakultas Teknik, Universitas Islam Bandung Jl. TamansariNo. 1 Bandung 40116, Tlp. 022.423368 Ext.313, Fac. 022.4264065 e_mail : hn_solihin@yahoo.com
Abstract
One of diversification usage of coal is made for carbon active. The main element in coal which is very useful for carbon active is carbon (C) as other raw materials such as bone, coffee bean, coconut shell, etc. This research used carbonized coalfrom PTBukit Asam as a media to absorb methyl mercury (CH3Hg+2) solution.
The carbonized coal has an iodine number of± 386 mg/gram after it was activated at 9000C for 1 hour It has an adsorption level of 70-80% because the SEMphotograph showed a pore size ofcoarsefraction higher thanfinefraction. The degree ofsaturation was influenced by the grain size of the coal carbon active where the saturation degree of coarse fraction was relatively faster than the fine fraction. Moreover weighter and bigger debit of carbon active could adsorp higher MeHg concentration.
Keywords: carbonization, carbonactive, adsorption, coalite, methylmercury, iodinenumber
Kasus pencemaran limbah cair yang mengandung logam berat air raksa (Hg), di Indonesia saat ini banyak terjadi dan masih sedang berlangsung terutama di daerah-daerah industri dan kegiatan pertambangan emas rakyat, pertambangan emas tanpa ijin (PETI), seperti di Jawa Barat yaitu di daerah Pongkor - Bogor, Cineam - Tasikmalaya, Ciawitali, Wal.™,- Sukat»™,di Bengkulu ⅞ebong Tundui), di Sulawesi Utara (Lanud) dan masih banyak lagi di daerah lainnya. Di daerah-daerah tersebut, masyarakat setempat saat ini sedang aktif melakukan penambangan dan pengolahan bijih emas secara konvesional yaitu dengan cara amalgamasi. Limbah dari kegiatan pengolahan (ekstraksi) emas dengan cara amalgamasi tersebut masih mengandung logam b"" Hg cukuP tinggi dan IangSung d⅛uang k. badan air penerima (sungai/ kolam/ waduk) tanpa diolah terlebih dahulu, sehingga mencemari lingkunganperairan sekitarnya (Hasanudin, D., 1995).
Berkenaan dengan hal itu, penelitian ini mencoba melakukan percobaan penyerapan (adsorption) logam berat Hg dalam bentuk senyawa
kompleks methyl mercury, sehingga diharapkan dapat diterapkan dalam mengatasi pencemaran limbah cair yang mengandung logam berat Hg (Ellis, D., 1989). Adapun media yang digunakan adalah karbon aktif yang dibuat dari batubara jenis sub bituminus yang telah dikarbonisasi (coalite) dan berasal dari P.T. BukitAsam, Tbk., Tanjung Enim, Sumatera Selatan.
Tujuan dari penelitian ini adalah :
-
a. Mengetahui kemampuserapan karbon aktif batubara terhadap logam berat Hg dalam limbah cair yang berbentuk senyawa methyl mercury.
-
b. Mengetahui kemungkinan pemanfaatan karbon aktif yang berasal dari batubara jenis sub-bituminus sebagai media penyerap logam berat Hgpad. knndIsi se- (H⅛ j∙W,19M).
-
c. Agar batubara dapat menjadi alternatif (pilihan) sebagai bahan baku dalam pembuatan karbon aktif, yang saat ini bahan baku umumnya dibuat dari arang tempurung kelapa bahkan beberapa industri banyak menggunakan karbon aktif impor sehingga masih relatif mahal (Rumbino, Y.,2002).
Untuk mendapatkan larutan buatan (artificial) dilakukan dengan cara mencampur atau mengaduk antara air raksa (Hg) murni dengan asam humus (humic acid) sehingga diperoleh larutan kompleks methyl mercury (Hassler, J.W., 1974). Sedangkan media yang digunakan adalah karbon aktif yang dibuat dari batubara jenis sub bituminus yang telah dikarbonisasi (coalite) dan berasal dari P.T. Bukit Asam, Tbk. Secara lengkap metodologi penelitian dapat dilihat diagram alir pada Gambar2.1.
Percobaan ini menggunakan pendekatan sebagaimana sistem netralisasi limbah cair dan penyerapan logam emas atau perak dari bijihnya, yaitu dengan sistem unggun karbon aktif tetap atau fιxedbed (Stanley,G.G., 1997). Adapunsusunanalat percobaan penyerapan tersebut dapat dilihat Gambar 3.1 dan dengan memvariasikan antara fraksi ukuran butir, berat karbon aktif dan debit larutan yang mengalir, dapat diketahui konsentrasi logam berat Hg baik sebelum dan setelah proses adsorpsi yang nilainya dapat dilihat Tabel 3.1 dan 3.2. Pengamatan
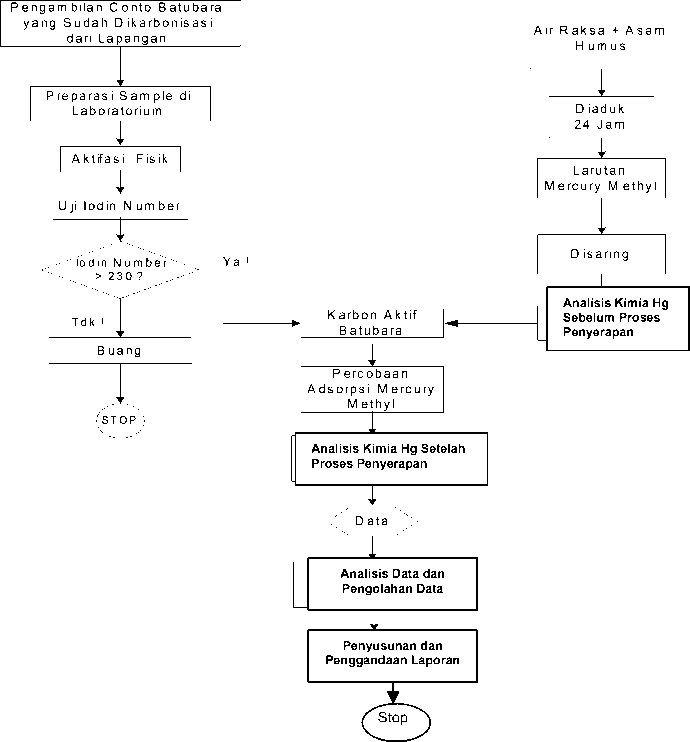
Gambar 2.1 DiagramAlir PercobaanAdsorpsi Logam Berat Hg dalam Larutan Methyl Mercuty dengan Menggunakan KarbonAktif Batubara
dan pengambilan conto dilakukan secara sesaat denganselangwaktu2jamselama6jam.
lem
Pipa Karet Penghubung Udar
Botol Penampung
Larutan MeHg (Influent)
Kran Pengatur Debit
upport
Unggun KarbonAktif
Bejana Unggun KarbonAktif
Pipa Pengeluaran H asil Adsorpsi
Botol Penam pung Hasil Adsorpsi (Effluent)
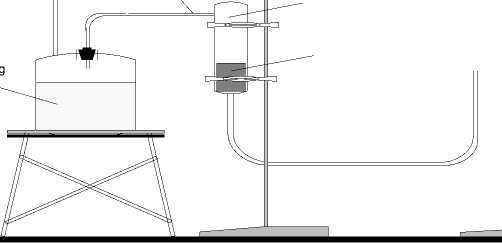
Gambar 3.1 SusunanAlat PercobaanAdsorpsi Logam Berat Hg dalam Larutan
-
4. Pembahasan
-
4.1 Pengaruh Waktu Terhadap Penurunan
-
Konsentrasi Hg
Pengertian waktu dalam pembahasan ini adalah lamanya karbon aktif sebagai media penyerap (adsorbent) dialiri larutan yang membawa logam berat Hg sebagai zatyang diserap (adsorbat). Pengukuran dan pengambilan conto (sampling) dilakukan dengan mengambil larutan yang telah diserap Hg-nya sebagai effluent secara sesaat pada setiap selang waktu dua jam selama enam jam (satu siklus percobaan).
Dari hasil pengamatan, pengukuran dan analisis kimia konsentrasi Hg seperti dapat dilihat pada Tabel 3.1, dengan tiga variabel yang dikombinasikan yaitu fraksi ukuran butir, berat karbon aktif dan debit aliran, penurunan konsentrasi Hg terhadap lamanya waktu pengaliran sangat signifikan pengaruhnya, hal ini dapat dilihat dari penurunan konsentrasi Hg setelah proses adsorpsi dengan waktu 2 jam, bisa mencapai rata-rata 71,08% (dengan kesalahan pengukuran ± 5% ). Demikian halnya untuk waktu 4 dan 6 jam, penurunan konsentrasi Hg kecenderungannya naik lebih besar lagi yaitu mencapai rata-rata 73,53% dan 74,85%.
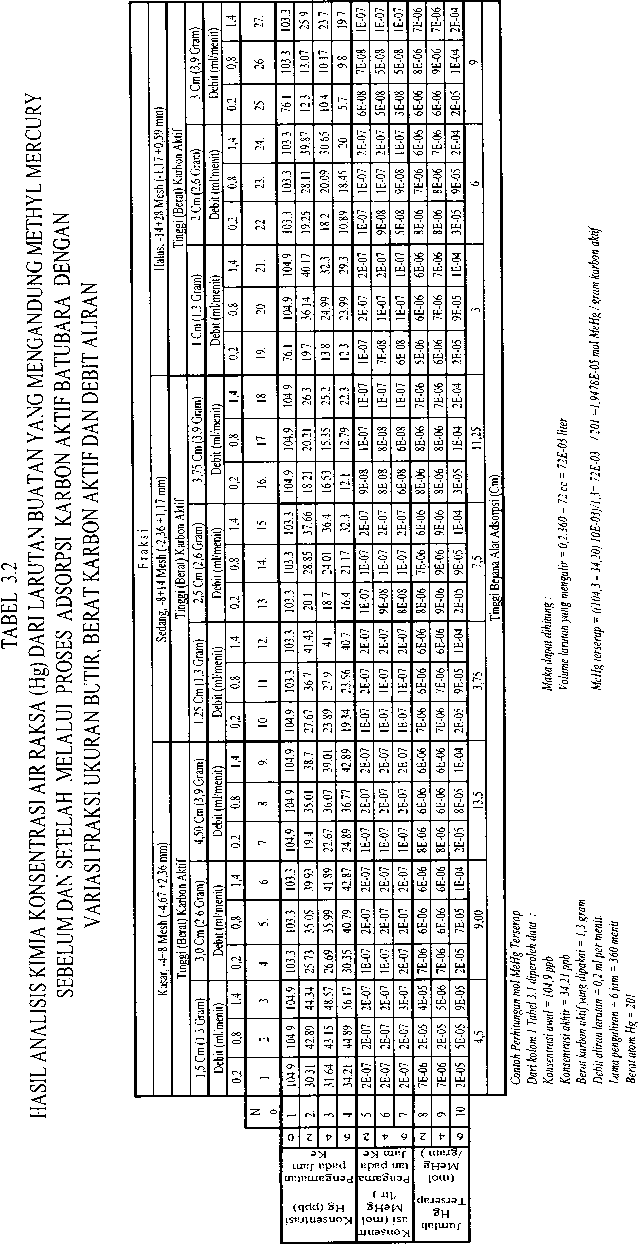
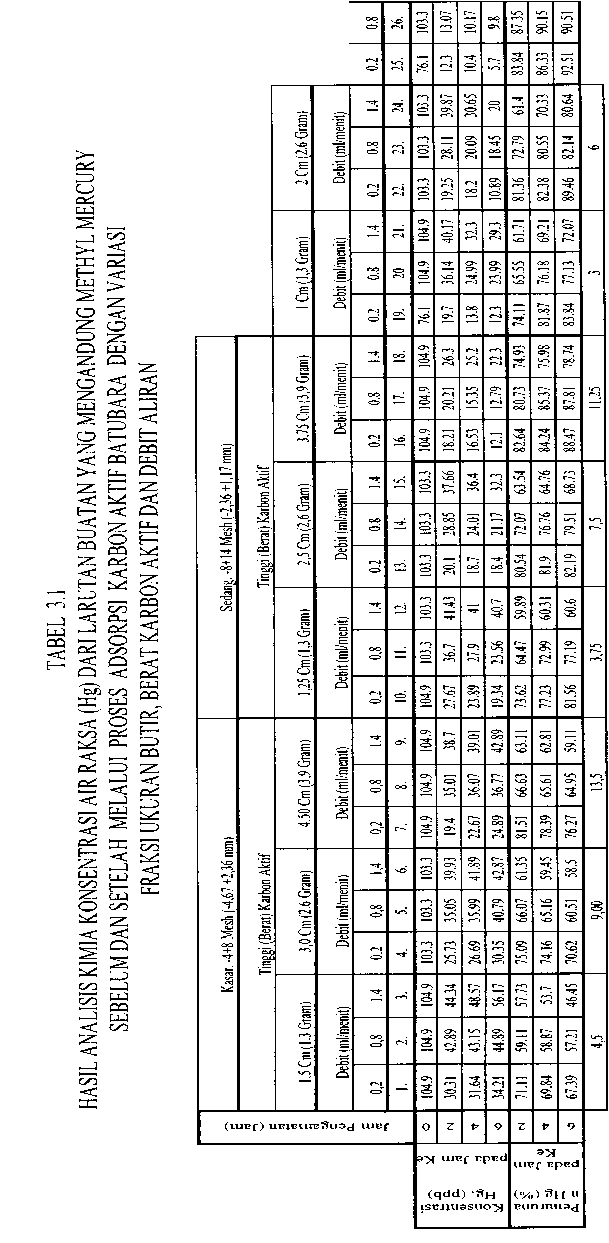
Pengaruh fraksi ukuran butir terhadap penurunan konsentrasi Hg dari larutan setelah proses adsorpsi, memberikan nilai yang signifikan (lihat Tabel 3.1). Misalnya untuk fraksi kasar, dengan debit pengaliran 0,2 ml per menit pada berat unggun karbon aktif 3,9 gram dengan waktu pengamatan setelah 4 jam, penurunan Hg dari 104,9 ppb dapat diturunkan mencapai 22,67 ppb. Kondisi ini, untuk debit dan jumlah karbon aktif yang sama, dengan fraksi ukuran butir yang lebih halus memberikan kecenderungan penurunan konsentrasi Hg yang semakin tinggi. Hal ini merupakan suatu konsekuensi logis karena pada fraksi ukuran butir yang lebih halus selain iodine number dan jumlah penyebaran pori yang cukup besar, juga waktu kontak (retention time) antara adsorbate dengan adsorbent relatif lebih lama bila dibandingkan dengan yang lebih kasar (Dubimin, MM.1966)- ...........
Hal lain yang cukup menarik di antara tiga fraksi pada percobaan ini, bahwa pada fraksi ukuran butir kasar dengan selang waktu pengamatan tiap 2 jam selama 6 jam untuk berat unggun karbon aktif 1,3 gram dan debit aliran 0,2 ml per menit (misalnya), pada saat dua jam pertama tingkat penurunan konsentrasi Hg cukup tinggi yaitu dapat menurunkan konsentrasi Hg dari 104,9 menjadi 30,31 ppb, namun naik menjadi 31,64 pada 4 jam kemudian dan terus naik lagi menjadi 34,21 ppb setelah6jam. Keadaan tersebut terjadi karena pada fraksi ukuran butir kasar distribusi penyebaran porinya relatif lebih kecil dibandingkan dengan fraksi sedang dan fraksi halus yang lebih besar (Milansmisek, R.N., 1970).
Melihat kecenderungan di atas, maka pada fraksi yang kasar tingkat kejenuhan karbon aktif relatiflebih cepat dicapai bila dibandingkan dengan fraksi ukuran butir halus. Hal ini dapat dilihat bahwa pada fraksi ukuran butir yang lebih halus tingkat penurunan Hg umumnya masih terus meningkat pada pengamatan jam ke 4 dan ke 6, hal inijuga dapat dilihat dari kurva, dimana garis horizontal Gambar 4.2.b dan 4.2. c yang terus menurun meskipun pada suatu saat dengan waktu yang relatiflebih lama akan naik sampai tingkat kejenuhan penyerapan tercapai. Jadi dalam hal ini
terjadi kondisi yang terbalik, yaitu pada fraksi ukuran butir yang lebih halus tingkat kejenuhan karbon aktif lebih lama bila dibandingkan dengan fraksi ukuran butir yang kasar (Rumbino, Y., 2002). Untuk kurva pengamatan dengan fraksi ukuran butir karbon aktif yang berbeda dapat dilihat Gambar 4.2.a- 4.2.c.
Berat unggun karbon aktif merupakan hal yang juga perlu diperhatikan, karena hal ini selain akan menentukan kebutuhanjumlah karbon aktif, juga akan menentukan tinggi bejana alat adsorpsi yang diperlukan baik untuk skala laboratorium ataupun urnkskalab^^
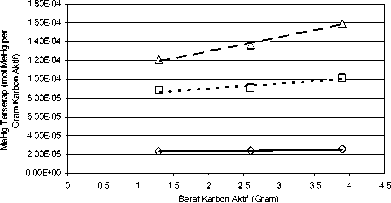
Kondisi tersebut di atas bila dikaitkan dengan mol MeHg teradsorpsi, dari hasil pengamatan dan perhitungan (Tabel 3.2) dapat dilihat bahwa dengan berat karbon aktif yang makin besar, mol MeHg teradsoprsi padajam pengamatan dan debit tertentu memperlihatkan kecenderungan yang meningkat. Misalnya untuk berat karbon aktif 1,3 gram dengan debit 0,2 ml per menit pada pengamatan 6jam dengan fraksi ukuran kasar, mol MeHg yang terserap 1,95E-05 mol MeHg per gram karbon aktif. Demikianjuga untukberatkarbon aktif2,6 dan 3,9 gram memberikan nilai mol MeHg teradsorpsi yang kecenderungannya makin meningkat yaitu 2,01E-05 dan 2,20E-05 mol MeHg per gram karbon aktif.
Dengan kondisi seperti dijelaskan di atas, maka pengaruh berat karbon aktif terhadap tingkat penurunan atau penyerapan mol MeHg memberikan pengaruh yang signifikan, hal tersebut terjadi karena dengan berat karbon aktif yang semakin besar, luas permukaanjuga makin besar, sehingga kesempatan kontak antara adsorbate dengan adsorbent menjadi lebih besar (Milansmisek, R.N., 1970).
Dalam suatu proses penyerapan dengan sistem pengaliran yang kontinyu, pengaturan debit aliran merupakan suatu variabel yang penting karena dengan debit ini merupakan masukkan (input) yang akan menentukan keluaran (output) baik secara kualitatif ataupun secara kuantitatif.
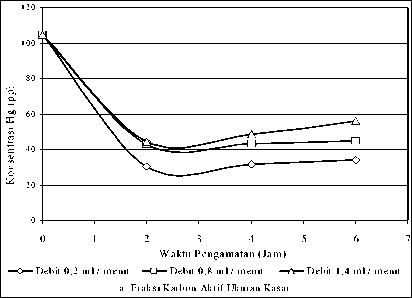
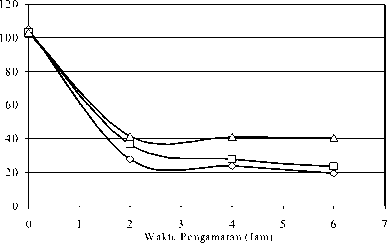
Debit 0,2 ml / menit Debit 0,8 ml / menit Debit 1,4 ml / menit b. Fraksi Karbon Aktif Ukuran Sedang
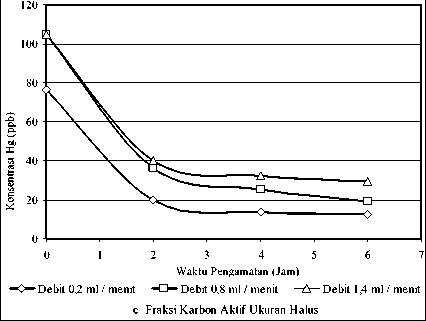
Gambar 4.2 Kurva Penurunan Konsentrasi Hg (ppb) dengan Berat Unggun Karbon Aktif 1,3 Gram pada Pengamatan 2, 4 dan 6 Jam dan Fraksi Ukuran Butir Karbon Aktif Kasar (a), Sedang (b) dan Halus (c)
Secara umum berdasarkan hukum kesetimbangan masa, bahwa debit aliran yang besar akan menghasilkan debit yang besar pula, namun keluaran yang besar tersebut secara kualitatif belum tentu memberikan hasil yang dapat memenuhi keinginan. Misalnya dalam penelitian ini dengan debit aliran 0,2 ml per menit pada fraksi kasar dan berat karbon aktif 1,30 gram pada pengamatan 2jam pertama menghasilkan tingkat penurunan Hg sebesar 71,11%. Nilai ini kecenderungannya menurun pada yang “ er y"tu 59∙11% dan 5773%unn,k debit 0,8 dan 1,4 ml per menit. Kecenderungan ini sama untuk variabel pada kondisi yang berbeda, untuk jelasnya hal tersebut dapat dilihat Tabel 3.1.
.....B≡riτ≡M3.2d≡"0≡ta5^
dilihat garis kurva untuk debit 1,4mlper menit berada di atas garis kurva 0,8 dan 0,2 ml per menit, sehingga dengan demikian dapat disimpulkan bahwa dengan debit yang semakin besar mol MeHg terserap kecenderungannya semakin meningkat, hal tersebut bisa terjadi karena dengan debit yang besar, akan membawa konsentrasi Hg yang lebih banyak
sehingga mol MeHg terserap juga besar. Namun demikian kondisi ini perlu dipertimbangkan, karena dengan debit yang besar, akan membawa konsekuensi mempercepat tingkat kejenuhan karbon aktif-
PadaGam.ar.4•4%4.4•3T.^^ menarik adalah bila debit aliran dikaitkan dengan fraksi ukuran butir, menambahjelas bahwa pengaruh fraksi ukuran butir karbon aktif sangat signifikan terhadap mol MeHg yang diserap, yang mana dapat dilihat dari kurva masing-masing debit, posisi yang tertinggi berada pada fraksi yang halus.
Dari uraian di atas, untuk melihat sampai sejauh mana garam Hg diserap oleh karbon aktif, secara visual dapat dilihat gambar (foto) hasil scanning electron microscope (SEM) dari coalite sebelum diaktifasi, coalite setelah diaktifasi tetapi belum digunak,n proses .dsorpsi dan c°αl,⅛ yang telah diaktifasi setelah digunakan proses adsorpsi logam berat Hg.
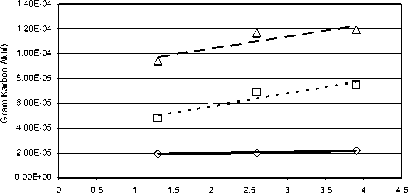
Berat Karbon Aktif (Gram)
Linear (Debit 0,2 ml / menit) Linear (Debit 0,8 ml / menit ) Linear (Debit 1,4 ml / menit)
Gambar 4.4.1 Kurva Hubungan Berat Karbon Aktif (Gram) terhadap Besar mol MeHg Terserap per Gram Karbon Aktif pada Fraksi
Kasar dan Debit 0,2, 0,8 & 1,4 ml / menit
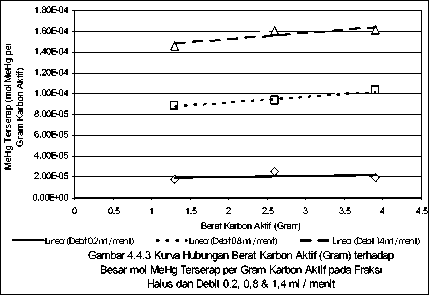
Linear (Debit 0,2 ml / menit) Linear (Debit 0,8 ml / menit) Linear (Debit 1,4 ml / menit)
Ganbar 4.4.2 Kurva Hubungan Berat Karbon Aktif (Gram) terhadap
Besar mol MeHg Terserap per Gram Karbon Aktif pada Fraksi
Sedang dan Debit 0,2, 0,8 & 1,4 ml / menit
-
4.5.1 Foto Hasil SEM dari Struktur Pori Coalite (Sebelum Diaktifasi)

Gambar 4.5.1-a. Struktur Pori Coalite Fraksi Kasar, Pembesaran 1000X, nampak pori yang kurang begitujelas, karena butirannya kasar dan masih Terisi Tar serta Bahan Lain
Gambar 4.5.1-b. Coalite Fraksi Sedang, pembesaran 1000X, nampak pori agakjelas tetapi masih diselimuti tar serta bahan lain
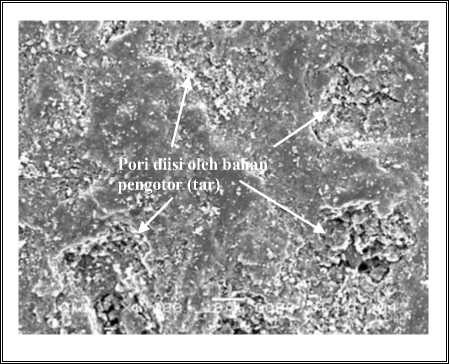
Gambar 4.5.1-c. Coalite Fraksi Halus, Pembesaran 1000X, nampak pori agak jelas terlihat tetapi masih diselimuti tar serta bahan lain
4.5.2 Foto SEM dari Struktur Pori Coalite Setelah Diaktifasi (Sebelum Proses Diaktifasi)

Gambar 4.6.1-a.Karbon AktifBatubara Fraksi Kasar, Pembesaran 1000X, Jumlahpenyebaranpori ± 30%, Ukuranpori 25-35 μm
Gambar 4.6.1-b. KarbonAktifBatubara Fraksi
Sedang, Pembesaran 1000X, Jumlahpenyebaran pori ± 40%, Ukuran pori 15-20 μm
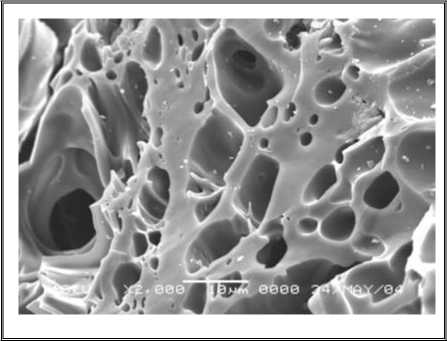
Gambar 4.6.1-c. Karbon Aktif Batubara Fraksi Halus, Pembesaran 2000 X, Jumlah penyebaran pori ± 65%, Ukuran pori 2 - 7 µm
4.5.3 Foto Hasil SEM dari Struktur Pori Coalite Hasil Aktifasi Setelah Proses Adsorpsi
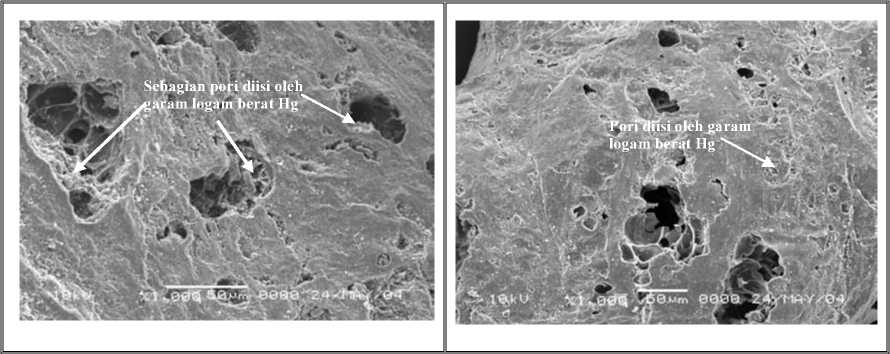
Gambar 4.7.1-a.Karbon AktifBatubara Fraksi Kasar setelah Adsorpsi, Pembesaran 1000X, tampakpori yang kotor dan diisi oleh garam logam berat Hg
Gambar 4.7.1-b. KarbonAktifBatubara Fraksi Sedang, Pembesaran 1000X, tampakpori, sebagian telah diisi oleh garam logam berat Hg
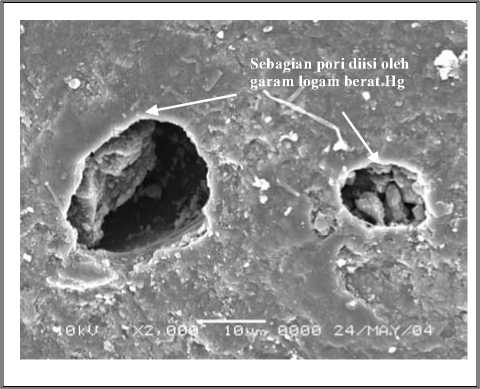
Gambar 4.7.1-c. Karbon Aktif Batubara Fraksi Halus, Pembesaran 2000 X, tampak pori, sebagian telah diisi oleh garam logam berat Hg
-
1) Batubara (coalite), cukup baik dan sangat potensial untuk dikembangkan sebagai bahan baku karbon aktif, hal ini dapat dilihat dari angka iodin number (sebagai tolok ukur angka tingkat penyerapan) yang relatif cukup besar yaitu 258,465 (fraksikasar), 361,486 (fraksi sedang)
.. “^’““^ _
-
2) Karbon aktif dengan angka iodin seperti di atas, dapat menyerap MeHg dengan tingkat penyerapan mencapai 70 - 80%;
-
3) Fraksi ukuran butir karbon aktifbatubara, selain
b^ngrnh teΛadap tingkat Penn^a1HaH Hg atau terhadap mol MeHg terserap, juga sangat —'ll terhadap t⅛kM HajenuHan ^a-nmnτnyeta≈nkanbonal^ halus fraksi ukuran butir, relatif makin lama umur penyerapannya.
-
4) B^lasflbni^ sEm, mtVerbJ^ bahwa
ukuran pori fraksi kasar relatiflebih besar bila dibaHdhgkaH dengan Hakai sedHHg dan Halaa. Demikianjuga penyebaran porinya, karbon aktif fraksi kasar relatiflebih sedikit;
-
5) Berdasarkan datayangadadapatdilihat,bahwa variabel berat karbon aktif dihubungkan dengan mol MeHg terserap memberikan kecenderungan makin naik pada berat yang lebih besar;
-
6) Berkaitan dengan butir 4 di atas, hal yang sama juga terjadi untuk variabel debit pengaliran, makin kecil debit pengaliran akan memberikan tingkat penyerapan Hg yang cenderung naik;
Daftar Pustaka
Arief Sudarsono, Untung Sukamto, Pramusanto. 1998. “Penggunaan KarbonAktif dari Tempurung Kelapa untuk Adsorbsi Logam Cu, Cd, dan Cr”, Jurnal Teknologi Mineral (JTM), ITB, Volume V, No. 3,
Bansal, R.C. 1988 .Active Carbon. MarcelDeckerInc.,NewYork.
Dubimin, M.M.. 1966. Porous and Adsorption Properties of Active Carbon. Institute ofPhysical Chemistry, USSRAcademyofScience Moscow, USSR.
Ellis, D. 1989. Environments ofRisk: CaseHistories oflmpact Assesment. Springer - Vertag Berlin, Heidelberg NewYork.
Hasanudin, D. 1995.Pengkojian Limbah Pengolahan Bljih Emas MilikKUD Mekaijaya di KarangPaningal Cineam Tasikmalaya Jawa Barat. DPE, DJPU, Puslitbang Teknologi Mineral dan Batubara.
Hassler, J.W. 1974. Purification with Actived Carbon : Specialist in Activated Carbon, Research, Manufacture & Marketing. Chemical Publishing Co Inc., NewYork.
Milansmisek, R.N. 1970. Active Carbon. ElsivierPublication, Company.
Osborn, D.G.. 1988. Coal Preparation Technology. Vol 1&2, Graham TrotmanLimitedaMemberofKluwer Academic Publisher Group.
Rumbino, Y.. 2002. Studi Daya Serap Karbon Akt,f Batubara untuk Menurunkan Konsentrasi Larutan Logam Cu, Cd dan Mn . Tesis Bidang Khusus Teknologi Pemanfaatan Batubara, Program Pascasarjana Rekayasa Pertambangan, Institut Teknologi Bandung.
Speight, J.G. 1994. The Chemistry and Technology of Coal. Marcel Dekker Inc., 2nd Edition, Revised & Expanded, New York.
Stanley, G.G. 1997. TheExtractiveMetallurgy ofGoldin SouthAfrica. The SouthAfrica Institute ofMining & Metallurgy, Johannesberg, Vol. 1.
Widodo. 2008. “Pengaruh PerlakuanAmalgamasi Terhadap Tingkat Perolehan Emas dan Kehilangan Merkuri”, dalam Jurnal Riset Geologi dan Pertambangan, LIPI, Jilid 18 No. 1, (47 -53)
Keputusan Menteri Negara Lingkungan Hidup No. 51/MENLH/10/1995, tentang Baku Mutu Limbah Cair Bagi Kegiatan Industri.
253
Discussion and feedback