Characterization of Bacillus cereus strain IrN with multiresistance traits for copper and synthetic dye
on
JURNAL BIOLOGI UDAYANA 26(2): 248-259
P ISSN: 1410-5292 E ISSN: 2599-2856
Karakterisasi Bacillus cereus strain IrN yang memiliki sifat multiresistensi terhadap tembaga dan pewarna
Characterization of Bacillus cereus strain IrN with multiresistance traits for copper and synthetic dye
Wahyu Irawati1*, Egilia Lucky2, Yovanka P.P Tumakaka3, Charles Immanuel4, Eunike Bunga Marvella5
1,2) Program Studi Pendidikan Biologi, Fakultas Ilmu Pendidikan, Universitas Pelita Harapan, Tangerang, Indonesia – 15811 3,4) Program Studi Pendidikan Kimia, Fakultas Ilmu Pendidikan, Universitas Pelita Harapan, Tangerang, Indonesia – 15811
5) Jurusan Sains, Sekolah Menengah Atas, BPK Penabur Gading Serpong, Tangerang, Indonesia - 15811
*Email: w.irawati3@gmail.com
Diterima 15 September 2022 Disetujui 23 Desember 2022
INTISARI
Peningkatan aktivitas industri tekstil semakin menambahkan jumlah limbah di lingkungan. Tembaga merupakan salah satu komponen pewarna sintetis sehingga limbah industri tekstil berpeluang mengandung pewarna dan tembaga. Bioremediasi menggunakan bakteri indigenus yang resisten terhadap pewarna dan tembaga diharapkan dapat meningkatkan efesiensi pengolahan limbah tekstil. Isolat bakteri IrN merupakan bakteri indigenus yang resisten terhadap tembaga dan diisolasi dari pengolahan limbah. Penelitian ini bertujuan untuk melakukan karakterisasi molekular serta menguji resistensi dan kemampuan dekolorisasi bakteri terhadap berbagai pewarna. Karakterisasi molekular dilakukan dengan analisis gen 16S rDNA. Medium yang digunakan adalah Luria Bertani dengan penambahan pewarna dan atau CuSO4 sebagai perlakuan. Pewarna yang digunakan ada 12 macam, yaitu: Methylene Blue, Malachite Green, Congo Red, Mordant Orange, Reactive Black, Direct Yellow, Basic Fuchsin, Reactive Orange, Disperse Orange, Remasol, Wantex Red, dan Wantex Yellow. Kemampuan dekolorisasi dan pertumbuhan bakteri diukur dengan menggunakan spektrofotometer. Hasil analisis 16S rDNA menunjukkan bahwa bakteri IrN teridentifikasi sebagai Bacillus cereus dengan kemiripan sebesar 99,91%. Isolat bakteri IrN memiliki multiresistensi terhadap 3 mM CuSO4 serta semua pewarna yang diuji pada konsentrasi 200 ppm, tetapi pada 500 ppm IrN hanya resisten terhadap methylene blue. Bakteri IrN dapat mendekolorisasi 200 ppm dan 500 ppm Methylene Blue masing-masing sebesar 42,78% dan 38,1%. Penambahan 3 mM CuSO4 pada medium 500 ppm Methylene BlueBlue tetap membuat bakteri mampu mendekolorisasi Methylene Blue, walaupun kemampuan dekolorisasinya menurun menjadi 34,17%. Isolat bakteri IrN juga dapat mendekolorisasi Malachite Green, Congo Red, Basic Fuchsine dengan kemampuan maksimal masing-masing sebesar 98,16%, 70,29%, dan 79,07%.
Kata kunci: Bacillus cereus, dekolorisasi, pewarna, resisten, tembaga
ABSTRACT
An increase in the activity of textile industries has increased the load waste disposal into the environment. Copper is a component of synthetic dyes used in textile industries, and therefore their wastes have potential to contain copper in addition to dyes. Bioremediation using indigenous bacteria with resistant to dyes and copper is expected to increase the efficiency of textile waste treatment. IrN bacterial isolate is an indigenous bacterium with resistant properties to copper. This bacterium was isolated from waste treatment. The main
aims of this study were to identify the molecular characteristics and to investigate its resistance and ability to decolorize various dyes. Molecular identification of the isolate was carried out by sequencing its 16S rDNA gene. The medium used was Luria Bertani with the addition of dye and/or CuSO4 as a treatment. There were 12 kinds of dyes used, namely: Methylene Blue, Malachite Green, Congo Red, Mordant Orange, Reactive Black, Direct Yellow, Basic Fuchsin, Reactive Orange, Disperse Orange, Remasol, Wantex Red, and Wantex Yellow. Decolorization ability and bacterial growth were measured using a spectrophotometer. The results of the 16S rDNA analysis showed that the IrN isolate were identified as Bacillus cereus with a similarity of 99.91%. Strain IrN bacterial isolates had multi-resistance to 3 mM CuSO4, and all dyes were tested at a concentration of 200 ppm. However, at 500 ppm IrN was only resistant to methylene blue. IrN bacteria decolorized at 200 ppm and 500 ppm Methylene Blue by 42.78% and 38.1%, respectively. The addition of 3 mM CuSO4 to 500 ppm Methylene Blue medium still enabled bacteria to decolorize Methylene Blue even though its decolorization ability decreased to 34.17%. IrN bacteria could also decolorize Malachite Green, Congo Red, and Basic Fuchsine with a maximum capacity of 98.16%, 70.29%, and 79.07% respectively.
Keywords: Bacillus cereus, decolorization, dye, resistance, copper
PENDAHULUAN
Kebutuhan pokok manusia terbagi atas sandang, pangan, dan papan. Kebutuhan sandang merujuk kepada kebutuhan manusia terhadap pakaian, pangan kepada kebutuhan terhadap makanan, dan papan kepada kebutuhan terhadap tempat tinggal. Sebagai sektor yang memenuhi kebutuhan sandang, industri tekstil menjadi bagian yang tidak terpisahkan dari kehidupan manusia. Industri tekstil menghasilkan pencemaran lingkungan melalui debu dari penggunaan mesin, dan limbah cair dari tumpahan, air cucian, dan sisa proses pewarnaan (Pratiwi, 2010). Limbah-limbah tersebut kemudian dialirkan ke kolam-kolam penampungan dan akhirnya dibuang ke sungai, sehingga sangat disayangkan bahwa industri tekstil dapat turut andil dalam pencemaran air, udara, sekaligus tanah.
Pewarna tekstil adalah gabungan dari senyawa organik tak jenuh, yakni kromofor dan auksokrom yang berperan sebagai aktivator kerja kromofor dan pengikat warna kepada serat (Naimah et al., 2014). Secara umum zat pewarna tekstil terbagi atas pewarna alami dan sintetik. Pewarna sintetik dibuat melalui reaksi kimia dengan bahan dasar tar, arang, batu bara atau bahkan minyak bumi (Sitanggang, 2017). Terdapat 12 jenis pewarna tekstil yang sering digunakan, yaitu Methylene Blue, Malachite
Green, Congo Red, Mordant Orange, Reactive Black, Direct Yellow, Basic Fuschin, Reactive Orange, Disperse Orange, Remasol, Wantex Red, dan Wantex Yellow. Kualitas air limbah pewarna yang buruk dipengaruhi oleh kontribusi bahan pewarna yang sering digunakan dalam variasi konsentrasi berbeda. Terdapat beberapa jenis bahan pewarna yang beracun serta berdampak karsinogenik dan mutagenik terhadap kehidupan manusia dan ekosistem perairan (Couto, 2009).
Chemical Oxygen Demand (COD) merupakan salah satu parameter mutu air. Air yang tercemar limbah tekstil memiliki nilai COD pada rentang 150-12000 mg/L (Al-Kdasi et al., 2004) yang cukup jauh melebihi nilai ambang batas mutu limbah cair industri tekstil. Limbah tekstil yang mencemari perairan dapat mengganggu proses penetrasi sinar matahari dan difusi oksigen ke dalam air karena pewarna sintesis umumnya sulit diuraikan atau sulit mengalami degradasi, sehingga merusak kualitas hidup organisme air serta keberlangsungan ekosistem. Berdasarkan penelitian yang dilakukan Pratiwi (2010), akibat dari pencemaran limbah industri tekstil adalah penurunan koefisien nilai nutrisi ikan yang hidup di sungai tersebut. Beberapa aspek yang diamati adalah temperatur, pH, kekeruhan, konsentrasi CO2 dan O2, dan hasil pengamatan tersebut menunjukkan buruknya kualitas air yang tercemar limbah industri tekstil, sehingga ikan
yang hidup di dalamnya tidak memenuhi syarat untuk dikonsumsi manusia.
Berkembangnya ilmu pengetahuan dan teknologi menghasilkan sejumlah solusi dalam upaya menanggulangi limbah industri tekstil. Beberapa di antara solusi tersebut merupakan bentuk pencegahan, seperti mengganti jenis pewarna yang digunakan, yakni dari pewarna sintetis ke pewarna alami atau dengan cara menurunkan kadar warna yang digunakan. Selain itu, terdapat cara lain yakni dengan menggunakan bantuan alat yang terdiri dari tiga tahapan yaitu penyaringan (filtrasi), penstabilan zat organik dalam limbah, serta penghilangan unsur-unsur kimia dan mikroorganisme patogen (Enrico, 2019). Pengolahan limbah industri tekstil dapat dilakukan dengan prinsip kimiawi, tepatnya dengan metode elektroflotasi. Elektroflotasi adalah proses pemisahan polutan atau zat pengotor pada suatu medium cairan dengan cara mengapungkan polutan yang terdispersi dalam air ke permukaan cairan dengan bantuan gaya angkat gelembung gas oksigen dan hidrogen (Haryono et al., 2018). Proses ini memerlukan instalasi alat maupun prosedur kimiawi yang memakan biaya besar, sehingga dibutuhkan solusi lain yang lebih murah namun tetap efektif.
Pengolahan limbah dengan metode biologis, atau disebut dengan bioremediasi, merupakan teknik pengolahan yang lebih sederhana. Bioremediasi merupakan penggunaan mikroorganisme yang dipilih secara khusus untuk menurunkan kadar polutan (Priadie, 2012). Bakteri dapat mendegradasi limbah melalui proses metabolisme, dan menghasilkan enzim-enzim yang membantu proses degradasi polutan . Proses secara biologis menjadi alternatif terbaik karena cenderung murah dan tidak banyak menggunakan bahan kimia (Komarawidjaja, 2007). Prinsip pengolahan limbah secara biologis dilakukan dengan memanfaatkan mikroorganisme yang dapat menguraikan zat organik terlarut dalam air limbah menjadi bahan seluler baru serta sebagai sumber tenaga (Enrico, 2019).
Sejumlah penelitian membuktikan adanya beberapa jenis bakteri yang mampu terlibat di dalam pengolahan limbah industri tekstil. Sunaryanto (2019) menyatakan bahwa mikroba konsorisum seperti yakni Bacillus sp., Bacillus thuringiensis, Bacillus subtilis, dan Pseudomonas sp. mampu menurunkan 94% kadar COD. Komarawidjaja (2007) melaporkan adanya bakteri Bacillus sp. yang berperan dalam proses bioflokulasi. Hasil penelitian Sastrawidana (2011) menunjukkan bahwa Enterobacter aerogenes memiliki potensi dalam pengolahan limbah tekstil secara aerob dan dapat mendegradasi zat warna remazol red reactive black hingga 87,90%.
Tembaga merupakan salah satu komponen yang ada di dalam pewarna sintetik sehingga limbah industri tekstil bukan hanya menghasilkan limbah pewarna tetapi juga tembaga. Tembaga merupakan unsur mikro yang dibutuhkan organisme namun bersifat toksik dalam jumlah melimpah di alam. Tembaga dalam konsentrasi yang tinggi menyebabkan kanker bahkan mengakibatkan kematian. Tembaga tidak dapat didegradasi sehingga keberadaannya di lingkungan semakin lama semakin meningkat sehingga membahayakan organisme di habitat tersebut. Bioremediasi limbah industri tekstil memerlukan bakteri yang memiliki multi-resistensi terhadap pewarna dan tembaga agar proses pengolahan limbah berlangsung lebih efektif. Bakteri resisten tembaga merupakan bakteri yang memiliki` kemampuan untuk bertahan agar tidak mengalami degradasi di dalam medium yang mengandung tembaga (Irawati et al., 2022).
Pewarna sintetis memiliki atom logam dalam senyawanya yang memberikan warna, sehingga diharapkan bakteri resisten tembaga juga cenderung untuk resisten terhadap warna, serta dapat berperan pada proses dekolorisasi, yakni proses penurunan intensitas warna dari zat warna berbahaya maupun dari suatu limbah industri. Isolat bakteri IrN merupakan bakteri resisten tembaga yang diisolasi dari pengolahan limbah tembaga. Penelitian ini bertujuan untuk: 1)
melakukan karakterisasi molekuler isolat bakteri IrN, 2) menguji pengaruh penambahan tembaga terhadap pertumbuhan isolat bakteri, 3) menguji resistensi isolat bakteri terhadap 12 jenis pewarna, 4) menguji kemampuan dekolorisasi isolat bakteri terhadap berbagai pewarna, serta 5) menguji pengaruh penambahan tembaga terhadap kemampuan dekolorisasi pewarna.
MATERI DAN METODE PENELITIAN
Isolat bakteri dan medium pertumbuhan
Bakteri yang digunakan adalah isolat IrN yaitu bakteri yang diisolasi dari pengolahan limbah tembaga di Laboratorium Teacher College, Universitas Pelita Harapan, Lippo Karawaci, Indonesia. Medium yang digunakan adalah Luria Bertani (LB) Miller dengan komposisi: NaCl, 10 g/L, Tryptone, 10 g/L, Yeast Extract, 5 g/L. Medium cair dibuat dengan melarutkan 20 g LB ke dalam 1 L akuades. Medium padat dibuat dengan menambahkan Baterial Agar sebanyak 20 g/L. Medium disterilkan menggunakan otoklaf 120oC pada suhu 120 oC, selama 20 menit. Larutan tembaga dibuat dalam bentuk stok 1 M CuSO4 (Merck) dan disterilkan menggunakan 0,2 µm syringe filter (Merck Millipore). Pewarna yang digunakan ada 12 macam, yaitu Methylene Blue, Malachite Green, Congo Red, Mordant Orange, Reactive Black, Direct Yellow, Basic Fuschin, Reactive Orange, Disperse Orange, Remasol, Wantex Red, dan Wantex Yellow. Masing-masing pewarna dibuat stok 10.000 ppm dan disterilkan menggunakan 0,2 µm syringe filter (Merck Millipore).
Karakterisasi molekuler isolat bakteri
Karakterisasi molekuler merupakan teknik yang digunakan untuk mengidentifikasi spesies bakteri (Wulandari & Purwaningsih, 2019). Teknik ini dilakukan dengan cara analisis gen 16S rDNA memakai primer universal. Urutan dari pasangan basa dari bakteri dapat diidentifikasi secara spesifik dengan melihat sekuens 16S rDNA. Gen 16S rDNA digunakan karena dapat dijumpai di semua bakteri, memiliki lokasi gen yang tingkat evolusinya rendah, serta sudah
dikarakterisasi dari berbagai jenis bakteri. Amplifikasi gen 16S rDNA dilakukan dengan menggunakan primer universal gen Escherichia coli 16S rDNA untuk menggandakan DNA pada posisi 1482 hingga 1507. Hasil amplifikasi dilakukan pengurutan basa gen 16S rDNA kemudian hasilnya dibandingkan dengan data GeneBank untuk menentukan nama isolat bakteri IrN berdasarkan persentase kesamaan basa terdekat (Irawati, 2020).
Pengaruh tembaga terhadap pertumbuhan isolat bakteri
Kultur pemula dibuat dengan menginokulasikan satu ose biakan agar miring ke dalam 50 mL medium LB agar cair kemudian diinkubasikan dalam penggojog 200 rpm hingga mencapai kekeruhan sel (Optical Density/OD) = 0,8-1. Kultur pemula sebanyak 500 µL diinokulasikan ke dalam 50 mL LB cair yang mengandung 3 mM CuSO4 atau tanpa CuSO4 kemudian masing-masing diinkubasikan dalam penggojog 200 rpm. Pertumbuhan bakteri diamati dengan menggunakan spektrofotometer (LaboMed) pada panjang gelombang 600 nm.
Uji pertumbuhan isolat bakteri pada berbagai pewarna
Satu ose penuh biakan agar miring diinokulasikan dengan metode streak plate empat kuadran ke dalam medium LB padat dengan penambahan 200 ppm atau 50 ppm atau tanpa pewarna. Biakan diinkubasi selama 24 jam pada suhu 37OC kemudian diamati pertumbuhannya dan adanya zona bening di sekitar koloni sebagai pertanda adanya kemampuan dekolorisasi. Uji pada koloni-koloni bakteri ini bertujuan menghilangkan pewarna dengan cara isolasi di medium yang mengandung nutrisi. Bakteri yang telah ditumbuhkan pada media dan ditambahkan pewarna akan dilihat kemampuannya untuk dekolorisasi warna (Cheriaa et al., 2012).
Uji dekolorisasi pada berbagai pewarna
Sebanyak 50 µL kultur pemula diinokulasikan ke dalam medium 50 mL LB padat yang masing-masing mengandung 200 ppm atau 500 ppm
pewarna atau tanpa pewarna. Pengaruh penambahan tembaga terhadap kemampuan dekolorisasi dilakukan dengan menambahkan 3 mM CuSO4 ke dalam medium yang mengandung pewarna 200 ppm atau 500 ppm. Biakan bakteri diinkubasi dengan penggojogan 200 rpm pada suhu 37oC. Kultur cair hasil inkubasi sebanyak 1 mL disentrifugasi pada 15.000 rpm selama 1 menit kemudian absorbansi supernatan diukur menggunakan spektrofotometer pada panjang gelombang 300-900 nanometer (nm). Persentase dekolorisasi dihitung dengan rumus sebagai berikut (Irawati et al., 2022):
% dekolorisasi =
Absorbansi kontrol-Absorbansi sampel Absorbansi kontrol
HASIL DAN PEMBAHASAN
Karakterisasi molekuler
Tabel 1 merupakan hasil identifikasi molekuler isolat bakteri IrN dari program BLAST (Basic Local Alignment Search Tool). Daerah gen 5S, 16S, dan 23S dari RNA merupakan daerah dimana hubungan filogenitas bakteri dapat ditentukan. Daerah yang memiliki keakuratan paling tinggi adalah pada 16S RNA karena
memiliki urutan basa hingga 1550 pasang basa dan molekul 16S RNA memiliki beberapa daerah pada urutan basa yang relatif konservatif, dan beberapa daerah lainnya variatif. Daerah yang konservatif membantu dalam konstruksi pohon filogenetik universal karena perubahan yang dialami relatif lambat, sedangkan daerah yang variatif berguna untuk menemukan keragaman dan menempatkan galur-galur dalam satu spesies (Kasi et al., 2019).
Hasil analisis gen 16S rDNA menunjukkan bahwa isolat bakteri IrN memiliki kesamaan basa dengan Bacillus cereus dengan persentase kesamaan 99,91% (Tabel 1) sehingga selanjutnya isolat IrN dapat disebut sebagai Bacillus cereus strain IrN. Bakteri dinyatakan memiliki kesamaan spesies apabila memiliki kesamaan urutan basa nukleotida yang signifikan melalui program BLAST (Ihsan et al., 2020). Stackerbrandt dan Goebel (1994) menyatakan bahwa spesies bakteri dapat dikategorikan sama ketika memiliki kesamaan hingga 97%. Hal itu disebabkan oleh perbedaan 3% atau sekitar 45 pasangan basa tersebut tidak tersebar merata di struktur utama dari molekul. Perbedaan yang kecil itu kemudian digunakan sebagai ukuran jarak filogenetik antar strain.
Tabel 1. Karakterisasi Molekuler Isolat Bakteri IrN berdasarkan 16S rDNA
|
Nama Bakteri |
Similaritas |
Nomor aksesi |
|
Bacillus paramycoides strain NH24A2(T) 16S ribosomal RNA gene partial sequence |
99.91% |
MT256266.1 |
|
Bacillus cereus strain NRC215 16S ribosomal RNA gene partial sequence |
99.91% |
MT229271.1 |
|
Bacillus pacificus strain NCCP 15909 chromosome complete genome |
99.91% |
CP041979.1 |
|
Bacillus paramycoides strain NA-15 16S ribosomal RNA gene partial sequence |
99.91% |
MN882641.1 |
|
Bacillus sp. (in: Bacteria) strain VITJSB1 16S ribosomal RNA gene partial sequence |
99.91% |
MN319464.1 |
|
Bacillus sp. (in; Bacteria FJLN431 gene for 16S ribosomal RNA partial sequence |
99.91% |
LC484719.1 |
|
Bacillus sp. (in: Bacteria) FJLN43 gene for 16S ribosomal RNA partial sequence |
99.91% |
LC484716.1 |
|
Bacillus thuringienses strain Y1 16S ribosomal RNA gene partial sequence |
99.91% |
MH921608.1 |
|
Bacillus cereus strain TUN/POB/5 16S ribosomal RNA gene partial sequence |
99.91% |
MH916584.1 |
|
Bacillus cereus strain TUN/POB/3 16S ribosomal RNA gene partial sequence |
99.91% |
MH916582.1 |
IrN
MNO79O48. I Bacillus cereus strain AKADAI-I
MT421928. I Bacillus cereus strain CCAf 2010
MG645258. 1 Bacillus thuringiensis strain ATCC 10792
MW485925. 1 Bacillus Ihuringiensis strain 1019
MW559388. I Bacillus cereus strain XaAfl 8
MN907670. I Bacillus albus strain SSRSW7
MN9O7683. 1 Bacillus albus strain SGRSWl
MW5564 76. 1 Bacillus thuringiensis strain AH6
NR 157729. 1 Bacillus albus strain MCCC 1AO2I4 6
NR 024570. 1 Escherichia coli strain U 5/41
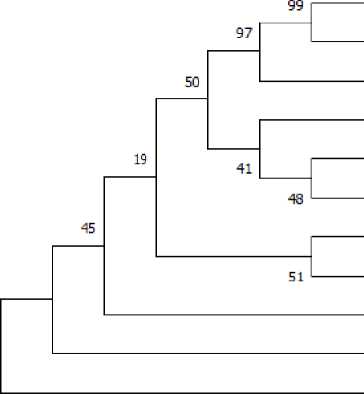
Gambar 1. Pohon filogenetik isolat bakteri IrN berdasarkan analisis sekuens daerah 16S rDNA menggunakan metode Neighbor joining 1000x Bootstrap, MEGA 7. Escherichia coli sebagai outgroup.
Berdasarkan pohon filogenetik pada Gambar 1 diketahui bahwa isolat IrN memiliki hubungan kekerabatan yang dekat dengan Bacillus cereus strain AKADA 1-1. Pohon filogenetik isolat bakteri IrN ini diperoleh dengan metode neighbor-joining dengan 1000x Bootstrap dalam program MEGA 7 (Molecular Evolutionary
Genetics Analysis versi 7). Muzzazinah (2017) menjelaskan bahwa metode neighbor-joining adalah dasar pembuatan filogenetik berdasarkan perbedaan antara dua sekuen, dimana nilai
bootstrap yang lebih dari 70% menyatakan pohon filogenetik yang baik. Berdasarkan pohon
filogenetik tersebut, sekuens bakteri IrN
membentuk garis keturunan filogenetik yang
ketat dengan Bacillus cereus strain AKADA 1-1. Hal terebut dapat diketahui dengan melihat nilai bootstrap yang tinggi antara kedua sekuens tersebut, yakni 99%. Nilai persentase bootstrap tersebut menunjukkan bahwa dari 1000 kali rekonstruksi pohon filogenetik ini, isolat bakteri IrN teridentifikasi memiliki 99% kekerabatan dengan bakteri Bacillus cereus strain AKADA 11.
Pengaruh tembaga terhadap pertumbuhan bakteri
Gambar 2 menunjukkan bahwa penambahan 3 mM CuSO4 mempengaruhi pertumbuhan isolat
bakteri IrN. Penambahan 3 mM CuSO4 menurunkan densitas sel yang dapat dilihat dari kekeruhan suspensi bakteri. Hal ini menunjukkan bahwa tembaga menghambat pertumbuhan bakteri. Tembaga sebagai unsur mikro berperan penting sebagai kofaktor enzim, seperti sitokrom C oksidase, tetapi besifat toksik karena dapat mengikat protein melalui pembentukan jembatan disulfida sehingga mengakibatkan degradasi protein (Irawati et al., 2022).
Tingkat kekeruhan sel merupakan salah satu metode pengukuran yang dilakukan untuk menghitung seluruh jumlah sel bakteri terhitung yang terdapat dalam suatu media, baik dalam keadaan hidup atau mati (Murwani, 2015). Gambar 2 menunjukkan bahwa jumlah sel bakteri terus bertambah seiring berjalannya waktu inkubasi, yaitu semakin lama waktu inkubasi maka semakin tinggi tingkat kekeruhan sel. Terdapat perbedaan grafik kekeruhan sel yang tumbuh pada medium pertumbuhan normal dan medium pertumbuhan yang mengandung tembaga, dan hasilnya menunjukkan bahwa pertumbuhan bakteri pada medium yang mengandung tembaga berlangsung lebih lambat. Tembaga merupakan salah satu unsur logam berat yang penting dalam proses metabolisme sel, akan tetapi dalam konsentrasi yang besar dapat
menjadi racun bagi makhluk hidup (Bondarczuk & Piotrowska-Seget, 2013).
Pertumbuhan isolat bakteri IrN dalam medium yang mengandung 3 mM CuSO4 menunjukkan bahwa bakteri ini resisten terhadap tembaga. Bakteri yang resisten terhadap tembaga dapat memanfaatkan logam berat untuk digunakan sebagai substrat (Beoang, 2019). Bakteri menggunakan enzim dalam menghasilkan metabolit sekunder dan meremediasi logam berat. Logam berat dapat direduksi oleh sel bakteri hingga mencapai 98% Bakteri resisten tembaga mampu secara spesifik mengelola konsentrasi tembaga di dalam sitoplasma agar tidak meracuni ketika konsentrasi tembaga di dalam sel menjadi sangat tinggi. Bakteri sudah memiliki mekanisme dalam tubuhnya untuk dapat mengatasi stres akibat tembaga (Samanovic et al., 2012).
Susilawati (2009), menyatakan bahwa resistensi suatu bakteri terhadap logam berat dalam medium pertumbuhannya terjadi karena bakteri memiliki kemampuan untuk mengakumulasi logam berat melalui mekanisme active uptake dan passive uptake (Rakhmawati & Yulianti, 2016). Resistensi merujuk kepada tidak terhambatnya pertumbuhan bakteri dengan pemberian bahan yang berbahaya secara sistemik dengan dosis normal atau kadar hambat minimalnya (Utami, 2012). Kemampuan ini
membuat bakteri dapat tetap hidup pada media tumbuhnya yang telah mengandung tembaga, walaupun konsentrasi zat yang diserap membuat pertumbuhannya menjadi terhambat akibat sifat toksik logam berat.
Uji pertumbuhan bakteri pada berbagai pewarna
Resistensi isolat bakteri IrN terhadap pewarna diuji melalui kemampuannya untuk tumbuh pada berbagai pewarna pada konsentrasi 200 ppm dan 500 ppm. Hasil uji pertumbuhan pada Tabel 2 menunjukkan bahwa bakteri tumbuh pada semua pewarna yaitu (a) Methylene Blue, (b) Malachite Green, (c) Congo Red, (d) Mordant Orange, (e) Reactive Black, (f) Direct Yellow, (g) Basic Fuchsin, (h) Reactive Orange, (i) Disperse Orange, (j) Remasol, (k) Wantex Red, dan (l) Wantex Yellow dengan konsentrasi 200 ppm namun pada konsentrasi 500 ppm bakteri hanya tumbuh pada pewarna Methylene Blue.
Pertumbuhan isolat bakteri IrN pada 12 jenis pewarna dengan konsentrasi 200 ppm di media Luria Bertani agar dapat diamati pada Gambar 3. Tabel 3 menunjukkan bahwa isolat bakteri IrN hanya mendekolorisasi pewarna (a) Methylene Blue, (b) Malachite Green, (c) Congo Red pada konsentrasi 200 ppm sedangkan pada konsentrasi 500 ppm bakteri hanya mendekolorisasi Methylene Blue.
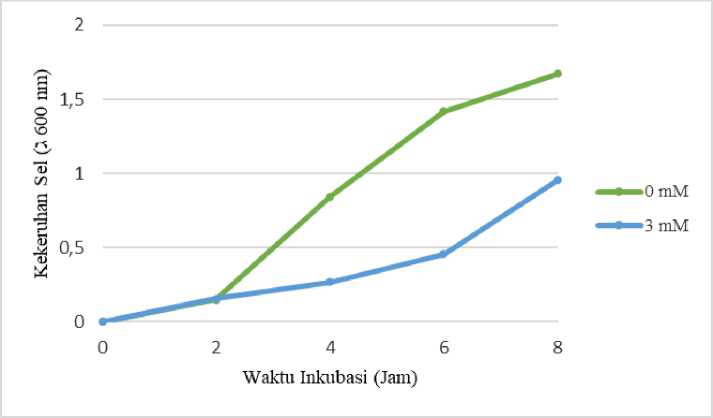
Gambar 2. Pengaruh tembaga terhadap pertumbuhan isolat bakteri IrN
Tabel 2. Uji Pertumbuhan isolat bakteri pada berbagai pewarna konsentrasi 200 dan 500 ppm
|
Perlakuan konsentrasi pewarna |
Pertumbuhan bakteri pada pewarna konsentrasi 200 dan 500 ppm | ||
|
a |
b c d e f g h i j k |
l | |
|
200 ppm |
+ |
+ + + + + + + + + + |
+ |
|
500 ppm |
+ |
--- - - - - - - - |
- |
Keterangan: (a) Methylene Blue; (b) Malachite Green; (c) Congo Red; (d) Mordant Orange; (e) Reactive Black; (f)
Direct Yellow; (g) Basic Fuchsin; (h) Reactive Orange; (i) Disperse Orange; (j) Remasol; (k) Wantex Red; (l) Wantex Yellow.
+: tumbuh.
- : tidak bertumbuh
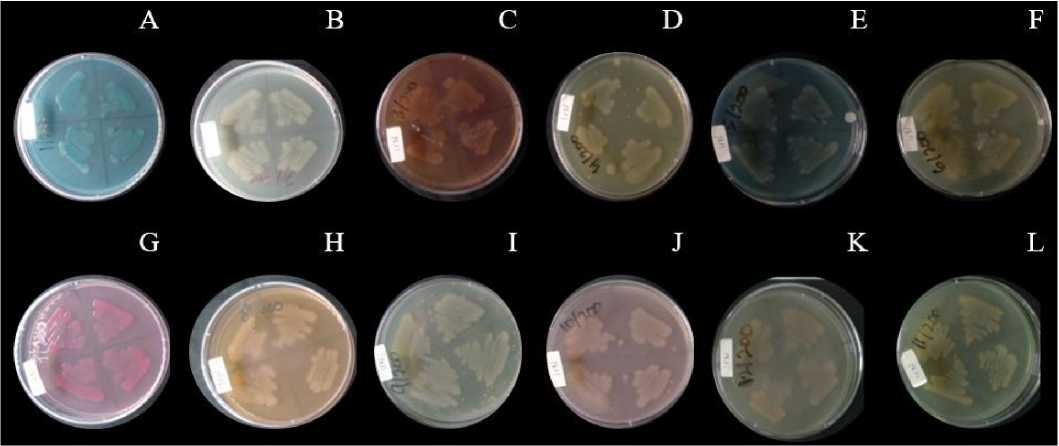
Gambar 3. Hasil pertumbuhan Isolat IrN pada media Luria Bertani agar dengan penambahan 200 ppm pewarna (a) Methylene Blue; (b) Malachite Green; (c) Congo Red; (d) Mordant Orange; (e) Reactive Black; (f) Direct Yellow; (g) Basic Fuchsin; (h) Reactive Orange; (i) Disperse Orange; (j) Remasol; (k) Wantex Red; (l) Wantex Yellow.
Tabel 3. Uji dekolorisasi isolat bakteri pada berbagai pewarna konsentrasi 200 ppm
|
Konsentrasi |
Pertumbuhan bakteri pada pewarna konsentrasi 200 ppm |
|
Pewarna |
a b c d e f g h i j k l |
|
200 ppm |
+ + + - - - + - - - - - |
|
500 ppm |
+ ----------- |
Keterangan:
+ : isolat bakteri IrN mengalami pertumbuhan
- : isolat bakteri IrN tidak bertumbuh
Hasil dekolorisasi di medium dengan 500 ppm Methylene Blue dapat diamati pada Gambar 4. Panah hitam menunjukkan adanya zona bening di sekeliling pertumbuhan koloni bakteri. Menurut Saratale et al. (2011), bakteri dapat mengembangkan dua jenis mekanisme resistensi
terhadap pewarna, yaitu dekolorisasi dan degradasi. Victor et al. (2020) mendefinisikan dekolorisasi sebagai proses penghilangan zat warna dari spesimen yang diwarnai melalui penyerapan, sementara degradasi adalah proses penguraian zat warna menjadi molekul yang lebih
kecil. Bukti penyerapan zat warna dapat diamati melalui perubahan warna koloni yang tampak
lebih gelap setelah ditumbuhkan pada media yang diberi pewarna (An et al., 2002).

(a)

(b)
Gambar 4. Hasil uji dekolorisasi pada medium yang mengandung 500 ppm Methylene Blue. (a) Kontrol tanpa bakteri; (b) Isolat IrN. Panah menunjukkan zona bening
Kemampuan dekolorisasi pewarna
Isolat IrN diamati kemampuannya dalam mendekolorisasi pewarna dengan melihat persentase dekolorisasi pada beberapa medium yang mengandung Methylene Blue, Congo Red, dan Basic Fuchsine. Gambar 5 menunjukkan bahwa kemampuan dekolorisasi isolat IrN pada 200 ppm dan 500 ppm Methylene Blue masing-masing sebesar 42,78% dan 38,1%. Kemampuan dekolorisasi bakteri pada konsentrasi pewarna 500 ppm rendah dibanding 200 ppm mungkin dipengaruhi oleh efek toksisitas pewarna pada konsentrasi yang lebih tinggi. Penambahan 3 mM CuSO4 pada medium 500 ppm methylene blue tetap membuat bakteri mampu mendekolorisasi methylene blue walaupun kemampuan dekolorisasinya menurun menjadi 34,17%. Kemampuan dekolorisasi ini lebih besar dibanding bakteri Pseudomonas aeruginosa dengan kemampuan dekolorisasi 21,31 %, namun lebih kecil dibanding Ralstonia mannitolilytica dengan 60,3 %, Comamonas aquatica dengan 67,9%, dan Desmodesmus sp. dengan 98,6 % (Al-Fawwaz & Abdullah, 2016; Laurensia, 2018;
Sekarlangit & Martani, 2018; Michelle et al., 2020). Kemampuan tumbuh bakteri IrN pada medium yang mengandung methylene blue dan tembaga serta mampu mendekolorisasi menunjukkan bahwa bakteri ini memiliki kemampuan multiresistensi terhadap tembaga dan pewarna.
Isolat bakteri IrN juga dapat mendekolorisasi pewarna lain yaitu Malachite Green, Congo Red, Basic Fuchsine dengan kemampuan maksimal masing-masing sebesar 98,16%, 70,29%, dan 79,07%. Kemampuan dekolorisasi bakteri IrN terhadap Congo Red lebih besar dibanding bakteri indigenus Acinetobacter sp. strain CN5, yaitu sebesar 53,17%. Kemampuan dekolorisasi bakteri IrN terhadap Basic Fuchsine lebih rendah dibanding Acinetobacter sp. strain CN5 (91,37%) dan Desmodesmus sp. (98.6 %) (Irawati et al., 2022) namun lebih tinggi dari Ralstonia mannitolilytica dengan 60.3 %, Comamonas aquatica dengan 67.9% (Al-Fawwaz & Abdullah, 2016; Laurensia, 2018; Sekarlangit & Martani, 2018; Michelle et al., 2020).
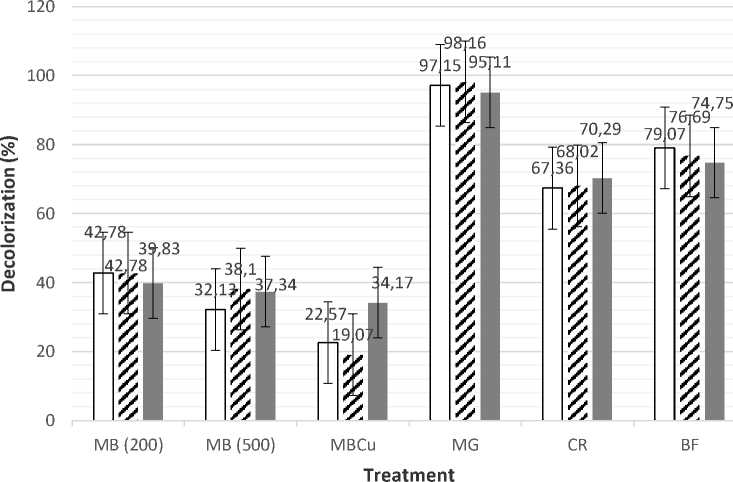
□ 2 Hours
∕, 4 Hours
■ 6 Hours
Gambar 5. Kemampuan dekolorisasi isolat bakteri IrN pada medium yang mengandung methylene blue, malachite green, congo red, dan basic fuchsine. MB: Methylene Blue, MBCu: Methylene Blue dan Cu, MG: Malachite Green, CR: Congo Red, BF: Basic Fuchsine
SIMPULAN
Hasil analisis 16S rDNA menunjukkan bahwa bakteri IrN memiliki similaritas tertinggi dengan Bacillus cereus sebesar 99,91%. Isolat bakteri IrN merupakan bakteri yang memiliki multiresistensi terhadap 3 mM CuSO4 serta pewarna Methylene Blue, Malachite Green, Congo Red, Mordant Orange, Reactive Black, Direct Yellow, Basic Fuchsin, Reactive Orange, Disperse Orange, Remasol, Wantex Red, dan Wantex Yellow dengan konsentrasi 200 ppm, tetapi pada 500 ppm, IrN hanya resisten terhadap Methylene Blue. Bakteri IrN dapat medekolorisasi 200 ppm dan 500 ppm Methylene Blue masing-masing sebesar 42,78% dan 38,1%. Penambahan 3 mM CuSO4 pada medium 500 ppm Methylene Blue tetap membuat bakteri mampu mendekolorisasi methylene blue walaupun kemampuan dekolorisasinya menurun menjadi 34,17%. Bakteri IrN juga dapat mendekolorisasi Malachite Green, Congo Red, Basic Fuchsine dengan kemampuan maksimal masing-masing sebesar 98,16%, 70,29%, dan 79,07%.
DAFTAR PUSTAKA
Al-Fawwaz AT, Abdullah M. 2016.
Decolorization of methylene blue and malachite green by immobilized Desmodesmus sp. isolated from North
Jordan. International Journal of Environmental Science and Development 7(2): 95–99.
https://doi.org/10.7763/IJESD.2016.V7.748
Al-Kdasi A, Idris A, Saed K, Guan CT. 2004. Treatment of textile wastewater by advanced oxidation processes– A review. Global Nest Journal 6(1): 222–230.
An SY, Min SK, Cha IH, Choi YL, Cho YS, Kim CH, Lee YC. 2002. Decolorization of triphenylmethane and azo dyes by Citrobacter sp. Biotechnology Letters 24(12): 1037–1040.
https://doi.org/10.1023/A:1015610018103
Bondarczuk K, Piotrowska-Seget Z. 2013. Molecular basis of active copper resistance mechanisms in Gram-negative bacteria. Cell Biology and Toxicology 29(6): 397–405.
https://doi.org/10.1007/s10565-013-9262-1
Cheriaa J, Khaireddine M, Rouabhia M, Bakhrouf A. 2012. Removal of triphenylmethane dyes by bacterial consortium. The Scientific World Journal 1–9.
https://doi.org/10.1100/2012/512454
Enrico. 2019. Dampak limbah cair industri tekstil terhadap lingkungan dan aplikasi tehnik eco printing sebagai usaha mengurangi limbah. Moda 1(1): 5-13.
Haryono H, Faizal DM, Liamita NC, Rostika A. 2018. Pengolahan limbah zat warna tekstil terdispersi dengan metode elektroflotasi. EduChemia (Jurnal Kimia Dan Pendidikan) 3(1): 94-105.
https://doi.org/http://dx.doi.org/10.30870/ed uchemia.v3i1.2625
Ihsan YN, Fellatami K, Permana R, Mulyani Y, Pribadi TDK. 2020. Analisis bakteri pereduksi konsentrasi logam timbal Pb(CH3COO)2 menggunakan gen 16S rRNA. Jurnal Kelautan: Indonesian Journal of Marine Science and Technology 13(2): 151–162.
https://doi.org/10.21107/jk.v13i2.7285
Irawati W. 2020. Isolasi dan karakterisasi bakteri resisten tembaga dari Pantai Timur Surabaya. BioLink: Jurnal Biologi Lingkungan Industri Kesehatan 6(2): 95-105.
https://doi.org/10.31289/biolink.v6i2.2558
Irawati W, Pinontoan R, Mouretta B, Yuwono T. 2022. The potential of copper-resistant bacteria Acinetobacter sp. strain CN5 in decolorizing dyes. Biodiversitas 23 (2).
https://doi.org/10.13057/biodiv/d230212
Kasi PD, Ariandi, Tenriawaru EP. 2019. Identifikasi bakteri asam laktat dari limbah cair sagu dengan gen 16S rRNA. Majalah Ilmiah Biologi Biosfera 36(1): 35-40.
https://doi.org/10.20884/1.mib.2019.36.1.92 4
Komarawidjaja W. 2007. Peran mikroba aerob dalam pengolahan limbah cair tekstil. Jurnal Teknologi Lingkungan 8(3): 223-228.
https://doi.org/https://dx.doi.org/10.29122/jtl .v8i3.429
Michelle, Siregar RAN, Sanjaya A, Lucy J, Pinontoan R. 2020. Methylene blue decolorizing bacteria isolated from water sewage in Yogyakarta, Indonesia. Biodiversitas 21(3): 1136-1141.
https://doi.org/10.13057/biodiv/d210338
Murwani S. 2015. Dasar-dasar mikrobiologi veteriner. UB Press.
Muzzazinah. 2017. Metode filogenetik pada indigofera. Prosiding Seminar Nasional Pendidikan Biologi Dan Biologi 25–40.
Naimah SA, Jati BN, Aidha NN, Cahyaningtyas AA. 2014. Degradasi Zat Warna Pada Limbah Cair Industri Tekstil Dengan Metode Fotokatalitik Menggunakan Nanokomposit Tio2 – Zeolit. Jurnal Kimia Dan Kemasan 36(2).
https://doi.org/10.24817/jkk.v36i2.1889
Pratiwi Y. 2010. Penentuan Tingkat Pencemaran Limbah Industri Tekstil Berdasarkan
Nutrition Value Bioindikator. Jurnal
Teknologi 3(2).
Priadie B. 2012. Teknik Bioremediasi Sebagai Alternatif dalam Upaya Pengendalian Pencemaran Air. Jurnal Ilmu Lingkungan 10(1). https://doi.org/ 10.14710/jil.10.1.38-48
Rakhmawati A, Yulianti E. 2016. Resistensi bakteri termofilik pasca erupsi Merapi terhadap logam berat. In A. Nuryanto & Surono (Eds.), Prosiding Seminar Nasional “Meneguhkan Peran Penelitian dan Pengabdian kepada Masyarakat dalam Memuliakan Martabat Manusia” (pp. 1018– 1027). Lembaga Penelitian dan Pengabdian Masyarakat Universitas Negeri Yogyakarta. www.blh.go.id
Rodríguez Couto S. 2009. Dye removal by immobilised fungi. In Biotechnology Advances (Vol. 27, Issue 3). https://doi.org/10.1016/j.biotechadv.2008.12 .001
Samanovic MI, Ding C, Thiele DJ, Darwin KH. 2012. Copper in microbial pathogenesis: Meddling with the metal. Cell Host and Microbe 11(2): 106-115.
https://doi.org/10.1016/j.chom.2012.01.009
Saratale RG, Saratale GD, Chang JS, Govindwar SP. 2011. Bacterial decolorization and degradation of azo dyes: A review. Journal of the Taiwan Institute of Chemical Engineers 42(1): 138-157.
https://doi.org/10.1016/j.jtice.2010.06.006
Sastrawidana I. 2011. Studi perombakan zat warna tekstil remazol red Rb recara aerob menggunakan bakteri Enterobacter
aerogenes yang diisolasi dari lumpur limbah tekstil. Jurnal Kimia 5(2): 117-124.
Sitanggang PY. 2017. Pengolahan limbah tekstil dan batik di Indonesia. Jurnal Teknik Lingkungan 1(12): 1-10.
Stackebrandt E, Goebel BM. 1994. Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology. International Journal of Systematic Bacteriology 44(4): 846-849.
https://doi.org/10.1099/00207713-44-4-846
Sunaryanto R. 2019. Kemampuan mikroba konsorsium untuk aplikasi pengolahan limbah tekstil. Seminar Nasional Inovasi Teknologi 145–151.
Utami ER. 2012. Antibiotika, resistensi, dan rasionalitas terapi. SAINSTIS 1(1): 124-138. https://doi.org/10.18860/sains.v0i0.1861
Victor H, Ganda V, Kiranadi B, Pinontoan R. 2020. Metabolite identification from biodegradation of congo red by Pichia sp. KnE Life Sciences Biotechnology and Life Sciences 102–110.
https://doi.org/10.18502/kls.v5i2.6443
Wulandari D, Purwaningsih D. 2019. Identifikasi dan karakterisasi bakteri amilolitik pada umbi Colocasia esculenta L. secara morfologi, biokimia, dan molekuler. Jurnal Bioteknologi & Biosains Indonesia 6(2): 247–258.
259
Discussion and feedback