Biokompatibilitas scaffold sutera asal Bombyx mori ukuran pori 100µm terhadap adipose-derived stem cells (ADSCs) yang dikultur pada berbagai medium pertumbuhan
on
JURNAL BIOLOGI UDAYANA 24(1): 7-15
P ISSN: 1410-5292 E ISSN: 2599-2856
Biokompatibilitas scaffold sutera asal Bombyx mori ukuran pori 100µm terhadap adipose-derived stem cells (ADSCs) yang dikultur pada berbagai medium pertumbuhan
Biocompability of silk fibroin scaffold of Bombyx mori with pore of size 100µm towards adipose-derived stem cells (ADSCs) cultured on various of growth medium
Imam Rosadi1, *, Karina1,2,3, Komang A. Wahyuningsih1,2,4, Anggraini Barlian5, Iis Rosliana1,
Tias Widyastuti1, Siti Sobariah1, Irsyah Afini1
-
1) HayandraLab, Yayasan Hayandra Peduli, Jakarta, Indonesia
-
2) Klinik Hayandra, Yayasan Hayandra Peduli, Jakarta, Indonesia
-
3) Biomedik, Universitas Indonesia, Jakarta, Indonesia
-
4) Histologi, Universitas Katolik Indonesia Atma Jaya, Jakarta, Indonesia
-
5) Sekolah Ilmu dan Teknologi Hayati, Institut Teknologi Bandung, Bandung, Indonesia
*Email: imam.rosadi@hayandra.com
Diterima 31 Juli 2019 Disetujui 12 Februari 2020
INTISARI
Rekayasa jaringan terdiri dari 3 komponen utama yaitu sel, nutrisi, dan scaffold. Penggunaan sel punca asal jaringan lemak (adipose-derived stem cells/ ADSCs) telah banyak dikembangkan sebagai sumber sel dalam teknologi rekayasa jaringan. Medium yang digunakan dalam mendukung pertumbuhan sel diantaranya medium yang mengandung serum seperti fetal bovine serum (FBS), kombinasi FBS dan L-ascorbic acid 2-phosphate (LAA) atau platelet-rich plasma (PRP). Pada penelitian ini, sutera asal Bombyx mori diproduksi menjadi scaffold sutera ukuran pori 100µm kemudian ADSCs dikultur diatas scaffold dalam medium mengandung 10% FBS, 10% FBS-LAA atau 10% PRP. Uji yang dilakukan adalah uji pertumbuhan ADSCs yang dikultur pada polystyrene kemudian uji biokompabilitas scaffold sutera pada ADSCs dalam medium mengandung 10% FBS, 10% FBS-LAA dan 10% PRP. Hasilnya menunjukkan bahwa ketiga kelompok ADSCs dalam variasi medium yang mengandung FBS, FBS-LAA atau PRP dapat mendukung pertumbuhan sel. Ketiga medium tersebut juga tidak berbeda bermakna antar kelompok pada uji biokompabilitas ADSCs yang dikultur pada scaffold sutera. Berdasarkan hasil tersebut, scaffold sutera berpotensi sebagai substrat ADSCs yang dapat dikembangkan sebagai teknologi rekayasa jaringan.
Kata kunci: ADSCs, ascorbic acid, platelet-rich plasma, rekayasa jaringan, scaffold sutera
ABSTRACT
There are three components of tissue engineering which are cell, nutrient, and scaffold. Adipose-derived stem cells (ADSCs) have been used as cell source of tissue engineering. To support the cell proliferation, the medium should be contained serum as nutrition such as fetal bovine serum (FBS), combination of FBS and L-ascorbic acid 2-phosphate (LAA) or platelet-rich plasma (PRP). In this study, silk from Bombyx mori was fabricated into scaffold with pore of size 100μm then ADSC was cultured on scaffold in medium containing 10% FBS, 10% FBS-LAA or 10% PRP. This study observed ADSCs proliferation on polystyrene substrate and biocompability of silk scaffold in medium containing 10% FBS, 10% FBS-LAA and 10% PRP. The results showed that the three groups of medium which contain FBS, FBS-LAA, or PRP
can support proliferation rate of ADSCs. There is no significant different of various medium on ploriferation rate of ADSCs towards biocompability of silk scaffold. The conclusion of this study is silk scaffold can be used as ADSCs substrate to develop tissue engineering.
Keywords: ADSCs, ascorbic acid, platelet-rich plasma, silk scaffold, tissue engineering
PENDAHULUAN
Rekayasa jaringan merupakan salah satu solusi untuk menyediakan kebutuhan akan jaringan atau organ. Teknologi rekayasa jaringan memerlukan sel, nutrisi, dan scaffold (O'brien, 2011). Sumber sel untuk mengembangkan rekayasa jaringan dapat berasal dari sel asal jaringan dewasa atau sel punca, namun pada umumnya sel asal jaringan dewasa terbatas jumlah dan proliferasinya sehingga sel punca lebih banyak dimanfaatkan sebagai sumber sel. Sel punca asal jaringan lemak atau disebut sebagai adipose-derived stem cells (ADSCs) dilaporkan memiliki sifat multipotensi, mudah diperoleh dan merupakan limbah pada operasi sedot lemak (Zuk, 2010). Oleh karena itu, ADSCs merupakan kandidat sumber sel punca yang dapat digunakan untuk mempelajari rekayasa jaringan. Komponen kedua dalam rekayasa jaringan adalah nutrisi bagi pertumbuhan sel.
Medium yang digunakan untuk mendukung pertumbuhan ADSCs diantaranya adalah medium yang mengandung serum. Serum tersebut dapat berasal dari hewan atau manusia seperti fetal bovine serum (FBS) atau platelet-rich plasma (PRP). Laporan studi pendahuluan menunjukkan bahwa medium mengandung FBS atau PRP dapat meningkatkan pertumbuhan ADSCs (Suryani et al., 2013). Kombinasi FBS dengan L-ascorbic acid dilaporkan juga dapat meningkatkan pertumbuhan sel fibroblas dan sel osteo (Hata & Senoo, 1989; Takamizawa et al., 2004). Efektifitas dari ketiga medium tersebut perlu dilakukan studi terhadap pertumbuhan ADSCs dalam mempelajari rekayasa jaringan. Komponen terakhir dalam rekayasa jaringan adalah scaffold.
Pemilihan scaffold ditentukan berdasarkan biokompabilitas, biodegradibilitas, sifat mekanis, arsitektur dan teknologi pembuatan scaffold (O'brien, 2011). Scaffold dalam teknologi
rekayasa jaringan yang didesain harus mampu mendukung lingkungan sel baik secara fisik, kimia maupun biologi (Howard et al., 2008). Peran scaffold adalah sebagai struktur kerangka untuk penempelan sel dalam regenerasi sel secara in vivo maupun in vitro. Scaffold berdasarkan sumbernya terbagi menjadi scaffold alami seperti sutera, kolagen, dan alginat serta scaffold sintetik seperti poly-lactide (PLA), poly-glycolide (PGA), copolymer poly-lactide-co-glycolide (PLGA) (Meinel et al., 2004; Wang et al., 2006). Scaffold sintetik telah dilaporkan dapat menimbulkan reaksi inflamasi pada pengujian secara in vivo (Meinel et al., 2004), sedangkan scaffold berbahan dasar alami seperti kolagen dan alginat memiliki kelemahan diantaranya mudah terdegradasi. Scaffold asal sutera memiliki kekuatan, porositas, biodegradabilitas, biokompabilitas, proliferasi dan diferensiasi sel yang baik menurut Wang et al., (2005), Meinel et al., (2004), dan Hofmann, et al., (2006).
Scaffold sutera dapat dibentuk menjadi berbagai macam struktur (Wang et al., 2006). Struktur scaffold seperti ukuran pori dan konektivitas pori menentukan laju transpor nutrisi, metabolit dan mengatur pergerakan molekul (Meinel et al., 2004). Pada studi ini, dilakukan uji biokompabilitas scaffold sutera asal ulat sutera (Bombyx mori) Indonesia dengan metode salt-leaching yang memiliki ukuran pori sebesar 100µm terhadap ADSCs yang dikultur pada medium mengandung 10% FBS, kombinasi 10% FBS-LAA serta 10% PRP. Luaran dari hasil yang diperoleh bertujuan untuk mengetahui potensi scaffold asal ulat sutera Indonesia sebagai material rekayasa jaringan dengan suplementasi medium FBS, FBS-LAA dan PRP.
MATERI DAN METODE
Pembuatan Scaffold Sutera
Pembuatan scaffold sutera asal ulat sutera (Bombyx mori) mengacu pada Wang et al., (2005). Sutera berasal dari ulat sutera yang diperoleh dari Bandung, Indonesia. Sutera kemudian didegumisasi dan dilarutkan dalam 8% w/v CaCl2/asam format hingga didapatkan konsentrasi akhir 12% w/v. Campuran keduanya dihomogenisasi menggunakan magnetic stirrer selama 15 menit, lalu ditambahkan garam (NaCl) ukuran 100μm dengan perbandingan 5:1, kemudian dihomogenisasi menggunakan batang pengaduk dan dicetak hingga permukaan rata. Scaffold dikering-anginkan selama semalam, kemudian direndam dalam alkohol 70% selama 30 menit. Scaffold direndam dalam akuabides selama 3 hari dengan penggantian akuabides setiap 3-12 jam sekali hingga scaffold bebas garam. Indikator penggantian akuabides adalah tingkat kekeruhan air. Pengukuran pH akuabides pada jam akhir perendaman scaffold dilakukan untuk memastikan pH air mendekati atau sama dengan nilai pH akuabides murni. Scaffold yang tercetak dengan diameter 3 cm dengan ketebalan 1 mm kemudian dikeringkan menggunakan tisu beberapa saat dan disimpan dalam freezer -80°C selama 30 menit kemudian ditimbang berat scaffold. Scaffold dipotong dengan ukuran 5 x 5 mm dan ditimbang serta kemudian disterilisasi menggunakan autoklaf dan siap untuk digunakan.
Kultur Adipose-Derived Stem Cells (ADSCs)
Stromal vascular fraction (SVF) diisolasi dari lipoaspirat jaringan lemak bawah kulit yang berasal dari satu donor. Isolasi ADSCs manusia mengacu pada protokol yang telah dipatenkan oleh Yayasan Hayandra Peduli (Nomor Paten: IDP000055609) yaitu dengan melakukan proses digesti jaringan lemak menggunakan larutan enzim rekombinan H-Remedy. Sebanyak 10% enzim H-Remedy ditambahkan pada sampel jaringan lemak dan diinkubasi pada suhu 37oC, 300 rpm, selama 1 jam. Enzim kemudian diinaktivasi dengan menambahkan medium Dulbecco's Modified Eagle's (DMEM) rendah
glukosa (1 g/L) mengandung L-glutamin (4 mM) dan disentrifugasi pada kecepatan 600xg selama 5 menit. Supernatan yang terbentuk pada lapisan bagian atas kemudian dibuang, sedangkan pelet sel SVF yang mengandung ADSCs dikultur menggunakan medium DMEM yang mengandung 1% antibiotic-antimycotic (Gibco, 100X) dan 10% FBS (Gibco) pada suhu 37oC, 5% CO2. ADSCs kemudian dipasase untuk digunakan pada uji selanjutnya. Penelitian ini telah lulus kaji etik dengan nomor 666/UN6.C.10/PN/2017 oleh Fakultas Kedokteran Universitas Padjadjaran, Bandung.
Platelet Rich Plasma
Platelet rich plasma (PRP) asal donor manusia diperoleh dari Palang Merah Indonesia (PMI), Jl. Kramat Raya, No. 47, Jakarta Pusat, DKI Jakarta (10450) dengan melampirkan surat lulus kaji etik dari FK UNPAD. Bahan PRP digunakan sebagai subtitusi FBS.
Uji Pertumbuhan ADSCs
Sebanyak 5 x 103 ADSCs pasase 4 dikultur pada 96 well-plate dalam berbagai medium yaitu medium DMEM dan antibiotik yang mengandung:
-
a. 10% FBS
-
b. 10% FBS dan L-ascorbic acid (10% FBS-LAA)
-
c. 10% PRP
Sel dilakukan analisis pertumbuhan ADSCs untuk mengetahui laju pertumbuhan diantara ketiga medium tersebut. Medium ADSCs ketiga kelompok perlakuan dibuang dan dibilas dengan Hank's Balanced Salt Solution (HBSS, Gibco) pada hari ke 1, 3, 5, 7, dan 14. Sel kemudian ditambahkan 100 µl DMEM dan 10 µl reagen 3-(4,5-Dimethylthiazol-2-yl)-2,5-
Diphenyltetrazolium Bromide (MTT) (Sigma-Aldrich) ke dalam 96 well-plate. Sel kemudian diinkubasi selama 4 jam. Larutan dalam well dibuang lalu ditambahkan 100 µl DMSO dan diinkubasi selama 10 menit didalam inkubator (Thermo Fisher Scientific). Larutan dalam well kemudian dipindahkan ke dalam 96 well-plate
baru kemudian diamati absorbansinya menggunakan microplate reader (Biorad iMark) dengan panjang gelombang 595 nm.
Uji Biokompabilitas ADSCs
Sel dilakukan analisis toksisitas dan pertumbuhan sel untuk mengetahui
biokompabilitas scaffold sutera terhadap ADSCs.
Scaffold sutera yang telah dipotong dengan ukuran 5 x 5 mm kemudian direndam dalam berbagai medium (10% FBS, 10% FBS-LAA, dan 10% PRP) selama 1, 3, 5, dan 7 hari. Kode uji toksisitas scaffold secara tidak langsung adalah 10% FBS-T, 10% FBS-LAA-T, dan 10% PRP-T. Sel sebanyak 1 x 105 kemudian dikultur pada scaffold sutera menggunakan 96 well-plate dalam medium yang direndam scaffold. Pada hari ke-3 kultur, medium sel yang ditanam pada scaffold ketiga kelompok perlakuan dibuang dengan perendaman selama 1, 3, 5, 7 hari kemudian dibilas dengan Hank's Balanced Salt Solution (HBSS, Gibco). Selanjutnya, sel ditambahkan 100 µl DMEM (Gibco) dan 10 µl reagen 3-(4,5-Dimethylthiazol-2-yl)-2,5-Diphenyltetrazolium Bromide (MTT) ke dalam 96 well-plate. Sel kemudian
diinkubasi selama 4 jam. Larutan dalam well dibuang lalu ditambahkan 100 µl DMSO dan diinkubasi selama 10 menit di dalam inkubator (Thermo Fisher Scientific). Larutan dalam well kemudian dipindahkan ke dalam 96 well-plate baru dan diamati absorbansinya menggunakan microplate reader (Biorad iMark) dengan panjang gelombang 595 nm.
Sebanyak 1 x 105ADSCs pasase 4 dikultur pada scaffold sutera dengan berbagai medium yaitu DMEM mengandung 10% FBS, 10% FBS-LAA, dan 10% PRP. Medium sel yang ditanam pada scaffold ketiga kelompok perlakuan
dibuang dan dibilas dengan Hank's Balanced Salt Solution (HBSS, Gibco). Selanjutnya, sel pada hari ke 1, 3, 5, 7, 14, dan 21 ditambahkan 100 µl DMEM (Gibco) dan 10 µl reagen 3-(4,5-Dimethylthiazol-2-yl)-2,5-
Diphenyltetrazolium Bromide (MTT) ke dalam 96 well-plate. Sel kemudian diinkubasi selama 4 jam. Larutan dalam well dibuang lalu ditambahkan 100 µl DMSO dan diinkubasi selama 10 menit didalam inkubator (Thermo Fisher Scientific). Larutan dalam well kemudian dipindahkan ke dalam 96 well-plate baru kemudian diamati absorbansinya menggunakan microplate reader (Biorad iMark) dengan panjang gelombang 595 nm.
Analisis Statistik
Data ditampilkan dalam bentuk gambar dan grafik (dinyatakan dalam rerata ± standar deviasi (SD)). Analisis statistik dimulai dengan uji normalitas dan homogenitas. Analisis perbedaan menggunakan uji statistik parametrik analysis of variance (ANOVA).
HASIL
Scaffold Sutera
Garam yang digunakan dalam produksi scaffold dihilangkan dengan teknik perendaman air. Hal ini disebabkan, konsentrasi garam yang tinggi dapat bersifat toksik bagi sel jika tidak dilarutkan sebelum digunakan sebagai scaffold ADSCs. Pada studi ini, kadar pH akuades dari bilasan terakhir untuk menghilangkan sisa-sisa garam pada scaffold sutera tidak berbeda bermakna dengan pH akuades murni yang menunjukkan scaffold bebas dari tingginya kadar garam. Berat scaffold sutera dengan diameter 3 cm dan ketebalan 1 mm adalah 0,49 ± 0,04 g. Scaffold sutera yang dipotong hingga berukuran 5 x 5 x 1 mm memiliki rerata berat scaffold sebesar 0,07 ± 0,006 g yang selanjutnya digunakan dalam pengujian. Bentuk scaffold sutera disajikan pada Gambar 1.
Tabel 1. Produksi Scaffold Sutera
|
pH |
Pengujian |
Rerata ± SD |
|
1 |
Air Bebas Mineral (ABM) |
6,33 ± 0,41 |
|
2 |
ABM + Scaffold Sutera |
6,35 ± 0,45 |
|
Berat Scaffold Sutera | ||
|
1 |
Scaffold ukuran 3 cm (g) |
0,49 ± 0,04 |
|
2 |
Scaffold ukuran 5 mm (g) |
0,07 ± 0,006 |

(A) (B) (C)
Gambar 1. Scaffold sutera (A) ketebalan scaffold yaitu 1 mm; (B) diameter scaffold awal produksi adalah 3 cm; (C) scaffold dipotong menjadi ukuran 5 x 5 mm yang selanjutnya digunakan dalam penelitian
Pertumbuhan ADSCs pada Substrat Polystyrene
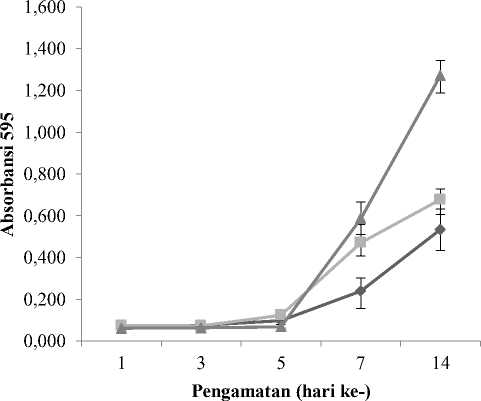
Pertumbuhan ADSCs pada berbagai medium memiliki kecenderungan yang sama yaitu meningkat pada hari ke-7 hingga hari ke-14. Laju pertumbuhan tertinggi ADSCs yang dikultur diatas polystyrene 96 well-plate adalah ADSCs yang dikultur menggunakan medium PRP,
kemudian ADSCs yang dikultur pada medium FBS-LAA dan FBS (Gambar 2). Data tersebut menunjukkan bahwa ketiga medium tersebut berpotensi sebagai nutrisi pertumbuhan ADSCs. Hasil tersebut kemudian menjadi acuan untuk digunakan kembali ketiga medium pertumbuhan tersebut dalam mempelajari potensi scaffold sutera terhadap pertumbuhan ADSCs
—♦—Medium 10% FBS
—■—Medium 10% FBS-LAA
—⅛-Medium 10% PRP
Gambar 2. Pertumbuhan ADSCs pada berbagai medium selama 14 hari pengamatan
Biokompabilitas Scaffold Sutera – Metode Tidak Langsung
Metode ini bertujuan untuk melihat efek medium yang direndam dalam scaffold sutera dengan masa inkubasi 1, 3, 5, dan 7 hari terhadap potensinya untuk mendukung pertumbuhan ADSCs dengan waktu pengamatan selama 3 hari. Hasil studi menunjukkan bahwa ada kecenderungan penurunan absorbasi jika scaffold direndam dalam waktu 7 hari. Scaffold sutera yang direndam menggunakan FBS dan PRP selama 5 dan 7 hari mengalami penurunan absorbansi yang menunjukkan sedikitnya
pertumbuhan sel hidup pada kelompok tersebut. Akan tetapi, pada kelompok ADSCs yang dikultur dalam medium mengandung FBS-LAA terjadi peningkatan absorbansi jika medium digunakan untuk merendam scaffold sutera selama 3 dan 5 hari, namun teramati adanya penurunan absorbansi jika lama waktu perendaman selama 7 hari. Tidak ada perbedaan yang signifikan terhadap kelompok medium dengan masing-masing waktu perendaman scaffold sutera (Gambar 3). Berdasarkan hasil tersebut, scaffold sutera berpotensi sebagai scaffold ADSCs dalam rekayasa jaringan.
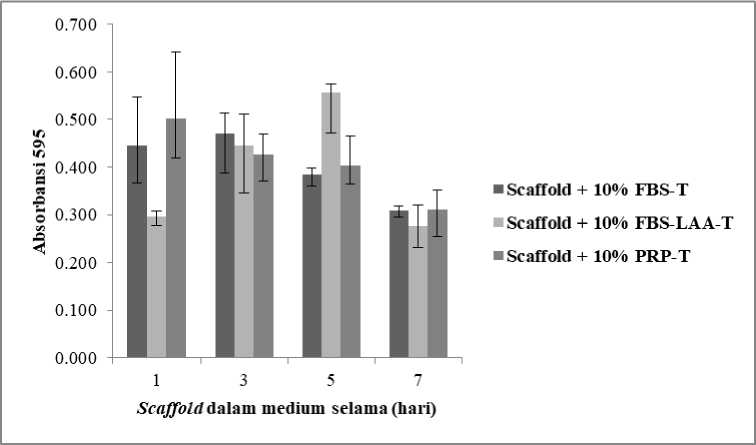
Gambar 3. Uji toksisitas scaffold sutera menggunakan metode tidak langsung yaitu medium 10% FBS, 10% FBS-LAA dan 10% PRP direndam dalam scaffold selama 1, 3, 5, dan 7 hari, pengamatan dilakukan selama 3 hari. Huruf “T” = Uji Toksisitas
Biokompabilitas Scaffold Sutera –Metode Langsung
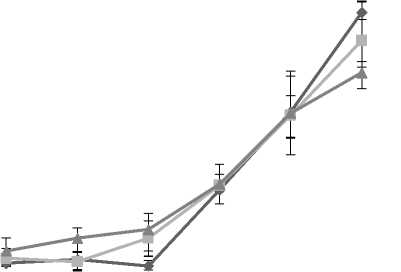
ADSCs yang dikultur selama 21 hari pada scaffold sutera ukuran 100µm dalam berbagai medium mengalami peningkatan pertumbuhan hingga hari ke-21. Tidak ada perbedaan yang bermakna diantara ketiga medium tersebut dalam mendukung pertumbuhan sel. Hasil ini menunjukkan bahwa scaffold sutera tidak bersifat toksik (biokompatibel) dan mendukung pertumbuhan ADSCs. Pertumbuhan ADSCs yang dikultur pada medium yang mengandung FBS memiliki laju proliferasi yang lebih tinggi
dibandingkan kelompok FBS-LAA dan PRP (Gambar 4). Hasil tersebut berbanding terbalik dengan pengujian awal ketika sel dikultur diatas polystyrene yaitu laju proliferasi tertinggi ditunjukkan pada kelompok PRP kemudian diikuti oleh kelompok FBS-LAA dan FBS.
Pada hari ke-7, ADSCs pada kelompok yang dikultur menggunakan FBS mengalami peningkatan 3,1x lipat dibandingkan hari pertama, sedangkan kelompok FBS-LAA dan PRP hanya mengalami peningkatan sebesar 2,8x dan 2,4x lipat dibandingkan hari pertama. Peningkatan ini terus teramati pada kelompok
ADSCs-FBS yaitu sebesar 5,3x dan 8,2x lipat pada hari ke-5 dan 7 dibandingkan hari pertama. Sedangkan kelompok ADSCs-FBS-LAA meningkat sebesar 4,6x dan 6,4x pada hari ke-5
dan 7, kemudian diikuti oleh kelompok ADSCs-PRP sebesar 3,9x dan 4,8x pada hari ke-5 dan 7 jika dibandingkan pada hari pertama pengamatan.
1,400
1,200
1,000 m c∖ m
S 0,800
«
S 0,600
0,400
0,200
—♦— Scaffold + 10% FBS
■ Scaffold + 10% FBS-LAA
—⅛— Scaffold + 10% PRP
1 3 5 7 14 21
Pengamatan (hari ke-)
0,000
Gambar 4. Bikompabilitas scaffold sutera terhadap pertumbuhan sel menggunakan berbagai media selama 21 hari pengamatan
PEMBAHASAN
Sutera merupakan polimer berpilin yang tidak mudah larut dengan air atau larutan basa. Sutera hanya larut dalam formic acid, hexaflouroisopropanol (HFIP), atau calcium sitrate (Altman et al., 2003). Sutera diproduksi oleh Lepidoptera seperti laba-laba dan ulat sutera (Bombyx mori). Berat molekul sutera laba-laba berkisar antara 70 – 700 kDa. Sutera dari laba-laba memiliki karakteristik diantaranya terdiri dari polialanin dan daerah gly-gly-X dengan X adalah tirosin, glutamin atau leusin. Sutera asal laba-laba juga memiliki urutan arginin, glisin, dan asam aspartat (RGD) yang berfungsi mendukung protein integrin pada sel untuk menempel pada scaffold berbahan dasar sutera. Urutan RGD ini tidak ditemukan pada sutera asal ulat sutera B. mori (Meinel et al., 2004). Namun, sutera asal B. mori memiliki komposisi asam amino yang didominasi oleh glisin (Gly) dengan presentase sebanyak 43% kemudian diikuti oleh alanin (Ala)
30% dan serin (Ser) sebanyak 12% (Vepari dan Kaplan 2007; Wray et al., 2011).
Komposisi asam amino tersebut diduga berperan dalam proses penempelan dan proliferasi sel. Selain itu, serat sutera asal B. mori diliputi oleh serisin, yaitu keluarga protein gluelike yang membentuk 2 protein serat fibroin pada kepompong. Serisin yang terkandung pada sutera dapat menyebabkan inflamasi sehingga harus dihilangkan agar scaffold bersifat biocompatible (Wang et al., 2006). Serisin dapat dihilangkan dengan proses degumisasi (Wray et al., 2011). Pada penelitian ini sutera telah dilakukan degumisasi untuk menghilangkan serisin sehingga dapat digunakan sebagai scaffold bagi pertumbuhan ADSCs.
Penggunaan pori 100μm pada scaffold sutera mengacu pada hasil studi Han et al., (2015). Han et al., (2015) melaporkan bahwa ukuran pori 90-180μm dari scaffold sutera merupakan ukuran terbaik untuk proliferasi kondrosit yang ditandai dengan meningkatnya ekspresi gen kolagen tipe 2
dan agrekan pada level mRNA. Studi dan pengembangan scaffold sutera ini selain untuk mengetahui potensi biokompabilitas scaffold terhadap pertumbuhan ADSCs juga sebagai studi pendahuluan untuk digunakan sebagai acuan dalam rekayasa jaringan kartilago. Oleh karena itu, perlu dilakukan studi awal terhadap potensi sutera Bombyx moriasal Indonesia. Pada studi ini, pengujian pertumbuhan ADSCs dilakukan pada polystyrene untuk mengkonfirmasi bahwa ADSCs yang diisolasi asal jaringan lemak dapat tumbuh dalam berbagai medium rendah glukosa yang mengandung 10% FBS, 10% FBS-LAA, dan PRP.
Suryani et al. (2013) melaporkan bahwa ADSCs yang dikultur pada medium mengandung PRP atau FBS dapat mendukung pertumbuhan sel, namun PRP mendukung pertumbuhan ADSCs lebih baik dibandingkan FBS, sehingga PRP dapat menggantikan FBS sebagai nutrisi pertumbuhan. Hasil serupa dilaporkan oleh Rosadi et al. (2019) yang menunjukkan bahwa ADSCs yang dikultur pada substrat polystyrene menggunakan medium mengandung PRP memiliki laju pertumbuhan sel yang lebih tinggi dibandingkan kombinasi FBS-LAA maupun FBS saja.
Pada uji biokompabilitas secara tidak langsung, pertumbuhan ADSCs pada medium dari rendaman scaffold sutera selama 7 hari cenderung memiliki absorbansi yang lebih rendah dibandingkan pengamatan hari lainnya. Namun, kecenderungan tersebut masih menunjukkan adanya potensi yang positif bagi scaffold sutera dalam mendukung pertumbuhan ADSCs karena medium akan selalu diganti setiap 2-3 hari sekali. Oleh karena itu, sel dalam medium yang digunakan dalam pengujian ini akan mengalami penyegaran dari zat toksik scaffold maupun produk samping dari metabolisme ADSCs. Secara alami, sel akan mensekresikan produk samping seperti asam laktat yang bersifat toksik bagi sel. Metabolisme dan pertumbuhan sel akan dihambat dengan menurunkan pH atau meningkatkan laktat pada lingkungan mikro sel (Chen et al., 2009). Sedangkan laju pertumbuhan ADSCs dapat dipengaruhi oleh formulasi
medium yang digunakan dalam kultur ADSCs (Schipper et al., 2008).
Pada studi ini, telah dilakukan normalisasi densitas sel awal yang dikultur. Adanya perbedaan formulasi medium dilakukan untuk mengetahui efektivitas LAA dan subtitusi FBS menjadi PRP dalam mendukung pertumbuhan ADSCs yang dikultur pada scaffold sutera ukuran pori 100µm. Laju pertumbuhan ADSCs yang dikultur pada ketiga medium menunjukkan kecenderungan yang serupa yaitu meningkat seiring lamanya waktu pengamatan (21 hari). Berdasarkan hasil tersebut, ketiga formulasi medium mendukung pertumbuhan ADSCs dan scaffold sutera asal Bombyx mori bersifat biokompatibel bagi pertumbuhan ADSCs.
SIMPULAN
Scaffold sutera ukuran pori 100 µm dapat digunakan untuk pengembangan rekayasa jaringan menggunakan ADSCs dalam medium mengandung fetal bovine serum (FBS), kombinasi FBS dan L-ascorbic acid 2-phosphate dan platelet-rich plasma (PRP) asal manusia.
UCAPAN TERIMAKASIH
Peneliti mengucapkan terimakasih pada Lembaga Pengelola Dana Pendidikan (LPDP) Kementrian Keuangan Republik Indonesia yang telah mendanai penelitian ini melalui pemberian Beasiswa Tesis, sesuai dengan Nota Perjanjian nomor: PRJ-1332 /LPDP.3/2016.
KEPUSTAKAAN
Altman GH, Diaz F, Jakuba C, Calabro T, Horan RL, Chen J, Lu H, Richmond J, Kaplan DL. 2003. Silk-based biomaterials. Biomaterials 24(3): 401-416.
Chen T, Zhou Y, Tan WS. 2009. Influence of lactic acid on the proliferation, metabolism, and differentiation of rabbit mesenchymal stem cells. Cell Bio. & Toxic 25(6): 573-586.
Han KS, Song, JE, Tripathy N, Kim H, Moon BM, Park CH, Khang G. 2015. Effect of pore
sizes of silk scaffolds for cartilage tissue engineering. Macromol. Res. 23(12): 10911097.
Hata RI, Senoo H. 1989. L‐ascorbic acid 2‐ phosphate stimulates collagen accumulation, cell proliferation, and formation of a three‐ dimensional tissuelike substance by skin fibroblasts. J. Cellular Phy. 138(1): 8-16.
Hofmann S, Knecht S, Langer R, Kaplan DL, Vunjak-Novakovic G, Merkle HP, Meinel L. 2006. Cartilage-like tissue engineering using silk scaffolds and mesenchymal stem cells. Tissue Eng. 12(10): 2729-2738.
Howard D, Buttery LD, Shakesheff KM, Roberts SJ. 2008. Tissue engineering: strategies, stem cells and scaffolds. J. Anatomy 213(1): 6672.
Meinel L, Hofmann S, Karageorgiou V, Zichner L, Langer R, Kaplan D, Vunjak-Novakovic G. 2004. Engineering cartilage‐like tissue using human mesenchymal stem cells and silk protein scaffolds. Biotech. & Bioeng. 88(3): 379-391.
O'brien FJ. 2011. Biomaterials & scaffolds for tissue engineering. Materials today 14(3):88-95.
Rosadi I, Karina K, Rosliana I, Sobariah S, Afini I, Widyastuti T, Barlian A. 2019. The Effect of Human Platelet-Rich Plasma and L-Ascorbic Acid on Morphology, Proliferation, and Chondrogenesis Ability towards Human Adipose-Derived Stem Cells. Mol. Cell. Biomed. Sci. 3(1): 26-33.
Schipper BM, Marra KG, Zhang W. 2008. Regional anatomic and age effects on cell
function of human adipose-derived stem cells. Ann Plast Surg. 60: 538 –544.
Suryani D, Pawitan JA, Lilianty J, Purwoko RY, Liem IK, Damayanti L. 2013. Comparison of fetal bovine serum and platelet-rich plasma on human lipoaspirate-derived mesenchymal stem cell proliferation. Med. J. Indonesia. 22(3): 146-151.
Takamizawa S, Maehata Y, Imai K, Senoo H, Sato S, Hata RI. 2004. Effects of ascorbic acid and ascorbic acid 2‐phosphate, a long‐ acting vitamin C derivative, on the proliferation and differentiation of human osteoblast‐like cells. Cell Bio. Intern. 28(4): 255-265.
Vepari C, Kaplan DL. 2007. Silk as a biomaterial. Progress in Polymer Sci. 32(8-9): 991-1007.
Wang Y, Kim HJ, Vunjak-Novakovic G, Kaplan DL. 2006. Stem cell-based tissue engineering with silk biomaterials. Biomaterials 27(36): 6064-6082.
Wang Y, Kim UJ, Blasioli DJ, Kim HJ, Kaplan DL. 2005. In vitro cartilage tissue engineering with 3D porous aqueous-derived silk scaffolds and mesenchymal stem cells. Biomaterials 26(34): 7082-7094.
Wray LS, Hu X, Gallego J, Georgakoudi I, Omenetto FG, Schmidt D, Kaplan DL. 2011. Effect of processing on silk‐based biomaterials: Reproducibility and
biocompatibility. J. Biomed. Materials Res. Part B: Applied Biomaterials 99(1): 89-101.
Zuk PA. 2010. The Adipose-derived Stem Cell: Looking Back and Looking Ahead. Mol Bio Cell. 21: 1783-1787.
15
Discussion and feedback